Журнал неорганической химии, 2020, T. 65, № 7, стр. 888-893
Синтез композиционного материала на основе смеси фосфатов кальция и альгинат-хитозанового полиэлектролитного комплекса
А. А. Цыганова a, *, О. А. Голованова a, А. Н. Еловский a
a Омский государственный университет им. Ф.М. Достоевского
644077 Омск, пр-т Мира, 55-А, Россия
* E-mail: a.a.tsyganova1993@yandex.ru
Поступила в редакцию 23.12.2019
После доработки 18.02.2020
Принята к публикации 27.02.2020
Аннотация
Получены композиционные материалы на основе смеси фосфатов кальция и альгинат-хитозанового полиэлектролитного комплекса (ПЭК), свойства которых можно корректировать варьированием соотношения наполнитель/матрица и температуры сушки, что позволяет рассматривать применение данных материалов в ортопедии и травматологии как допустимое. Изучен состав, морфология полученных образцов и их динамическое растворение. Установлено, что внедрение порошкового материала в матрицу ПЭК не изменяет его состав, но увеличивает скорость его резорбции. Подобраны оптимальные условия синтеза композиционного материала: соотношение наполнитель/матрица, температура и продолжительность сушки.
ВВЕДЕНИЕ
Одним из важнейших направлений регенеративной медицины является поиск и разработка новых материалов. Синтез композитов на основе фосфатов кальция, содержащих неорганическое вещество в матрице органического полимера, активно развивается учеными с целью их использования в ортопедии и травматологии для восстановления поврежденных или утраченных участков костей человека [1–3]. Кроме того, данные композиты могут применяться в качестве биологически активного слоя имплантатов, выполненных из нержавеющей стали, хром-кобальтовых сплавов, титана и т.д. [4].
В настоящее время интерес вызывают природные полимеры животного и растительного происхождения, в частности полисахариды (пектин, альгинат, хитозан, гликоген). Широкое применение этих полимеров связано с их биологическими свойствами – биосовместимостью, противовоспалительным действием, низкой токсичностью [5, 6]. Наиболее перспективными из них являются альгинат натрия и хитозан [7–10]. Альгинат натрия – ионогенный полисахарид, получаемый в результате щелочной экстракции бурых водорослей. Благодаря таким свойствам, как водорастворимость, высокая загущающая способность и нетоксичность этот полимер нашел широкое применением в медицине, пищевой, косметической, текстильной, бумажной и других отраслях промышленности [11]. Особый интерес к альгинату натрия обусловлен его способностью формировать гидрогели в водных растворах при добавлении бивалетных металлов, что позволяет разрабатывать новые материалы различного назначения [12]. Хитозан – дезацетилированное производное хитина, второй по распространенности природный полимер после целлюлозы [7, 13]. Хитозан обладает иммунологическими и противоопухолевыми свойствами, высокой биосовместимостью, а также антитромботическими и кровоостанавливающими свойствами [5]. В последние годы особый интерес исследователей уделяется новому классу биополимеров – полиэлектролитным комплексам (ПЭК) разноименно заряженных полисахаридов. Часто ПЭК обладают физико-химическими и биологическими свойствами, отличными от свойств исходных полимеров. Согласно литературным данным, образование альгинат-хитозанового комплекса осуществляется за счет электростатических взаимодействий между карбоксильными группами альгината и аминогруппами хитозана, а также за счет дисперсионных взаимодействий и водородных связей, возникающих между отдельными макромолекулами [14–16]. Водорастворимые альгинат-хитозановые комплексы находят применение как стабилизаторы в пищевой промышленности, матрицы для лекарственных препаратов и основа получения высокотехнологичного льда для охлаждения гидробионтов [17–19]. Известно, что данный комплекс биосовместим, нетоксичен и легко подвергается биодеградации, следовательно, в сочетании с фосфатным наполнителем [20] он может быть перспективным материалом для остеопластики.
Целью настоящей работы является получение композиционного материала на основе ПЭК и смеси фосфатов кальция (ФК), описание его физико-химических свойств, а также установление возможности использования в медицинских целях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
На основе литературных данных [21, 22] был выбран способ синтеза смеси фосфатов кальция [23] путем осаждения из водного раствора. Осаждение проводили при температуре 40°С, рН 6.5 с введением добавки ионов магния в концентрации 12.5 ммоль/л. Эта добавка позволяет получать многофазные порошки фосфатов кальция, которые в перспективе могут оказаться более приживаемыми и биологически активными [24], чем в настоящее время. В основе данного способа лежит следующая химическая реакция:
(1)
$\begin{gathered} 8{\text{CaC}}{{{\text{l}}}_{2}} + 6{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{HP}}{{{\text{O}}}_{4}} + 4{\text{NаOH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{C}}{{{\text{a}}}_{{\text{8}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}})}_{6}} \cdot 5{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 16{\text{NaCl}}. \\ \end{gathered} $Смешивание растворов проводили при охлаждении до 0–5°С. После вызревания осадка под маточным раствором в течение 48 ч твердую фазу отделяли от раствора фильтрованием, высушивали при температуре ~80°С до полного удаления химически несвязанной воды, взвешивали и исследовали с применением группы физико-химических методов.
Для получения композиционного материала в качестве биополимера использовали альгинат-хитозановый ПЭК. Готовили смесь 1 : 1 – 2%-ной водной суспензии альгината натрия и 2%-ного раствора хитозана в 0.5%-ной уксусной кислоте. В суспензию вводили порошок (смесь фосфатов кальция) в количестве 10, 30, 50 мас. % и интенсивно перемешивали. Вспенивание осуществляли с помощью магнитной мешалки. Пену помещали в тигель и высушивали при температуре 25 или 200°С.
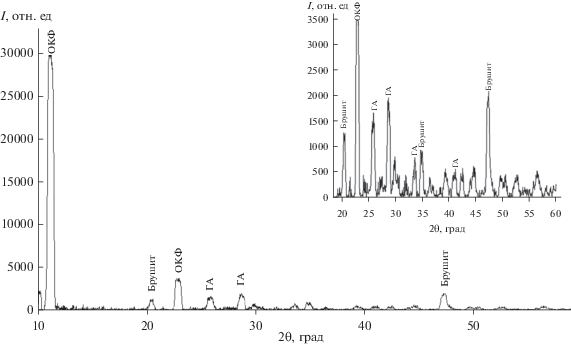
Фазовый состав полученных образцов исследовали с помощью РФА (дифрактометр D8 Advance фирмы Bruker). Съемку рентгеновской дифрактограммы выполняли на порошковом рентгеновском дифрактометре D8 Advance фирмы Bruker в CuKα-излучении (длина волны 0.15406 нм) с использованием позиционно-чувствительного детектора Lynxeye. Область сканирования 5°–80°. Идентификацию пиков на дифрактограммах проводили с помощью картотеки JCPDS (гидроксилапатит (ГА) – JCPDS 09-0432, брушит – JCPDS 72-0713, октакальций фосфат (ОКФ) – JCPDS 26-1056) и программных пакетов DifWin 4.0 и Crystallographica Search-Match. Содержание присутствующих фаз в образцах определяли по методу корундовых чисел (метод Чанга, программа Crystallographica Search-Match).
ИК-спектры получали на спектрофотометре ФСМ 2202 (Инфраспек, Россия). В ходе исследования образец в виде порошка смешивали с KBr, насыпали в германиевую кювету и прессовали. Регистрацию спектров проводили с разрешением 4 см–1, общее число сканирований – 50. Запись спектра исследуемых образцов проводили в области от 400 до 4000 см–1. Обработку данных осуществляли с использованием программы Origin Pro 8.0. Предел обнаружения составлял 5%.
Измерение удельной поверхности образцов по методу БЭТ (SБЭТ-N2) проводили на адсорбционном приборе “Сорбтометр” по адсорбции стандартного газа азота при 77.4 K по одной точке изотермы адсорбции азота в токе гелия (относительное давление паров азота p/p0 = 0.075) в течение 3 ч. Диапазон измерения удельной поверхности от 0.5 до 999 м2/г. Предел допускаемой относительной погрешности измерений удельной поверхности в режиме многократного измерения <5%.
Изучение морфологии и определение формы частиц твердых фаз проводили методом оптической микроcкопии c помощью микроcкопa серии XSP-140. В качестве материала для исследования использовали осадок фосфатов кальция с добавкой ПЭК. Пробы тонким слоем наносили на часовое стекло и изучали материал под микроскопом. Расчет размеров кристаллов проводили с помощью программы Toup View.
Измерения динамической вязкости осуществляли при помощи ротационного вискозиметра серии SMART (Fungilab).
Исследование резорбции полученных образцов проводили путем их динамического растворения при постоянном перемешивании в растворе 0.9%-ного хлорида натрия (рН 7.0), ацетатном буфере (pH 4.75) и растворе соляной кислоты (рН 1.0) при температуре 22°C. Через определенные промежутки времени (0–90 мин) с помощью прямой потенциометрии фиксировали значение кислотности среды и показателя концентрации ионов кальция в растворе. Кинетические кривые были обработаны в соответствии с предложенными в работах [23, 25] алгоритмами. Математическую обработку всех данных осуществляли с использованием статистических программ Statistica 10 из статистического пакета StatSoft и Static2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
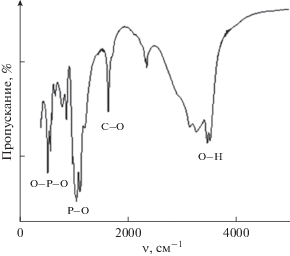
При синтезе смеси фосфатов кальция методом РФА установлено, что полученный осадок представлен фазами октакальций фосфата, брушита и гидроксилапатита (рис. 1), основным интенсивным линиям которых соответствуют углы 2θ: ОКФ – 11.4°, 22.8°; ГА – 25.9°, 29.6°, 31.8°; брушит – 20.4°, 47.3°, 35.2°. ИК-спектр полученного образца содержит полосы, характерные для фосфатных групп (рис. 2): валентные асимметричные колебания при 1024 и 1154 см–1, характерные для связей О–Р–О, а также пики при 530 и 574 см–1, соответствующие колебаниям в ${\text{РО}}_{4}^{{3-}}.$ Из результатов оптической микроскопии (рис. 3) следует, что образующиеся кристаллы имеют морфологию “розеток”, состоящих из пластинчатых кристаллов, характерных для ОКФ, кристаллов моноклинной структуры, характерной для брушита, и кристаллов гексагональной сингонии, характерной для ГА, с размерами кристаллитов: ОКФ – 2.96, брушит – 2.45, ГА – 2.15 нм.
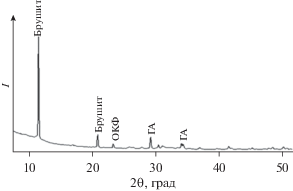
По результатам РФА получено, что внедрение порошкового материала в матрицу ПЭК не изменяет его состав вне зависимости от соотношения наполнитель/матрица. Например, композит с соотношением 50/50 представлен смесью фаз ОКФ, брушита и ГА, основным интенсивным линиям которых соответствуют углы 2θ (рис. 4): ОКФ – 23.4°; ГА – 29.6°, 33.6°; брушита – 11.6°, 20.8°.
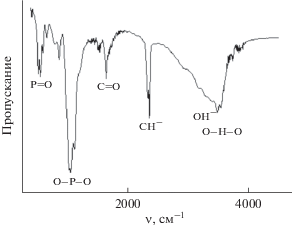
Методом ИК-спектроскопии установлено, что композиционные материалы на основе ПЭК содержат полосы, характерные для фосфатов кальция и альгината натрия. На рис. 5 представлены валентные колебания, характерные для группы >С=О, при 1240 см–1, колебания СН-группы при 2490 см–1, валентные асимметричные колебания при 1024 и 1154 см–1, характерные для связей О–Р–О, а также пики при 530, 574 см–1, соответствующие колебаниям в Р${\text{O}}_{4}^{{3 - }}$.
Из литературных данных известно, что альгинат натрия подвергается значительному структурированию в присутствии ионов кальция, которые замещают ионы натрия и сшивают полимерные полисахаридные цепи между собой [26]. Для ПЭК характерен схожий механизм, о чем свидетельствует почти двукратное увеличение вязкости суспензии при добавлении 1% наполнителя – смеси ФК (табл. 1).
Таблица 1.
Динамическая вязкость образцов
| Матрица | Динамическая вязкость матрицы, мПа с | Динамическая вязкость матрицы в присутствии наполнителя, мПа с | |
|---|---|---|---|
| 0.5% | 1.0% | ||
| Альгинат натрия | 5992.5 | 7580.0 | 11805.5 |
| Хитозан | 3057.5 | 3508.0 | 3818.0 |
| ПЭК | 4332.0 | 5716.0 | 7481.5 |
Стоит отметить, что композиционный материал принял заданную форму и монолитность (рис. 6).
Методом БЭТ установлено, что удельная поверхность композиционного материала, характеризующегося соотношением наполнитель/матрица 30/70, уменьшилась по сравнению с порошковым материалом от 23 до 18 м2/г, но при этом занимает промежуточное значение между данными, полученными для подобных композиционных материалов, матрицей в которых выступали альгинат натрия – 37 м2/г и хитозан – 6 м2/г. Важно отметить, что увеличение температуры сушки образца от 25 до 200°С способствовало росту удельной поверхности до 27 м2/г, что свидетельствует о возможности получения композита с заданной удельной поверхностью путем варьирования температуры сушки и соотношения альгинат натрия/хитозан.
Для изучения биорезорбируемости образцов было проведено их растворение в 0.1 М растворе HCl, ацетатном буферном и 0.9%-ном растворе NaCl. Экспоненциальная зависимость (рис. 7) соответствует кинетике реакции первого порядка, поэтому в качестве количественной меры процесса можно рассматривать начальную скорость растворения (табл. 2), определенную, как тангенс угла наклона линейного участка прямой, построенной в координатах pCa = f(τ).
Рис. 7.
Кинетические кривые растворения композиционного материала с различным содержанием наполнителя в растворе: а – 0.1 М HCl; б – ацетатном буферном; в – 0.9%-ном NaCl.
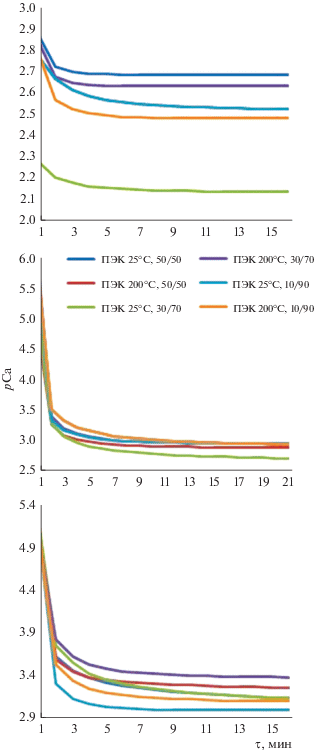
Таблица 2.
Значение начальной скорости растворения
| Среда | Соотношение наполнитель/матрица в композите | Начальная скорость, моль/(л мин) |
|
|---|---|---|---|
| tсушки = 25°С | tсушки = 200°С | ||
| 0.1 М раствор HCl | 100/0 | 4.9 | |
| 10/90 | 5.6 | 14.5 | |
| 30/70 | 7.4 | 15.7 | |
| 50/50 | 7.4 | 25.3 | |
| Ацетатный буферный раствор | 100/0 | 12.1 | |
| 10/90 | 15.4 | 27.8 | |
| 30/70 | 26.9 | 47.4 | |
| 50/50 | 63.4 | 105.2 | |
| 0.9%-ный раствор NaCl | 100/0 | 9.0 | |
| 10/90 | 24.2 | 29.3 | |
| 30/70 | 27.2 | 34.5 | |
| 50/50 | 29.5 | 55.2 | |
Из данных табл. 2 следует, что резорбируемость полученных композитов выше, чем у соответствующего образца (ФК) без биополимера. Установлено, что при увеличении соотношения наполнитель/матрица и роста температуры сушки композита резорбируемость возрастает, что связано с повышением пористости материала.
ЗАКЛЮЧЕНИЕ
Предложен способ получения композиционных материалов на основе смеси ФК и ПЭК, свойства которых можно корректировать за счет варьирования соотношения наполнитель/матрица и температуры сушки. Выяснено, что оптимальная температура сушки образцов – 200°С, так как при данной температуре характеризуются максимальным значением удельной поверхности и начальной скорости растворения. Установлено, что скорость резорбции синтезированных образцов увеличивается с ростом температуры сушки и содержания наполнителя. Таким образом, в работе получен композиционный материал, который имеет перспективу применения в медицинских изделиях.
Список литературы
Solonenko A.P., Golovanova O.A. // Russ. J. Inorg. Chem. 2015. V. 60. № 9. P. 1034. [Солоненко А.П., Голованова О.А. // Журн. неорган. химии. 2015. Т. 60. № 9. С. 1139.]https://doi.org/10.1134/S0036023615090181
Plokhikh N., Filippov Ya., Putlyaev V. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 10. P. 1152. [Плохих Н.В., Филиппов Я.Ю., Путляев В.И. и др. // Журн. неорган. химии. 2013. Т. 58. № 10. С. 1298.]https://doi.org/10.1134/S0036023613100173
Azarmi R., Ashjaran A. // J. Pharmaceutical, Biol. Chem. Sci. 2014. № 5. P. 320.
Ling-Hao He, Lu Yao, Rui Xue. et al. // J. Frontiers Materials Sci. 2011. V. 5. № 3. P. 282. https://doi.org/10.1007/s11706-011-0140-6
Dutta P.K. // Chitin and chitosan for regenerative medicine. Berlin: Springer, 2016. 389 p.
Andersen Th. // J. Carbohydr. Chem. 2012. № 37. P. 227.
Fadeeva T.V., Golovanova O.A. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 847. [Фадеева Т.В., Голованова О.А. // Журн. неорган. химии. 2019. Т. 64. № 7. С. 690. https://doi.org/10.1134/S0044457X19070067]https://doi.org/10.1134/S0036023619070064
Elson Santiago de Alvarenga // Universidade Federal de Viçosa. 2011. P. 91. https://doi.org/10.5772/17020
Хотимченко Ю.С., Ковалев В.В., Савченко О.В., Загиншина О.А. // Биология моря. 2001. Т. 27. № 3. С. 151.
Malikova T.V., Golovanova O.A., Chikanova E.S. // Inorg. Mater. 2018. V. 54. № 9. P. 957.
Усов А.И. // Успехи химии. 1999. Т.68. № 11. С. 1051.
Fabia J. // Fibres & Textiles in Eastern Europe. 2005. V. 13. № 5(53). P. 114.
Скрябин К.Г. // М.: Центр “Биоинженерия” РАН, 2013. С. 593.
Бровко О.С., Паламарчук И.А., Вальчук Н.А. // Журн. физ. химии. 2017. Т. 91. № 8. С. 1420.
Бровко О.С., Паламарчук И.А., Сысоева Н.В. и др. // Лесной журн. 2017. № 1. С. 186. https://doi.org/10.17238/issn0536-1036.2017.1.186
Peng P. // Biointerphases. 2007. V. 2. № 2. P. 95.
Манаенков О.В. // Вестник МИХТ. 2010. Т. 5. № 2. С. 76.
Киржанова Е.А., Печенкин М.А., Демина Н.Б. и др. // Вестник Моск. ун-та. Сер. 2 Химия. 2016. Т. 57. № 2. С. 103.
Максимова С.Н., Суровцева С.Ю., Федосеева Е.В. и др. // Изв. ТИНРО. 2016. Т. 186. С. 231.
Yan X. L., Khor E., Lim L.Y. // J. Biomedical Mater. Res. 2001. P. 58.
Tung M.S., Tomazic B., Brown W.E. // Arch. Oral Biol. 1992. P. 585.
Dorozhkin S. V. // Biomaterials. 2010. V. 31. P. 1465.
Golovanova O.A., Tsyganova A.A., Chikanova E.S. // Glass Phys. Chem. 2016. V. 42. № 6. C. 615. https://doi.org/10.1134/S1087659616060043
Tsyganova A.A., Golovanova O.A. // Inorg. Mater. 2017. V. 53. № 12. P. 1261.
Фомин А.С., Комлев B.C., Баринов С.М. и др. // Перспективные материалы. 2006. № 2. С. 51.
Юсова А.А., Гусев И.В., Липатова И.М. // Химия растительного сырья. 2014. № 4. С. 59. https://doi.org/10.14258/jcprm.201404380
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии