Журнал неорганической химии, 2020, T. 65, № 7, стр. 880-887
Синтез и ионоселективные свойства (NH4)xV2O5 · nH2O
Н. В. Подвальная a, *, Г. С. Захарова a
a Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: podnat@inbox.ru
Поступила в редакцию 16.12.2019
После доработки 31.01.2020
Принята к публикации 27.02.2020
Аннотация
Изучены условия образования аммонийсодержащих соединений на основе гидратированного оксида ванадия ${{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{x}}{\text{V}}_{y}^{{{\text{4}} + }}{\text{V}}_{{{\text{2}} - y}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (0.24 ≤ х ≤ 0.36, 0.24 ≤ y ≤ 0.36), полученных методом гидролитического осаждения с использованием в качестве подкислителя гидрата сульфата ванадила. Соединение ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ с максимальным содержанием четырехвалентного ванадия получено при молярном отношении 0.1 ≤ NH4VO3/VOSO4 · 3H2O ≤ 1.0. Золь-гель синтезом в комбинации с методом ионного обмена синтезирован${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{1}}.4{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$характеризующийся минимальным содержанием четырехвалентного ванадия. Показана возможность использования синтезированных аммонийсодержащих соединений на основе гидратированного оксида ванадия в качестве активного материала твердофазных ионоселективных электродов. Электроды на основе ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{1}}.4{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ селективны к катионам аммония в интервале концентраций 1 ≤ ${\text{р}}{{С}_{{{\text{NH}}_{{\text{4}}}^{ + }}}}$ ≤ 4 при кислотности рабочих растворов 4 ≤ рH ≤ 7 и 5 ≤ рH ≤ 6 с угловыми коэффициентами 55 и 50 ${\text{мВ/р}}{{С}_{{{\text{NH}}_{{\text{4}}}^{ + }}}}$ соответственно. Определены коэффициенты селективности электродов на основе (NH4)xV2O5 · nH2O в ряду одно-, двух- и трехзарядных катионов.
ВВЕДЕНИЕ
Гидратированный оксид ванадия V2O5 · nH2O привлекает внимание исследователей благодаря уникальным свойствам и перспективам использования в качестве катализаторов [1], химических сенсоров [2, 3], элементов электрохромных устройств [4], катодных материалов [5] и др. Характерной особенностью этого соединения является подвижная квазиодномерная слоистая структура. В ней ванадий-кислородные слои образованы спутанными волокнами V−O и соединены молекулами воды, расположенными в межслоевом пространстве [6]. По своей химической природе гидратированный оксид ванадия является поливанадиевой кислотой H2V12O31 · nH2O [7]. Наличие обменно-активных протонов позволяет вводить в структуру гидратированного оксида ванадия катионы одно- и двухвалентных металлов [8]. Содержание ионов четырехвалентного ванадия в V2O5 · nH2O можно легко варьировать применением в процессе синтеза различных восстановителей, таких как поливиниловый спирт (C2H4O)x, триоксид сурьмы Sb2O3 [9], этанол С2H5OH [8], а также изменяя величину рН и концентрацию ванадия(IV) в реакционном растворе [10].
Универсальным способом получения аммонийсодержащих соединений на основе гидратированного оксида ванадия является золь-гель метод [11–13]. Соединение (NH4)0.33V2O5 · nH2O термически устойчиво до температуры 200°С, но его стабильность может быть увеличена до 250–300°С при частичном замещении ионов ванадия на молибден [11]. Пленки ксерогеля состава (NH4)0.15V2O5 · 1.3H2O и (NH4)0.3V2O5 · 1.25H2O можно получить химическим осаждением из растворов метаванадата аммония в присутствии уксусной кислоты в интервале температур 50−85°С. Они имеют лентоподобную морфологию шириной 100−50 нм и длиной ~500 нм [14, 15]. Установлено, что пленки (NH4)0.15V2O5 · 1.3H2O толщиной ~200 нм при длине волны поглощенного света 400 нм имеют максимальный коэффициент пропускания [14]. Для пленок (NH4)0.3V2O5 · 1.25H2O характерно проявление двухступенчатого электрохромизма (желтый/зеленый и зеленый/синий), обусловленного процессами окисления и восстановления ионов ванадия [15]. Очевидно, что свойства (NH4)xV2O5 · nH2O зависят от содержания в данных соединениях ионов аммония и, следовательно, от концентрации ионов четырехвалентного ванадия. Однако в литературе отсутствует описание простого и надежного метода, позволяющего получать аммонийсодержащие соединения на основе гидратированного оксида ванадия с различным содержанием ионов четырехвалентного ванадия без использования минеральной или карбоновой кислоты.
Цель настоящей работы − изучение условий образования аммонийсодержащих соединений на основе гидратированного оксида ванадия методом гидролитического осаждения с использованием в качестве подкислителя гидрата сульфата ванадила, а также исследование электродных свойств полученных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходными веществами служили метаванадат аммония NH4VO3, гидрат сульфата ванадила VOSO4 ∙ 3H2O, пентаоксид ванадия V2O5, пероксид водорода H2O2, хлорид аммония NH4Cl марки не ниже “х. ч.”. Соединение (NH4)xV2O5 · nH2O с повышенным содержанием четырехвалентного ванадия синтезировали методом гидролитического осаждения из растворов метаванадата аммония с использованием в качестве подкислителя сульфата ванадила при молярном отношении 0.1 ≤ NH4VO3/VOSO4 · 3H2O ≤ 3.0, температуре 80°С и времени процесса 2 ч (суммарная концентрация ванадия 0.2 моль/л). В результате получали темно-зеленый осадок, который отфильтровывали, промывали водой и сушили на воздухе при комнатной температуре.
Для сравнения методом ионного обмена в сочетании c золь-гель синтезом получали (NH4)xV2O5 · nH2O c минимальным содержанием четырехвалентного ванадия. Для этого V2O5 растворяли при охлаждении в H2O2, затем реакционную смесь при постоянном перемешивании медленно нагревали на водяной бане. В результате образовался гель, который сушили на воздухе при температуре 60°С. К полученному ксерогелю (0.5 г) добавляли 100 мл 1 M раствора NH4Cl. Реакционную смесь выдерживали в течение 7 сут при постоянном перемешивании, затем темно-коричневый осадок промывали, отфильтровывали и сушили на воздухе при комнатной температуре.
Для определения содержания ионов в полученных соединениях образцы помещали в 1 М раствор КСl и выдерживали при перемешивании в течение 7 сут. Затем осадки промывали водой, отфильтровывали, сушили на воздухе и анализировали на содержание калия методом атомной абсорбционной спектроскопии в пламени ацетилен-воздух на приборе Perkin–Elmer. Концентрацию ионов аммония в образцах определяли, считая, что ионы калия полностью замещаются ионами аммония [16]. Полноту замещения ионов аммония на калий контролировали методом энергодисперсионного рентгеновского микроанализа. Суммарное содержание ванадия определяли титрованием солью Мора в присутствии фенилантрониловой кислоты, концентрацию ванадия(IV) − перманганатом калия. Рентгенофазовый анализ образцов выполняли на дифрактометре Shimadzu XRD 7000. ИК-спектры таблетированных с СsI образцов регистрировали на ИК-Фурье-спектрометре Spectrum Оne B. Текстурные характеристики (площадь удельной поверхности, пористость) определяли методом низкотемпературной адсорбции азота на анализаторе Gemini VII (Micromeritics). Исследование морфологии образцов проводили на сканирующем электронном микроскопе JEOL JSM 6390 LA, совмещенном с энергодисперсионным рентгеновским анализатором EX-23010BU. Термический анализ выполняли c использованием термоанализатора STA 449 F3 Jupiter (Netzsch), совмещенного с квадрупольным масс-спектрометром QMS 403, в атмосфере воздуха.
Электроды на основе (NH4)xV2O5 · nH2O готовили по методике [17]. Измерение потенциала проводили иономером И-130.2М в режиме вольтметра с точностью ±1 мВ. Водородную функцию электродов изучали в растворах НСl и NaOH. Для определения коэффициентов селективности использовали метод непрерывных растворов [17].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтезировано два типа аммонийсодержащих соединений на основе гидратированного оксида ванадия, различающихся содержанием четырехвалентного ванадия. Гидролитическим методом осаждения с применением гидрата сульфата ванадила, выполняющего одновременно роль подкислителя и источника четырехвалентного ванадия, получены соединения с повышенным содержанием четырехвалентного ванадия. В интервале 0.1 ≤ NH4VO3/VOSO4 · 3H2O ≤ 1.0 формируется соединение ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ характеризующееся постоянным максимальным содержанием четырехвалентного ванадия. При этом величина кислотности рабочего раствора изменяется в интервале 1.5 ≤ рН ≤ 2.8. При молярном отношении 1.0 < NH4VO3/VOSO4 · 3H2O ≤ 3.0 количество четырехвалентного ванадия в осадках ${{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{x}}{\text{V}}_{y}^{{{\text{4}} + }}{\text{V}}_{{{\text{2}} - y}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ изменяется в пределах 0.24 ≤ y ≤ 0.27. Ванадат с минимальным содержанием четырехвалентного ванадия состава ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ был синтезирован с помощью золь-гель метода в сочетании с ионным обменом. На рис. 1 приведены дифрактограммы синтезированных ванадатов, различающихся содержанием ионов V4+. На дифрактограммах ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ имеются рефлексы от плоскостей (00l), свидетельствующие об их слоистом строении. Появление дополнительных рефлексов hkl с повышенным содержанием четырехвалентного ванадия в образцах по сравнению с ксерогелем V2O5 ⋅ 1.6H2O (ICSD № 40-1296) обусловлено частичной потерей слоистой ориентации слоев V–O при внедрении ионов ${\text{NH}}_{4}^{ + }$ в межслоевое пространство [15]. Аналогичное разупорядочение слоистой структуры наблюдается и при допировании ксерогелей оксида ванадия катионами натрия, тетраметиламмония (CH3)4N+ [18] и калия [19]. Все дифракционные пики индексируются как моноклинная фаза V2O5 ⋅ nH2O (пр. гр. С12/m1) и согласуются с литературными данными (ICSD № 74-3093), приведенными в табл. 1. Увеличение межслоевого расстояния ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (d00l = 11.25 Å) по сравнению с межслоевым расстоянием для (NH4)0.3V2O5 · 1.25H2O, равным 10.68 Å [14], определяется количеством ионов четырехвалентного ванадия VO2+, которые, по-видимому, частично расположены в межслоевом пространстве этого соединения. Меньшее значение величины d00l (10.98 Å) ванадата с минимальным содержанием четырехвалентного ванадия ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ по сравнению с величиной межслоевого расстояния для V2O5 ⋅ 1.6H2O (11.57 Å [6]) связано, по-видимому, с присутствием ионов аммония в межслоевом пространстве ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ и различным содержанием воды в указанных соединениях. Очевидно, что концентрация четырехвалентного ванадия в соединениях (NH4)xV2O5 · nH2O, полученных методом гидролитического осаждения, зависит от содержания четырехвалентного ванадия в рабочем растворе, и ее можно целенаправленно варьировать, изменяя условия проведения синтеза.
Рис. 1.
Дифрактограммы порошков ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1), ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (2) и позиции брегговских пиков V2O5 ∙ 1.6H2O по данным ICSD (№ 40-1296).
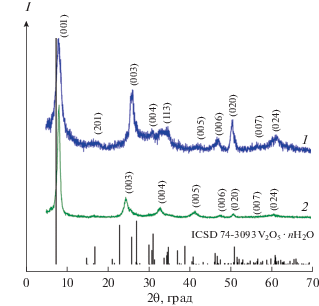
Таблица 1.
Параметры элементарной ячейки аммонийсодержащих соединений на основе гидратированного оксида ванадия по сравнению с таковыми для V2O5 · nH2O (ICSD № 74-3093)
| Фаза | a, Å | b, Å | c, Å | β, град | V, Å3 |
|---|---|---|---|---|---|
| ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ | 11.852(5) | 3.545(2) | 11.251(3) | 91.75(9) | 472.55(4) |
| ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{1}}.4{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ | 12.535(8) | 3.695(7) | 10.985(5) | 89.58(7) | 508.94(4) |
| V2O5 · nH2O | 11.722 | 3.57 | 11.52 | 88.65 | 481.95 |
C помощью уравнения Шеррера была проведена оценка среднего размера частиц аммонийсодержащих соединений на основе гидратированного оксида ванадия с различным содержанием четырехвалентного ванадия:
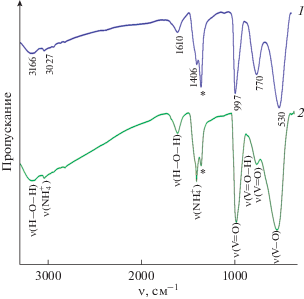
где D − размер частиц в направлении, перпендикулярном плоскости (hkl), от которой получен рефлекс, k − безразмерный коэффициент формы частиц (постоянная Шеррера), ${\Delta (2\theta )}$ − полуширина угла дифракции, ${\theta }$ − брегговский угол, ${\lambda }$ − длина волны рассеянного излучения. Расчет вели по интенсивным и хорошо разрешенным (001) пикам. Средний размер частиц ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ синтезированного гидролитическим осаждением, и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ полученного золь-гель методом в сочетании с ионным обменом, равен 5.7 и 10.8 нм соответственно. Таким образом, ванадаты, содержащие большое количество четырехвалентного ванадия, имеют примерно в два раза меньший размер частиц, чем ванадаты, содержащие меньшее его количество.Структурные особенности аммонийсодержащих соединений на основе гидратированного оксида ванадия были дополнительно изучены ИК-спектроскопическим методом анализа (рис. 2). ИК-спектры полученных соединений в области колебаний связей V−O подобны спектрам ксерогелей V2O5 ⋅ 1.6H2O [20] и (NH4)0.15V2O5 · 1.3H2O [14]. Полоса при ∼1406 см–1 соответствует симметричным деформационным колебаниям ${\text{NH}}_{4}^{ + }$-групп [21]. Отличительной особенностью ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ характеризующегося высоким содержанием четырехвалентного ванадия, является отсутствие в ИК-спектре плеча при ~925 см–1, отвечающего валентным колебаниям связей V=O…H [21]. Полученные результаты хорошо согласуются с данными ИК-спектроскопии соединений на основе гидратированного оксида ванадия, различающихся концентрацией четырехвалентного ванадия [8]. Ранее было установлено, что четырехвалентный ванадий, в зависимости от его содержания в соединениях на основе гидратированного оксида ванадия, может находиться в слоях V–O или между ними. Вероятно, в синтезированном нами соединении с максимальным содержанием четырехвалентного ванадия часть его переходит в межслоевое пространство в виде ионов VO2+.
Рис. 2.
ИК-спектры порошков ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1) и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (2). Звездочкой обозначены ионы ${\text{NO}}_{{\text{3}}}^{ - }$ в матрице CsI.
Согласно данным электронно-микроскопических исследований, (NH4)xV2O5 · nH2O, полученный гидролитическим осаждением, независимо от содержания четырехвалентного ванадия в образцах, образован частицами стержневой морфологии диаметром 50−80 нм и длиной 1−1.5 мкм, агломерированными в ансамбли, подобные цветам диаметром 2−3 мкм (рис. 3а). Порошок (NH4)xV2O5 · nH2O, синтезированный золь-гель методом в сочетании с ионным обменом, имеет частицы неправильной формы размером 8–10 мкм (рис. 3б). Основным фактором, определяющим морфологию (NH4)xV2O5 · nH2O, по-видимому, является присутствие четырехвалентного ванадия в структуре соединений. Энергодисперсионный рентгеновский микроанализ аммонийсодержащих соединений на основе гидратированного оксида ванадия подтвердил чистоту синтезированных продуктов и отсутствие каких-либо посторонних примесей (рис. 3в).
Рис. 3.
СЭМ-изображения ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (а) и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (б) и спектр рентгеновского энергодисперсионного микроанализа ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (в). Дополнительный пик от углерода обусловлен подложкой, применяемой для фиксации образца.

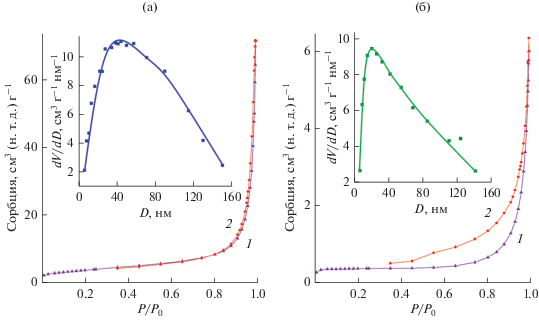
На рис. 4 представлены результаты исследования удельной поверхности и пористости образцов (NH4)xV2O5 · nH2O. Согласно классификации ИЮПАК [22], изотермы сорбции порошков ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ относятся к IV типу, характерному для мезопористых материалов с петлей гистерезиса Н3. Такое поведение ассоциируется с наличием в соединении пор щелевидной формы. Размер пор в ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ изменяется в широком интервале с преимущественным размером ∼43 нм (рис. 4a, вставка). В ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ преимущественный размер пор равен ∼22 нм (рис. 4б, вставка). Следует отметить, что величина площади удельной поверхности ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (13.8 м2/г) значительно больше по сравнению с аналогичной величиной для ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1.19 м2/г). Очевидно, величину удельной поверхности (NH4)xV2O5 · nH2O можно регулировать, изменяя содержание четырехвалентного ванадия в реакционных растворах.
Рис. 4.
Изотермы сорбции и кривые распределения пор по размерам (вставка) ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (a) и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (б).
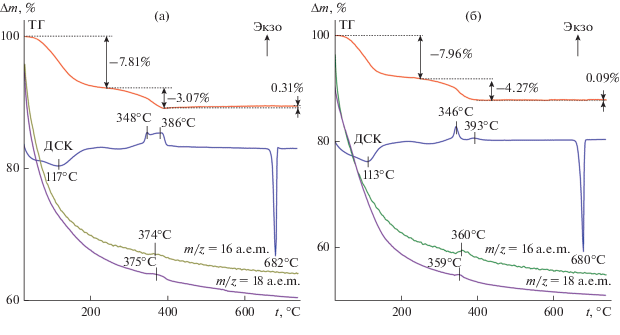
Термический анализ, совмещенный с масс-спектрометрией, позволил оценить термическую стабильность (NH4)xV2O5 · nH2O в зависимости от содержания четырехвалентного ванадия в образцах (рис. 5). Согласно ТГ-кривой, в интервале температур 20‒235°С наблюдается основная убыль массы, которую можно отнести к потере адсорбционной воды. Процессу удаления адсорбционной воды соответствует слабый размытый эндоэффект. Дальнейшее нагревание ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ сопровождается убылью массы и сильными экзотермическими эффектами с двумя максимумами в интервале температур 340−400°С. В ходе процесса происходит выделение воды и аммиака. При дальнейшем повышении температуры наблюдается прибыль массы, обусловленная окислением четырехвалентного ванадия и образованием V2O5. При этом на кривой МС регистрируется размытый пик, соответствующий удалению адсорбционной воды (m/z = 18 a. e. м.) с максимумом при 375°С, и одновременно фиксируется выделение аммиака (m/z = 16 a. e. м.) с максимумом при 375°С. В случае ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ происходит убыль массы, сопровождаемая сильными экзотермическими эффектами с двумя максимумами в интервале температур 338−410°С и практически одновременным выделением воды и аммиака с максимумами при 359 и 360°С соответственно. Термолиз (NH4)xV2O5 · nH2O заканчивается эндоэффектом при ∼681°С, соответствующим плавлению V2O5. По кривым ТГ с учетом количества выделившегося аммиака рассчитано содержание кристаллогидратной воды в образцах – ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{1}}.4{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$
Рис. 5.
Кривые ТГ, ДСК и ионного тока ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (а) и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{1}}{\text{.4}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (б) в атмосфере воздуха.
Учитывая данные по ионному состоянию ванадия(V) в растворах [23] в слабокислой области рН и присутствие в растворе VOSO4 ∙ 3H2O, процесс образования ванадата аммония, обогащенного четырехвалентным ванадием, может быть представлен реакцией:
(2)
$\begin{gathered} 2{\text{NH}}_{4}^{ + } + {{{\text{H}}}_{{\text{2}}}}{{{\text{V}}}_{{{\text{10}}}}}{\text{O}}_{{28}}^{{4 - }} + 2{\text{V}}{{{\text{O}}}^{{2 + }}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{{{\text{V}}}_{{{\text{12}}}}}{{{\text{O}}}_{{30}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{О}} + 2{{{\text{Н}}}^{ + }}. \\ \end{gathered} $Таким образом, введение в реакционную массу гидрата сульфата ванадила (ионов VO2+) позволяет синтезировать ванадаты аммония с повышенным содержанием четырехвалентного ванадия.
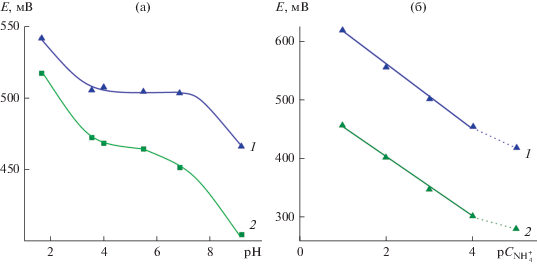
Структурные особенности (NH4)xV2O5 · nH2O послужили основанием для изучения ионоселективных свойств с целью использования его в качестве активного материала твердофазных ионоселективных электродов. Из порошков ванадатов, различающихся содержанием четырехвалентного ванадия, были изготовлены пленочные электроды. На рис. 6а показана зависимость потенциалов электродов ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (электрод I) и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{1}}.4{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (электрод II) от величины рН раствора. Установлено, что потенциал электрода I практически не реагирует на изменение концентрации ионов водорода в растворе в интервале 4 ≤ рH ≤ 7. При использовании электрода II потенциал системы остается практически постоянным в более узком диапазоне 5 ≤ рH ≤ 6, что, вероятно, связано со структурным разупорядочением, обусловленным различным содержанием четырехвалентного ванадия в соединениях. Чтобы исключить отклик электродов на изменения концентрации ионов водорода, исследования катионной функции проводили при величине рН, для которой значения потенциала цепи не зависят от кислотности раствора (рН 6). В выбранных условиях электроды I и II проявляют аммонийную функцию в интервале 1 ≤ ${\text{р}}{{С}_{{{\text{NH}}_{{\text{4}}}^{ + }}}}$ ≤ 4 с угловыми коэффициентами 55 и 50 ${\text{мВ/р}}{{С}_{{{\text{NH}}_{{\text{4}}}^{ + }}}}$ соответственно (рис. 6б). Очевидно, что для электрода I угловой коэффициент электродной функции максимально зависит от содержания четырехвалентного ванадия в образцах, его величина близка к теоретическому значению $\left( {{\text{59}}\,\,{\text{мВ/р}}{{С}_{{{\text{NH}}_{{\text{4}}}^{ + }}}}} \right).$ Потенциал аммонийной функции электрода может быть представлен следующей потенциалобразующей реакцией, описывающей образование твердого раствора внедрения на основе гидратированного оксида ванадия:
(3)
$\begin{gathered} {{\left( {{\text{N}}{{{\text{H}}}_{4}}} \right)}_{x}}{{{\text{V}}}_{2}}{{{\text{O}}}_{5}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + z{\text{NH}}_{4}^{ + } + z{{{\text{e}}}^{ - }} \leftrightarrow \\ \leftrightarrow {{({\text{N}}{{{\text{H}}}_{4}})}_{{x + z}}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{5}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{О}}. \\ \end{gathered} $Рис. 6.
Зависимость потенциала электродов на основе ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1) и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{1}}{\text{.4}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (2) от рН раствора (a) и концентрации ионов аммония при рН 6 (б).
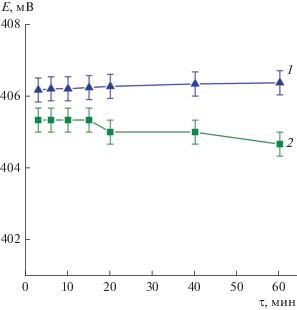
Время установления стационарного потенциала при концентрации потенциалопределяющего иона 10–3 составляет 1–2 мин и с течением времени изменяется лишь в пределах погрешности измерения (рис. 7).
Рис. 7.
Зависимость потенциала электродов на основе ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1) и ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{1}}{\text{.4}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (2) от времени выдержки в растворах хлорида аммония с концентрацией 10–3 моль/л.
Для установления влияния посторонних ионов на аммонийную функцию изучаемых электродов были определены значения потенциометрических коэффициентов селективности $\left( {{{K}_{{{\text{NH}}_{{\text{4}}}^{ + }{\text{/}}{{{\text{M}}}^{{n + }}}}}}} \right)$ (табл. S1). По степени влияния на работу электродов посторонние катионы можно расположить в виде следующих рядов:
Cr3+ > Al3+ > Ba2+ = Ni2+ > Cu2+ = Co2+ > Sr2+ > > K+ > Rb+ > Cs+ > Na+ (электрод I),
Cr3+ > Al3+ > Co2+ > Ni2+ > Cu2+ > Sr2+ > Ba2+ > > K+ > Rb+ > Na+ = Cs+ (электрод II).
Согласно полученным данным, предлагаемые электроды достаточно селективны к ионам аммония в присутствии однозарядных катионов и умеренно селективны к двух- и трехзарядным катионам. Сравнительный анализ электродных свойств позволил сделать вывод, что электрод на основе ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ характеризующийся максимальным содержанием четырехвалентного ванадия, обладает наилучшими электродными характеристиками, что, по-видимому, обусловлено размерным фактором и морфологией активного материала.
ЗАКЛЮЧЕНИЕ
Впервые показана возможность использования гидрата сульфата ванадила, выполняющего одновременно роль подкислителя и источника четырехвалентного ванадия, при получении аммонийсодержащего гидратированного оксида ванадия гидролитическим методом осаждения. Варьирование содержания четырехвалентного ванадия в исходном растворе позволяет получить конечный продукт с различным соотношением четырех- и пятивалентного ванадия. Предложенный метод синтеза является простым, низкозатратным и позволяет получать наночастицы (NH4)xV2O5 · nH2O стержневой морфологии. Исследование ионоселективных свойств ванадатов аммония показало, что они могут быть использованы в качестве активного материала твердофазных ионоселективных электродов. Электрод с мембраной на основе ${{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{0}}{\text{.36}}}}}{\text{V}}_{{{\text{0}}{\text{.36}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.64}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.7{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ обладает наилучшими характеристиками и проявляет аммонийную функцию в интервале 1 ≤ ${\text{р}}{{С}_{{{\text{NH}}_{{\text{4}}}^{ + }}}}$ ≤ 4 с угловым коэффициентом, близким к теоретическому.
Список литературы
Schroeder W., Fontenot C.J., Schrader G.L. // J. Catal. 2001. V. 203. P. 382. https://doi.org/10.1006/jcat.2001.3333
Grigorieva A., Badalyan S., Goodilin E. et al. // Eur. J. Inorg. Chem. 2010. V. 210. № 33. P. 5247. https://doi.org/10.1002/ejic201000372
Liu J., Wang X., Peng Q. et al. // Adv. Mater. 2005. V. 17. № 6. P. 764. https://doi.org/10.1002/adma.200400993
Livage J. // Coord. Chem. Rev. 1999. V. 190. P. 391. https://doi.org/10.1016/S0010-8545(99)00096-X
Legagneur V., Le Gal La Salle A., Verbaere A. et al. // Electrochem. Commun. 2006. V. 8. № 1. P. 21. https://doi.org/10.1016/j.elecom.2005.10.021
Aldebert P., Baffier N., Charbi N. et al. // Mater. Res. Bull. 1981. V. 16. № 6. P. 669. https://doi.org/10.1016/0025-5408(81)90266-X
Livage J. // Coord. Chem. Rev. 1998. V. 180. P. 999. https://doi.org/10.1016/S0010-8545(98)00105-2
Волков В.Л., Захарова Г.С. // Журн. неорган. химии. 1988. Т. 33. № 6. С. 1580.
Babonneau F., Barboux P., Josien F.A. et al. // J. Chim. Phys. Phys.-Chim. Biol. 1985. V. 82. № 7–8. P. 761.
Podvalnaya N.V., Zakharova G.S. // Russ. J. Inorg. Chem. 2017. V. 62. № 8. P. 1104. [Подвальная Н.В., Захарова Г.С. // Журн. неорган. химии. 2017. Т. 62. № 8. Р. 1107.]https://doi.org/10.1134/S0036023617080150
Volkov V.L., Zakharova G.S., Kristallov L.V. // Inorg. Mater. 2001. V. 37. № 4. P. 408. [Волков В.Л., Захарова Г.С., Кристаллов Л.В. и др. // Неорган. материалы. 2001. Т. 37. № 4. С. 492.]
Butler A., Clague M.J., Meister G.E. // Chem. Rev. 1994. V. 94. № 3. P. 625.
Livage J. // Chem. Mater. 1991. V. 3. № 4. P. 578. https://doi.org/10.1021/cm00016a006
Najdoski M., Koleva V., Samet A. // Dalton Trans. 2014. V. 43. P. 12536. https://doi.org/10.1039/c3dt53628a
Najdoski M., Koleva V., Samet A. // J. Phys. Chem. C. 2014. V. 118. P. 9636. https://doi.org/10.21./jp4127122
Волков В.Л., Захарова Г.С., Ивакин А.А. // Журн. неорган. химии. 1985. Т. 30. № 3. С. 642.
Окунев М.С., Хитрова Н.В., Корниенко О.И. // Журн. аналит. химии. 1982. Т. 37. № 1. С. 5.
Durupthy O., Steunou N., Coradin T. et al. // J. Mater. Chem. 2005. V. 15. P. 1090. https://doi.org/10/1039/b414893b
Ивакин А.А., Кручинина М.В., Корякова О.В. // Журн. неорган. химии. 1987. Т. 32. № 12. С. 3075.
Baddour R., Pereira-Ramas J.S., Messina R. et al. // J. Electroanal. Chem. 1991. V. 314. № 1–2. P. 81.
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. Moscow: Mir, 1991.
Sing K.S.W., Everett D.H., Haul R.A.W. et al. // Pure Appl. Chem. 1985. V. 57. № 4. P. 603. https://doi.org/10.1351/pac198557040603
Livage J. // J. Solid State Chem. 1986. V. 64. № 3. P. 322.
Дополнительные материалы
- скачать ESM.docx
- Supplementary materials
Инструменты
Журнал неорганической химии


