Журнал неорганической химии, 2020, T. 65, № 7, стр. 894-902
Направленный синтез ультрадисперсных индивидуальных и биметаллических оксидов циркония и гафния методом сверхкритического антисольвентного осаждения
Д. В. Дробот a, Е. Е. Никишина a, *
a МИРЭА – Российский технологический университет, институт тонких химических технологий
им. М.В. Ломоносова
119571 Москва, пр-т Вернадского, 86, Россия
* E-mail: helena_nick@mail.ru
Поступила в редакцию 12.12.2019
После доработки 26.02.2020
Принята к публикации 28.02.2020
Аннотация
Разработан метод синтеза моно- и биметаллических оксидов циркония и/или гафния методом сверхкритического антисольвентного осаждения. Оксиды синтезированы с помощью лабораторной системы диспергирования, в качестве предшественников применены алкоксиды (пропоксид циркония, бутоксид гафния) и ацетилацетонат циркония. Во всех экспериментах получен порошок белого цвета, представляющий собой аморфную фазу состава MO2 · mH2O · nCxHyOz (M = Zr, Hf). Методами дифференциального термического и рентгенофазового анализа исследованы синтезированные фазы и продукты их термолиза (моно- и биметаллические диоксиды циркония и/или гафния). Методами оптической и электронной микроскопии и динамического рассеяния света измерен размер частиц, исследована их морфология. Показано, что частицы синтезированных оксидов имеют сферическую форму, а их размер зависит от мольного отношения компонентов исходного раствора. Согласно данным электронной микроскопии, отожженные образцы имеют меньший размер частиц по сравнению с исходными образцами.
ВВЕДЕНИЕ
Диоксиды циркония и гафния являются важными функциональными материалами, которые нашли применение в различных областях науки и техники благодаря потребительским свойствам – высоким температурам плавления, механической прочности, высоким диэлектрическим и оптическим характеристикам, сохраняющимся в широком интервале температур [1, 2].
Известно несколько модификаций диоксида циркония и диоксида гафния. Наиболее изучены три модификации: низкотемпературная моноклинная (m-MO2, М = Zr, Hf), высокотемпературные – тетрагональная (t-MO2) и кубическая (c-MO2). Температуры полиморфных переходов у диоксида гафния выше, чем у диоксида циркония. Зависимость коэффициента линейного расширения от температуры ограничивает применение оксидов в высокотемпературных приложениях. Например, при переходе от моноклинной к тетрагональной решетке диоксида циркония происходит уменьшение объема на 7.5–7.7%, что делает невозможным его использование в качестве огнеупорного материала. Это приводит к необходимости стабилизации высокотемпературных фаз диоксидов циркония и гафния. Наиболее распространенным методом является легирование индивидуальных диоксидов циркония и гафния оксидами магния, кальция и редкоземельных элементов [3–7].
В литературе описан ряд способов получения ультрадисперсных и наноразмерных диоксидов циркония и гафния. Химические методы основаны на осаждении гидроксидов циркония и гафния нейтрализацией их солей (хлоридов, оксохлоридов) щелочным агентом. Полученный осадок гидроксида фильтруют, промывают, сушат и прокаливают до диоксида. Главным недостатком является высокая степень агрегации и агломерации получаемых порошков. Для получения керамики с развитой активной поверхностью в качестве исходных веществ необходимо использовать малоагрегированные порошки. Для устранения проблем агрегации используют различные технические решения [8–11].
В основе наиболее известного варианта золь-гель метода лежат процессы контролируемого гидролиза соединений (обычно алкоксидов или соответствующих хлоридов) в водной или органической (чаще спиртовой) среде [12–14].
Метод гидротермального синтеза основан на способности воды и водных растворов растворять при высоких температурах (до 500°С) и давлении (до 300 МПа) вещества, практически нерастворимые в обычных условиях (некоторые оксиды, силикаты, сульфиды). Существует также родственная гидротермальному группа сольвотермальных методов синтеза, основанная на использовании органических растворителей [15–17].
Известно использование метода самораспространяющегося высокотемпературного синтеза для получения композиционных материалов на основе диоксида циркония [18, 19].
Найти в литературе сведения о получении оксидов циркония и гафния методом сверхкритического антисольвентного осаждения (Supercritical AntiSolvent, SAS) не удалось. Однако в настоящее время известно, что одним из наиболее развивающихся направлений SAS-технологий является получение микро- и наночастиц оксидов и гидроксидов металлов из их алкоголятов [20–22]. К преимуществам данного метода относятся: возможность получения высокочистых и химически активных веществ с узким распределением частиц по размерам, мягкие условия синтеза (в частности, низкая температура синтеза по сравнению с известными методами твердофазного синтеза), фазовая однородность получаемого продукта. Реакции с участием сверхкритического диоксида углерода позволяют получить сформированную структуру материала и эффективно удалить органический растворитель. Возврат CO2 в систему и его повторное использование в последующих реакциях, а также его инертность, негорючесть и дешевизна увеличивают экологичность процесса синтеза оксидов (“зеленые технологии”) [23–25].
Цель настоящей работы – разработка SAS-метода направленного синтеза ультрадисперсных индивидуальных и биметаллических оксидов циркония и гафния и изучение их свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали ацетилацетонат циркония (чистота 98%, Sigma Aldrich, США), пропоксид циркония (70%-ный раствор в пропаноле-1, Sigma Aldrich, США), бутоксид гафния (99.99%, Sigma Aldrich, США), изопропиловый спирт марки “ос. ч.” (ГОСТ 9805-84, Химмед, Россия), н-бутиловый спирт квалификаци “ч. д. а.” (ГОСТ 6006-78, Химмед, Россия).
Элементный анализ на содержание C и H выполняли на приборе Heraeus CHN-O-RAPID. Погрешность анализа составляла ~0.2%.
Дифференциальный термический анализ проводили на дериватографе Q-1500 D F. Paulik, J. Paulik, L. Erdey (MOM, Венгрия). Температуру измеряли платина-платинородиевой (ПП-1) термопарой с погрешностью ±5°С в интервале температур 20–1000°С, скорость нагрева составляла 10 град/мин.
Рентгенофазовый анализ (РФА) выполняли на дифрактометре Shimadzu XRD (Япония). Фокусировка по Брэггу–Брентано с первичным Ge (111) монохроматором по Иогансону. Параметры съемки: излучение CuKα1 (λ = 1.5406 Å), шаг Δ2θ = 0.05°, скорость съемки 2 град/мин. Параметры элементарной ячейки рассчитывали методом наименьших квадратов с помощью программы UnitCell.
Гранулометрический анализ (расчет функции распределения частиц по размерам) проводили с помощью лазерного анализатора частиц DelsaNano фирмы Beckman Coulter Inc. (США), позволяющего методом динамического светорассеяния определять распределение частиц по размерам в диапазоне от 0.6 нм до 7 мкм. Принцип измерения размеров частиц основан на измерении и анализе флуктуаций интенсивности рассеянного света в объеме, содержащем коллоидные частицы в растворе, в разные моменты времени [26].
Морфологию и размер частиц отожженных образцов, полученных из алкоксидов, исследовали на двухлучевом микроскопе Helios NanoLab 660 (FEI, США) с системой оцифровки и обработки изображений, сочетающем сканирующий электронный микроскоп и технологию фокусированного ионного пучка Sidewinder FIB.
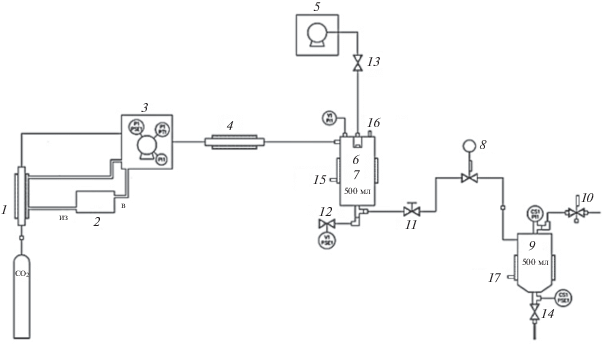
Синтез оксидов проводили на лабораторной системе диспергирования, модель SAS-50 (Thar Technologies, США). Рабочие параметры системы оставались неизменными в ходе синтеза: давление в системе составляло 8.2 МПа, температура на нагревающем теплообменнике и в сосуде-сборнике 50°С, температура в сепараторе 30°С, скорость потока СК-СО2 30 г/мин, скорость подачи раствора в реактор 0.5 мл/мин (рис. 1).
Рис. 1.
Принципиальная схема установки SAS-50: 1 – охлаждающий теплообменник низкого давления; 2 – циркуляционный термостат; 3 – насос высокого давления CO2; 4 – электрический нагревающий теплообменник; 5 – насос растворов высокого давления; 6 – коаксиальное сопло; 7 – сосуд формирования частиц; 8 – автоматический регулятор давления; 9 – циклонный сепаратор высокого давления; 10 – механический регулятор давления; 11–14 – краны высокого давления; 15 – термопара нагревательной рубашки сосуда 7; 16 – термопара контроля внутри сосуда 7; 17 – термопара нагревательной рубашки сепаратора 9.
Метод SAS основан на способности сверхкритического диоксида углерода (СК-CO2) выступать в роли осадителя полярных веществ из полярных растворителей. Обязательным условием для успешной реализации метода являются хорошая растворимость растворителя во флюиде и практически полная нерастворимость микронизируемого вещества в СК-CO2, а также в образующейся смеси полярного растворителя с СК-CO2. Это приводит к формированию кристаллов микронизируемого вещества на стенках реактора. Одной из главных сфер применения SAS-технологий, где сфокусированы достижения использования SAS, является создание частиц [27].
Проведено четыре серии экспериментов по синтезу диоксида циркония. Исходный раствор для первых трех получен смешением ацетилацетоната циркония с изопропиловым спиртом в мольных соотношениях 1 : 100, 1 : 150 и 1 : 200 (табл. 1). Для последнего опыта в качестве исходного вещества использовали раствор пропоксида циркония в изопропиловом спирте в мольном соотношении 1 : 200.
Таблица 1.
Условия получения порошков интермедиатов диоксидов циркония и гафния методом SAS (t = 50°C, Vр-ра = 0.5 мл/мин, ${{F}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 30 г/мин, давление внутри системы 8.2 МПа)
| Исходное вещество | Растворитель | Мольное соотношение исходное вещество : растворитель | Обозначение образца-интермедиата, полученного методом SAS |
|---|---|---|---|
| Ацетилацетонат циркония | Изопропиловый спирт | 1 : 100 | I |
| 1 : 150 | II | ||
| 1 : 200 | III | ||
| Пропоксид циркония | 1 : 200 | IV | |
| Бутоксид гафния | н-Бутиловый спирт | 1 : 100 | V |
| Бутоксид гафния и пропоксид циркония (1 : 3) | Изопропиловый спирт | 1 : 100 | VI |
В экспериментах по синтезу диоксида гафния исходный раствор получали смешением бутоксида гафния с бутанолом в мольном соотношении 1 : 100.
В экспериментах по синтезу биметаллических диоксидов циркония и гафния исходный раствор получали смешением бутоксида гафния и пропоксида циркония в мольном соотношении 1 : 3. Далее к нему приливали изопропиловый спирт в мольном соотношении 1 : 100.
В результате проведения экспериментов в сосуде для формирования частиц находился белый порошок, который просушивали флюидом перед извлечением. Предполагаемый механизм заключался в том, что в сверхкритической среде в спирте, используемом в качестве растворителя, происходила реакция этерификации, продуктами которой являлись соответствующий эфир и вода, которая мгновенно реагировала со спиртом, что и объясняет образование оксидной фазы [28–30]. В сепараторе конденсировалась часть растворителя со следами продукта. Неконденсированные остатки растворителя и летучие продукты реакции выходили из системы вместе с диоксидом углерода. Полученные порошки сушили при 80°С в течение суток и анализировали на содержание углерода и водорода. Все образцы содержали углерод и водород, количество которых определяется природой исходных веществ. Можно полагать, что первичным продуктом является интермедиат общей формулы MO2 · mH2O · nCxHyOz (M = Zr, Hf), содержащий органические остатки (nCxHyOz – оставшиеся в порах остатки органических производных) [23, 31]. Наличие углерода и водорода в полученных образцах может быть обусловлено присутствием в них некоторого (незначительного) количества неразложившегося прекурсора или сорбцией продуктов реакции и паров воды. Последние удаляются в процессе термической обработки. В табл. 2 представлены результаты элементного анализа.
Таблица 2.
Результаты элементного анализа
| Образец | Обозначение образца-интермедиата | Навеска, мг | С, % | H, % |
|---|---|---|---|---|
| ZrO2 (acac) | III | 6.248 | 22.34 | 3.52 |
| ZrO2 (iPr) | IV | 4.04 | 5.81 | 1.21 |
| HfO2 | V | 2.981 | 3.87 | 1.61 |
| ZrO2-HfO2 | VI | 3.012 | 2.40 | 1.20 |
Анализируя полученные результаты, можно сделать вывод, что при использовании в качестве исходного вещества ацетилацетоната циркония протекает некоторое количество побочных реакций. Литературные данные говорят о том, что в таких случаях образуются соединения Zr(OnPr)4 –x(acac)x, которые подвергаются гидролизу. Алкоксогруппы легко вступают в реакцию, флюид является благоприятной средой для этого, однако часть ацетилацетоната остается непрореагировавшей из-за образования мостиков с CO2, чем и можно объяснить такой процент углерода в образце [26, 32].
Порошки изотермически отжигали при температурах 300–1000°С с шагом 100°С. Результаты термогравиметрического анализа показали, что во всех случаях незначительная потеря массы (~4–6 мас. %) заканчивалась при температуре ~500°С. По данным РФА, вплоть до 700°С фазы являются рентгеноаморфными. Высокую температуру кристаллизации образцов можно объяснить тем, что исходные продукты представляют собой фазы сложного состава MO2 · mH2O · nCxHyOz (M = = Zr, Hf), которые вплоть до температуры ~500°С претерпевают процесс термодеструкции.
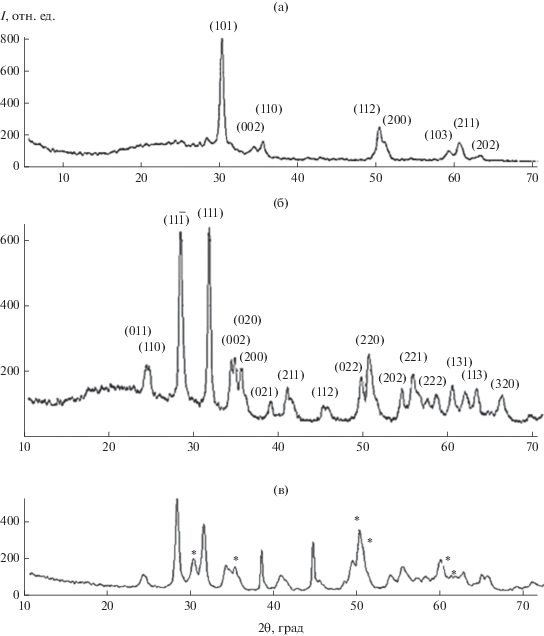
Таким образом, в качестве температуры отжига была выбрана 700°С, продолжительность отжига составляла 24 ч. Далее проводили рентгенофазовый анализ отожженных образцов. На рис. 2а приведена дифрактограмма диоксида циркония, предшественником которого служил образец III. РФА показал образование тетрагонального диоксида циркония, рассчитанные параметры решетки которого (арасч = 0.361 ± 0.002, срасч = 0.513 ± 0.001 нм) согласуются с данными картотеки ICDD-JCPDS (а = 0.360, с = 0.515 нм, ICDD-JCPDS № 88-1007).
Что касается образцов I и II, подвергнутых термической обработке при 700°С, при мольном соотношении ацетилацетоната циркония и изопропилового спирта 1 : 100 (образец I) образуется диоксид циркония моноклинной модификации (aрасч = 0.517 ± 0.002, bрасч = 0.518 ± 0.019, cрасч = = 0.528 ± 0.042 нм, βрасч = 97.56° ± 2.78°). Увеличение мольного соотношения до 1 : 150 (образец II) приводит к образованию диоксида циркония тетрагональной модификации (aрасч = 0.359 ± 0.001, cрасч = = 0.519 ± 0.002 нм).
При использовании пропоксида циркония (образец IV) в качестве предшественника не удалось получить при 700°С однофазный образец – на дифрактограмме помимо моноклинной присутствовали пики тетрагональной модификации.
На рис. 2б приведена дифрактограмма отожженного при 700°С образца диоксида гафния. Он кристаллизуется в моноклинной сингонии. Для него рассчитаны параметры элементарной ячейки (aрасч = 0.495 ± 0.058, bрасч = 0.530 ± 0.020, cрасч = 0.508 ± 0.068 нм, βрасч = 94.22° ± 7.50°), которые согласуются с таковыми из базы данных ICDD-JCPDS в пределах ошибки расчета (а = 0.511, b = 0.518, с = 0.528 нм, β = 99.26°, ICDD-JCPDS № 78-0049).
На рис. 2в приведена дифрактограмма отожженного образца VI на основе диоксидов циркония и гафния. Исходя из полученных данных можно предположить, что образец представляет собой механическую смесь твердого раствора замещения на основе моноклинных модификаций диоксида циркония и гафния и тетрагональной модификации диоксида циркония (его пики отмечены звездочками). Вывод о существовании твердого раствора замещения авторы делают на основании смещения дифракционных пиков моноклинной модификации. Можно констатировать, что в данном образце пики с максимальной интенсивностью имеют угол 2θ, значения которого лежат между соответствующими пиками моноклинных модификаций индивидуальных диоксидов циркония и гафния.
Обобщая результаты рентгенофазового анализа, можно констатировать, что образцы, полученные из растворов с разной концентрацией, при нагревании в одинаковых условиях кристаллизуются в разных полиморфных модификациях. В данном случае наблюдается важный эффект, который состоит в том, что аморфный диоксид циркония кристаллизуется в тетрагональной модификации при температуре значительно ниже температуры фазового перехода. Так, в образце с мольным соотношением пропоксида циркония к изопропиловому спирту 1 : 200 (образец IV), подвергнутом термической обработке при 700°С, присутствует диоксид циркония тетрагональной модификации. Это связано с методом получения аморфного порошка, размером частиц и поведением кислородной подрешетки [33, 34].
У отожженных образцов методом динамического светорассеяния измеряли размер частиц. В табл. 3 представлено распределение частиц по размерам в образцах, полученных из алкоксидов (образцы IV–VI) и отожженных при 700°С. Табл. 4 иллюстрирует распределение по размерам частиц, полученных при использовании ацетилацетоната циркония в качестве предшественника.
Таблица 3.
Распределение частиц по размерам в образцах, полученных из алкоксидов (образцы IV–VI) и отожженных при 700°С
| ZrO2 | HfO2 | ZrO2-HfO2 | |||
|---|---|---|---|---|---|
| размер, нм | доля, % | размер, нм | доля, % | размер, нм | доля, % |
| 220–270 | 54 | 600–650 | 27 | 450–550 | 46 |
| 270–320 | 32 | 650–700 | 39 | 550–650 | 21 |
| 320–370 | 11 | 800–850 | 23 | 650–750 | 29 |
| 370–400 | 3 | 950–1000 | 11 | св. 1000 | 4 |
| Средний размер, нм | 257 | Средний размер, нм | 721 | Средний размер, нм | 539 |
Таблица 4.
Распределение частиц по размерам в образцах, полученных из ацетилацетоната циркония (образцы I–III) и отожженных при 700°С
| Мольное соотношение ацетилацетоната циркония и изопропилового спирта | |||||
|---|---|---|---|---|---|
| 1 : 100 | 1 : 150 | 1 : 200 | |||
| размер, нм | доля, % | размер, нм | доля, % | размер, нм | доля, % |
| 800–1000 | 45 | 500–650 | 25 | 30–40 | 67 |
| 1000–1200 | 34 | 650–800 | 45 | 40–50 | 16 |
| 1200–1400 | 16 | 800–950 | 24 | 50–60 | 8 |
| 1400–1600 | 5 | 950–1100 | 6 | 80–90 | 9 |
| Средний размер, нм | 952 | Средний размер, нм | 722 | Средний размер, нм | 38 |
Как видно из табл. 4, в случае образца III, подвергнутого термической обработке при 700°С, наблюдается достаточно узкое распределение частиц по размерам (30–90 нм). При исследовании образцов, полученных из ацетилацетоната и отожженных при 700°С, выявлена зависимость размера частиц от концентрации предшественника в растворителе. При увеличении разбавления от 1 : 100 до 1 : 200 средний размер частиц уменьшается от 952 до 38 нм.
С целью выяснения морфологии образцов исследовали порошки, полученные из алкоксидов (образцы IV–VI, не подвергнутые термической обработке). Фотографии с увеличением в 400 раз приведены на рис. 3. Из приведенных фотографий можно сделать вывод, что частицы в основном имеют правильную сферическую форму. Средний диаметр частиц, согласно грубому статистическому методу обработки, равен ~500 нм для образца IV, ~1250 нм для образца V и ~875 нм для образца VI.
Морфологию и размер частиц образцов, отожженных при 700°С, полученных из алкоксидов, исследовали на приборе FEI Helios NanoLab 660. На рис. 4 приведены фотографии образцов с увеличением в 50 000 раз.
Рис. 4.
Фотографии частиц образцов IV (а), V (б), VI (в), подвергнутых термической обработке при 700°С.

Как видно из фотографий, частицы обладают сферической формой. В образцах присутствуют агломераты, причем наиболее сильная агрегация наблюдается на рис. 4в. Средний диаметр частиц, согласно грубому статистическому методу обработки, равен ∼300 нм для ZrO2, ∼800 нм для HfO2 и ∼600 нм для ZrO2-HfO2, значения согласуются с данными, полученными на приборе DelsaNano методом динамического светорассеяния.
Уменьшение размера частиц отожженных образцов по сравнению с размерами частиц интермедиатов может быть связано с деструкцией фазы MO2 · mH2O · nCxHyOz (M = Zr, Hf) в ходе термической обработки.
ЗАКЛЮЧЕНИЕ
Впервые осуществлен синтез аморфных моно- и биметаллических оксидов циркония и/или гафния методом SAS с использованием в качестве предшественников ацетилацетоната циркония, пропоксида циркония, бутоксида гафния.
Исследован фазовый состав и термические свойства полученных порошков. Выявлены закономерности влияния предшественников на кристаллизацию образцов. Показано, что в зависимости от мольного соотношения предшественника (ацетилацетоната циркония) и растворителя (изопропилового спирта) можно получить разные модификации диоксида циркония. Установлено, что уже при 700°С образуется тетрагональная модификация ZrO2. Данная температура значительно ниже температуры фазового перехода моноклинной модификации диоксида циркония в тетрагональную (~1170°С). Методами микроскопии (оптической и электронной) и динамического рассеяния света измерен размер частиц и исследована их морфология, выявлена зависимость размера от мольного соотношения предшественника и растворителя. Частицы имеют сферическую форму. Для отожженных образцов результаты, полученные методами спектроскопии и оптической микроскопии, удовлетворительно согласуются: dрасс(ZrO2) = 257 нм, dмикр(ZrO2) ∼ ~ 300 нм, dрасс(HfO2) = 721 нм, dмикр(HfO2) ~ 800 нм, dрасс(ZrO2-HfO2) = 539 нм, dмикр(ZrO2-HfO2) ~ ~ 600 нм.
Согласно данным электронной микроскопии, у отожженных образцов происходит уменьшение размеров частиц по сравнению с размерами частиц интермедиатов. Помимо этого с увеличением мольного соотношения компонентов исходного раствора размер частиц меняется следующим образом: ZrO2 (1 : 100) = 952 нм, ZrO2 (1 : 150) = 722 нм, ZrO2 (1 : 200) = 38 нм.
Список литературы
Wang J. // J. Mater. Sci. 1992. V. 27. № 20. P. 5397. https://doi.org/10.1007/BF00541601
Wang Y., Zahid F., Wang J., Guo H. // Phys. Rev. B. 2013. V. 85. № 22. P. 224110. https://doi.org/10.1103/PhysRevB.85.224110
Simoncic P., Navrotsky A. // J. Am. Ceram. Soc. 2007. V. 90. № 7. P. 2143. https://doi.org/10.1111/j.1551-2916.2007.01678.x
Никишина Е.Е., Лебедева Е.Н., Дробот Д.В. // Тонкие химические технологии. 2018. Т. 13. № 5. С. 30. https://doi.org/10.32362/2410-6593-2018-13-5-30-37
Lowther J.E., Dewhurst J.K., Leger J.M., Haines J. // Phys. Rev. 1999. V. 60. № 21. P. 14485. https://doi.org/10.1103/PhysRevB.60.14485
Folomeikin Yu.I., Karachevtsev F.N., Stolyarova V.L. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 934. [Фоломейкин Ю.И., Карачевцев Ф.Н., Столярова В.Л. // Журн. неорган. химии. 2019. Т. 64. № 7. С. 774.] https://doi.org/10.1134/S0036023619070088
Aribi K., Ghelamallah M., Bellifa A. et al. // J. Struct. Chem. 2018. V. 59. № 2. P. 474. [Aribi K., Ghelamallah M., Bellifa A. et al. // Журн. структур. химии. 2019. Т. 59. № 2. С. 486.] https://doi.org/10.1134/S0022476618020312
Петрунин В.Ф. Способы получения нанопорошка диоксида циркония. Пат. России № 2404125. 2010. Бюл. изобр. № 32.
Глушкова В.Б., Кравчинская М.В., Кузнецов А.К., Тихонов П.А. Диоксид гафния и его соединения с оксидами редкоземельных элементов. Л.: Наука, Ленингр. отд-ние, 1984. 176 с.
Tret'yakov Yu.D., Oleinikov N.N., Vertegel A.A. // Russ. J. Inorg. Chem. 1996. V. 41. № 6. P. 896. [Третьяков Ю.Д., Олейников Н.Н., Вертегел А.А. // Журн. неорган. химии. 1996. Т. 41. № 6. С. 896.]
Попов В.В. Образование и эволюция оксидных наносистем, полученных гидролитической поликонденсацией: Дис. … д-ра хим. наук. М., 2011. 403 с.
Courtin E., Boy P., Rouhet C. et al. // Chem. Mater. 2012. № 24. P. 4540. https://doi.org/10.1021/cm302177s
Suciu C., Hoffmann A.C., Kosinski P. // J. Mater. Proc. Tech. 2008. V. 202. № 1–3. P. 316. https://doi.org/10.1016/j.jmatprotec.2007.09.009
Алешин Д.К., Сотников С.Г., Карташов В.В. // Энергосберегающее оборудование и экологически безопасные производства: тез. докл. Междунар. научн. конф. Иваново, 2004. Т. 2. С. 77.
Komarneni S., Li Q., Stefansson K.M., Roy R. // J. Mater. Res. 1993. V. 8. № 12. P. 3176. https://doi.org/10.1557/JMR.1993.3176
Khollam Y.B., Deshpande A.S., Patil A.J. et al. // Mater. Chem. Phys. 2001. V. 71. № 3. P. 235. https://doi.org/10.1016/S0254-0584(01)00287-5
Коленько Ю.В. Синтез нанокристаллических материалов на основе диоксида титана с использованием гидротермальных и сверхкритических растворов: Дис. … канд. хим. наук. М., 2004. 161 с.
Третьяков Ю.Д., Путляев В.И. Введение в химию твердофазных материалов. М.: Изд-во Моск. ун-та, 2006. 400 с.
Anselmi-Tamburini U., Arimondi M., Maglia F. et al. // J. Am. Ceram. Soc. 1998. V. 81. № 7. P. 765. https://doi.org/10.1111/j.1151-2916.1998.tb02546.x
Паренаго О., Покровский О., Устинович К. // Наноиндустрия. 2013. Т. 5. № 43. С. 62.
Aymonier C., Loppinet-Serani A., Reverón H. et al. // J. Supercrit. Fluids. 2006. V. 38. № 2. P. 242. https://doi.org/10.1016/j.supflu.2006.03.019
Reverchon E., Adami R. // J. Supercrit. Fluids. 2006. V. 37. № 1. P. 1. https://doi.org/10.1016/j.supflu.2006.03.019
Дробот Д.В., Смирнова К.А., Куликова Е.С., Мусатова В.Ю. // Цветные металлы. 2016. № 11. С. 59. https://doi.org/10.17580/tsm.2016.11.06
Tao Y., Pescarmona P.P. // Catalysis. 2018. V. 8. № 5. P. 212. https://doi.org/10.3390/catal8050212
Zhang X., Heinonen S., Levanen E. // RSC Advances. 2014. V. 105. P. 61137. https://doi.org/10.1039/C4RA10662H
Kulikov K.G., Koshlan T.V. // Techn. Phys. 2015. V. 60. № 12. P. 1758. [Куликов К.Г., Кошлан Т.В. // Журн. техн. физики. 2015. Т. 85. № 12. С. 26.] https://doi.org/10.1134/S1063784215120099
Залепугин Д.Ю., Тилькунова Н.А., Чернышова И.В., Поляков В.С. // Сверхкритические флюиды: теория и практика. 2006. Т. 1. № 1. С. 27.
McDaniel L.H., Taylor L.T. // J. Chromatogr. A. 1999. V. 858. № 2. P. 201. https://doi.org/10.1016/s0021-9673(99)00818-3
Sui R., Charpentier P. // Chem. Rev. 2012. № 112. P. 3057. https://doi.org/10.1021/cr2000465
Sui R., Rizkalla A.S., Charpentier P.A. // Langmuir. 2006. V. 22. № 9. P. 4390. https://doi.org/10.1021/la053513y
Смирнова К.А. Синтез и свойства ультрадисперсных и наноразмерных оксидов и сложнооксидных фаз на основе ниобия и тантала: Автореф. … дис. канд. хим. наук. М., 2017. 26 с.
Hoebbel D., Reinert T., Schmidt H., Arpac E. // J. Sol-Gel Sci. Technol. 1997. V. 10. № 2. P. 115. https://doi.org/10.1023/A:1018305811088
Kurapova O.Yu., Konakov V.G. // Rev. Adv. Mater. Sci. 2014. № 36. № 2. P. 177.
Zhang F., Chupas P.J., Lui S.L.A. et al. // Chem. Mater. 2007. V. 19. № 13. P. 3118. https://doi.org/10.1021/cm061739w
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии