Журнал неорганической химии, 2020, T. 65, № 7, стр. 867-871
Синтез и высокотемпературные термодинамические свойства InFeGe2O7 и GdFeGe2O7
Л. Т. Денисова a, *, Л. А. Иртюго a, Ю. Ф. Каргин b, В. В. Белецкий a, Н. В. Белоусова a, В. М. Денисов a
a Сибирский федеральный университет, Институт цветных металлов и материаловедения
660041 Красноярск, Свободный пр-т, 79, Россия
b Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: ldenisova@sfu-kras.ru
Поступила в редакцию 20.12.2019
После доработки 20.02.2020
Принята к публикации 27.02.2020
Аннотация
Германаты InFeGe2O7 и GdFeGe2O7 получены в виде поликристаллических порошков из стехиометрических смесей In2O3 (Gd2O3), Fe2O3 и GeO2 твердофазным методом. Обжиг проводили на воздухе в интервале температур 1273–1473 K. С использованием дифференциальной сканирующей калориметрии измерена высокотемпературная теплоемкость оксидных соединений. На основании полученных экспериментальных данных Cp = f(T) рассчитаны термодинамические функции (изменения энтальпии, энтропии) исследованных германатов Fe-In и Fe-Gd.
ВВЕДЕНИЕ
В последнее время внимание исследователей привлекают сложные оксидные соединения с общей формулой ABGe2O7 (A и B – редкоземельные и трехвалентные элементы, переходные металлы) [1–4]. При этом наибольший интерес вызывают соединения, в состав которых входит железо [5–12]. В работе [13] проанализировано формирование многогранников Ge–O для 114 нецентросимметричных германатов. Отмечено, что тип пространственного формирования многогранников Ge–O зависит от стехиометрического отношения SR = = n(O)/n(Ge), где n(O) – общее количество атомов кислорода в стехиометрической формуле, n(Ge) – число атомов германия. Для соединений ABGe2O7SR одинаково и равно 3.5. В то же время эти германаты идентифицируются в двух типах кристаллической структуры: тортвейтитоподобной и тортвейтитовой [4]. Кроме того, соединения ABGe2O7 в зависимости от отношения ионных радиусов rB/rA кристаллизуются в четырех пространственных группах (C2, P21/m, P21/c, C2/c). К таким соединениям относятся InFeGe2O7 и GdFeGe2O7. К настоящему времени они исследованы недостаточно, имеются лишь данные об их структуре ([10] и [5, 7] соответственно). Сведения об их теплофизических свойствах в литературе отсутствуют. Для термодинамического моделирования фазовых равновесий и определения оптимальных условий синтеза необходимы данные по высокотемпературной теплоемкости, которых к настоящему времени нет.
В настоящей работе впервые исследовано изменение теплоемкости InFeGe2O7 и GdFeGe2O7 в интервале температур 350–1000 K и по экспериментальным данным рассчитаны их термодинамические свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
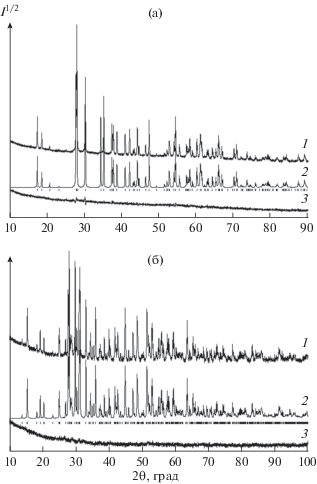
Для измерения теплоемкости германаты In FeGe2O7 и GdFeGe2O7 получали в виде поликристаллических порошков твердофазным методом из исходных оксидов In2O3, Fe2O3, Gd2O3 (ос. ч.) и GeO2 (99.999%). Для этого стехиометрические смеси предварительно прокаленных при 1173 K исходных оксидов, отвечающих по составу соответствующему германату, гомогенизировали в агатовой ступке и прессовали в таблетки. Обжиг таблеток осуществляли на воздухе ступенчато при температурах 1273 K (40 ч), 1373 K (100 ч) и 1473 K (60 ч). Через каждые 20 ч проводили перетирание образцов с последующим прессованием. Принимая во внимание возможность частичного испарения GeO2 при относительно высоких температурах твердофазного синтеза [14], для обжига образцов использовали тигли с крышками. Необходимое количество добавляемого сверх стехиометрии GeO2 и время синтеза подбирали экспериментально. Фазовый состав полученных образцов контролировали с помощью рентгенофазового анализа на дифрактометре X´Pert Pro MPD (PANalytical, Нидерланды), CuKα-излучение. Регистрацию дифрактограмм выполняли высокоскоростным детектором PIXcel с графитовым монохроматором. На рис. 1 приведены дифрактограммы синтезированных однофазных образцов германатов InFeGe2O7 и GdFeGe2O7. Параметры кристаллических решеток полученных соединений определяли по методике, описанной в работе [15]. Теплоемкость Cp германатов InFeGe2O7 и GdFeGe2O7 измеряли в области температур 350–1000 K методом дифференциальной сканирующей калориметрии с помощью термоанализатора STA 449 C Jupiter (Netzsch, Германия). Измерения проводили в платиновых тиглях с крышкой. Методика экспериментов описана ранее в работах [16, 17]. Прибор калибровали по температуре и чувствительности при помощи K2Cr2O4, BaCO3, RbNO3, KClO4, CsCl (чистота 99.99%). Для калибровки Cp (сертификат Netzsch) в качестве эталона использовали синтетический сапфир (Al2O3 чистотой 99.99%). Скорость нагревания при измерении теплоемкости составляла 10 град/мин. Для каждой серии образцов проводили не менее трех измерений. Погрешность измерения теплоемкости не превышала 2%. Экспериментальные результаты обрабатывали с помощью пакета программ Netzsch Proteus Thermal Analysis и лицензионного программного обеспечения Systat Sigma Plot 12 (Systat Software Inc., США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные нами рентгенографические характеристики InFeGe2O7 (пр. гр. C2/m, a = 6.4891(3), b = 8.5767 (5), c = 4.8921(20) Å, β = 102.659(3)°, V = = 265.65(2) Å3, Z = 2) удовлетворительно согласуются с данными [10]: пр. гр. C2/m, a = 6.5124(4), b = 8.5914(3), c = 4.8936(3) Å, β = 102.683(2)°, V = = 267.12(3) Å3, Z = 2. Наши данные для GdFeGe2O7 в сравнении с результатами других авторов приведены в табл. 1. Можно отметить хорошее совпадение параметров решетки полученного нами германата Fe-Gd с литературными данными.
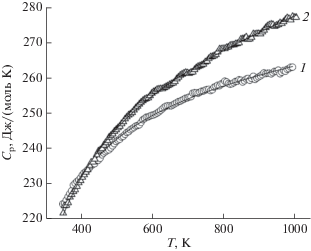
На рис. 2 показано влияние температуры на теплоемкость InFeGe2O7 и GdFeGe2O7. Видно, что в интервале 350–1000 K значения Cp закономерно увеличиваются, а на зависимостях Cp = f(T) не наблюдается каких-либо экстремумов. Последнее может свидетельствовать об отсутствии у исследованных германатов полиморфных превращений в этой области температур. Полученные данные могут быть описаны уравнением Майера–Келли [18]:
Для InFeGe2O7 и GdFeGe2O7 соответственно оно имеет вид:
(2)
$\begin{gathered} {{C}_{p}} = \left( {250.43 \pm 0.46} \right) + \left( {17.00 \pm 0.50} \right) \times {{10}^{{-3}}}T - \\ - {\text{ }}\left( {40.63 \pm 0.49} \right) \times {{10}^{5}}{{T}^{{-2}}} \\ \end{gathered} $(3)
$\begin{gathered} {{C}_{p}} = \left( {245.70 \pm 0.39} \right) + \left( {36.31 \pm 0.40} \right) \times {{10}^{{-3}}}T - \\ - \,\,\left( {45.47 \pm 0.43} \right) \times {{10}^{5}}{{T}^{{-2}}}. \\ \end{gathered} $Коэффициенты корреляции для уравнений (2) и (3) равны 0.9985 и 0.9995 соответственно, а максимальные отклонения экспериментальных точек от сглаживающих кривых составляют 0.57 и 0.50%.
Поскольку данные по теплоемкости для InFeGe2O7 и GdFeGe2O7 в литературе отсутствуют, сравнить полученные нами значения Cp для этих соединений можно, сопоставив величины Cp при 298 K, найденные по уравнениям (2) и (3), с рассчитанными по различным модельным представлениям: Неймана–Коппа (НК) [19–21], Келлога (Кел) [22], инкрементным методом Кумока (ИМК) [23]. Эти данные приведены в табл. 2. Видно, что лучшее согласие с экспериментом для исследованных германатов дает метод Неймана–Коппа. Необходимые для расчета последним методом значения теплоемкости индивидуальных оксидов брали из литературных источников: Fe2O3, Gd2O3 и GeO2 – из работы [19], In2O3 – из работы [24].
Таблица 2.
Сравнение экспериментальных значений Cp, 298 (Дж/(моль K)) для InFeGe2O7 и GdFeGe2O7 с величинами, рассчитанными разными методами: Неймана–Коппа (НК), Келлога (Кел), инкрементным методом Кумока (ИМК)
| Соединение | Cp,298 | НК | ∆, % | Кел. | ∆, % | ИМК | ∆, % |
|---|---|---|---|---|---|---|---|
| InFeGe2O7 | 209.7 | 205.8 | –1.9 | 219.0 | +4.4 | 214.9 | +2.5 |
| GdFeGe2O7 | 205.3 | 209.0 | +1.8 | 218.2 | +6.3 | 217.0 | +6.0 |
С использованием уравнений (2) и (3) по известным термодинамическим соотношениям ($\Delta H_{{{{T}_{2}}}}^{^\circ }$ = $\Delta H_{{{{T}_{1}}}}^{^\circ }$ + $\int_{{{T}_{1}}}^{{{T}_{2}}} {\Delta {{C}_{p}}dT} ,$ $\Delta S_{{{{T}_{2}}}}^{^\circ }$ = $\Delta S_{{{{T}_{1}}}}^{^\circ }$ + + $\int_{{{T}_{1}}}^{{{T}_{2}}} {\frac{{\Delta {{C}_{p}}}}{T}dT} $) рассчитаны термодинамические свойства исследованных германатов (изменения энтальпии H°(T) – H°(350 K) и энтропии S°(T) – – S°(350 K)). Эти результаты приведены в табл. 3. Из представленных данных следует, что для InFeGe2O7 значения Cp во всем исследованном интервале температур не превышают классический предел Дюлонга–Пти 3Rs (R – универсальная газовая постоянная, s – число атомов в формульной единице оксидного соединения), тогда как для GdFeGe2O7 при T > 900 K значения Cp его превышают. Известно, что при сравнении экспериментальных величин теплоемкости со значениями 3Rs нужно использовать теплоемкость при постоянном объеме CV, а не при постоянном давлении Cp. Для определения CV по экспериментальным значениям Cp необходимы дополнительные данные. Например, при расчете CV по соотношению Cp = CV (1 + 3γGαT) [25] необходимы сведения о температурной зависимости постоянной Грюнайзена γG и температурном коэффициенте линейного расширения α. Такие данные для InFeGe2O7 и GdFeGe2O7 в литературе отсутствуют. Можно отметить, что при 350 K полученные значения Cp для InFeGe2O7 и GdFeGe2O7 сопоставимы с величинами теплоемкости NdGaGe2O7 [26], DyInGe2O7, HoInGe2O7 [27] и Y2Ge2O7 [28].
Таблица 3.
Сглаженные величины теплоемкости и рассчитанные по ним значения термодинамических свойств InFeGe2O7 и GdFeGe2O7
| T, K | Cp, Дж/(моль K) | H°(T) – H°(350 K), кДж/моль | S°(T) – S°(350 K), Дж/(моль K) |
|---|---|---|---|
| InFeGe2O7 | |||
| 350 | 223.2 | – | – |
| 400 | 231.8 | 11.39 | 30.40 |
| 450 | 238.0 | 23.14 | 58.08 |
| 500 | 242.7 | 35.16 | 83.41 |
| 550 | 246.3 | 47.39 | 106.7 |
| 600 | 249.3 | 59.79 | 128.3 |
| 650 | 251.9 | 72.32 | 148.3 |
| 700 | 254.0 | 84.97 | 167.1 |
| 750 | 256.0 | 97.72 | 184.7 |
| 800 | 257.7 | 110.6 | 201.3 |
| 850 | 259.2 | 123.5 | 216.9 |
| 900 | 260.7 | 136.5 | 231.8 |
| 950 | 262.1 | 149.6 | 245.9 |
| 1000 | 263.4 | 162.7 | 259.4 |
| GdFeGe2O7 | |||
| 350 | 221.0 | – | – |
| 400 | 231.8 | 11.34 | 30.27 |
| 450 | 239.6 | 23.13 | 58.04 |
| 500 | 245.6 | 35.27 | 83.61 |
| 550 | 250.6 | 47.68 | 107.3 |
| 600 | 254.8 | 60.32 | 129.2 |
| 650 | 258.5 | 73.15 | 149.8 |
| 700 | 261.8 | 86.16 | 169.1 |
| 750 | 264.8 | 99.33 | 187.2 |
| 800 | 267.6 | 112.6 | 204.4 |
| 850 | 270.2 | 126.1 | 220.7 |
| 900 | 272.7 | 139.7 | 236.2 |
| 950 | 275.1 | 153.4 | 251.1 |
| 1000 | 277.4 | 167.2 | 265.2 |
ЗАКЛЮЧЕНИЕ
Обжигом на воздухе стехиометрических смесей исходных оксидов In2O3 (Gd2O3), Fe2O3 и GeO2 получены поликристаллические образцы соединений InFeGe2O7 и GdFeGe2O7. Уточнены параметры элементарных ячеек германатов Fe-In и Fe-Gd. Методом дифференциальной сканирующей калориметрии исследовано влияние температуры на их молярную теплоемкость. Установлено, что зависимости Cp в области температур 350–1000 K описываются уравнением Майера–Келли. На основании экспериментальных данных по теплоемкости рассчитаны термодинамические функции сложных оксидов InFeGe2O7 и GdFeGe2O7.
Список литературы
Kaminskii A.A., Mill B.V., Butashin A.V. et al. // Phys. Status Solidi A. 1987. V. 103. P. 575.
Lozano G., Cascales C., Zaldo C., Porcher P. // J. Alloys Compd. 2000. V. 303–304. P. 34.
Juarez-Arellano E.A., Rosales I., Oliver A. et al. // Acta Crystallogr. 2004. V. C60. P. i14. https://doi.org/10.1107/S0108270103029056
Juarez-Arellano E.A., Campa-Molina J., Ulloa-Godinez S. et al. // Mater. Res. Soc. Symp. Proc. 2005. V. 848. P. FF6.15.1.
Милль Б.В., Казей З.А., Рейман С.И. и др. // Вестн. Моск. ун-та. Сер. 3. Физика, астрономия. 1987. Т. 28. № 4. С. 95.
Bucio L., Cascales C., Alonso J.A., Rasines I. // Mater. Sci. Forum. 1996. V. 228–231. P. 735.
Bucio L., Cascales C., Alonso J.A., Rasines I. // J. Phys.: Condens. Matter. 1996. V. 8. P. 2641.
Cascales C., Gutierrez Puebla E., Klimin S. et al. // Chem. Mater. 1999. V. 11. P. 2520.
Baran E.J., Cascales C., Mercader R.C. // Spectrochem. Acta, Part A. 2000. V. 56. P. 1277.
Bucio L., Ruvalcaba-Sil J.L., Rosales I. et al. // Z. Kristallogr. 2001. V. 216. P. 438.
Cascales C., Fernández-Diaz M.T., Monge M.A., Bucio L. // Chem Mater. 2002. V. 14. P. 1995.
Drokina T.V., Petrakovskii G.A., Velikanov D.A., Molokeev M.S. // Phys. Solid. State. 2014. V. 56. № 6. P. 1131. [Дрокина Т.В., Петраковский Г.А., Великанов Д.А., Молокеев М.С. // Физика твердого тела. 2014. Т. 56. № 6. С. 1088.] https://doi.org/10.1134/S1063783414060122
Korotkov A.S. // J. Solid State Chem. 2014. V. 218. P. 141. https://doi.org/10.1016/j.jssc.2014.06.022
Becker U.W., Felsche J. // J. Less-Common. Met. 1987. V. 128. P. 269.
Denisova L.T., Irtyugo L.A., Kargin Yu.F. et al. // Inorg. Mater. 2018. V. 54. № 2. P. 167. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Неорган. материалы. 2018. Т. 54. № 2. С. 181.] https://doi.org/10.1134/S0020168518020048
Denisov V.M., Denisova L.T., Irtyugo L.A., Biront V.S. // Phys. Solid. State. 2010. V. 52. № 7. P. 1362. [Денисов В.М., Денисова Л.Т., Иртюго Л.А., Биронт В.С. // Физика твердого тела. 2010. Т. 52. № 7. С. 1274.]https://doi.org/10.1134/S1063783410070073
Denisova L.T., Irtyugo L.A., Kargin Yu.F. // Inorg. Mater. 2017. V. 53. № 1. P. 93. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. // Неорган. материалы. 2017. Т. 53. № 1. С. 71.] https://doi.org/10.1134/S0020168517010046
Maier C.G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3243.
Leitner J., Chuchvalec P., Sedmidubcký D. et al. // Thermochim. Acta. 2003. V. 395. P. 27.
Моисеев Г.К., Ватолин Н.А., Маршук Л.А., Ильиных Н.И. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных АСТРА. OWN). Екатеринбург: УрО РАН, 1999. 230 с.
Морачевский А.Г., Сладков И.Б., Фирсова Е.Г. Термодинамические расчеты в химии и металлургии. СПб.: Лань, 2018. 208 с.
Кубашевский О., Олкокк С.Б. Металлургическая термохимия. М.: Металлургия, 1982. 392 с.
Кумок В.Н. // Прямые и обратные задачи химической термодинамики. Новосибирск: Наука, 1987. С. 108.
Cordfunke E.H.P., Westrum E.F.Jr. // J. Phys. Chem. Solids. 1992. V. 53. № 3. P. 361.
Prekul A.F., Kazantsev V.A., Shchegolikhina N.I. et al. // Phys. Solid State. 2008. V. 50. № 11. P. 2013. [Прекул А.Ф., Казанцев В.А., Щеголихина Н.М. и др. // Физика тв. тела. 2008. Т. 50. № 11. С. 1933.]https://doi.org/10.1134/S1063783408110024
Денисова Л.Т., Каргин Ю.Ф., Иртюго Л.А. и др. // Журн. неорган. химии. 2020. Т. 65. № 5. https://doi.org/10.31857/S0044457X20050074
Denisova L.T., Irtyugo L.A., Kargin Yu.F. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 1161. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 980.] https://doi.org/10.1134/S0036023619090079
Denisova L.T., Irtyugo L.A., Kargin Yu.F. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 361. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Журн. неорган. химии. 2018. Т. 63. № 3. С. 338.] https://doi.org/10.1134/S003602361803004X
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии