Журнал неорганической химии, 2020, T. 65, № 7, стр. 936-941
Моделирование молекулярных структур гетеролигандных комплексов M(IV) 3d-элементов с порфиразином и оксоанионом методом функционала плотности
Д. В. Чачков b, О. В. Михайлов a, *
a Казанский национальный исследовательский технологический университет
420015 Казань, ул. К. Маркса, 68, Россия
b Казанское отделение Межведомственного суперкомпьютерного центра РАН –
филиал ФГУ ФНЦ Научно-исследовательский институт системных исследований РАН
420111 Казань, ул. Лобачевского, 2/31, Россия
* E-mail: olegmkhlv@gmail.com
Поступила в редакцию 11.11.2019
После доработки 15.01.2020
Принята к публикации 27.02.2020
Аннотация
Методом DFT OPBE/TZVP осуществлен расчет молекулярных структур (6666) макротетрациклических хелатов M(IV) (M = Ti, V, Cr, Mn, Fe, Co, Ni, Cu) с (NNNN)-донорно-атомным лигандом – порфиразином и оксоанионом. Приведены значения основных длин связей, валентных и невалентных углов в образующихся комплексах. Рассчитаны значения стандартной энтальпии, энтропии и энергии Гиббса образования этих соединений. Отмечено, что все эти комплексы имеют структуру слегка искаженной тетрагональной пирамиды, где комплексообразователь M(IV) приподнят над ее основанием, образованным донорными атомами азота. Установлено, что все 6-членные металлохелатные циклы в каждой из этих структур идентичны друг другу как по сумме входящих в них валентных углов, так и по их набору, хотя ни один из них не является плоским. Представлены изображения молекулярных структур некоторых из этих координационных соединений.
ВВЕДЕНИЕ
Порфиразин (I) принадлежит к категории азотсодержащих макроциклических соединений и может рассматриваться в качестве “родоначальника” более сложных органических соединений – фталоцианина и его производных, которые в настоящее время находят широкое применение в различных отраслях науки и техники. Благодаря наличию донорных атомов азота в четырех пиррольных кольцах порфиразин и его алкил- и/или арилзамещенные производные могут выступать в качестве полидентатных (NNNN)-донорно-атомных лигандов и формировать весьма устойчивые металлохелаты со многими ионами p-, d- и f-элементов, находящихся в разнообразных состояниях окисления [1–5]. Число исследований, посвященных данному хелатному лиганду и его различным алкил- и арилпроизводным, довольно велико. В целом ряде публикаций рассматривались гетеролигандные тетрагонально-пирамидальные металлохелаты, содержащие различные порфирины, порфиразины и/или фталоцианины, в которых донорные атомы азота располагаются по вершинам плоского четырехугольника (чаще всего квадрата, ромба или прямоугольника), и один оксолиганд, расположенный в вершине тетрагональной пирамиды [5]. В связи с этим представляло интерес провести квантово-химический расчет молекулярных структур гетеролигандных металлохелатов с дважды депротонированной формой порфиразина I и оксоанионом общей формулы II (M = Ti, V, Cr, Mn, Fe, Co, Ni, Cu) методом функционала плотности (DFT).
I
II
Следует отметить, что в макроциклических металлохелатах общей формулы II каждый из указанных выше 3d-элементов имеет нехарактерную для него степень окисления +4, за исключением Ti, V и Mn, что обусловливает дополнительный интерес к этим комплексам. С другой стороны, результаты данного расчета способны расширить наши представления о специфике координации порфиразина и его аналогов, а также “аксиального” лиганда к комплексообразователю M(IV). Настоящая работа посвящена теоретическому изучению данных координационных соединений.
МЕТОД РАСЧЕТА
При проведении квантово-химических расчетов в настоящем исследовании, как и в работах [6–10], использовали теорию функционала плотности (DFT) в варианте, включающем функционал OPBE [11, 12] и базис TZVP [13, 14], сочетание которых, по данным [12, 15–18], в случае комплексов 3d-элементов с достаточно большой точностью характеризует как соотношение между энергиями высоко- и низкоспиновых состояний этих координационных соединений, так и основные геометрические параметры их молекулярных структур. Расчеты проводили с использованием программного пакета Gaussian09 [19], визуализацию полученных результатов осуществляли посредством программы ChemCraft (Version 1.8). Как и в работах [6–10], соответствие найденных стационарных точек минимумам энергии во всех случаях доказывалось расчетом вторых производных энергии по координатам атомов; при этом все равновесные структуры, соответствовавшие точкам минимума на поверхностях потенциальной энергии, имели лишь вещественные положительные значения частот. Для комплексов Co(IV) и Cu(IV) рассматривали спиновые мультиплетности 2, 4 и 6, для комплексов Fe(IV) и Ni(IV) – мультиплетности 1, 3 и 5, для комплексов Ti(IV) и Cr(IV) – мультиплетности 1 и 3, для комплексов V(IV) и Mn(IV) – мультиплетности 2 и 4. Из оптимизированных при указанных мультиплетностях структур выбирали ту, которая обладала наименьшей энергией. Расчет параметров молекулярных структур при мультиплетностях, отличных от 1, всегда проводили неограниченным методом (UOPBE); при мультиплетности 1 – ограниченным методом (ROPBE). При мультиплетности 1 применяли также вариант расчета неограниченным методом в сочетании с опцией GUESS = Mix. Получаемые при этом результаты всегда были аналогичны результатам, полученным с использованием ограниченного метода. Во всех случаях осуществляли проверку волновых функций полученных оптимизированных молекулярных структур соответствующих металлокомплексов на стабильность. Согласно результатам этой проверки, все волновые функции соответствовали указанному критерию. Расчет стандартных термодинамических параметров образования рассматриваемых металлохелатов формулы II осуществляли по методике, изложенной в [20].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно полученным в ходе расчета данным, комплексы общей формулы II для всех указанных выше 3d-элементов могут существовать самостоятельно, хотя значения ключевых термодинамических параметров: стандартных энтальпии (ΔHf,298), энтропии (Sf,298) и энергии Гиббса их образования $(\Delta G_{{f,298}}^{0})$ – в большинстве положительны (табл. 1). Это свидетельствует о невозможности образования указанных комплексов из простых веществ химических элементов, входящих в их состав, при стандартных условиях. Исключение составляет металлохелат Ti(IV) с $\Delta G_{{f,298}}^{0}$ = –247.5 кДж/моль, что представляется естественным, так как для титана состояние окисления IV наиболее типично. Отметим, что возможно существование комплекса II и для M = Cu, в этом случае стабилизируется необычное для данного 3d-элемента состояние окисления IV, которое до сих пор наблюдалось лишь в немногих случаях [21]. Обращают на себя внимание весьма низкие значения эффективных зарядов на атомах M во всех рассматриваемых нами комплексах II, которые, согласно данным NBO-анализа, составляют +0.89 ē (Ti), +0.53 ē (V), +0.38 ē (Cr), +0.43 ē (Mn), +0.24 ē (Fe), +0.33 ē (Co), +0.56 ē (Ni) и +0.82 ē (Cu). Это обстоятельство, так же как и значения эффективных зарядов на других атомах, входящих в состав этих химических соединений (см. Supplementary Materials), прямо указывает на очень высокую степень делокализации электронной плотности в них.
Таблица 1.
Стандартные термодинамические параметры образования комплексов M(IV) с порфиразином и оксоанионом типа II в газовой фазе
| M(IV) | Δ$H_{{f,298}}^{0}$, кДж/моль | $S_{{f,298}}^{0}$, Дж/(моль K) | Δ$G_{{f,298}}^{0}$, кДж/моль |
|---|---|---|---|
| Ti | –449.4 | 738.2 | –247.5 |
| V | –27.3 | 740.5 | 171.7 |
| Cr | 480.6 | 746.3 | 678.9 |
| Mn | 179.1 | 729.5 | 383.9 |
| Fe | 315.7 | 731.7 | 518.5 |
| Co | 483.8 | 732.5 | 687.2 |
| Ni | 617.7 | 755.7 | 814.0 |
| Cu | 863.6 | 749.6 | 1062.9 |
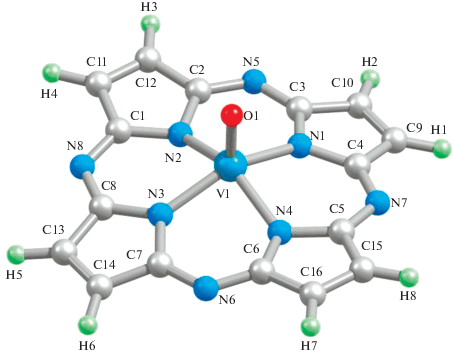
Рассчитанные с помощью метода DFT OPBE/TZVP важнейшие длины связей и валентные углы для гетеролигандных металлохелатов M(IV) общей формулы II, где M = Ti, V, Cr, Mn, Fe, Co, Ni и Cu, представлены в табл. 2. Согласно этим данным, длины связей (d) между атомами M и донорными атомами N в хелатном узле MN4, а именно (M1N1), (M1N2), (M1N3) и (M1N4), монотонно уменьшаются в ряду Ti–Ni, а при переходе от Ni к Cu увеличиваются. При этом в большинстве таких соединений указанные значения d(M–N) одинаковые; исключением являются металлохелаты V(IV) и Cu(IV), в которых они попарно равны друг другу (d(M1N1) = d(M1N3), d(M1N2) = d(M1N4)). Различие в величинах d(M–N) в этих двух металлохелатах незначительное – 0.3 и 0.9 пм соответственно, но в первом из них d(M1N1) > d(M1N2), во втором, напротив, d(M1N1) < d(M1N2). Длина связи между центральным атомом M и атомом O (M1O1) при движении от Ti к Cu изменяется более сложным образом. Кривая ее зависимости от порядкового номера 3d-элемента имеет зигзагообразный вид (табл. 2): на участках Ti–V, Mn–Fe, Ni–Cu она снижается, а на участках V–Mn, Fe–Ni отмечается повышение значений d(M1O1). На длинах связей углерод–азот и азот–азот природа M(IV) сказывается в гораздо меньшей степени, чем на длинах связей, образованных данным комплексообразователем с атомами азота и кислорода, и тем слабее, чем дальше эти связи располагаются по отношению к металлохелатному узлу MN4 (см. Supplementary Materials).
Таблица 2.
Важнейшие длины связей, валентные и невалентные углы в комплексах M(IV) с порфиразином и оксоанионом типа II
| Связь, угол | Ti | V | Cr | Mn | Fe | Co | Ni | Cu |
|---|---|---|---|---|---|---|---|---|
| Длины связей в хелатном узле MN4, пм | ||||||||
| (M1N1) | 207.5 | 199.1 | 196.4 | 194.6 | 192.5 | 190.4 | 189.9 | 195.5 |
| (M1N2) | 207.5 | 198.8 | 196.4 | 194.6 | 192.5 | 190.4 | 189.9 | 196.4 |
| (M1N3) | 207.5 | 199.1 | 196.4 | 194.6 | 192.5 | 190.4 | 189.9 | 195.5 |
| (M1N4) | 207.5 | 198.8 | 196.4 | 194.6 | 192.5 | 190.4 | 189.9 | 196.4 |
| Длины связей M–O, пм | ||||||||
| (M1O1) | 161.9 | 157.5 | 158.0 | 164.0 | 161.8 | 170.1 | 197.8 | 193.1 |
| Валентные углы в хелатном узле MN4, град | ||||||||
| (N1M1N2) | 83.5 | 86.1 | 87.1 | 88.6 | 88.8 | 89.4 | 89.7 | 88.9 |
| (N2M1N3) | 83.5 | 86.1 | 87.1 | 88.6 | 88.8 | 89.4 | 89.7 | 88.9 |
| (N3M1N4) | 83.5 | 86.1 | 87.1 | 88.6 | 88.8 | 89.4 | 89.7 | 88.9 |
| (N4M1N1) | 83.5 | 86.1 | 87.1 | 88.6 | 88.8 | 89.4 | 89.7 | 88.9 |
| Сумма углов (VAS) | 334.0 | 344.4 | 348.4 | 354.4 | 355.2 | 357.6 | 358.8 | 355.6 |
| Невалентные углы в группировке N4, град | ||||||||
| (N1N2N3) | 90.0 | 90.8 | 90.0 | 90.0 | 90.0 | 89.9 | 90.0 | 89.9 |
| (N2N3N4) | 90.0 | 89.1 | 90.0 | 90.0 | 90.0 | 90.1 | 90.0 | 90.1 |
| (N3N4N1) | 90.0 | 90.8 | 90.0 | 90.0 | 90.0 | 89.9 | 90.0 | 89.9 |
| (N4N1N2) | 90.0 | 89.1 | 90.0 | 90.0 | 90.0 | 90.1 | 90.0 | 90.1 |
| Сумма углов (NVAS) | 360.0 | 359.8 | 360.0 | 360.0 | 360.0 | 360.0 | 360.0 | 360.0 |
| Валентные углы в 6-членном хелатном цикле (N1C4N7C5N4M1), град | ||||||||
| (M1N1C4) | 125.5 | 126.9 | 126.5 | 126.2 | 126.5 | 126.6 | 126.8 | 125.8 |
| (N1C4N7) | 127.5 | 126.9 | 127.8 | 127.5 | 127.7 | 127.8 | 128.0 | 127.8 |
| (C4N7C5) | 122.9 | 122.5 | 121.0 | 121.9 | 121.0 | 120.5 | 120.3 | 122.2 |
| (N7C5N4) | 127.5 | 126.0 | 127.8 | 127.5 | 127.7 | 127.7 | 128.0 | 127.7 |
| (C5N4M1) | 125.5 | 124.0 | 126.5 | 126.2 | 126.5 | 126.8 | 126.7 | 125.6 |
| (N4M1N1) | 83.5 | 86.1 | 87.1 | 88.6 | 88.8 | 89.4 | 89.7 | 88.9 |
| Сумма углов (VAS6) | 712.4 | 712.4 | 716.7 | 717.9 | 718.2 | 718.8 | 719.5 | 718.0 |
| Валентные углы в 5-членном нехелатном цикле (C3N1C4C9C10), град | ||||||||
| (C3N1C4) | 107.4 | 106.2 | 106.4 | 106.9 | 106.3 | 106.0 | 106.3 | 107.7 |
| (N1C4C9) | 109.3 | 109.6 | 109.6 | 109.5 | 110.0 | 110.1 | 110.1 | 109.2 |
| (C4C9C10) | 107.0 | 107.3 | 107.2 | 107.0 | 106.8 | 106.9 | 106.8 | 107.0 |
| (C9C10C3) | 107.0 | 107.3 | 107.2 | 107.0 | 106.8 | 106.9 | 106.8 | 106.9 |
| (C10C3N1) | 109.3 | 109.6 | 109.6 | 109.5 | 110.0 | 110.1 | 110.1 | 109.2 |
| Сумма углов (VAS5) | 540.0 | 540.0 | 540.0 | 540.0 | 539.9 | 540.0 | 540.0 | 540.0 |
| Валентные углы (OMN), град | ||||||||
| (O1M1N1) | 109.6 | 103.8 | 103.0 | 98.9 | 98.5 | 96.5 | 94.3 | 97.6 |
| (O1M1N2) | 109.6 | 106.7 | 103.0 | 98.9 | 98.5 | 95.3 | 94.3 | 98.5 |
| (O1M1N3) | 109.6 | 103.8 | 103.0 | 98.9 | 98.5 | 96.5 | 94.3 | 97.6 |
| (O1M1N4) | 109.6 | 106.7 | 103.0 | 98.9 | 98.5 | 95.3 | 94.3 | 98.5 |
Из приведенных в табл. 2 данных видно, что для всех указанных комплексообразователей M(IV) характерна тетрагонально-пирамидальная координация донорных центров порфиразина относительно M, поскольку сумма валентных углов (N1M1N2), (N2M1N3), (N3M1N4) и (N4M1N1) (VAS) в нем составляет 344.0° (Ti), 344.4° (V), 348.4° (Cr), 354.4° (Mn), 355.2° (Fe), 357.6° (Co), 358.8° (Ni) и 355.6° (Cu). В ряду Ti–Ni наблюдается возрастание значений VAS и, следовательно, снижение степени “пирамидальности” хелатного узла MN4, т.е. его отклонение от плоскостности. При переходе от Ni к Cu наблюдается небольшое снижение VAS. Некомпланарность группировки N4 хелатного узла выражена в меньшей степени, так как отклонение суммы четырех невалентных углов, образованных атомами азота, от 360° имеет место лишь в хелате V(IV), в остальных рассматриваемых металлохелатах оно отсутствует. В хелатном узле MN4 всех рассматриваемых металлохелатов валентные углы (NMN) равны между собой, хотя каждый из них <90°. Иная картина отмечается в группировке атомов N4, где полное равенство углов (NNN) наблюдается лишь в пяти из восьми рассматриваемых комплексов, а именно в металлохелатах Ti(IV), Cr(IV), Mn(IV), Fe(IV) и Ni(IV). Для них характерно попарное равенство этих углов ((N1N2N3) = (N3N4N1), (N2N3N4) = = (N4N1N2)). Поскольку металлохелатный узел MN4 ни в одном из этих металлокомплексов не является строго плоским, следует ожидать, что и валентные углы, образованные атомами O, M и любым из атомов N, входящих в состав хелатного узла, будут отличаться от 90°. Данные нашего расчета находятся в полном соответствии с ожиданием. При этом в тех же пяти комплексах из восьми, что упоминались выше, эти четыре угла равны между собой, тогда как для остальных трех (V(IV), Co(IV) и Cu(IV)) характерно лишь попарное их равенство, различие в величинах которых, однако, не превосходит 3°.
Входящие в состав каждого из таких металлокомплексов 6-членные металлохелатные циклы по набору внутренних валентных углов в каждом из этих комплексов равны друг другу. Из данных, приведенных в табл. 2, видно, что ни один из них не является плоским, так как сумма внутренних углов в них меньше суммы внутренних углов в плоском шестиугольнике (720°). Динамика изменения этой суммы в ряду Ti–Cu в точности повторяет таковую для значений VAS в хелатном узле. В отличие от 6-членных циклов, 5-членные циклы, содержащие один атом азота и четыре атома углерода, во всех комплексах общей формулы II являются плоскими (сумма валентных углов VAS5 в каждом из них или в точности совпадает с суммой внутренних углов в плоском пятиугольнике (540°), или отличается от нее всего на 0.1°) и идентичными друг другу по набору внутренних углов.
Молекулярные структуры этих комплексов (рис. 1) незначительно отличаются друг от друга, и для них характерна заметно выраженная “пирамидальность”. Расчет электрических моментов диполя рассматриваемых соединений (μ) в рамках использованного нами варианта метода DFT дает для комплекса Ti(IV) значение 3.08, V(IV) – 1.58, Cr(IV) – 2.13, Mn(IV) – 2.74, Fe(IV) – 2.17, Co(IV) – 2.41, Ni(IV) – 2.52 и Cu(IV) – 3.50 ед. Дебая. Приведенные величины весьма значительны, это вполне объяснимо, если учесть, что в любом из металлохелатов II отсутствует центр симметрии. В связи с этим обращает на себя внимание факт, что не наблюдается какой-либо корреляции между этими значениями и величинами углов (OMN), как и других основных валентных углов.
Согласно полученным нами расчетным данным, основным состоянием координационных соединений Ti(IV) (3p63d0), V(IV) (3d1), Cr(IV) (3d2) и Mn(IV) (3d3) общей формулы II в полном соответствии с теоретическими ожиданиями являются спиновый синглет, дублет, триплет и квартет соответственно. Электронные конфигурации остальных ионов M(IV), рассматриваемых в настоящей работе, допускают возможность реализации по крайней мере двух различных значений спиновой мультиплетности основного состояния, а именно спинового синглета [Ni(IV) (3d6)], дублета [Co(IV) (3d5), Cu(IV) (3d7)] и триплета [Fe(IV) (3d4)]. Из этих данных видно, что каждый из четырех последних металлохелатов относится к числу низкоспиновых комплексов. Для большинства изученных нами соединений общей формулы II имеет место значительное различие в энергиях между основным и ближайшим к нему возбужденным состоянием с иной спиновой мультиплетностью (синглетной в случае Ti(IV), квартетной – V(IV), квинтетной – Cr(IV), дублетной – Mn(IV), синглетной – Fe(IV), секстетной – Co(IV), синглетной – Ni(IV), квартетной – Cu(IV)), а именно: 140.3, 60.5, 14.1, 3.9, 102.4, 46.3, 73.2 и 92.2 кДж/моль соответственно. Можно полагать, что из всех рассматриваемых комплексов II спин-кроссовер способен проявляться лишь в случае комплекса Mn(IV), в котором ближайшее возбужденное состояние по энергии лежит менее чем на 4.0 кДж/моль выше основного.
ЗАКЛЮЧЕНИЕ
Все рассмотренные макроциклические гетеролигандные металлохелаты M(IV) (M = Ti, V, Cr, Mn, Fe, Co, Ni, Cu) общей формулы II являются некомпланарными, это связано с отклонением (в некоторых случаях заметным) от компланарности самого хелатного узла MN4. Некомпланарными в этих комплексах оказываются и 6-членные металлохелатные циклы, тогда как все 5-членные циклы строго компланарны. Степень отклонения от компланарности как самих входящих в состав хелатов II 6-членных металлохелатных циклов, так и макроцикла в целом для различных 3d-элементов существенно отличается. Это свидетельствует о хорошо выраженной зависимости данного параметра от природы комплексообразователя M(IV). Большинство этих комплексов – низкоспиновые, исключением являются хелаты Ti(IV), V(IV) и Cr(IV), для которых в силу специфики электронных конфигураций основного состояния атомов-комплексообразователей (3p63d0, 3d1 и 3d2 соответственно) разграничение на категории низко- и высокоспиновые комплексы не может быть проведено.
Список литературы
Kasuda K., Tsutsui M. // Coord. Chem. Rev. 1980. V. 32. № 1. P. 67.
Thomas A.L. Phthalocyanines. Research & Applications, CRC Press, 1990.
Sliva W., Mianovska B. // Transit. Met. Chem. 2000. V. 25. № 5. P. 491.
Mamardashvili G.M., Mamardashvili N.Z., Koifman O.I. // Russ. Chem. Rev. 2008. V. 77. № 1. P. 59.
Ломова Т.Н. Аксиально координированные металлопорфирины в науке и практике. М.: URSS-КРАСАНД, 2018. 700 с.
Chachkov D.V., Mikhailov O.V. // Macroheterocycles. 2009. V. 2. № 3–4. P. 271.
Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2012. V. 57. № 7. P. 981. [Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2012. Т. 57. № 7. С. 1056.]https://doi.org/10.1134/S0036023612070078
Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2013. V. 58. № 2. P. 174. [Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2013. Т. 58. № 2. С. 209.]https://doi.org/10.1134/S0036023613020186
Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2013. V. 58. № 9. P. 1073. [Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2013. Т. 58. № 9. С. 1199.]https://doi.org/10.1134/S0036023613090052
Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2015. V. 60. № 9. P. 1117. [Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2015. Т. 60. № 9. С. 1225.]https://doi.org/10.1134/S0036023615090065
Hoe W.-M., Cohen A., Handy N.C. // Chem. Phys. Lett. 2001. V. 341. № 1. P. 319. https://doi.org/10.1016/S0009-2614(01)00581-4
Perdew J.P., Burke K., Ernzerhof M. // Phys. Rev. Lett. 1996. V. 77. № 18. P. 3865. https://doi.org/10.1103/PhysRevLett.77.3865
Schaefer A., Horn H., Ahlrichs R. // J. Chem. Phys. 1992. V. 97. № 4. P. 2571. https://doi.org/10.1063/1.463096
Schaefer A., Huber C., Ahlrichs R. // J. Chem. Phys. 1994. V. 100. № 8. P. 5829. https://doi.org/10.1063/1.467146
Paulsen H., Duelund L., Winkler H. et al. // Inorg. Chem. 2001. V. 40. № 9. P. 2201. https://doi.org/10.1021/ic000954q
Swart M., Groenhof A.R., Ehlers A.W., Lammertsma K. // J. Phys. Chem. A. 2004. V. 108. № 25. P. 5479. https://doi.org/10.1021/jp049043i
Swart M., Ehlers A.W., Lammertsma K. // Mol. Phys. 2004. V. 102. № 23. P. 2467. https://doi.org/10.1080/0026897042000275017
Swart M. // Inorg. Chim. Acta. 2007. V. 360. № 1. P. 179. https://doi.org/10.1016/j.ica.2006.07.073
Gaussian 09, Revision A.01, Frisch M.J, Trucks G.W., Schlegel H.B. et al. Gaussian, Inc., Wallingford CT, 2009.
Ochterski J.W. Thermochemistry in Gaussian. Gaussian, Inc. Wallingford CT, 2000.
Popova T.V., Aksenova N.V. // Russ. J. Coord. Chem. 2003. V. 29. № 11. P. 743. [Попова Т.В., Аксенова Н.В. // Коорд. химия. 2003. Т. 29. № 11. С. 803.]https://doi.org/10.1023/b:ruco.0000003432.39025.cc
Дополнительные материалы
- скачать ESM.docx
- Supplementary Materials
Инструменты
Журнал неорганической химии