Журнал неорганической химии, 2020, T. 65, № 6, стр. 804-808
Синтез и строение комплексов гафния ${\text{[P}}{{{\text{h}}}_{{\text{3}}}}{\text{PR]}}_{{\text{2}}}^{{\text{ + }}}$[HfCl6]2–, R = Et, CH2C6H4CN-4, CH2C6H4F-4
В. В. Шарутин a, *, О. К. Шарутина a, Е. В. Лобанова a
a Южно-Уральский государственный университет
454080 Челябинск, пр-т Ленина, 76, Россия
* E-mail: vvsharutin@rambler.ru
Поступила в редакцию 01.11.2019
После доработки 14.11.2019
Принята к публикации 24.01.2020
Аннотация
Взаимодействием тетрахлорида гафния с хлоридами тетраорганилфосфония в растворе ацетонитрила получены и структурно охарактеризованы комплексы ${\text{[P}}{{{\text{h}}}_{{\text{3}}}}{\text{PR]}}_{{\text{2}}}^{{\text{ + }}}$[HfCl6]2–, R = Et (I), CH2C6H4CN-4 (II), CH2C6H4F-4 (III). По данным РСА, атомы фосфора в катионах тетраорганилфосфония имеют искаженную тетраэдрическую координацию: углы CPC 108.07(8)°−110.89(8)° (I), 105.0(3)°−113.8(3)° (II), 99.5(4)°−115.7(4)° (III), длины связей P−С 1.7958(17)−1.8042(19) Å (I), 1.758(6)−1.834(6) Å (II), 1.714(8)−1.930(10) Å (III). В центросимметричных октаэдрических анионах [HfCl6]2– комплекса I расстояния Hf−Cl составляют 2.4549(8)−2.4584(10) Å. В II и III октаэдрическая конфигурация анионов искажена: углы транс-ClHfCl составляют 177.23(13)°−180.00° и 177.73(9)°, 178.07(10)°, 178.84(9)° соответственно, связи Hf−Cl равны 2.3949(18)−2.4976(17) Å (II) и 2.411(2)−2.527(5) Å (III). Структурная организация кристаллов обусловлена слабыми водородными связями Cl⋅⋅⋅Н–С (2.75−2.92, 2.63−2.94, 2.75−2.83 Å) между анионами и катионами.
ВВЕДЕНИЕ
Последние достижения в химии хлоридных комплексов гафния описаны в литературе [1–12]. Показано, что галогениды гафния перспективны в качестве реагентов для безводного синтеза ионных продуктов присоединения в реакциях с солями аммония [4, 5], фосфония [6, 7], диалкилселеном [8], ареном [9], Si-содержащими алкенами [10]. Трифенилметилхлорид с тетраборгидридом гафния образует комплекс с органическим катионом трехкоординированного углерода и биядерным анионом [11]. Показано, что комплекс гафния, полученный из тетрахлорида гафния и производного аминофенола, является катализатором полимеризации этилена и лактидов [12].
В настоящей работе впервые синтезированы и структурно охарактеризованы гексахлорогафниаты(V) алкилтрифенилфосфония ${\text{[P}}{{{\text{h}}}_{{\text{3}}}}{\text{PR]}}_{{\text{2}}}^{{\text{ + }}}$[HfCl6]2–, R = Et (I), CH2C6H4CN-4 (II), CH2C6H4F-4 (III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез [Ph3PEt]+2[HfCl6]2– (I). Смесь 306 мг (0.94 ммоль) хлорида трифенилэтилфосфония, 150 мг (0.47 ммоль) тетрахлорида гафния и 15 мл ацетонитрила перемешивали в течение 1 ч. При медленном концентрировании прозрачного раствора до 3 мл происходило образование кристаллического осадка. Получили 424 мг (88%) комплекса I с tразл = 263°С. ИК-спектр (ν, см−1): 3419, 3170, 3080, 3055, 3022, 2981, 2945, 2910, 1585, 1573, 1483, 1452, 1435, 1400, 1382, 1332, 1319, 1261, 1234, 1188, 1163, 1112, 1028, 1010, 995, 754, 742, 736, 721, 690, 665, 530, 503, 491, 455, 437.
Соединения II и III синтезировали аналогично.
$[{\mathbf{P}}{{{\mathbf{h}}}_{{\mathbf{3}}}}{\mathbf{PC}}{{{\mathbf{H}}}_{{\mathbf{2}}}}{{{\mathbf{C}}}_{{\mathbf{6}}}}{{{\mathbf{H}}}_{{\mathbf{4}}}}{\mathbf{CN}}{\text{ - }}{\mathbf{4}}]_{{\mathbf{2}}}^{ + }$[HfCl6]2– (II). Бесцветные кристаллы, выход 90%, tразл = 290°С. ИК-спектр (ν, см−1): 3317, 3082, 3047, 3030, 3007, 2989, 2972, 2920, 2868, 2850, 2765, 2582, 2513, 2424, 2281, 2229, 2009, 1978, 1928, 1822, 1600, 1587, 1500, 1487, 1481, 1436, 1421, 1411, 1338, 1319, 1288, 1265, 1197, 1176, 1166, 1112, 1031, 1018, 995, 987, 960, 881, 866, 839, 833, 752, 744, 738, 721, 692, 648, 615, 565, 528, 507, 493, 464, 449, 435, 426.
$[{\mathbf{P}}{{{\mathbf{h}}}_{{\mathbf{3}}}}{\mathbf{PC}}{{{\mathbf{H}}}_{{\mathbf{2}}}}{{{\mathbf{C}}}_{{\mathbf{6}}}}{{{\mathbf{H}}}_{{\mathbf{4}}}}{\mathbf{F}}{\text{ - }}{\mathbf{4}}]_{{\mathbf{2}}}^{ + }$[HfCl6]2– (III). Бесцветные кристаллы, выход 88%, tразл = 274°С. ИК-спектр (ν, см−1): 3446, 3169, 3091, 3055, 2989, 2966, 2910, 2872, 2846, 2773, 2520, 2426, 2264, 1984, 1913, 1834, 1788, 1598, 1587, 1508, 1483, 1436, 1421, 1406, 1342, 1327, 1317, 1217, 1199, 1159, 1139, 1112, 1051, 1028, 1012, 997, 958, 933, 875, 856, 846, 833, 821, 779, 750, 742, 719, 704, 692, 634, 615, 555, 505, 489, 476, 447, 441, 430, 418.
Для получения ИК-спектров и проведения РСА монокристаллов I−III использовали приборы Shimadzu IR Affinity-1S (4000−400 см−1, таблетирование с KBr) и Bruker D8 QUEST (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор, программы [13–15]).
Кристаллы соединения I (C40H40P2Cl6Hf, M = = 973.85) бесцветные, триклинные (пр. гр. Р$\bar {1}$), при 293.15 K a = 10.268(3), b = 10.442(5), c = = 10.873(3) Å, α = 79.95(2)°, β = 66.827(12)°, γ = = 73.585(16)°, V = 1025.4(6) Å3, Z = 1, ρвыч = 1.577 г/см3; μ = 3.040 мм–1, F(000) = 484.0. Измерено 76 149 отражений, из них 11 001 независимое отражение (Rint = 0.0374) и 9243 наблюдаемых отражения [I ≥ ≥ 2σ(I)], 224 параметра уточнения: R1 = 0.0313, wR2 = 0.0561.
Кристаллы соединения II (C52H42N2P2Cl6Hf, M = 1148.01) бесцветные, моноклинные (пр. гр. C2), при 293.15 K a = 29.593(18), b = 9.374(4), c = = 23.543(12) Å, α = 90.00°, β = 130.124(19)°, γ = = 90.00°, V = 4994(4) Å3, Z = 8, ρвыч = 3.054 г/см3, μ = 5.022 мм–1, F(000) = 4576.0. Измерено 88 523 отражения, из них 24 247 независимых (Rint = = 0.0469) и 17 788 наблюдаемых отражений [I ≥ ≥ 2σ(I)], 571 параметр уточнения: R1 = 0.0567, wR2 = = 0.1314.
Кристаллы соединения III (C50H42F2P2Cl6Hf, M = 1133.97) бесцветные, моноклинные (пр. гр. P21/c), при 293.15 K a = 19.876(16), b = 12.878(7), c = 21.395(10) Å, α = 90.00°, β = 116.73(3)°, γ = = 90.00°, V = 4891(5) Å3, Z = 4, ρвыч = 1.540 г/см3, μ = 2.567 мм–1, F(000) = 2256.0. Измерено 41 852 отражения, из них 13 346 независимых (Rint = 0.0583) и 9744 наблюдаемых отражения [I ≥ 2σ(I)], 550 параметров уточнения: R1 = 0.0738, wR2 = 0.1709.
Несмотря на одинаковые условия кристаллизации, качество кристалла III было низким, поэтому точность РСА в этом случае была ниже, чем для других образцов.
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1910538 (I), 1910536 (II), 1910537 (III); deposit@ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез комплексов I−III осуществляли добавлением четыреххлористого гафния к раствору хлорида алкилтрифенилфосфония в ацетонитриле:
При медленном удалении растворителя наблюдали образование крупных бесцветных кристаллов целевого продукта с выходом до 90%. Отметим, что аналогичным способом ранее нами были получены комплексы циркония, выход которых достигал 96% [16–18].
Известно, что поглощение C≡N-групп в ИК-спектрах соединений, независимо от их природы (органические, неорганические, элементоорганические), наблюдается в узком интервале частот: 2200–2000 см–1, т.е. колебания связей C≡N не чувствительны к влиянию окружения [19]. В связи с этим соединения с цианогруппами легко обнаружить по поглощению в указанной области. В ИК-спектре комплекса II колебаниям C≡N-групп соответствует полоса при 2230 см–1. Полосы поглощения при 1435, 1437 и 1437 см–1 в спектрах соединений I, II и III можно отнести к колебаниям связей фосфор–углерод фенильных колец в катионах, так как поглощение связей P–СPh проявляется в интервале частот 1450–1435 см–1 [19].
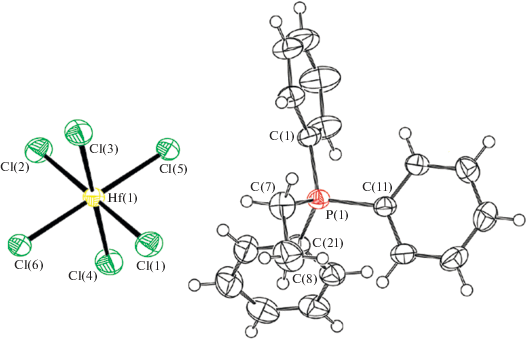
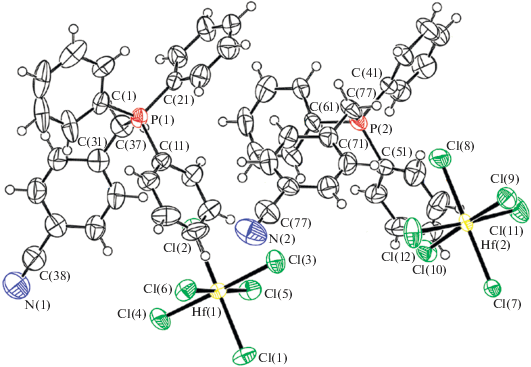
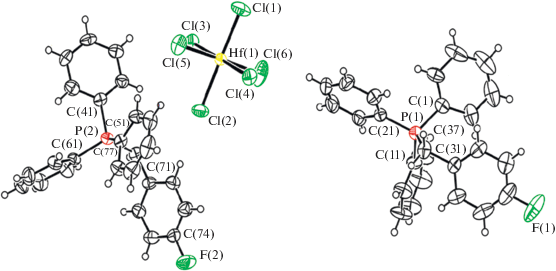
По данным РСА, в кристаллах I−III присутствуют тетраэдрические фосфониевые катионы и октаэдрические анионы [HfCl6]2– (рис. 1–3). Кристаллы II, III содержат по два типа кристаллографически независимых катионов [Ph3PR]+. Тетраэдрическая конфигурация катионов несколько искажена: углы CPC изменяются в интервалах 108.07(8)°−110.89(8)° (I), 105.0(3)°−113.8(3)° (II), 99.5(4)°−115.7(4)° (III). Длины связей P−С имеют близкие значения и составляют 1.7958(17)− 1.8042(19), 1.758(6)−1.834(6) и 1.714(8)−1.930(10) Å в I, II и III соответственно. Отметим, что такие же геометрические параметры имеют аналогичные фосфониевые катионы в комплексах циркония [20]. В октаэдрических анионах [HfCl6]2– комплекса I расстояния Hf−Cl составляют 2.4549(8)− 2.4584(10) Å, что близко к сумме ковалентных радиусов гафния и хлора (2.45 Å [21]). В II и III октаэдрическая конфигурация анионов искажена: транс-углы ClHfCl составляют 177.23(13)°−180.00° и 177.73(9)°, 178.07(10)°, 178.84(9)° соответственно, связи Hf−Cl сопоставимы по длине и изменяются в пределах 2.3949(18)−2.4976(17) Å (II) и 2.411(2)−2.527(5) Å (III).
В кристаллах I, II, III присутствуют слабые водородные связи Cl⋅⋅⋅Н–С (2.75−2.92, 2.63−2.94, 2.75−2.83 Å) между анионами и катионами, а также Н⋅⋅⋅π-взаимодействия между катионами (2.75−2.85, 2.77−2.89, 2.56−2.81 Å). Кроме того, в II и III имеют место укороченные межмолекулярные контакты N⋅⋅⋅Н–С и F⋅⋅⋅Н–С (2.46, 2.71 и 2.34, 2.55 Å), что согласуется с данными [22].
Список литературы
Ruhlandt-Senge K., Bacher A.-D., Muller U. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 1990. V. 46. P. 1925. https://doi.org/10.1107/S0108270190004243
Schormann M., Garratt S., Hughes D.L. et al. // J. Am. Chem. Soc. 2002. V. 124. P. 11266. https://doi.org/10.1021/ja026443f
Андреев П.В., Лобанова Е.В., Дрожилкин П.Д. // Вестн. ЮУрГУ. Сер. хим. 2019. Т. 11. № 4. С. 26. https://doi.org/10.14529/chem190403
Hagfeldt C., Kessler V., Persson I. // New J. Chem. 2003. V. 27. P. 850. https://doi.org/10.1039/B210969G
Dotterl M., Haas I., Alt H.G. // Z. Anorg. Allg. Chem. 2011. V. 637. P. 1502. https://doi.org/10.1002/zaac.2011002446
Neumuller B., Dehnicke K. // Z. Anorg. Allg. Chem. 2004. V. 630. P. 2576. https://doi.org/10.1002/zaac.200400370
Minasian S.G., Boland K.S., Feller R.K. et al. // Inorg. Chem. 2012. V. 51. P. 5728. https://doi.org/10.1021/ic300179d
Reid S.D., Hector A.L., Levason W. et al. // Dalton Trans. 2007. P. 4769. https://doi.org/10.1039/B708809D
Calderazzo F., Ferri I., Pampaloni G., Troyanov S. // J. Organomet. Chem. 1996. V. 518. P. 189. https://doi.org/10.1016/0022-328X(96)06194-3
Schormann M., Garratt S., Bochmann M. // Organometallics. 2005. V. 24. P. 1718. https://doi.org/10.1021/om0491692
Calderazzo F., Pallavicini P., Pampaloni G., Zanazzi P.F. // J. Chem. Soc., Dalton Trans. 1990. P. 2743. https://doi.org/10.1039/DT9900002743
Roymuhury S.K., Chakraborty D., Ramkumar V. // New J. Chem. 2015. V. 39. P. 5218. https://doi.org/10.1039/C5NJ00486A
Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Sharutin V.V., Sharutina O.K., Lobanova E.V. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1549. [Шарутин В.В., Шарутина О.К., Лобанова Е.В. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1549.]https://doi.org/10.1134/S0036023618120197
Sharutin V.V., Sharutina O.K., Tarasova N.M., Eltsov O.S. // Russ. Chem. Bull. 2019. V. 68. № 1. P. 24. [Шарутин В.В., Шарутина О.К., Тарасова Н.М., Ельцов О.С. // Изв. РАН. Серия хим. 2019. № 1. С. 24.]https://doi.org/10.1007/s11172-019-2411-9
Шарутин В.В., Шарутина О.К., Тарасова Н.М. и др. // Изв. высш. учебн. заведений. 2019. Т. 62. Вып. 6. С. 36. https://doi.org/10.6060/ivkkt.20196206.5885
Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. М.: Мир, 2006. 440 с.
Cambridge Crystallographic Data Center, 2018.
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. С. 3015.
Зефиров Ю.В., Зоркий П.М. // Успехи химии. 1995. Т. 64. № 5. С. 446. https://doi.org/10.1070/RC1995v064n05ABEH000157
Дополнительные материалы
- скачать ESMI_1487_0m_a.cif
- скачать ESMI_checkcif.docx
- Structure factors have been supplied for datablock(s) 1487_0m_a
- скачать ESMII.cif
- скачать ESMII_checkcif.docx
- Structure factors have been supplied for datablock(s) 1238_0ma_b
- скачать ESMIII_1239_0ma_a.cif
- скачать ESMIII_checkcif.docx
- Structure factors have been supplied for datablock(s) 1239_0ma_a
Инструменты
Журнал неорганической химии