Журнал неорганической химии, 2020, T. 65, № 6, стр. 764-769
Синтез фторидов кальция и стронция c иcпользованием расплава эвтектики системы Li2SO4–Na2SO4
В. Ю. Пройдакова a, А. А. Александров a, В. В. Воронов a, П. П. Федоров a, *
a Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 27.12.2019
После доработки 24.01.2020
Принята к публикации 25.01.2020
Аннотация
Методом химической реакции в растворе–расплаве сульфатов лития и натрия при 700°С синтезированы порошки фторидов кальция и стронция из сульфатов соответствующих щелочноземельных металлов. В качестве фторирующего агента использован фторид натрия. Неправильная форма частиц полученных порошков связана, по-видимому, с явлениями топотаксии на исходных частицах сульфатов кальция и стронция.
ВВЕДЕНИЕ
Известны разнообразные методы синтеза неорганических фторидов [1–15]. Использование высоких температур и фторирующей атмосферы позволяет получать продукты высокой степени чистоты, однако требует специальной аппаратуры [1, 2, 6]. Синтез осаждением из водных растворов приводит к образованию агломерированных и гидратированных наночастиц, причем полное освобождение от кислородных примесей затруднительно [8, 9, 14]. При гидротермальном синтезе [5] происходит систематическое загрязнение продуктов ионами гидроксила, оказывающее отрицательное влияние на эффективность люминесценции. Особый интерес вызывают безводные методы синтеза, позволяющие избежать пирогидролиза. Синтез из неводных органических растворителей позволяет получать ансамбли наночастиц, однако характеризуется малой производительностью и дороговизной [10, 12, 15]. Перспективным методом является синтез в растворах–расплавах (флюсах) [4, 15]. Л.Р. Бацановой [16, 17] был предложен синтез фторидов из расплавов нитратов, который с успехом применяется для получения порошков люминофоров [18–28]. Рабочий диапазон температур при синтезе из нитратных расплавов составляет 140–500°С, причем верхний предел температуры определяется термической устойчивостью расплавов нитратов. Иногда при синтезе фаз сложного состава этим методом время установления равновесия слишком велико.
Для синтеза оксидов из солевых расплавов (Molten Salt Synthesis) широко применяется сульфатный флюс, а именно легкоплавкая эвтектика в системе сульфат лития–сульфат натрия [29]. Координаты эвтектики: 580°С, 40 мол. % Na2SO4 [30, 31]. Эта система удовлетворяет условию легкой отмывки продукта водой от флюса. Однако нам неизвестны попытки применения сульфатного синтеза для получения фторидов.
Цель настоящей работы – синтез порошков фторидов кальция и стронция из соответствующих сульфатов щелочноземельных металлов с использованием сульфатного флюса.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Для синтеза фторидов щелочноземельных элементов использовали фторид натрия NaF в качестве фторирующего агента. Химические реакции, протекающие при синтезе, соответствуют фазообразованию в четырехкомпонентных взаимных системах Li,Na,Ca||F,SO4 и Li,Na,Sr||F,SO4. Поскольку фазовые диаграммы соответствующих систем не изучены, к сожалению, физико-химический анализ не может служить ориентиром в намеченном синтезе.
Соответствующие химические превращения описываются следующими уравнениями:
(1)
${\text{CaS}}{{{\text{O}}}_{4}} + 2{\text{NaF}} \to {\text{Ca}}{{{\text{F}}}_{2}}{\kern 1pt} \downarrow + \,{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}},$(2)
${\text{SrS}}{{{\text{O}}}_{{\text{4}}}} + 2{\text{NaF}} \to {\text{Sr}}{{{\text{F}}}_{2}}{\kern 1pt} \downarrow + \,{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}}.$Расчет изобарно-изотермических потенциалов реакций, проведенный с использованием стандартных термохимических данных (табл. 1) дал следующие величины: ΔG298 = –31.2 кДж/моль и ΔG1000 = –37.6 кДж/моль для реакции (1), ΔG298 = = –9.2 кДж/моль и ΔG1000 = –14.5 кДж/моль для реакции (2). Полученные величины носят оценочный характер. Однако они свидетельствуют о незначительном сдвиге реакций (1), (2) вправо. Использование расплавов сульфатов в качестве среды реакции может существенно изменить термодинамику процессов. Проверка возможности синтеза фторидов кальция и стронция предлагаемым способом требует прямого экспериментального исследования. Для сдвига химического равновесия вправо при синтезе использовали избыток осадителя (NaF).
Таблица 1.
Термохимические характеристики исходных веществ и продуктов реакций [32]
| Вещество | $\Delta H_{{298}}^{0},$ кДж/моль | $S_{{298}}^{0},$ Дж/(моль K) |
|---|---|---|
| Na2SO4 | –1389.5 | 149.62 |
| CaSO4 | –1436.3 | 106.7 |
| SrSO4 | –1459.0 | 121.81 |
| NaF | –572.8 | 51.17 |
| CaF2 | –1220.9 | 68.5 |
| SrF2 | –1222.0 | 82.1 |
МЕТОДИЧЕСКАЯ ЧАСТЬ
Для синтеза фторидов использовали сульфаты стронция (SrSO4) и кальция (CaSO4), полученные по приведенной ниже методике, сульфат лития (Li2SO4), полученный по методике [33], коммерческие NaF (99.99 мас. %, Химмед, Россия) и сульфат натрия Na2SO4 марки “х. ч.” (Химмед, Россия), а также бидистиллированную воду. Сульфаты лития и натрия предварительно обезвоживали при температуре ~250°C.
Безводные сульфаты стронция и кальция получали с использованием карбонатов стронция и кальция марки “х. ч.”, серной кислоты “х. ч.”, бидистиллированной воды по реакции:
(3)
${\text{MC}}{{{\text{O}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} = {\text{MS}}{{{\text{O}}}_{4}} + {\text{C}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow + \,{{{\text{H}}}_{{\text{2}}}}{\text{O}},$где M = Ca, Sr. В стакан объемом 200 мл с мешалкой помещали 10 г карбонатов стронция или кальция и 10 мл H2O и постепенно прикапывали серную кислоту до почти полной нейтрализации (~31.5 мл H2SO4). После нейтрализации раствору давали отстояться и фильтровали. Фильтрат упаривали до объема 20 мл. Выпавшие кристаллы MSO4 · nH2O отсасывали на воронке Бюхнера и нагревали на воздухе при 250 и 420°C.
Порошки фторидов кальция (CaF2) и стронция (SrF2) получали в сульфатном солевом расплаве. Состав исходной загрузки (50% Li2SO4–30% Na2SO4–20% CaSO4, 52.5% Li2SO4–32.5% Na2SO4–15% SrSO4, мол. %) и температуру синтеза 700°C выбирали исходя из возможных фазовых равновесий в тройных сульфатных системах, которые, к сожалению, не изучены. К смеси добавляли фторирующий агент в следующих соотношениях: CaSO4 : NaF = 1 : 1.5, SrSO4 : NaF = 1 : 5. Температура синтеза выбрана ниже температуры начала пирогидролиза фторидов кальция и стронция [34, 35]. Исходные реагенты измельчали в агатовой ступке пестиком до образования однородного порошка, затем все компоненты помещали в фарфоровый глазурованный или платиновый тигель и ставили в муфельную печь. Реакционную смесь выдерживали при температуре 700°С (скорость нагрева 10 град/мин) в течение 3 ч, затем тигель вынимали из печи и остужали. Расплавленные продукты вынимали из тигля и переносили в пластиковую емкость, далее трижды промывали бидистиллированной водой для удаления сульфатов лития, натрия и избытка фторирующего агента. Образцы фторидов сушили при температуре ~45°C в течение 2 ч.
Полученные образцы исследовали методом рентгенофазового анализа на дифрактометре Bruker D8 Advance (CuKα-излучение), параметры решетки рассчитывали в программе Powder 2.0 (∆Q < 10). Размер частиц и морфологию определяли на растровом электроном микроскопе (РЭМ) Carl Zeiss NVision 40 при ускоряющем напряжении 1 кВ с приставкой XMAX 80 mm2 (Oxford Instruments) для энергодисперсионной рентгеновской спектроскопии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
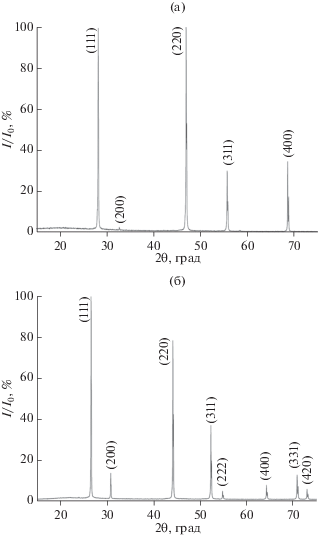
Результаты рентгенофазового анализа (РФА) синтезированных образцов представлены на рис. 1. Полученные препараты кристаллизуются в кубической гранецентрированной решетке (пр.гр. Fm$\bar {3}$m). РФА показал, что рассчитанный параметр решетки флюоритовой фазы SrF2 (a = 5.7994(1) Å) соответствует литературным данным (JCPDS card #06-0262), а для синтезированного CaF2 значение a = 5.4597 (3) Å, чуть меньше параметра чистого CaF2 (a = 5.463 Å, JCPDS card #35-0816). При этом на рентгенограмме наблюдается слабый пик с индексом (200), который полностью отсутствует на рентгенограмме чистого фторида кальция. Это может быть связано с наличием небольшой примеси натрия в синтезированном образце [36].
Выход продуктов реакции составил 98% для реакции (1) и 90% для реакции (2).
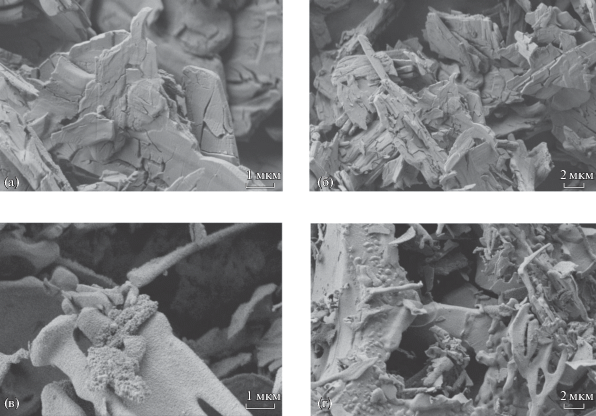
На рис. 2 и 3 представлены микрофотографии, полученные методом РЭМ. Видно, что полученные порошки фторидов кальция (рис. 2в, 2г) и стронция (рис. 3в, 3г) имеют очень причудливую морфологию, совершенно нехарактерную для этих веществ, кристаллизующихся в кубической сингонии [37]. На рис. 2 видно, что частицы фторида кальция в результате синтеза унаследовали неправильную для агломератов форму исходных частиц сульфата кальция. Таким образом, в результате протекания реакции (2) имеет место ярко выраженный процесс топотаксии [38].
В случае фторида стронция ситуация сложнее. Исходный порошок сульфата стронция состоял из кристаллических наночастиц, габитус которых определялся ромбической структурой целестина. В процессе синтеза фторида стронция получены более крупные бесформенные частицы микронных размеров. При этом на их поверхности видны ограненные и правильно взаимно ориентированные кубические наночастицы. Можно предположить, что в результате реакции (2) наночастицы сульфата стронция превратились в ограненные наночастицы фторида, которые, в свою очередь, срослись в более крупные микрочастицы неправильной формы (агломераты) по механизму неклассического роста кристаллов [37].
Таким образом, проведенные исследования свидетельствуют о том, что синтез фторидов щелочноземельных металлов из соответствующих сульфатов в сульфатном расплаве возможен. Однако неправильная форма частиц получаемых образцов вызывает сомнения, что такие порошки можно будет эффективно использовать в качестве прекурсоров функциональных материалов со стабильными характеристиками.
Список литературы
Guggenheim H. // J. Phys. Chem. 1960. V. 64. P. 938.
Bamberger C.E. // Advances in molt salt chemistry / Eds. Braunstein J., Mamantov G., Smith G.P. N.Y.: Plenum Press, 1975. P. 177.
Bergmann P.H. // Handbuch der anorganischen Chemie. Syst. Nummer 39: Seltenerdelemente. Teil C.3: Sc, Y, La und Lanthanide. Fluoride, Oxifluoride und zugehogige Alkalidoppelverbindungen. Springer Vlg., Berlin, 1976.
Wanklyn B.M., Wondre F.R., Garrard B.J. et al. // J. Mater. Sci. 1981. V. 16. P. 2303. https://doi.org/10.1007/BF00542395
Demianets L.N. // Prog. Cryst. Growth Charact. 1990. V. 21. P. 299.
Sobolev B.P. The Rare Earth Trifluorides. P. 2. Introduction to Materials Science of Multiconoinent Metal Fluoride Crystals. Barcelona, 2001. 459 p.
Zhang C., Chen J., Zhou Y., Li D. // J. Phys. Chem. C. 2008. V. 112. P. 10083. https://doi.org/10.1021/jp802083q
Fedorov P.P., Luginina A.A., Kuznetsov S.V., Osiko V.V. // J. Fluor. Chem. 2011. V. 132. P. 1012. https://doi.org/10.1016/j.jfluchem.2011.06.025
Fedorov P.P., Kuznetsov S.V., Mayakova M.N. et al. // Russ. J. Inorg. Chem. 2011. V. 56. P. 1525. [Федоров П.П., Кузнецов С.В., Маякова М.Н. и др. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1604.]https://doi.org/10.1134/S003602361110007X
Bartůněk V., Jakeš V., Král V., Rak J. // J. Fluor. Chem. 2012. V. 135. P. 358. https://doi.org/10.1016/j.jfluchem.2011.09.003
Lucier B.E.G., Johnston K.E., Arnold D.C. et al. // J. Phys. Chem. C. 2014. V. 118. P. 1213. https://doi.org/10.1021/jp408148b
Naccache R., Yu Q., Capabianco J.A. // Adv. Opt. Mater. 2015. V. 3(4). P. 482. https://doi.org/10.1002/adom20140062.8
Wilkening M., Duvel A., Preishuber-Pflugl F. et al. // Z. Kristallogr. 2016. V. 232. P. 107. https://doi.org/10.1515/zkri-2016-1963
Kuznetsov S.V., Kozlova A.N., Voronov V.V. et al. // Russ. J. Inorg. Chem. 2018. V. 64. № 3. P. 293. [Кузнецов С.В., Козлова А.Н., Воронов В.В. и др. // Журн. неорган. химии. 2018. Т. 64. № 3. С. 273.]https://doi.org/10.1134/S0036023618030130
Fedorov P.P., Alexandrov A.A. // J. Fluorine Chem. 2019. V. 227. P. 109374. https://doi.org/10.1016/j.jfluchem.2019.109374
Бацанова Л.Р., Куприянова А.К., Дорошенко В.И. // Неорган. материалы. 1971. V. 7. P. 1876.
Batsanova L.R. // Usp. Khim. 1971. V. 40. № 6. P. 945. [Бацанова Л.Р. // Успехи химии. 1971. Т. 40. № 6. С. 945.]
Ding M., Lu C., Cao L. et al. // CrystEngComm. 2013. V. 15. P. 6015. https://doi.org/10.1039/c3ce40477c
Huang X., Hu G., Xu Q. et al. // J. Alloys Compd. 2014. V. 616. P. 652. https://doi.org/10.1016/j.jallcom.2014.07.067
Hu L., Chen J., Fan L. et al. // J. Am. Ceram. Soc. 2014. V. 97. P. 1009. https://doi.org/10.1111/jace.12855
Niu N., He F., Wang L. et al. // J. Nanosci. Nanotechnol. 2014. V. 14. P. 3509. https://doi.org/10.1166/jnn.2014.7976
Ding M., Xi J., Yin S., Ji Z. // Superlattices Microstruct. 2015. V. 83. P. 390. https://doi.org/10.1016/j.spmi.2015.03.026
Huang X., Jiang L., Xu Q. et al. // RSC Adv. 2017. V. 7. P. 41190. https://doi.org/10.1039/c7ra05479c
Huang X., Jiang L., Li X., He A. // J. Alloys Compd. 2017. V. 721. P. 374. https://doi.org/10.1016/j.jallcom.2017.05.320
Pornpatdetaudom T., Serivalsatit K. // Key Eng. Mater. 2018. V. 766. P. 34. https://doi.org/10.4028/www.scientific.net/KEM.766.34
Jong-Wook Ha, Eun-Ho Sohn, In Jun Park et al. // Mater. Lett. 2017. V. 209. P. 357. https://doi.org/10.1016/j.matlet.2017.08.029
Fedorov P.P., Mayakova M.N., Alexandrov A.A. et al. // Inorganics. 2018. V. 6. P. 38. https://doi.org/10.3390/inorganics6020038
Fedorov P.P., Mayakova M.N., Voronov V.V. et al. // J. Fluorine Chem. 2019. V. 218. P. 69. https://doi.org/10.1016/j.jfluchem.2018.11.018
Kimura T. // Advances in Ceramics Synthesis and Characterization, Processing and Specific Applications / Ed. Sikalidis C., London, 2011. P. 750. https://doi.org/10.5772/20472
Посыпайко В.И., Алексеева Е.А., Васина Н.А. и др. Диаграммы плавкости солевых систем. М.: Металлургия, 1977. 304 с.
Fedorov P.P., Proydakova V.Yu., Kuznetsov S.V. et al. // J. Am. Ceram. Soc. 2020. V. 103. № 5. P. 3390.https://doi.org/10.1111/jace.16996
https://chemiday.com/ru/thermodynamic_inorganic
Fedorov P.P., Proidakova V.Y., Kuznetsov S.V., Voronov V.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 11. P. 1508. [Федоров П.П., Пройдакова В.Ю., Кузнецов С.В., Воронов В.В. // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1513.]
Warf J.C., Cline W.D., Tevebaugh R.D. // Analyt. Chem. 1954. V. 26. P. 342. https://doi.org/10.1021/ac60086a019
Messier D.R. // J. Electrochem. Soc. 1968. V. 115. P. 397.
Fedorov P.P., Mayakova M.N., Kuznetsov S.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 11. P. 14728. [Федоров П.П., Маякова М.Н., Кузнецов С.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 11. С. 1529.]
Fedorov P.P., Osiko V.V. // Dokl. Phys. 2019. V. 64. № 9. P. 353. [Федоров П.П., Осико В.В. // Докл. РАН. 2019. Т. 488. № 3. С. 253.]https://doi.org/10.1134/S1028335819090076
Олейников Н.Н. // Рос. хим. журн. 1995. Т. 39. № 2. С. 85.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии