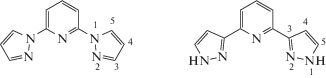Журнал неорганической химии, 2020, T. 65, № 6, стр. 797-803
Новый оксокомплекс железа(III) с замещенным 2,6-бис(пиразол-3-ил)пиридином
И. А. Никовский a, А. В. Полежаев a, b, Е. К. Мельникова a, c, Ю. В. Нелюбина a, d, *
a Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119334 Москва, ул. Вавилова, 28, Россия
b Московский государственный технический университет им. Баумана
105005 Москва, ул. 2-я Бауманская, 5, Россия
c Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
d Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: unelya@ineos.ac.ru
Поступила в редакцию 18.11.2019
После доработки 09.01.2020
Принята к публикации 30.01.2020
Аннотация
Окислением комплекса железа(II) с тридентатным лигандом (L) – 2,6-бис(5-(4-фторфенил)-1H-пиразол-3-ил)пиридином получен новый биядерный оксокомплекс железа(III) [(L)FeOFe(L)](PO2F2)4 (1) с противоионами ${\text{P}}{{{\text{O}}}_{2}}{\text{F}}_{2}^{-},$ образовавшимися в результате окисления гексафторфосфат-аниона. По данным рентгенодифракционного исследования, ионы железа(III) находятся в высокоспиновом состоянии, как в ранее описанном оксокомплексе железа(III) с трет-бутилзамещенным бис(пиразол-3-ил)пиридином. Наличие в оксокомплексе 1 ароматических пара-фторфенильных заместителей и противоионов ${\text{P}}{{{\text{O}}}_{2}}{\text{F}}_{2}^{-}$ приводит к уменьшению разворота бис(пиразол-3-ил)пиридиновых лигандов друг относительно друга и, как результат, к менее искаженной молекулярной геометрии данного комплекса.
ВВЕДЕНИЕ
Биядерные оксокомплексы железа(III) представляют интерес в качестве катализаторов гидроксилирования алканов, обеспечивающих высокую селективность и скорость этих превращений [1]. Среди таких комплексов особо стоит отметить комплексы железа(III) с лигандами на основе производных пиридина, таких как бипиридин [2] или трис[(1-метилимидазол-2-ил)метил]амина [3]. Биядерные оксокомплексы железа(III) недавно были обнаружены в некоторых белках, содержащих негемовое железо [4], которые в присутствии молекулярного кислорода и при наличии источника электронов катализируют процесс превращения метана в метанол [5]. Кроме того, комплексы переходных металлов с тридентатными лигандами на основе пиридина проявляют каталитическую активность в реакциях циклопропанирования и эпоксидирования стирола [6] и полимеризации ε-капролактона [7].
Одним из популярных в литературе классов пиридиновых лигандов являются 2,6-бис(пиразол-1-ил)пиридины [8] и изомерные им 2,6-бис(пиразол-3-ил)пиридины (схема 1 ) [6], способные образовывать комплексы с широким набором металлов и обладающие широчайшими возможностями химической функционализации в различных положениях пиридинового и пиразолильного фрагментов [6]. Несмотря на то, что бис(пиразолил)пиридины ранее использовались для получения на их основе оксокомплексов переходных металлов [9], они менее изучены, чем другие классы лигандов, применяемых для этих целей [10, 11]. В случае N-незамещенных бис(пиразол-3-ил)пиридинов могут протекать процессы переноса протона с атома азота на кислород, что позволяет их использовать для активации кислорода воздуха. Возможность подобного поведения для бис(пиразол-3-ил)пиридиновых комплексов ранее была обнаружена при активации гидразина [12].
Хотя к настоящему моменту получена целая серия комплексов железа(II) с замещенными бис(пиразол-3-ил)пиридинами [6, 13–15], склонных к окислению кислородом воздуха [16], примеры оксокомплексов железа(III), содержащих такие лиганды, в литературе практически отсутствуют [9, 17–19].
Схема 1 . 2,6-Бис(пиразол-1-ил)пиридин и изомерный ему 2,6-бис(пиразол-3-ил)пиридин.
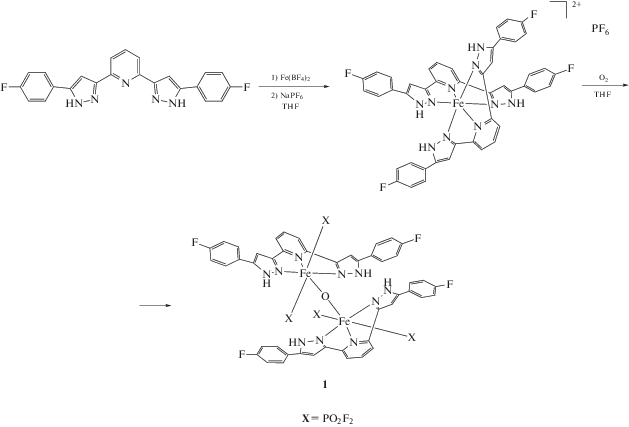
В настоящей работе синтезирован новый оксокомплекс железа(III) 1, являющийся продуктом окисления ранее описанного [15] комплекса железа(II) c 2,6-бис(5-(4-фторфенил)-1H-пиразол-3-ил)пиридином L. Полученный комплекс (схема 2 ) с анионами ${\text{P}}{{{\text{O}}}_{2}}{\text{F}}_{2}^{-}$ выделен в виде кристаллосольвата с диэтиловым эфиром, что однозначно подтверждается данными элементного анализа и рентгеновской дифракции.
Схема 2 . Синтез оксокомплекса 1 с 2,6-бис(5-(4-фторфенил)-1H-пиразол-3-ил)пиридином.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом бис(пиразол-3-ил)пиридинового лиганда и его комплекса, выполняли на воздухе с использованием коммерчески доступных органических растворителей, которые предварительно подвергали перегонке. Гексагидрат тетрафторбората железа Fe(BF4)2 ‧ 6H2O и NH4PF6 (Sigma-Aldrich) использовали без дополнительной очистки. Этерификацию пиридин-2,6-дикарбоновой кислоты (Acros) этиловым спиртом проводили по методике [20] в присутствии серной кислоты. Анализ на содержание углерода, азота и водорода проводили на микроанализаторе Carlo Erba, модель 1106.
Синтез 3,3'-пиридин-2,6-диил-бис(1-(4-фторфенил)пропан-1,3-диона). К смеси 2,6-пиридиндикарбонового этилового эфира (2.23 г, 10 ммоль) и 4'-фторацетофенона (2.5 мл, 25 ммоль) в сухом тетрагидрофуране (ТГФ) (25 мл) добавляли гидрид натрия (1.8 г, 50% в минеральном масле). Реакционную смесь кипятили с обратным холодильником в течение 6 ч и затем охлаждали. Растворитель выпаривали, а оставшееся твердое вещество промывали диэтиловым эфиром (2 × 30 мл), отфильтровывали и сушили. Сырой продукт диспергировали в воде (30 мл), а полученный щелочной раствор обрабатывали 1 М соляной кислоты до тех пор, пока он не становился слегка кислым (рН 5). Выпавший твердый продукт отфильтровывали, высушивали в вакууме и использовали без дальнейшей очистки. Выход 2.64 г (65%). 1H ЯМР (300 МГц, CDCl3): δ (м.д.) = 16.34 (с., уш., 2H, енольная OH), 8.32–8.11 (м., 3H, Py–H), 8.08 (д., 4H, J = = 7.5 Гц, Ar–H), 7.82–7.53 (м., 4H, Ar–H), 7.01 (с., 2H, енольная CH); 13C ЯМР (75 МГц, CDCl3): δ (м.д.) = 93.5 (c., енольная CH), 116.0 (c., 2-Ar/3-Ar), 116.3 (c., 3-Py), 124.6 (c., 2-Ar/3-Ar), 129.7(c., 1-Ar), 129.8 (c., 4-Py), 132.6 (c., 2-Py), 145.4 (д., 1JC,F = = 248.2 Гц, 4-Ar), 166.7 (c., C=O), 185.3 (c., енольная CH).
Синтез 2,6-бис(5-(4-фторфенил)-1H-пиразол-3-ил)пиридина (L). Продукт с предыдущей стадии (0.407 г, 1 ммоль) и гидрат гидразина (0.5 мл, 10 ммоль) растворяли в этаноле (10 мл) и кипятили с обратным холодильником в течение 8 ч, а затем охлаждали. Полученный раствор выдерживали при температуре –10°С в течение 12 ч. Образовавшиеся белые кристаллы собирали фильтрацией и высушивали в вакууме. Выход 271 мг (68%). 1H ЯМР (400 МГц, ДМСО-д6): δ (м.д.) = 7.28 (д.д., 4H, JHH = 7.3 Гц, o-Ph-F), 7.49 (с., 2H, m-CH-Pz), 7.8 (д., 2H, JH,H = 7.5 Гц, m-CH-Py), 7.9 (псевдо д.д., 4H, JHH = 7.9 Гц, m-Ph-F) 7.96 (т., 1H, JH,H = = 7.5 Гц, p-CH-Py), 13.57 (с., 2H, NH); 13C ЯМР (126 MГц, 25°C, ДМСО-д6): δ (м.д.) = 101.38 (c., 4-Pz), 116.02 (c., 2-Ar/3-Ar), 116.23 (c., 3-Py), 118.76 (c., 1-Ar), 127.50 (c., 2-Ar/3-Ar), 127.58, (c., 4-Py), 138.97 (c., 5-Pz), 139.13 (c., 3-Pz), 144.17 (c., 1-Py), 162.23 (д., 1JC,F = 245.1 Гц, 4-Ar).
Синтез оксокомплекса [(L)Fe(PO2F2)2OFe (PO2F2)2(L)] (1). Гексагидрат тетрафторбората железа (0.0337 г, 0.1 ммоль) и 2,6-бис(5-(4-фторфенил)-1H-пиразол-3-ил)пиридин (0.109 г, 0.2 ммоль) перемешивали в ТГФ в течение 3 ч в колбе объемом 25 мл. К полученному раствору добавляли NH4PF6 (0.0326 г, 0.2 ммоль) и перемешивали в течение 10 мин. После этого раствор помещали в колбу Шленка объемом 25 мл, замораживали, заменяли воздух в колбе кислородом и размораживали. Такую процедуру повторяли 3 раза. Затем раствор перемешивали в течение 41 ч при комнатной температуре. Реакционную смесь отфильтровывали от избытка лиганда. Продукт реакции осаждали из раствора гексаном. Осадок отфильтровывали и высушивали в вакууме. Перекристаллизацию осуществляли медленной диффузией паров диэтилового эфира в раствор комплекса в ТГФ. Выход 127 мг (48%).
| Найдено, %: | C, 42.05; | H, 2.41; | N, 10.08. |
| Для C46H30F12Fe2N10O9P4 · 0.5 Et2O | |||
| вычислено, %: | C, 42.16; | H, 2.58; | N, 10.24. |
ЯМР-спектроскопия. Спектры 1H и 13C ЯМР регистрировали в ДМСО-д6 и CDCl3 на спектрометрах Bruker Avance 300 и 400 (рабочие частоты для протонов 300.15 и 400 МГц соответственно) с использованием следующих параметров: для 1Н спектров диапазон 1000 м.д., время регистрации 0.1 с, длительность релаксационной задержки 0.1 с, длительность импульса 6.5 мкс, количество накоплений 1024; для 13С{1H} спектров диапазон 3000 м.д., время регистрации 0.1 с, длительность релаксационной задержки 0.1 с, длительность импульса 9 мкс, количество накоплений более 32 тыс. Значения химических сдвигов (δ, м.д.) в спектрах определяли относительно остаточного сигнала растворителя (1H –7.26 м.д., 13C –77.16 м.д. для CDCl3 и 1H 2.5 м.д., 13C 39.52 м.д. для ДМСО-д6).
Рентгеноструктурный анализ. Рентгенодифракционное исследование монокристаллов оксокомплекса 1, полученных диффузией паров диэтилового эфира в его раствор в ТГФ, проводили на дифрактометре Bruker APEX2 CCD (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структура расшифрована с использованием программы ShelXT [21] и уточнена полноматричным методом наименьших квадратов с помощью программы Olex2 [22] в анизотропном приближении по $F_{{hkl}}^{2}$. Атомы водорода NH-групп позиционировали, исходя из разностных Фурье-синтезов электронной плотности, а положения остальных атомов водорода рассчитывали геометрически. Все атомы водорода уточняли в изотропном приближении по модели наездника. Основные кристаллографические данные и параметры уточнения представлены в табл. 1. Структурные данные для комплекса 1 депонированы в Кембриджском банке структурных данных (CCDC № 1969488; http://www.ccdc.cam.ac.uk/).
Таблица 1.
Основные кристаллографические данные и параметры уточнения для комплекса 1
| Параметр | 1 |
|---|---|
| Брутто-формула | C48H35F12Fe2N10O9.5P4 |
| Молекулярная масса | 1367.44 |
| T, K | 120 |
| Кристаллическая система | Триклинная |
| Пр. гр. | P1 |
| Z | 2 |
| a, Å | 10.623(19) |
| b, Å | 16.42(3) |
| c, Å | 18.94(3) |
| α, град | 115.12(5) |
| β, град | 103.74(4) |
| γ, град | 91.15(5) |
| V, Å3 | 2879(9) |
| dвыч, г/см3 | 1.578 |
| μ, см–1 | 7.17 |
| F(000) | 1378 |
| 2θmax, град | 54 |
| Число измеренных отражений | 28 283 |
| Число независимых отражений | 12 570 |
| Число отражений с I > 3σ(I) | 6040 |
| Количество уточняемых параметров | 795 |
| R1 | 0.0700 |
| wR2 | 0.1886 |
| GOF | 1.001 |
| Остаточная электронная плотность, e Å–3 (dmax/dmin) | 0.802/–0.886 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
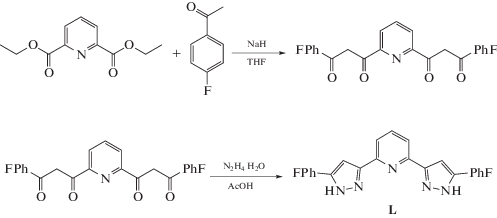
Для синтеза 2,6-бис(5-(4-фторфенил)-1H-пиразол-3-ил)пиридина (L) исходный 3,3'-пиридин-2,6-диил-бис(1-(4-фторфенил)пропан-1,3-дион) получали по методике [23] реакцией конденсации Кляйзена между диэтил-2,6-пиридиндикарбоксилатом и 4-фторацетофеноном в растворе ТГФ в присутствии гидрида натрия (cхема 3). Конденсация полученного дикетона и гидразингидрата с последующей циклизацией в уксусной кислоте приводила к получению целевого бис(пиразол-3-ил)пиридина L с высоким выходом. Плохая растворимость в ТГФ способствовала тому, что он выпадал в осадок при выдерживании реакционной смеси при температуре –10°С и не требовал дальнейшей очистки.
Схема 3 . 2,6-Бис(5-(4-фторфенил)-1H-пиразол-3-ил)пиридина (L).
Для синтеза соответствующего оксокомплекса железа(III) 1 проводили “one-pot” реакцию бис(пиразол-3-ил)пиридина L с гидратом тетрафторбората железа(II) с последующей заменой противоиона на гексафторфосфат в эквимолярной смеси ТГФ/ацетонитрил при комнатной температуре (схема 2 ) c дальнейшим окислением промежуточного продукта, который был описан ранее [15], насыщением кислородом растворителя и выдерживанием реакционной смеси в течение 41 ч. Реакция окисления Fe2+ c получением оксокомплекса 1 сопровождалась реакцией гидролиза противоиона с водой, содержавшейся в растворителе, как показано ранее [24]. Полученный оксокомплекс 1 с анионами ${\text{P}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{2}^{-}$ после перекристаллизации медленной диффузией паров диэтилового эфира в раствор ТГФ был выделен в виде кристаллосольвата с одной молекулой диэтилового эфира, приходящейся на две молекулы целевого продукта, что однозначно подтверждается данными элементного анализа и рентгеновской дифракции.
Согласно рентгеноструктурным данным, при 120 K оксокомплекс 1 (рис. 1, табл. 2) содержит два иона железа(III), связанных между собой мостиковым атомом кислорода (Fe–O 1.760(5)–1.765(5) Å) с углом FeOFe, близким к линейному (176.4(3)°). К каждому иону металла тремя атомами азота координирован бис(пиразол-3-ил)пиридиновый лиганд, причем соответствующие расстояния Fe–N (2.094(6)–2.169(7) Å) характерны для высокоспиновых комплексов железа(III) с азотсодержащими гетероциклами (2.1–2.2 Å) [25]. Кроме того, каждый ион железа(III) дополнительно связан с двумя анионами ${\text{P}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{2}^{-},$ которые образуют водородные связи N–H…O (N…O 1.649(7)–1.866(5) Å, NHO 135.9(3)°–172.5(4)°) с NH-группами второго бис(пиразол-3-ил)пиридина в оксокомплексе 1, дополнительно стабилизируя его молекулярную геометрию с лигандами, повернутыми друг относительно друга на 29.16(6)°.
Рис. 1.
Общий вид оксокомплексa 1 в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Молекула сольватного диэтилового эфира, а также атомы водорода, за исключением принадлежащих NH-группам, не показаны для ясности.
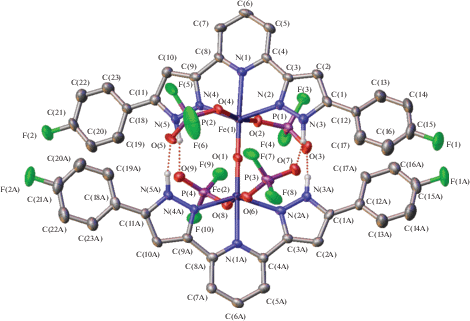
Таблица 2.
Основные геометрические параметры оксокомплекса 1 по данным рентгеноструктурного исследования при 120 K
| Параметр | 1 |
|---|---|
| M–N(Py), Å | 2.151(7)–2.169(7) |
| M–N(Pz), Å | 2.094(6)–2.127(7) |
| Fe–O(1), Å | 1.760(5)–1.765(5) |
| FeOFe, град | 176.4(3) |
| Fe–O(POF2), град | 2.003(6)–2.053(6) |
| θ, град | 29.16(6) |
| N(Py)N(Pz)N(Py), град | 105.1(3)–105.8(3) |
| α, град | 5.9(3)–18.2(3) |
| S(TP-6) | 13.491–14.123 |
| S(OC-6) | 1.398–1.521 |
Примечание. Атомы N(Py) и N(Pz) соответствуют атомам азота пиридинового и пиразол-3-ильного фрагментов, а атомы O(1) и O(POF2) – мостиковому атому кислорода и атому кислорода противоиона; θ – угол между среднеквадратичными плоскостями 2,6-бис(пиразол-3-ил)пиридиновых лигандов, α – угол поворота пара-фторфенильных заместителей относительно плоскости пиразол-3-ильного кольца. S(TP-6) и S(OC-6) – отклонения формы полиэдра иона железа(III) от идеальной тригональной призмы (TP-6) и идеального октаэдра (OC-6) соответственно.
Для сравнения угол между двумя бис(пиразол-3-ил)пиридиновыми лигандами с трет-бутильными группами в пятом положении пиразол-3-ильного кольца в единственном [9] аналогичном оксокомплексе железа(III) (Fe–N 2.137(4)–2.185(3) Å, Fe–O 1.780(2)–1.783(2) Å, FeOFe 177.80(19)°) составляет 46.86(3)°. Подобное различие, по-видимому, вызвано наличием в указанном комплексе объемных трифлат-анионов, координирующих ионы железа(III) и образующих аналогичные водородные связи с лигандами, а также стерически-нагруженных трет-бутильных групп в пятом положении пиразол-3-ильного кольца. В оксокомплексе 1 соответствующие пара-фторфенильные заместители практически не отклоняются от плоскости данного кольца (рис. 1, табл. 2); угол между плоскостями двух ароматических фрагментов лежит в диапазоне 5.9(3)°–18.2(3)°.
Стоит отметить, что для комплексов переходных металлов с “жесткими” 2,6-бис(пиразол-3-ил)пиридиновыми лигандами [26], о чем свидетельствуют углы N(Py)N(Pz)N(Py) 105.1(3)°–105.8(3)°, часто наблюдается тригонально-призматическое искажение (псевдо)октаэдрического координационного окружения иона металла. Для надежного описания формы координационного полиэдра ионов железа(III) в оксокомплексе 1 использовали так называемые “меры симметрии” [27], количественно характеризующие ее отклонение от идеального октаэдра S(OC-6) и идеальной тригональной призмы S(TP-6). Чем эти значения меньше, тем лучше форма полиэдра описывается соответствующим многогранником. В полученном оксокомплексе 1 величины октаэдрической S(OC-6) и тригонально-призматической S(TP-6) “мер симметрии”, оцененные на основе рентгенодифракционных данных с использованием программы Shape 2.1 [27], для ионов железа(III) составляют 1.398–1.521 и 13.491–14.123 соответственно. Таким образом, их координационное окружение, образованное 2,6-бис(пиразол-3-ил)пиридиновым лигандом, мостиковым атомом кислорода и двумя противоионами ${\text{P}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{2}^{-},$ близко к октаэдрическому, характерному для иона железа(III) в высокоспиновом состоянии.
ЗАКЛЮЧЕНИЕ
Синтезирован и охарактеризован новый оксокомплекс железа(III) с 2,6-бис(пиразол-3-ил)пиридином, содержащим пара-фторфенильный заместитель в пятом положении пиразол-3-ильного кольца, и анионами ${\text{P}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{2}^{-},$ образовавшимися в результате окисления гексафторфосфат-аниона. Полученные рентгенодифракционные данные, в первую очередь длины связей M–N и близкое к октаэдрическому координационное окружение металла, указывают на высокоспиновое состояние двух ионов железа(III), как в ранее описанном оксокомплексе железа(III) с трет-бутилзамещенными бис(пиразол-3-ил)пиридинами [9]. Однако их замена на ароматические пара-фторфенильные заместители и введение менее объемных анионов ${\text{P}}{{{\text{O}}}_{{\text{2}}}}{\text{F}}_{2}^{-}$ приводят к уменьшению разворота бис(пиразол-3-ил)пиридиновых лигандов друг относительно друга в оксокомплексе 1 и, как результат, к его менее искаженной молекулярной геометрии.
Список литературы
Schuchardt U., Cardoso D., Sercheli R. et al. // Appl. Catalysis A. 2001. V. 211. № 1. P. 1. https://doi.org/10.1016/S0926-860X(01)00472-0
Ménage S., Galey J.-B., Hussler G. et al. // Angew. Chem. Int. Ed. 1996. V. 35. № 20. P. 2353. https://doi.org/10.1002/anie.199623531
Costas M., Mehn M.P., Jensen M.P., Que L. // Chem. Rev. 2004. V. 104. № 2. P. 939. https://doi.org/10.1021/cr020628n
Donald M., Kurtz Jr. // J. Biol. Inorg. Chem. 1997. T. 2. P. 159. https://doi.org/10.1007/s007750050120
Wallar B.J., Lipscomb J.D. // Chem. Rev. 1996. V. 96. № 7. P. 2625. https://doi.org/10.1021/cr9500489
Halcrow M.A. // Coord. Chem. Rev. 2005. V. 249. № 25. P. 2880. https://doi.org/10.1016/j.ccr.2005.03.010
Zikode M., Ojwach S.O., Akerman M.P. // J. Mol. Catalysis A. 2016. V. 413. P. 24. https://doi.org/10.1016/j.molcata.2015.12.008
Halcrow M.A. // Coord. Chem. Rev. 2009. V. 253. № 21. P. 2493. https://doi.org/10.1016/j.ccr.2009.07.009
Umehara K., Kuwata S., Ikariya T. // Inorg. Chim. Acta. 2014. V. 413. P. 136. https://doi.org/10.1016/j.ica.2013.12.041
Сергиенко В., Чураков А. // Журн. неорган. химии. 2016. Т. 61. С. 873. https://doi.org/10.7868/S0044457X16070175
Qian H.Y. // Russ. J. Coord. Chem. 2017. V. 43. №11. P. 780. https://doi.org/10.1134/S1070328417110070
Umehara K., Kuwata S., Ikariya T. // J. Am. Chem. Soc. 2013. V. 135. № 18. P. 6754. https://doi.org/10.1021/ja3122944
Halcrow M.A. // Crystals. 2016. V. 6. № 510. https://doi.org/3390/cryst6050058
Nelyubina Y.V., Polezhaev A.V., Pavlov A.A. et al. // Magnetochemistry. 2018. V. 4. № 4. P. 46. https://doi.org/10.3390/magnetochemistry4040046
Pavlov A.A., Aleshin D.Y., Nikovskiy I.A. et al. // Eur. J. Inorg. Chem. 2019. V. 2019. № 23. P. 2819. https://doi.org/10.1002/ejic.201900432
Halcrow M.A. // Polyhedron. 2007. V. 26. № 14. P. 3523. https://doi.org/10.1016/j.poly.2007.03.033
Cook B.J., Polezhaev A.V., Chen C.-H. et al. // Eur. J. Inorg. Chem. 2017. V. 2017. № 34. P. 3999. https://doi.org/10.1002/ejic.201700558
Shiga T., Noguchi M., Sato H. et al. // Dalton Trans. 2013. V. 42. № 45. P. 16185. https://doi.org/10.1039/C3DT51480C
Plaul D., Spielberg E.T., Plass W. // Z. Anorg. Chem. 2010. V. 636. № 7. P. 1268. https://doi.org/10.1002/zaac.201000075
Polezhaev A.V., Chen C.-H., Kinne A.S. et al. // Inorg. Chem. 2017. V. 56. № 16. P. 9505. https://doi.org/10.1021/acs.inorgchem.7b00785
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Korzekwa J., Scheurer A., Heinemann F. W., Meyer K. // Dalton Trans. 2017. V. 46. № 40. P. 13811. https://doi.org/10.1039/C7DT02947K
Freire M. G., Neves C.M.S.S., Marrucho I. M. et al. // J. Phys. Chem. A. 2010. V. 114. № 11. P. 3744. https://doi.org/10.1021/jp903292n
Halcrow M.A. Spin-Crossover Materials: Properties and Applications. Oxford, UK: John Wiley & Sons, Ltd., 2013.
Alvarez S. // J. Am. Chem. Soc. 2003. T. 125. № 22. P. 6795. https://doi.org/10.1021/ja0283450
Alvarez S. // Chem. Rev. 2015. V. 115. P. 13447. https://doi.org/10.1021/acs.chemrev.5b00537
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии