Журнал неорганической химии, 2020, T. 65, № 5, стр. 703-710
Оптимизация термодинамических свойств системы Sm2O3–Y2O3–HfO2 при высоких температурах на основе метода Баркера
А. Л. Шилов a, *, В. Л. Столярова a, В. А. Ворожцов a, С. И. Лопатин a, С. М. Шугуров a
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: st901491@mail.ru
Поступила в редакцию 07.11.2019
После доработки 20.11.2019
Принята к публикации 24.12.2019
Аннотация
Проведено моделирование термодинамических свойств системы Sm2O3–Y2O3–HfO2 при температуре 2500 K на основе обобщенной решеточной теории ассоциированных растворов с привлечением экспериментальных данных, полученных методом высокотемпературной масс-спектрометрии. Сопоставлены результаты расчета термодинамических свойств системы Sm2O3–Y2O3–HfO2, найденные с помощью двух независимых подходов при моделировании на основе этой теории: по экспериментальным данным о свойствах трехкомпонентной системы и по данным о соответствующих бинарных системах Sm2O3–Y2O3, Sm2O3–HfO2 и Y2O3–HfO2. Показано, что химические потенциалы компонентов, рассчитанные в исследуемой трехкомпонентной системе на основе указанных выше подходов, иллюстрируют значительно лучшее соответствие с экспериментальными данными именно в первом случае.
ВВЕДЕНИЕ
Для анализа, систематизации и прогнозирования термодинамических свойств бинарных и многокомпонентных систем при высоких температурах в настоящее время широко применяются методы статистической термодинамики, основанные, в частности, на решеточных моделях и квазихимическом подходе [1–4]. Один из наиболее совершенных вариантов этой теории, получивший название обобщенной решеточной теории ассоциированных растворов (ОРТАР), был предложен Баркером [1, 2] для описания термодинамических свойств бинарных и многокомпонентных систем. В дальнейшем эта теория была неоднократно успешно использована для моделирования термодинамических функций органических растворов [3–5].
Для моделирования термодинамических свойств стеклообразующих расплавов и стекол метод Баркера был впервые применен с участием авторов настоящей работы [6–9] для описания стекол и расплавов бинарных систем на основе оксидов стеклообразователей (B2O3, GeO2, SiO2) и борогерманокремнеземной системы. Указанные расчеты проводились с привлечением экспериментальных результатов, полученных ранее методом высокотемпературной масс-спектрометрии в варианте эффузионного метода Кнудсена [10, 11].
Дальнейшее развитие этот модельный подход получил при оптимизации термодинамических свойств систем, включающих не только оксиды-стеклообразователи, но и оксиды-модификаторы в системах MgO–B2O3 [12], MgO–B2O3–SiO2 [13], SrO–B2O3–SiO2 [14], PbO–B2O3–SiO2 [15], Bi2O3–B2O3 и Bi2O3–SiO2 [16], Bi2O3–GeO2–SiO2 [17]. Было убедительно показано, что на основе ОРТАР может быть не только проведено моделирование и предсказание термодинамических свойств стекол и расплавов, но и установлена однозначная связь между изменением их термодинамических свойств и структурой. Необходимо отметить, что предложенное структурное описание оксидных стекол и расплавов было также неоднократно подтверждено результатами прямых методов изучения структуры, в частности, рентгеновского рассеяния под большими и малыми углами в системах Bi2O3–B2O3–SiO2, PbO–B2O3–SiO2, CdO–B2O3–SiO2, PbO–B2O3, Rb2O–B2O3–SiO2, Cs2O–B2O3–SiO2 [18–21].
Недавно с участием авторов настоящего исследования была показана корректность применения ОРТАР не только для моделирования термодинамических свойств оксидных систем, но и для расчета вязкости стекол и стеклообразующих расплавов на примере системы Bi2O3–GeO2–SiO2 [22].
В последние годы проиллюстрирована возможность использования ОРТАР для моделирования термодинамических свойств твердых растворов как бинарных, так и трехкомпонентных систем Gd2O3–Y2O3–HfO2 и La2O3–Y2O3–HfO2 [23–25] при температурах 2500 K с использованием результатов, полученных масс-спектрометрическим эффузионным методом Кнудсена [26–28].
Неоднократно показано [6, 10, 11], что отличительной особенностью применения ОРТАР для описания оксидных стекол, расплавов и твердых растворов по сравнению с растворами органических соединений являются значительно бóльшие значения энергетических параметров рассматриваемой модели. Тем не менее оптимизация термодинамических свойств изученных и рассматриваемых в данной работе оксидных систем с использованием ОРТАР имеет ряд достоинств, позволяющих решать широкий спектр задач.
1. В отличие от различных аппроксимационных подходов, например метода Редлиха–Кистера, интерполирующие термодинамические функции исследуемых систем находятся в строгом соответствии с выбранной структурной моделью ОРТАР.
2. Возможно проведение взаимно согласованной оценки значений активностей всех компонентов исследуемой системы только по величинам активности одного из компонентов.
3. Возможно проведение экстраполяции найденных значений термодинамических свойств в области концентраций изучаемой системы, где проведение экспериментальных исследований по различным причинам затруднено.
4. Энергии взаимообмена молекул, являющиеся параметрами ОРТАР, определенные в одной из систем, могут быть использованы как одно из приближений при расчете термодинамических свойств в других системах, аналогичных по химической природе.
Таким образом, именно иллюстрация последнего из достоинств ОРТАР явилась целью настоящей работы, в результате которой показано соответствие двух подходов в рамках ОРТАР при моделировании термодинамических свойств системы Sm2O3–Y2O3–HfO2:
а) только с использованием экспериментальных данных для исследуемой трехкомпонентной системы и
б) только с использованием экспериментальных значений для соответствующих бинарных систем Sm2O3–Y2O3, Sm2O3–HfO2 и Y2O3–HfO2.
Следует отметить, что, как и в случае любого экспериментального метода, эффузионный масс-спектрометрический метод Кнудсена в ряде случаев имеет ряд методических ограничений, в частности, невозможность в изотермических условиях одновременно определить активности всех компонентов исследуемой системы из-за их различной летучести. Именно по этой причине условия проведения эксперимента при испарении многокомпонентной системы в некоторых случаях могут оказаться менее благоприятными для определения активностей всех компонентов, чем при испарении составляющих ее бинарных систем. Так, в работе [22] активность оксида гафния в бинарной системе Y2O3–HfO2 была определена непосредственно из измеренного парциального давления HfO2, в то время как в трехкомпонентной системе Gd2O3–Y2O3–HfO2 [20] это было невозможно из-за сравнительно низкой температуры испарения оксида гадолиния.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Теория Баркера, ее варианты и применение для расчета и прогнозирования термодинамических свойств бинарных и многокомпонентных систем неоднократно излагались ранее, в частности в работах [1, 2, 4, 6]. Именно по этой причине далее приведены только основные положения этой теории в обобщенном виде, получившей название ОРТАР, которые состоят в следующем.
Согласно рассматриваемой модели, выбирается решетка с некоторым координационным числом z и распределенные на ней структурные элементы (молекулы) A, B, C, …, образующие систему и занимающие соответственно rA, rB, … узлов решетки. Структурным элементам приписываются контактные точки различного типа (μ, ν, …) в соответствии с координационным числом решетки так, чтобы числа контактов с соседними структурными элементами (пары контактных точек) cA, cB, … удовлетворяли соотношениям:
На основании выбранной модели с использованием квазихимического приближения записывается система уравнений относительно вспомогательных неизвестных $X_{{\mu }}^{A}{\text{:}}$
(2)
$X_{{\mu }}^{A}\sum\limits_{B,{\nu }} {\eta _{{{\mu \nu }}}^{{AB}}X_{{\nu }}^{B}} = {{Q_{{\mu }}^{A}{{x}_{A}}} \mathord{\left/ {\vphantom {{Q_{{\mu }}^{A}{{x}_{A}}} 2}} \right. \kern-0em} 2},$(3)
$\eta _{{{\mu \nu }}}^{{AB}} = \exp \left( {{{ - U_{{{\mu \nu }}}^{{AB}}} \mathord{\left/ {\vphantom {{ - U_{{{\mu \nu }}}^{{AB}}} {kT}}} \right. \kern-0em} {kT}}} \right).$Параметр $X_{{\mu }}^{A}$ в системе уравнений (2) можно определить как долю контактных точек μ-типа структурного элемента A, образующих данный тип связей.
Для выбранного состава и набора значений энергетических параметров модели (ημν) система (2) решается относительно неизвестных величин $X_{{\mu }}^{A},$ число которых равно числу уравнений системы, т.е. числу контактных точек различного типа.
В результате решения системы уравнений (2) по найденным значениям $X_{{\mu }}^{A}$ могут быть определены величины избыточного химического потенциала компонента А в исследуемой системе:
(4)
$\begin{gathered} \Delta \mu _{A}^{E} = RT\left[ {\sum\limits_{\mu } {Q_{{\mu }}^{A}\ln \left( {{{{{X_{{\mu }}^{A}} \mathord{\left/ {\vphantom {{X_{{\mu }}^{A}} {{{x}_{A}}}}} \right. \kern-0em} {{{x}_{A}}}}} \mathord{\left/ {\vphantom {{{{X_{{\mu }}^{A}} \mathord{\left/ {\vphantom {{X_{{\mu }}^{A}} {{{x}_{A}}}}} \right. \kern-0em} {{{x}_{A}}}}} {X_{{\mu }}^{{A{\text{p}}}}}}} \right. \kern-0em} {X_{{\mu }}^{{A{\text{p}}}}}}} \right)} + } \right. \\ \left. { + \,\,{{r}_{A}}(z{\text{/}}2 - 1)\ln \left( {\sum\limits_B {{{{{r}_{B}}{{x}_{B}}} \mathord{\left/ {\vphantom {{{{r}_{B}}{{x}_{B}}} {{{r}_{A}}}}} \right. \kern-0em} {{{r}_{A}}}}} } \right)} \right], \\ \end{gathered} $При моделировании термодинамических свойств системы Sm2O3–Y2O3–HfO2 была выбрана наиболее простая модель, аналогичная применявшейся ранее для твердых растворов трехкомпонентных систем, содержащих оксиды гадолиния [24] и лантана [25]. Для этого в решетке с координационным числом z = 3 были распределены структурные элементы Sm2O3, Y2O3 и HfO2 (обозначенные далее в формулах индексами 1, 2 и 3), занимающие по два узла решетки каждый. Отметим, что для каждого структурного элемента было выбрано по две контактные точки металла (Sm, Y, Hf) и две контактные точки кислорода, обозначенные, соответственно, индексами Sm, Y, Hf и O. Энергии взаимодействия контактных пар метал–метал и кислород–кислород были приняты равными нулю.
Таким образом, система из шести нелинейных уравнений (2) для изучаемой системы Sm2O3–Y2O3–HfO2 имеет следующий вид:
(5)
$\begin{gathered} {{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}}({{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}} + {{\eta }_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}} - {{{\text{O}}}_{{\text{1}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{1}}}}}}} + {{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}} + {{\eta }_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}} - {{{\text{O}}}_{{\text{2}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{2}}}}}}} + \\ + \,\,{{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}} + {{\eta }_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}} - {{{\text{O}}}_{{\text{3}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{3}}}}}}}) = {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}, \\ {{X}_{{{{{\text{O}}}_{{\text{1}}}}}}}({{\eta }_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}} - {{{\text{O}}}_{{\text{1}}}}}}}{{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}} + {{X}_{{{{{\text{O}}}_{{\text{1}}}}}}} + {{\eta }_{{{{{\text{Y}}}_{{\text{2}}}} - {{{\text{O}}}_{{\text{1}}}}}}}{{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}} + \\ + \,\,{{X}_{{{{{\text{O}}}_{{\text{2}}}}}}} + {{\eta }_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}} - {{{\text{O}}}_{{\text{1}}}}}}}{{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}} + {{X}_{{{{{\text{O}}}_{{\text{3}}}}}}}) = {{x}_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}, \\ {{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}}({{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}} + {{\eta }_{{{{{\text{Y}}}_{{\text{2}}}} - {{{\text{O}}}_{{\text{1}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{1}}}}}}} + {{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}} + {{\eta }_{{{{{\text{Y}}}_{{\text{2}}}} - {{{\text{O}}}_{{\text{2}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{2}}}}}}} + \\ + \,\,{{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}} + {{\eta }_{{{{{\text{Y}}}_{{\text{2}}}} - {{{\text{O}}}_{{\text{3}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{3}}}}}}}) = {{x}_{{{{{\text{Y}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}, \\ {{X}_{{{{{\text{O}}}_{{\text{2}}}}}}}({{\eta }_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}} - {{{\text{O}}}_{{\text{2}}}}}}}{{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}} + {{X}_{{{{{\text{O}}}_{{\text{1}}}}}}} + {{\eta }_{{{{{\text{Y}}}_{{\text{2}}}} - {{{\text{O}}}_{{\text{2}}}}}}}{{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}} + \\ + \,\,{{X}_{{{{{\text{O}}}_{{\text{2}}}}}}} + {{\eta }_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}} - {{{\text{O}}}_{{\text{2}}}}}}}{{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}} + {{X}_{{{{{\text{O}}}_{{\text{3}}}}}}}) = {{x}_{{{{{\text{Y}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}, \\ {{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}}({{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}} + {{\eta }_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}} - {{{\text{O}}}_{{\text{1}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{1}}}}}}} + {{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}} + \\ + \,\,{{\eta }_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}} - {{{\text{O}}}_{{\text{2}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{2}}}}}}} + {{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}} + {{\eta }_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}} - {{{\text{O}}}_{{\text{3}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{3}}}}}}}) = {{x}_{{{\text{Hf}}{{{\text{O}}}_{{\text{2}}}}}}}, \\ {{X}_{{{{{\text{O}}}_{{\text{3}}}}}}}({{\eta }_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}} - {{{\text{O}}}_{{\text{3}}}}}}}{{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}} + {{X}_{{{{{\text{O}}}_{{\text{1}}}}}}} + {{\eta }_{{{{{\text{Y}}}_{{\text{2}}}} - {{{\text{O}}}_{{\text{3}}}}}}}{{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}} + \\ + \,\,{{X}_{{{{{\text{O}}}_{{\text{2}}}}}}} + {{\eta }_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}} - {{{\text{O}}}_{{\text{3}}}}}}}{{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}} + {{X}_{{{{{\text{O}}}_{{\text{3}}}}}}}) = {{x}_{{{\text{Hf}}{{{\text{O}}}_{{\text{2}}}}}}}, \\ \end{gathered} $(6)
$\begin{gathered} \Delta {{\mu }^{E}}({\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}) = \\ = {\text{2}}RT{\text{ln}}\left[ {{{({{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{1}}}}}}})} \mathord{\left/ {\vphantom {{({{X}_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{1}}}}}}})} {\left( {X_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}^{{\text{p}}}X_{{{{{\text{O}}}_{{\text{1}}}}}}^{{\text{p}}}x_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}^{{\text{2}}}} \right)}}} \right. \kern-0em} {\left( {X_{{{\text{S}}{{{\text{m}}}_{{\text{1}}}}}}^{{\text{p}}}X_{{{{{\text{O}}}_{{\text{1}}}}}}^{{\text{p}}}x_{{{\text{S}}{{{\text{m}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}^{{\text{2}}}} \right)}}} \right], \\ \end{gathered} $(7)
$\Delta {{\mu }^{E}}({{{\text{Y}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}) = {\text{2}}RT{\text{ln}}\left[ {{{({{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{2}}}}}}})} \mathord{\left/ {\vphantom {{({{X}_{{{{{\text{Y}}}_{{\text{2}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{2}}}}}}})} {\left( {X_{{{{{\text{Y}}}_{{\text{2}}}}}}^{{\text{p}}}X_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{p}}}x_{{{{{\text{Y}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}^{{\text{2}}}} \right)}}} \right. \kern-0em} {\left( {X_{{{{{\text{Y}}}_{{\text{2}}}}}}^{{\text{p}}}X_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{p}}}x_{{{{{\text{Y}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}^{{\text{2}}}} \right)}}} \right],$(8)
$\Delta {{\mu }^{E}}({\text{Hf}}{{{\text{O}}}_{{\text{2}}}}) = {\text{2}}RT{\text{ln}}\left[ {{{({{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{3}}}}}}})} \mathord{\left/ {\vphantom {{({{X}_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}}{{X}_{{{{{\text{O}}}_{{\text{3}}}}}}})} {\left( {X_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}^{{\text{p}}}X_{{{{{\text{O}}}_{{\text{3}}}}}}^{{\text{p}}}x_{{{\text{Hf}}{{{\text{O}}}_{{\text{2}}}}}}^{{\text{2}}}} \right)}}} \right. \kern-0em} {\left( {X_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}}}^{{\text{p}}}X_{{{{{\text{O}}}_{{\text{3}}}}}}^{{\text{p}}}x_{{{\text{Hf}}{{{\text{O}}}_{{\text{2}}}}}}^{{\text{2}}}} \right)}}} \right].$Решения для индивидуальных компонентов, обозначенные в формулах (6)–(8) индексом “p”, в данном случае оказалось возможным получить наиболее точно.
Далее описанную выше процедуру повторяли при варьировании энергий взаимообмена ημν для поиска минимума суммы квадратов отклонений $\Delta \mu _{i}^{E}$ от соответствующих экспериментальных значений. Таким образом, найденный набор параметров ημν позволяет найти решение системы уравнений (5) и получить оптимизированные термодинамические функции исследуемой системы согласно уравнениям (6)–(8).
Для интерполяции граничных бинарных систем необходимо решить соответствующую систему, состоящую из четырех уравнений. Однако анализ необходимой для расчетов точности вычислений показывает, что для выбранной конкретной модели система уравнений (5) не имеет существенных особенностей и легко решается в приближении предельно малой концентрации одного из компонентов. Таким образом, для решения двух существенно различающихся задач был использован один и тот же алгоритм расчета.
Как было отмечено выше, измерения активностей компонентов в бинарных системах являются более простой задачей, и объем экспериментальных данных для них, как правило, значительно больше, чем для многокомпонентных систем.
Для выяснения вопроса о корректности расчета термодинамических свойств трехкомпонентных систем по данным о равновесиях в соответствующих бинарных системах, на основе ОРТАР в частности, предпринято данное исследование.
В настоящей работе с помощью вышеизложенного метода оптимизации сопоставлены:
– избыточная энергия Гиббса (ΔGE) в системе Sm2O3–Y2O3–HfO2, рассчитанная по экспериментальным величинам активности компонентов в системах Sm2O3–Y2O3, Sm2O3–HfO2, Y2O3–HfO2 (первый вариант), и
– ΔGE в этой же системе, рассчитанная с использованием значений активности компонентов, определенных ранее масс-спектрометрическим эффузионным методом Кнудсена (второй вариант).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучение состава пара и определение активностей компонентов в образцах исследуемых систем Sm2O3–Y2O3, Sm2O3–HfO2, Y2O3–HfO2 и Sm2O3–Y2O3–HfO2 выполнено масс-спектрометрическим эффузионным методом Кнудсена на масс-спектрометре МС-1301 (ионизирующее напряжение 25 В), предназначенном для изучения процессов испарения и термодинамических свойств труднолетучих веществ до температур 3000 K и детально описанном в работе [10]. Испарение образцов исследованных систем проводили из двойной вольфрамовой эффузионной камеры, нагреваемой электронным ударом. Температуру камеры измеряли оптическим пирометром ЭОП-66. Парциальные давления молекулярных форм пара над исследуемыми системами определяли методом сравнения ионных токов при использовании в качестве стандарта давления CaF2. Более подробное описание методики эксперимента приведено в работах [26, 27].
В первом варианте расчета при моделировании термодинамических свойств системы Sm2O3–Y2O3–HfO2 интерполяцию концентрационных зависимостей избыточных химических потенциалов компонентов (уравнения (6)–(8)) проводили с использованием экспериментальных значений активности Sm2O3 в системах Sm2O3–Y2O3 и Sm2O3–HfO2, а также величин активности Y2O3 и HfO2 в системе Y2O3–HfO2, определенных ранее [29] (табл. 1).
Таблица 1.
Экспериментальные значения активностей компонентов в системах Sm2O3–Y2O3 и Sm2O3–HfO2, полученные в настоящей работе, и в системе Y2O3–HfO2 по данным [29], использованные для оптимизации концентрационных зависимостей $\mu _{i}^{E}$ и построения функции ΔGE в системе Sm2O3–Y2O3–HfO2 на основе ОРТАР
| № | Содержание оксидов в образцах (по анализу), мол. д. | Активности компонентов | Избыточный химический потенциал компонентов, кДж/моль, T = 2500 K | ||||
|---|---|---|---|---|---|---|---|
| Sm2O3 | Y2O3 | HfO2 | a(Sm2O3), T = 2393 K |
a(HfO2), T = 2843 K |
–ΔμE(Sm2O3) | –ΔμE(HfO2) | |
| 1 | 0.70 | 0.30 | 0 | 0.33 | – | 15.6 | – |
| 2 | 0.50 | 0.50 | 0 | 0.21 | – | 18.0 | – |
| 3 | 0.30 | 0.70 | 0 | 0.053 | – | 36.1 | – |
| 4 | 0.10 | 0.90 | 0 | 0.0067 | – | 56.2 | – |
| 5 | 0.50 | 0 | 0.50 | 0.19 | – | 20.1 | – |
| 6 | 0.33 | 0 | 0.67 | 0.021 | – | 57.3 | – |
| 7 | 0 | 0.20 | 0.50 | – | 0.528 | – | 8.6 |
| 8 | 0 | 0.30 | 0.40 | – | 0.343 | – | 14.8 |
| 9 | 0 | 0.50 | 0.20 | – | 0.10 | – | 33.5 |
| 10 | 0 | 0.60 | 0.10 | – | 0.052 | – | 42.4 |
Во втором варианте расчета при моделировании термодинамических свойств системы Sm2O3–Y2O3–HfO2 интерполяцию проводили по экспериментальным данным для концентрационных областей трехкомпонентной системы, в которых соотношение x(Y2O3) : x(HfO2) = 1 : 1 (образцы 1–4), 3 : 1 (образцы 5–8) и 1 : 3 (образцы 9–12), где хi – мольная доля компонента i (табл. 2). Отметим, что содержание оксидов в исследуемых образцах (табл. 1 и 2), приведено по данным рентгеновского флуоресцентного анализа.
Таблица 2.
Активности и избыточные химические потенциалы Sm2O3 в образцах системы Sm2O3–Y2O3–HfO2
| № | Содержание оксидов в образцах (по результатам анализа), мол. д. | a(Sm2O3), T = 2393 K |
–ΔμE(Sm2O3), кДж/моль, T = 2500 K | ||
|---|---|---|---|---|---|
| Sm2O3 | Y2O3 | HfO2 | |||
| 1 | 48.4 | 25.8 | 25.8 | 0.32 | 8.61 |
| 2 | 37.5 | 31.3 | 31.3 | 0.32 | 3.30 |
| 3 | 25.0 | 37.5 | 37.5 | 0.15 | 10.6 |
| 4 | 12.5 | 43.8 | 43.8 | 0.033 | 27.7 |
| 5 | 50.0 | 37.5 | 12.5 | 0.36 | 6.83 |
| 6 | 37.5 | 46.9 | 15.6 | 0.24 | 9.28 |
| 7 | 25.0 | 56.3 | 18.8 | 0.083 | 22.9 |
| 8 | 12.6 | 65.6 | 21.8 | 0.023 | 35.4 |
| 9 | 50.0 | 12.5 | 37.5 | 0.28 | 12.1 |
| 10 | 37.5 | 15.6 | 46.9 | 0.23 | 10.2 |
| 11 | 25.0 | 18.8 | 56.3 | 0.10 | 19.1 |
| 12 | 12.6 | 21.8 | 65.6 | 0.0099 | 52.9 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящей работе в рассматриваемых бинарных системах масс-спектрометрическим эффузионным методом Кнудсена определена активность только одного из компонентов, величина второго была найдена по уравнению Гиббса–Дюгема. Во избежание внесения дополнительных погрешностей при определении искомых величин интерполяцию значений избыточных химических потенциалов компонентов проводили непосредственно по экспериментальным значениям избыточных химических потенциалов компонентов по уравнениям (6)–(8).
Значения активностей компонентов в исследуемых бинарных и трехкомпонентной системах (табл. 1, 2) определены при сильно различающихся температурах. Эти данные приведены к температуре 2500 K при допущении, что в рассматриваемом температурном интервале в пределах погрешности измерений в рамках масс-спектрометрического эффузионного метода Кнудсена активности исследуемых компонентов не зависят от температуры.
Процесс оптимизации величин $\Delta \mu _{i}^{E}$ предполагает варьирование всех значений ημν в системе уравнений (4) согласно основным положениям ОРТАР [6–9]. Однако чтобы сопоставить результаты моделирования на основе ОРТАР для всех исследованных трехкомпонентных систем, содержащих Y2O3 и HfO2, параметры ημν, относящиеся к этим компонентам и их взаимодействию в бинарной системе Y2O3–HfO2, были взяты из работы [23], где они были определены по экспериментальным данным [26, 27].
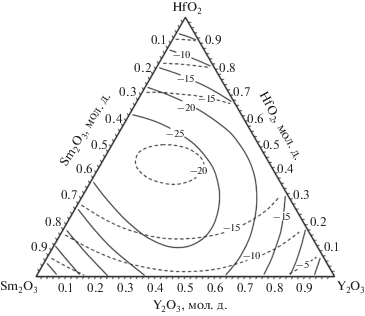
Таким образом, значения энергий взаимообмена ${{\eta }_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}--{{{\text{O}}}_{{\text{3}}}}}}},$ ${{\eta }_{{{{{\text{Y}}}_{{\text{2}}}}--{{{\text{O}}}_{{\text{2}}}}}}},$ ${{\eta }_{{{\text{H}}{{{\text{f}}}_{{\text{3}}}}--{{{\text{O}}}_{{\text{2}}}}}}},$ ${{\eta }_{{{{{\text{Y}}}_{{\text{2}}}}--{{{\text{O}}}_{{\text{3}}}}}}}$ при расчетах системы Sm2O3–Y2O3–HfO2 считались заданными величинами (как и ранее при расчетах систем Gd2O3–Y2O3–HfO2 и La2O3–Y2O3–HfO2), а остальные шесть параметров в системе уравнений (2) варьировались в процессе интерполяции. Оптимизированные величины энергий взаимообмена UAB для связей A–O[B] с учетом атома B второй координационной сферы, полученные при расчетах по экспериментальным данным табл. 2 и экспериментальным данным табл. 1, приведены в табл. 3. Сопоставление значений избыточных энергий Гиббса в системе Sm2O3–Y2O3–HfO2 при температуре 2500 K, полученных при моделировании на основе ОРТАР с использованием описанных выше первого и второго подходов, показано на рис. 1.
Таблица 3.
Энергии взаимообмена UAB для связей A‒O[B] с учетом второй координационной сферы, полученные при моделировании термодинамических свойств системы Sm2O3–Y2O3–HfO2 по экспериментальным данным для трехкомпонентной и соответствующих бинарных систем (в квадратных скобках указан элемент второй координационной сферы)
| Связи | UAB, кДж/моль | |
|---|---|---|
| трехкомпонентной системы | бинарных систем | |
| Sm–O[Sm] | 137.3 | 143.7 |
| Sm–O[Y] | 167.4 | 169.1 |
| Sm–O[Hf] | 176.8 | 178.4 |
| Y–O[Sm] | 172.6 | 189.3 |
| Hf–O[Sm] | 140.4 | 154.3 |
| Y–O[Y] | 178.4 | 178.4 |
| Y–O[Hf] | 193.3 | 193.3 |
| Hf–O[Y] | 159.8 | 159.8 |
| Hf–O[Hf] | 145.3 | 145.3 |
Рис. 1.
Результаты моделирования избыточной энергии Гиббса в системе Sm2O3–Y2O3–HfO2 на основе ОРТАР при температуре 2500 K: по экспериментальным данным для соответствующих бинарных систем (сплошные линии), а также изолинии, рассчитанные по экспериментальным данным для исследуемой трехкомпонентной системы (штриховые линии).
На рис. 2 даны активности компонентов Sm2O3 (1), Y2O3 (2) и HfO2 (3) в бинарных системах Sm2O3–Y2O3, Sm2O3–HfO2 и Y2O3–HfO2 при температуре 2500 K.
Рис. 2.
Активности компонентов Sm2O3 (1), Y2O3 (2) и HfO2 (3) в бинарных системах при температуре 2500 K. Сплошные кривые получены в результате оптимизации на основе ОРТАР экспериментальных данных [29], отмеченных на графиках квадратами. Зависимости активностей компонентов, приведенные на частях (a), (б) пунктиром, получены по уравнению Гиббса–Дюгема. 4 – активность Y2O3, определенная методом высокотемпературной масс-спектрометрии [29], 5 – активность Y2O3, рассчитанная по уравнению Гиббса–Дюгема из зависимости соответствующих значений (штриховая линия), обозначенной 3.
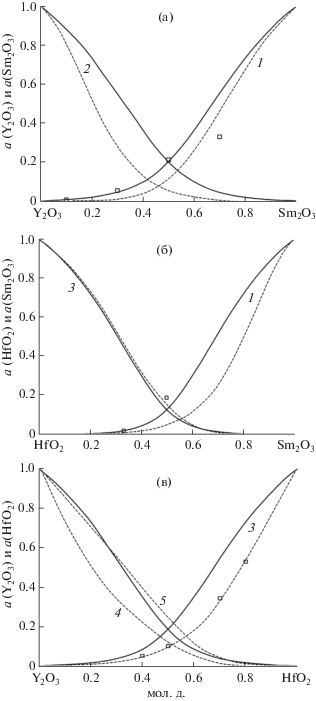
Таким образом, в результате проведенной в настоящей работе оптимизации значений активностей компонентов в бинарных системах Sm2O3–Y2O3, Sm2O3–HfO2 и Y2O3–HfO2 на основе ОРТАР получены значения, погрешность определения которых не превышает экспериментальной погрешности масс-спектрометрического эффузионного метода Кнудсена.
На рис. 3 сопоставлены концентрационные зависимости избыточных химических потенциалов компонентов в системе Sm2O3–Y2O3–HfO2 при температуре 2500 K, рассчитанные на основе ОРТАР с использованием двух описанных выше подходов. Следует отметить, что наибольшие расхождения с экспериментальными значениями при использовании данных только для бинарных систем Sm2O3–Y2O3, Sm2O3–HfO2 и Y2O3–HfO2 наблюдаются для области концентраций вблизи составов, лежащих на центральной секущей x(Y2O3) : x(HfO2) = 1. Погрешности определения значений термодинамических величин при моделировании на основе ОРТАР с использованием двух описанных выше подходов при сопоставлении с экспериментальными данными для некоторых составов системы Sm2O3–Y2O3–HfO2 при температуре 2500 K приведены в табл. 4. Наблюдается соответствие результатов моделирования на основе двух рассмотренных выше подходов в пределах, не превышающих экспериментальные погрешности определения активностей оксида самария масс-спектрометрическим эффузионным методом Кнудсена.
Рис. 3.
Избыточный химический потенциал оксида самария, рассчитанный на основе ОРТАР по данным для бинарных систем Sm2O3–Y2O3, Sm2O3–HfO2 и Y2O3–HfO2 (сплошные линии) и по данным для системы Sm2O3–Y2O3–HfO2 (штриховые линии). Отношение концентраций x(Y2O3) : x(HfO2), выраженное в мольных долях, для приведенных сечений составляло соответственно 3 : 1 (1), 1 : 1 (2) и 1 : 3 (3). Точками обозначены экспериментальные значения, использованные для построения пунктирных кривых.
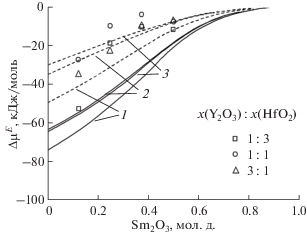
Таблица 4.
Относительные отклонения значений избыточных химических потенциалов компонентов в системе Sm2O3–Y2O3–HfO2 при температуре 2500 K, оптимизированных по экспериментальным данным для трехкомпонентной системы и соответствующих бинарных систем, по сравнению с экспериментальными значениями, полученными масс-спектрометрическим эффузионным методом Кнудсена в настоящей работе
| № | –ΔμE(Sm2O3), кДж/моль, T = 2500 K | Отклонение от экспериментальных значений, % | |
|---|---|---|---|
| трехкомпонентной системы | бинарных систем | ||
| 1 | 8.61 | 42 | – |
| 4 | 27.7 | 49 | – |
| 5 | 6.83 | 22 | – |
| 6 | 9.28 | 51 | – |
| 7 | 22.9 | 8.9 | 90 |
| 8 | 35.4 | 20 | 54 |
| 9 | 12.1 | 37 | 57 |
| 10 | 10.2 | 23 | – |
| 11 | 19.1 | 4.3 | – |
| 12 | 52.9 | 54 | 5.6 |
ЗАКЛЮЧЕНИЕ
Проиллюстрированы потенциальные возможности обобщенной решеточной теории ассоциированных растворов для моделирования и термодинамического описания твердых растворов системы Sm2O3–Y2O3–HfO2 при температуре 2500 K с использованием двух независимых подходов с привлечением экспериментальных данных, полученных масс-спектрометрическим эффузионным методом Кнудсена: по данным для трехкомпонентной системы и независимо для соответствующих бинарных систем. Рассмотренные подходы могут быть рекомендованы для включения в международные базы термодинамических данных и моделей при расчете высокотемпературных фазовых равновесий на основе подхода CALPHAD.
Список литературы
Barker J.A. // J. Chem. Phys. 1952. V. 20. № 10. P. 1526.
Barker J.A., Smith F. // J. Chem. Phys. 1954. V. 22. № 3. P. 375. https://doi.org/10.1063/1.1740077
Куртынина Л.М., Смирнова Н.А., Андрукович П.Ф. // Химия и термодинамика растворов. Вып. 2. 1968. С. 43.
Алексеева М.В., Зюнель К., Пиотровская Е.М. и др. // Вестник ЛГУ. 1985. № 11. С. 43.
Goats J.R., Ott J.B., Snow R.L. et al. // J. Chem. Thermodyn. 1980. V. 12. № 5. P. 447. https://doi.org/10.1016/0021-9614(80)90058-0
Шульц М.М., Иванов Г.Г., Столярова В.Л. и др. // Физика и химия стекла. 1986. Т. 12. № 3. С. 285.
Шульц М.М., Иванов Г.Г., Столярова В.Л. и др. // Физика и химия стекла. 1986. Т. 12. № 4. С. 385.
Шульц М.М., Иванов Г.Г., Столярова В.Л. // ДАН СССР. 1987. Т. 292. № 5. С. 1198.
Столярова В.Л., Иванов Г.Г., Шульц М.М. // ДАН СССР. 1989. Т. 305. № 2. С. 383.
Stolyarova V.L. // Russ. Chem. Rev. 2016. V. 85. P. 60. https://doi.org/10.1070/RCR4549
Stolyarova V.L. // Calphad. 2019. V. 64. P. 258. https://doi.org/10.1016/j.calphad.2018.12.013
Столярова В.Л., Лопатин С.И., Шугуров С.М. и др. // Журн. общ. химии. 2010. Т. 80. № 4. С. 529. https://doi.org/10.1134/S1070363210040018
Столярова В.Л., Лопатин С.И., Шугуров С.М. и др. // Журн. общ. химии. 2010. Т. 80. № 12. С. 1943. https://doi.org/10.1134/S1070363210120029
Столярова В.Л., Лопатин С.И., Шилов А.Л. // Журн. общ. химии. 2009. Т. 79. № 9. С. 1422. https://doi.org/10.1134/S1070363209090035
Stolyarova V.L., Shilov A.L. // J. Non-Cryst. Solids. 2013. V. 366. P. 6. https://doi.org/10.1016/j.jnoncrysol.2013.01.036
Stolyarova V.L., Shilov A.L., Lopatin S.I. et al. // Rapid Comm. Mass. Spectrom. 2014. V. 28. № 7. P. 801. https://doi.org/10.1002/rcm.6842
Столярова В.Л., Лопатин С.И., Шугуров С.М. и др. // Тез. XIV Рос. конф. по теплофизическим свойствам веществ (РКТС-14). Казань, 2014.
Golubkov V.V., Onushchenko P.A., Stolyarova V.L. // Glass Phys. Chem. 2015.V. 41. № 3. P. 247. https://doi.org/10.1134/S1087659615030074
Golubkov V.V., Onushchenko P.A., Stolyarova V.L. // Glass Phys. Chem. 2013. V. 39. № 6. P. 624. https://doi.org/10.1134/S1087659613060059
Golubkov V.V., Stolyarova V.L. // Glass Phys. Chem. 2011. V. 37. № 3. P. 252. https://doi.org/10.1134/S1087659611030047
Golubkov V.V., Stolyarova V.L. // Glass Phys. Chem. 2006. V. 32. № 3. P. 287. https://doi.org/10.1134/S1087659606030059
Shilov A.L., Stolyar S.V., Stolyarova V.L. et al. // Glass Technol.: Eur. J. Glass Sci. Technol. A. 2019. V. 60. № 4. P. 105. https://doi.org/10.13036/17533546.60.4.016
Shilov A.L., Lopatin S.I., Stolyarova V.L. et al. // JALCOM. 2019. V. 791. P. 1207. https://doi.org/10.1016/j.jallcom.2019.03.182
Ворожцов В.А., Шилов А.Л., Столярова В.Л. // Журн. общ. химии. 2019. Т. 89. № 3. С. 452. https://doi.org/10.1134/S1070363219030186
Shilov A.L., Stolyarova V.L., Vorozhtcov V.A. et al. // Calphad. 2019. V. 65. P. 165. https://doi.org/10.1016/j.calphad.2019.03.001
Kablov E.N., Stolyarova V.L., Lopatin S.I. et al. // Rapid Comm. Mass. Spectrom. 2017. V. 31. P. 538. https://doi.org/10.1002/rcm.7809
Kablov E.N., Stolyarova V.L., Lopatin S.I. et al. // Rapid Comm. Mass. Spectrom. 2017. V. 31. P. 1137. https://doi.org/10.1002/rcm.7892
Kablov E.N., Stolyarova V.L., Vorozhtcov V.A. et al. // Rapid Comm. Mass. Spectrom. 2018. V. 32. P. 686. https://doi.org/10.1002/rcm.8081
Белов А.Н., Семенов Г.А. // Журн. физ. химии. 1985. Т. 59. С. 589.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


