Журнал неорганической химии, 2020, T. 65, № 5, стр. 598-602
Термодинамика металлокластеров Al2M3 (M = 3d-элемент) в рамках квантово-химического моделирования методом DFT
О. В. Михайлов a, *, Д. В. Чачков b
a Казанский национальный исследовательский технологический университет
420015 Казань, ул. К. Маркса, 68, Россия
b Казанское отделение Межведомственного суперкомпьютерного центра РАН –
филиал ФГУ ФНЦ “Научно-исследовательский институт системных исследований РАН”
420111 Казань, ул. Лобачевского, 2/31, Россия
* E-mail: olegmkhlv@gmail.com
Поступила в редакцию 31.10.2019
После доработки 02.12.2019
Принята к публикации 24.12.2019
Аннотация
С помощью гибридного метода функционала плотности (DFT) в приближении OPBE/TZVP и программы Gaussian09 рассчитаны стандартные термодинамические параметры образования (ΔfH°(298 K), ΔfS°(298 K) и ΔfG°(298 K)) p,d-металлокластеров стехиометрического состава Al2M3 (M = 3d-элемент), а также значения стандартной энтальпии, энтропии и энергии Гиббса реакций их образования из одноатомных частиц в газовой фазе. Установлено, что такие реакции являются экзотермическими с энтальпийным фактором, а образующиеся в результате гетероядерные металлокластеры отличаются высокой термической устойчивостью. Обнаружена сложная динамика изменения как индивидуальных термодинамических характеристик рассматриваемых металлокластеров, так и термодинамических параметров реакций их образования в зависимости от природы 3d-элемента.
ВВЕДЕНИЕ
Среди наночастиц, содержащих атомы металлов, особый интерес представляют частицы, в состав которых входят два или большее количество различных p- и d-элементов, поскольку для них можно ожидать ряд специфических свойств, не присущих наночастицам, образованным атомами лишь одного химического элемента. К числу подобных объектов относятся p,d-гетероядерные металлокластеры, содержащие атомы алюминия и 3d-элементов. Ранее в работах [1–5] нами с использованием метода DFT OPBE/TZVP проведен квантово-химический расчет ключевых параметров молекулярных структур (межатомных расстояний металл–металл, валентных и торсионных (двугранных) углов) металлокластеров стехиометрического состава Al2M3, где M = Cr, Mn, Fe, Co, Ni, Cu, Zn. В этих работах отмечено, что металлокластеры с данной стехиометрией для каждого из указанных 3d-элементов существуют в виде целого ряда модификаций, различных по своим молекулярным структурам и устойчивости, однако вопрос о возможности их формирования в рамках каких-либо химических реакций, в частности непосредственно из соответствующих p- и d-элементов, входящих в их состав, до сих пор не рассматривался.
Цель настоящей работы – установить, возможен ли такой процесс, если да, то проследить влияние природы 3d-элемента на его термодинамические характеристики в рамках изобарного процесса (стандартной энтальпии ΔH°, стандартной энтропии ΔS° и стандартной энергии Гиббса ΔG°).
МЕТОД РАСЧЕТА
Для расчета структурных и термодинамических параметров металлокластеров Al2M3 использовали метод функционала плотности DFT в варианте OPBE/TZVP, сочетающий функционал OPBE [6, 7], который, согласно данным [7–11], в случае соединений 3p- и 3d-элементов дает достаточно точное соотношение между энергиями состояний с различной спиновой мультиплетностью, а также надежно характеризует основные геометрические параметры молекулярных структур указанных соединений, и стандартный расширенный валентно-расщепленный базис TZVP [12, 13]. Расчет проводили с использованием программного пакета Gaussian09 [14]; для визуализации полученных в результате расчета данных применяли программу ChemCraft (Version 1.8). Расчет стандартных термодинамических параметров образования металлокластеров ΔfH°(298 K), ΔfS°(298 K) и ΔfG°(298 K) осуществляли с использованием методики [15, 16].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Молекулярные структуры наиболее устойчивых в энергетическом отношении металлокластеров Al2M3 (M = Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) представлены на рис. 1. Видно, что эти структуры для различных 3d-элементов весьма существенно отличаются друг от друга как внешне, так и общим числом химических связей металл–металл и их сочетанием (Al–M, Al–Al и M–M). В связи с этим можно полагать, что и термодинамические параметры образования металлокластеров будут достаточно заметно отличаться друг от друга, и проведенный нами расчет показывает, что это действительно так (табл. 1). Различие между максимальными и минимальными значениями стандартной энтальпии ΔfH°(298 K) и стандартной энергии Гиббса ΔfG°(298 K) для рассматриваемых металлокластеров более чем двукратное: ΔfH°(298 K) = 1151.1 кДж/моль для Al2Cr3 и 516.8 кДж/моль для Al2Mn3, ΔfG°(298 K) = = 1067.5 кДж/моль для Al2Cr3 и 436.2 кДж/моль для Al2Mn3, аналогичное различие в значениях ΔfS°(298 K) намного меньше (<10%). Характерно, что параметры для каждого из соединений положительны и значительны по модулю, из этого следует вывод о невозможности их формирования из простых веществ, образованных атомами алюминия и 3d-элементами, т.е. из металлов. Однако с возможными реакциями их образования в газовой фазе по общей схеме:
(1)
$2{\text{Al}}\left( {\text{г}} \right) + 3{\text{M}}\left( {\text{г}} \right) \to {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{M}}}_{{\text{3}}}}\left( {\text{г}} \right)$(2)
${{\Delta }_{r}}G^\circ (T) = {{\Delta }_{r}}H^\circ (298\,{\text{K}}) - T{{\Delta }_{r}}S^\circ (298\,{\text{K}}),$Рис. 1.
Молекулярные структуры наиболее устойчивых в энергетическом отношении металлокластеров Al2M3 (M = = 3d-элемент) для различных M.
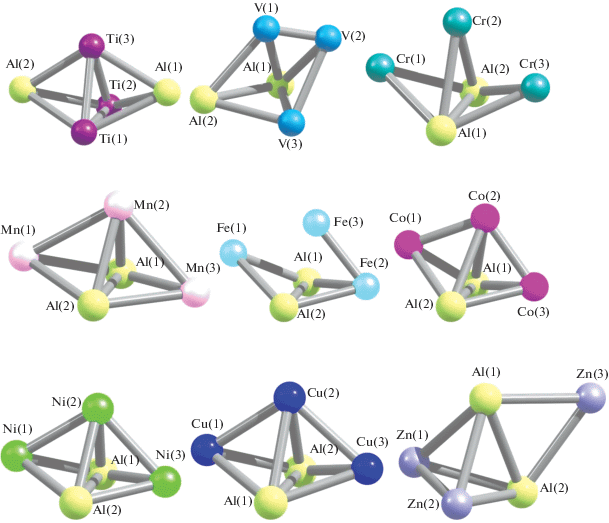
Таблица 1.
Стандартные термодинамические параметры образования для наиболее устойчивых в энергетическом отношении металлокластеров Al2M3
| Металлокластер | ΔfH°(298 K), кДж/моль | ΔfS°(298 K), Дж/(моль K) | ΔfG°(298 K), кДж/моль |
|---|---|---|---|
| Al2Ti3 | 967.4 | 429.9 | 883.5 |
| Al2V3 | 526.5 | 438.5 | 433.8 |
| Al2Cr3 | 1151.1 | 417.8 | 1067.5 |
| Al2Mn3 | 516.8 | 423.1 | 436.2 |
| Al2Fe3 | 823.4 | 430.0 | 736.5 |
| Al2Co3 | 817.6 | 427.6 | 733.9 |
| Al2Ni3 | 760.9 | 430.0 | 676.3 |
| Al2Cu3 | 812.2 | 406.9 | 737.7 |
| Al2Zn3 | 700.1 | 445.1 | 621.7 |
Таблица 2.
Значения параметров ΔrH°(298 K), кДж/моль и ΔrS°(298 K), кДж/(моль K) для реакции (1) в уравнении (2)
| Параметр | Al2Ti3 | Al2V3 | Al2Cr3 | Al2Mn3 | Al2Fe3 | Al2Co3 | Al2Ni3 | Al2Cu3 | Al2Zn3 |
|---|---|---|---|---|---|---|---|---|---|
| ΔrH°(298 K), кДж/моль | –1098.5 | –1672.0 | –694.0 | –973.4 | –1078.1 | –1109.1 | –1162.8 | –858.3 | –344.6 |
| ΔrS°(298 K), кДж/(моль K) | –0.439 | –0.437 | –0.434 | –0.427 | –0.440 | –0.439 | –0.445 | –0.421 | –0.366 |
ЗАКЛЮЧЕНИЕ
Все перечисленные металлокластеры Al2M3 с различными 3d-элементами (M), судя по термодинамическим параметрам реакций их формирования в газовой фазе, способны к самостоятельному существованию и устойчивы в термическом отношении, т.е. к термодеструкции. В то же время стандартные термодинамические характеристики (ΔfH°(298 K), ΔfS°(298 K) и ΔfG°(298 K)) соединений данного стехиометрического состава сильно зависят от природы 3d-элемента, а динамика их изменения в ряду Ti–Zn имеет сложный и непрогнозируемый характер.
Список литературы
Михайлов О.В., Чачков Д.В. // Журн. неорган. химии. 2017. Т. 62. № 3. С. 321.
Михайлов О.В., Чачков Д.В. // Журн. неорган. химии. 2019. Т. 64. № 1. С. 63.
Михайлов О.В., Чачков Д.В. // Журн. неорган. химии. 2018. Т. 63. № 6. С. 750.
Mikhailov O.V., Chachkov D.V. // Struct. Chem. 2018. V. 29. № 5. P. 1543.
Mikhailov O.V., Chachkov D.V. // Struct. Chem. 2019. V. 30. № 4. P. 1289.
Hoe W.-M., Cohen A., Handy N.C. // Chem. Phys. Lett. 2001. V. 341. № 1. P. 319.
Perdew J.P., Burke K., Ernzerhof M. // Phys. Rev. Lett. 1997. V. 78. № 7. P. 1396.
Paulsen H., Duelund L., Winkler H. et al. // Inorg. Chem. 2001. V. 40. № 9. P. 2201.
Swart M., Groenhof A.R., Ehlers A.W. et al. // J. Phys. Chem. A. 2004. V. 108. № 25. P. 5479.
Swart M., Ehlers A.W., Lammertsma K. // Mol. Phys. 2004. V. 102. № 23. P. 2467.
Swart M. // Inorg. Chim. Acta. 2007. V. 360. № 1. P. 179.
Schaefer A., Horn H., Ahlrichs R. // J. Chem. Phys. 1992. V. 97. № 4. P. 2571.
Schaefer A., Huber C., Ahlrichs R. // J. Chem. Phys. 1994. V. 100. № 8. P. 5829.
Gaussian 09, Revision A.01, Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian, Inc., Wallingford CT. 2009.
Curtiss A., Raghavachari K., Redfern P.C. et al. // J. Chem. Phys. 1998. V. 109. № 18. P. 7764.
Ochterski J.W. Thermochemistry in Gaussian. Gaussian, Inc., Wallingford CT. 2000.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


