Журнал неорганической химии, 2020, T. 65, № 5, стр. 669-672
Энтальпия образования ниобата висмута, замещенного эрбием
Н. И. Мацкевич a, *, А. Н. Семерикова a, Н. В. Гельфонд a, М. Ю. Мацкевич a, Е. Н. Ткачев a, О. И. Ануфриева a, В. Г. Мартынец a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: nata.matskevich@yandex.ru
Поступила в редакцию 05.11.2019
После доработки 18.11.2019
Принята к публикации 24.12.2019
Аннотация
Определены термодинамические характеристики ниобата висмута, замещенного эрбием (Bi3Nb0.2Er0.8O6.2). Данное соединение является представителем перспективного класса ионных проводников. С помощью метода калориметрии растворения в 4 М HCl измерены энтальпии растворения оксида висмута, оксида эрбия, хлорида ниобия и Bi3Nb0.2Er0.8O6.2. На основании экспериментальных и литературных данных рассчитана стандартная энтальпия образования ΔfH°(Bi3Nb0.2Er0.8O6.2, 298.15 K) = −1787.5 ± 8.9 кДж/моль и энтальпия решетки ΔlatH°(Bi3Nb0.2Er0.8O6.2, 298.15 K) = −28540 кДж/моль. Полученные термодинамические характеристики могут быть использованы для выработки рекомендаций по оптимизации условий синтеза материалов на основе оксидов висмута.
ВВЕДЕНИЕ
В последние десятилетия оксидные материалы вызывают повышенный интерес исследователей в связи с их широким применением в топливных элементах, электрокатализе, газоразделительных мембранах и др. [1–10]. Особое внимание уделяется разработке оксидных соединений для устройств, работающих при повышенных температурах. Известно [2, 6, 11–13], что одна из форм оксида висмута (δ-Bi2O3) обладает наиболее высокой ионной проводимостью в области средних температур. Однако проблема заключается в том, что эта форма существует в достаточно узком интервале температур (1000−1100 K). Для перспективного использования δ-форма должна быть устойчивой до комнатных температур. Для стабилизации δ-формы используют замещение изовалентными и неизовалентными элементами, в частности, замещение ниобием и редкоземельными элементами (РЗЭ) [8, 11, 12]. Однако добавление оксида ниобия к оксиду висмута сопровождается снижением ионной проводимости. Для увеличения ионной проводимости ниобатов висмута, в частности Bi3NbO7, используют замещение редкоземельными элементами. В работе [11] исследована система Bi2O3–Nb2O5–Y2O3 и показано, что замещение иттрием приводит к увеличению ионной проводимости. С другой стороны, ионная проводимость в системе Bi2O3–Er2O3 является самой высокой для систем на основе оксида висмута и РЗЭ. Оксид висмута, замещенный эрбием, может использоваться как перспективный материал для электролитов твердотельных топливных элементов [8]. К тому же в работе [6] показано, что термодинамическая стабильность увеличивается при уменьшении радиуса РЗЭ. Стабильность соединений, в частности термодинамическая стабильность, является одной из важных характеристик для применения. В настоящей работе синтезировано соединение Bi3Nb0.2Er0.8O6.2 и определены его параметры решетки.
Цель настоящей работы – измерение термохимических характеристик ниобата висмута, замещенного эрбием, оксида висмута, оксида эрбия и хлорида ниобия для определения стандартной энтальпии образования и энтальпии решетки Bi3Nb0.2Er0.8O6.2. Термодинамические характеристики необходимы для понимания перспектив использования вышеуказанного соединения. В настоящее время термодинамические характеристики Bi3Nb0.2Er0.8O6.2, в частности стандартная энтальпия образования, в литературе отсутствуют.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ниобат висмута, замещенный эрбием (Bi3Nb0.2Er0.8O6.2), синтезировали методом твердофазных реакций из стехиометрических количеств оксида висмута (Bi2O3), оксида эрбия (Er2O3) и оксида ниобия (Nb2O5) по реакции:
Высокочистый оксид висмута марки 5N (99.999 мас. %) был синтезирован в ИНХ СО РАН. Содержание примесей Ag, Ca, Ge, Cl, Cr, Cu, Fe, K, Mg, Mn, Na, Ni, Pb, Sb, Si, Te, Zn, определенное методом масс-спектрометрии с индуктивно-связанной плазмой (масс-спектрометр iCAP-Qc), не превышало 10−5 мас. %. Перед проведением экспериментов оксиды эрбия и ниобия (99.9 мас. %, Новосибирский завод редких металлов) прокаливали при температуре 900 K для удаления следов влаги, хлорид ниобия (99.9 мас. %) очищали перегонкой.
Исходные соединения (Bi2O3, Er2O3, Nb2O5) перемешивали в планетарной мельнице, спрессовывали в таблетки и прокаливали в печи при температуре 1073 K в течение 50 ч.
Индивидуальность соединений была подтверждена методами химического и рентгенофазового анализа. Содержание Bi, Nb, Er определяли методом атомно-абсорбционной спектроскопии, содержание кислорода – методом восстановительного плавления. Результаты анализов показали, что в пределах погрешности соединение соответствует формуле Bi3Nb0.2Er0.8O6.2.
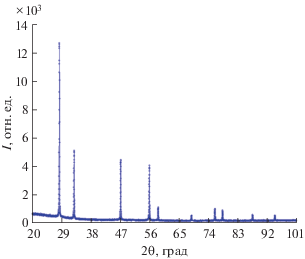
Рентгенофазовый анализ (РФА) полученного образца Bi3Nb0.2Er0.8O6.2 проводили на дифрактометре Shimadzu XRD-7000 (CuKα-излучение, Ni-фильтр, диапазон углов 2θ 20°–100°). Дифрактограмма образца Bi3Nb0.2Er0.8O6.2 приведена на рис. 1.
Для определения термодинамических характеристик использовали метод калориметрии растворения [14–17]. Детальная информация о конструкции калориметра растворения с изотермической оболочкой, изготовленного в ИНХ СО РАН, а также о процедуре проведения калориметрических экспериментов представлена в работах [6, 14]. Калориметр представляет собой стеклянный сосуд Дьюара объемом 250 мл, закрывающийся крышкой. На крышке расположены все необходимые устройства для проведения калориметрического опыта, а именно: платиновый термометр (чувствительность 10−4 K), устройство для разбивания и промывания ампул, калибровочный нагреватель, изготовленный из манганиновой проволоки, устройство для охлаждения калориметрической жидкости, мешалка. Для проверки корректности работы растворного калориметра была измерена энтальпия растворения стандартного вещества – хлорида калия (KCl). Хлорид калия (х. ч.) перед проведением калориметрических экспериментов очищали перекристаллизацией в дистиллированной воде, затем прокаливали при температуре 683 K. Полученная энтальпия растворения хлорида калия ΔsolH° = 17.41 ± 0.04 кДж/моль (0.028 моль/кг) в пределах погрешности совпадала с величиной, рекомендованной в литературе [18–20].
В качестве растворителя была выбрана 4 М соляная кислота (HCl). Растворитель был подобран таким образом, чтобы все соединения, необходимые для определения стандартной энтальпии образования ниобата висмута, замещенного эрбием, растворялись в течение нескольких минут. В 4 М HCl все соединения (Bi2O3, Er2O3, NbCl5, Bi3Nb0.2Er0.8O6.2) растворялись в течение 5–10 мин.
Схема термохимических реакций для определения стандартной энтальпии образования Bi3Nb0.2Er0.8O6.2 была построена таким образом, что энтальпию растворения Bi3Nb0.2Er0.8O6.2 сравнивали с энтальпиями растворения Bi2O3, Er2O3 и NbCl5. Далее с использованием экспериментальных и литературных данных рассчитывали стандартную энтальпию образования. Термохимические реакции приведены ниже:
(1a)
$\begin{gathered} {\text{1}}.{\text{5B}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{9HCl}}\left( {{\text{р - р}}} \right) = {\text{3BiC}}{{{\text{l}}}_{{\text{3}}}}\left( {{\text{р - р}}} \right) + \\ + \,\,{\text{4}}.{\text{5}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}\left( {{\text{р - р}}} \right) + {\text{1}}.{\text{5}}{{\Delta }_{{{\text{sol}}}}}H_{{{\text{1a}}}}^{^\circ }, \\ \end{gathered} $(2a)
$\begin{gathered} 0.{\text{4E}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{2}}.{\text{4HCl}}({\text{р - р}}) = 0.{\text{8ErC}}{{{\text{l}}}_{{\text{3}}}}({\text{р - р}}) + \\ + \,\,{\text{1}}.{\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{р - р}}) + 0.{\text{4}}{{\Delta }_{{{\text{sol}}}}}H_{{{\text{2a}}}}^{^\circ }, \\ \end{gathered} $(3a)
$\begin{gathered} 0.{\text{2NbC}}{{{\text{l}}}_{{\text{5}}}} + {\text{HCl}}({\text{р - р}}) = \\ = 0.{\text{2NbC}}{{{\text{l}}}_{{\text{5}}}}({\text{р - р}}) + 0.{\text{2}}{{\Delta }_{{{\text{sol}}}}}H_{{{\text{3a}}}}^{^\circ }, \\ \end{gathered} $(4a)
$\begin{gathered} {\text{B}}{{{\text{i}}}_{{\text{3}}}}{\text{N}}{{{\text{b}}}_{{0.{\text{2}}}}}{\text{E}}{{{\text{r}}}_{{0.{\text{8}}}}}{{{\text{O}}}_{{{\text{6}}.{\text{2}}}}} + {\text{12}}.{\text{4HCl}}\left( {{\text{р - р}}} \right) = \\ = {\text{3BiC}}{{{\text{l}}}_{{\text{3}}}}\left( {{\text{р - р}}} \right) + 0.{\text{2NbC}}{{{\text{l}}}_{{\text{5}}}}\left( {{\text{р - р}}} \right) + \\ + \,\,0.{\text{8ErC}}{{{\text{l}}}_{{\text{3}}}}\left( {{\text{р - р}}} \right) + {\text{6}}.{\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}\left( {{\text{р - р}}} \right) + {{\Delta }_{{{\text{sol}}}}}H_{{{\text{4a}}}}^{^\circ }. \\ \end{gathered} $С использованием закона Гесса на основании вышеприведенных реакций можно записать:
(5a)
$\begin{gathered} {\text{1}}.{\text{5B}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + 0.{\text{2NbC}}{{{\text{l}}}_{{\text{5}}}} + 0.{\text{4E}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + 0.{\text{5}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{B}}{{{\text{i}}}_{{\text{3}}}}{\text{N}}{{{\text{b}}}_{{0.{\text{2}}}}}{\text{E}}{{{\text{r}}}_{{0.{\text{8}}}}}{{{\text{O}}}_{{{\text{6}}.{\text{2}}}}} + {\text{HCl}} + {{\Delta }_{r}}H_{{{\text{5a}}}}^{^\circ }, \\ \end{gathered} $Энтальпии растворения были измерены при температуре 298.15 K. Все операции по расфасовке хлорида ниобия проводили в сухой камере, заполненной аргоном. Навески ниобата висмута, замещенного эрбием, которые использовали для определения энтальпий растворения, составляли 40 мг. Навески других веществ рассчитывали согласно представленному циклу.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Методом твердофазных реакций синтезировано соединение Bi3Nb0.2Er0.8O6.2. По данным РФА, соединение Bi3Nb0.2Er0.8O6.2 представляет собой индивидуальную фазу, имеет кубическую структуру флюорита (пр. гр. Fm$\bar {3}$m), параметр решетки равен 5.4835(4) Å и в пределах погрешности совпадает с величиной, приведенной в работе [8].
Методом калориметрии растворения измерены энтальпии растворения при 298.15 K в 4 М HCl для следующих соединений: Bi2O3, Er2O3, NbCl5, Bi3Nb0.2Er0.8O6.2. Энтальпия растворения оксида висмута рассчитана из шести параллельных экспериментов и составила:
Погрешности для представленной выше величины и всех других величин рассчитаны для 95%-го доверительного интервала с использованием коэффициента Стьюдента. Энтальпия растворения оксида эрбия (пять параллельных опытов) составила ${{\Delta }_{{{\text{sol}}}}}H_{{\text{2}}}^{^\circ }$ (Er2O3, 298.15 K) = −377.81 ± 3.28 кДж/моль. Энтальпия растворения NbCl5, рассчитанная из четырех параллельных опытов, составила ${{\Delta }_{{{\text{sol}}}}}H_{{\text{3}}}^{^\circ }$ (NbCl5, 298.15 K) = −210.05 ± 4.98 кДж/моль. Энтальпия растворения ниобата висмута, замещенного эрбием, рассчитана из пяти параллельных опытов и составила ${{\Delta }_{{{\text{sol}}}}}H_{{\text{4}}}^{^\circ }$ (Bi2O3, 298.15 K) = = −452.57 ± 5.59 кДж/моль.
На основании вышеприведенных экспериментальных данных рассчитана энтальпия реакции:
Далее с использованием литературных данных по стандартным энтальпиям образования оксида висмута, хлорида ниобия, оксида эрбия, воды и соляной кислоты (табл. 1) рассчитана стандартная энтальпия образования Bi3Nb0.2Er0.8O6.2:
Данная величина измерена нами впервые.
На основании измеренной стандартной энтальпии образования ниобата висмута, замещенного эрбием (Bi3Nb0.2Er0.8O6.2), с использованием литературных данных, приведенных в табл. 2, рассчитана энтальпия решетки Bi3Nb0.2Er0.8O6.2. Для расчета использовали цикл Борна–Габера:
(1b)
$\begin{gathered} {\text{3Bi}}\left( {{\text{тв}}} \right) + 0.{\text{2Nb}}\left( {{\text{тв}}} \right) + 0.{\text{8Er}}\left( {{\text{тв}}} \right) + {\text{3}}.{\text{1}}{{{\text{O}}}_{{\text{2}}}}\left( {\text{г}} \right) = \\ = {\text{B}}{{{\text{i}}}_{{\text{3}}}}{\text{N}}{{{\text{b}}}_{{0.{\text{2}}}}}{\text{E}}{{{\text{r}}}_{{0.{\text{8}}}}}{{{\text{O}}}_{{{\text{6}}.{\text{2}}}}}\left( {{\text{тв}}} \right) + {{\Delta }_{f}}H_{{{\text{1b}}}}^{^\circ }, \\ \end{gathered} $(2b)
${\text{3B}}{{{\text{i}}}^{{{\text{3}} + }}}\left( {\text{г}} \right) = {\text{3Bi}}\left( {{\text{тв}}} \right) + {\text{3}}{{\Delta }_{r}}H_{{{\text{2b}}}}^{^\circ },$(3b)
$0.{\text{2N}}{{{\text{b}}}^{{{\text{5}} + }}}\left( {\text{г}} \right) = 0.{\text{2Nb}}\left( {{\text{тв}}} \right) + 0.{\text{2}}{{\Delta }_{r}}H_{{{\text{3b}}}}^{^\circ },$(4b)
$0.{\text{8E}}{{{\text{r}}}^{{{\text{3}} + }}}\left( {\text{г}} \right) = 0.{\text{8Er}}\left( {{\text{тв}}} \right) + 0.{\text{8}}{{\Delta }_{r}}H_{{{\text{4b}}}}^{^\circ },$(5b)
${\text{6}}.{\text{2}}{{{\text{O}}}^{{{\text{2}}--}}}\left( {\text{г}} \right) = {\text{3}}.{\text{1}}{{{\text{O}}}_{{\text{2}}}}\left( {\text{г}} \right) + {\text{6}}.{\text{2}}{{\Delta }_{r}}H_{{{\text{5b}}}}^{^\circ }.$Далее с помощью закона Гесса можно рассчитать энтальпию решетки по следующей реакции:
(6b)
$\begin{gathered} 3{\text{B}}{{{\text{i}}}^{{3 + }}}\left( {\text{г}} \right) + 0.2{\text{N}}{{{\text{b}}}^{{5 + }}}{\kern 1pt} \left( {\text{г}} \right) + 0.8{\text{E}}{{{\text{r}}}^{{3 + }}}{\kern 1pt} \left( {\text{г}} \right) + 6.2{{{\text{O}}}^{{{\text{2--}}}}}{\kern 1pt} \left( {\text{г}} \right) = \\ = {\text{B}}{{{\text{i}}}_{{\text{3}}}}{\text{N}}{{{\text{b}}}_{{{\text{0}}{\text{.2}}}}}{\text{E}}{{{\text{r}}}_{{{\text{0}}{\text{.8}}}}}{{{\text{O}}}_{{{\text{6}}{\text{.2}}}}}\left( {{\text{тв}}} \right) + {{\Delta }_{{{\text{lat}}}}}H^\circ , \\ \end{gathered} $Рассчитанная энтальпия решетки с использованием полученной в настоящей работе экспериментальной величиной ΔfH°(Bi3Nb0.2Er0.8O6.2, 298.15 K) и литературных данных табл. 2 составляет:
ΔlatH°(Bi3Nb0.2Er0.8O6.2, 298.15 K) = −28 540 кДж/моль.
ЗАКЛЮЧЕНИЕ
В настоящей работе впервые с использованием метода калориметрии растворения в соляной кислоте измерена энтальпия растворения ниобата висмута, замещенного эрбием (Bi3Nb0.2Er0.8O6.2). На основании полученных экспериментальных данных с привлечением литературных величин рассчитана стандартная энтальпия образования Bi3Nb0.2Er0.8O6.2 и энтальпия решетки.
Список литературы
Li R., Li G., Greaves C. // J. Mater. Chem. 2018. V. 6. P. 5260. https://doi.org/10.1039/C7TA06883B
Tran T.B., Navrotsky A. // Chem. Mater. 2012. V. 24. P. 4185. https://doi.org/10.1021/cm302446e
Guskov V.N., Gavrichev K.S., Gagarin P.G. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1265. https://doi.org/10.1134/S0036023619100048
Mikhailovskaya Z.A., Petrova S.A., Abrahams I. et al. // Ionics. 2018. V. 24. P. 3983. https://doi.org/10.1007/s11581-018-2543-1
Guskov V.N., Sazonov E.G., Gavrichev K.S. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1041. https://doi.org/10.1134/S0036023619080059
Matskevich N.I., Wolf Th., Greaves C. et al. // J. Chem. Thermodyn. 2015. V. 91. P. 234. https://doi.org/10.1016/j.jct.2015.07.036
Kaimieva O.S., Buyanova E.S., Petrova S.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 4. P. 423. https://doi.org/10.1134/S0036023619040120
Leszczynska M., Holdynski M., Krok F. et al. // Solid State Ionics. 2010. V. 181. P. 796. https://doi.org/10.1016/j.ssi.2010.04.012
Harper G., Sommerville R., Kendrick E. et al. // Nature. 2019. V. 575. P. 75. https://doi.org/10.1038/s41586-019-1682-5
Denisova L.T., Kargin Yu.F., Belousova N.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 725. https://doi.org/10.1134/S0036023619060056
Abrahams I., Kozanecka-Szmigiel A., Krok F. et al. // Solid State Ionics. 2006. V. 177. P. 1761. https://doi.org/10.1016/j.ssi.2006.01.036
Emel’yanova Yu.V., Krylov A.A., Kazantseva A.D. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 151. https://doi.org/10.1134/S0036023619020050
Zhang Q., Yan A., Cui Z. et al. // J. Chem. Thermodyn. 2019. V. 130. P. 154. https://doi.org/10.1016/j.jct.2018.09.028
Levchenko L.N., Matskevich N.I., Kerzhentseva V.E. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 7. P. 923. https://doi.org/10.1134/S0036023618070136
Gruzhinina A.I., Tiflova L.A., Monaenkova A.S. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. P. 2101. https://doi.org/10.1134/S0036024419110098
Hughes J.T., Navrotsky A. // J. Am. Chem. Soc. 2011. V. 133. P. 9184. https://doi.org/10.1021/ja202132h
Aiswarya P.M., Kumar S.S., Ganesan R. et al. // Thermochim. Acta. 2019. V. 682. P. 178401. https://doi.org/10.1016/j.tca.2019.178401
Gunter R., Pfestorf M., Rother J. et al. // J. Thermal Anal. 1988. V. 33. P. 359. https://doi.org/10.1007/BF01914624
Sanahuja A., Cesari E. // J. Chem. Thermodyn. 1984. V. 16. P. 1195. https://doi.org/10.1016/0021-9614(84)90192-7
Glushko V.P. Termicheskie Konstanty Veshchestv (Thermal Constants of Substances). М.: VINITI, 1965–1982. № 1–10.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии