Журнал неорганической химии, 2020, T. 65, № 5, стр. 651-659
Низкотемпературная теплоемкость М-ортотанталата тербия и аномалия Шоттки
К. С. Гавричев a, А. В. Тюрин a, В. Н. Гуськов a, *, П. Г. Гагарин a, А. В. Гуськов a, М. А. Рюмин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: guskov@igic.ras.ru
Поступила в редакцию 01.11.2019
После доработки 15.11.2019
Принята к публикации 27.12.2019
Аннотация
Методом адиабатической калориметрии измерена молярная теплоемкость М-ортотанталата тербия в области температур 18–346 K. По сглаженным значениям теплоемкости рассчитаны энтропия, приращение энтальпии и приведенная энергия Гиббса. Проанализирован вклад аномалии Шоттки в теплоемкость соединений лантаноидов и способы его оценки.
ВВЕДЕНИЕ
Ортотанталаты редкоземельных элементов интересны с практической точки зрения благодаря высокой плотности, химической стойкости, отсутствию фазовых переходов в широкой области температур, а также функциональным свойствам, таким как ионная проводимость, люминесценция и др. [1–5]. В последнее время ортотанталаты рассматриваются как индивидуально, так и в качестве компонентов материалов для термобарьерных покрытий [6, 7]. Разработку термобарьерных покрытий для защиты поверхности лопастей турбин силовых установок с точки зрения живучести материалов наиболее рационально проводить, основываясь на термодинамическом моделировании высокотемпературных процессов, которые могут протекать на границах раздела защитных слоев при взаимодействии с газовой средой и возможными расплавами пылевых загрязнений, содержащихся в атмосфере [8]. Для проведения расчетов необходимы сведения по термодинамическим свойствам как материала покрытий, так и контактирующих веществ. Термодинамические свойства также необходимы для уточнения фазовых равновесий в таких тугоплавких оксидных системах, как цирконаты, гафнаты, танталаты и ниобаты редкоземельных элементов, диаграммы которых, как правило, известны достаточно схематично [1, 2]. Основой для расчета термодинамических функций, помимо энтальпий образования, является измерение молярной теплоемкости в широком температурном диапазоне. Особенностью температурных зависимостей теплоемкостей соединений лантаноидов, за исключением диамагнитных ионов лантана и лютеция, является существование вклада в теплоемкость аномалии Шоттки – некооперативного перехода, вызванного расщеплением f-электронных уровней под действием электрического поля кристалла [9]. Оценка вида и величины вклада аномалии Шоттки представляет особый интерес.
Сведения об исследовании ортотанталата тербия в основном касались его люминесценции [4, 10, 11] и температуры плавления ~2253 K [2, 12], тогда как о термодинамических свойствах сведений не обнаружено. Ортотанталат тербия при низкой температуре может существовать в двух моноклинных модификациях: M ' (пр. гр. P2/a, Z = 2) и M (пр. гр. I2/a, Z = 4), различающихся удвоением параметра b и числа формульных единиц элементарной ячейки соответственно. Устойчивость структур M и M' определяется ионным радиусом лантаноида. Так, ортотанталат неодима имеет единственную M-форму, в то время как ортотанталаты иттербия и лютеция устойчиво существуют в виде М'-модификации. Остальные ортотанталаты лантаноидов, включая тербий, могут существовать в виде двух форм. Особенностью теплового поведения соединений с общей формулой LnTaO4 (Ln = Sm–Tm) является необратимое превращение M'-формы в M-форму при нагревании. Существует предположение [13], что превращение M' в M происходит через предшествующее образование высокотемпературной тетрагональной модификации T (пр. гр. I41/a, Z = 4), однако, как было установлено в работах [14–16], имеется температурный интервал ниже области существования Т-фазы, в котором M '- и M-модификации могут существовать одновременно. Обратимое превращение ортотанталата тербия в высокотемпературную тетрагональную модификацию T происходит, по данным [17], около ~1700 K. Фазовые превращения ортотанталатов M ' → M, M ' → T и M ↔ T могут быть отнесены ко второму роду, так как они не сопровождаются тепловыми эффектами и скачкообразными изменениями параметров кристаллической решетки. Поскольку превращение M ' → M происходит необратимо и устойчивой формой ортотанталата тербия можно считать М-модификацию, при моделировании фазовых равновесий с участием TbTaO4 следует, по нашему мнению, опираться в первую очередь на термодинамические свойства М-ортотанталата тербия.
Целью настоящего исследования является определение молярной теплоемкости М-ортотанталата тербия в области от гелиевых температур до 346 K, расчет термодинамических функций в указанном температурном диапазоне, а также анализ возможностей оценки вклада аномалии Шоттки в величину измеренной теплоемкости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ортотанталат тербия получали обратным осаждением гидроксидов тантала и тербия в водном растворе аммиака стехиометрического водно-спиртового раствора хлоридов тербия и тантала с последующим обезвоживанием и ступенчатым отжигом. Для приготовления исходного раствора использовали Tb4O7 (99.99 мас. %, ООО “Ланхит”), предварительно растворенный в соляной кислоте (35–38 мас. %, ос. ч. 20-4, “Химмед”), и TaCl5 (99.99 мас. %, ООО “Ланхит”), растворенный в этаноле (95 об. %). Методика синтеза подробно описана в работах [18, 19] с тем отличием, что получение стехиометрической смеси хлоридных растворов проводили весовым способом, позволяющим увеличить точность соотношения металлов в конечном продукте. Окончательный отжиг полученного ортотанталата тербия осуществляли при температуре 1773 K. Дифракционные исследования фазового состава и кристаллической структуры порошка проводили на дифрактометре Bruker D8 Advance (CuKα-излучение, λ = = 1.5418 Å, Ni-фильтр, детектор LYNXEYE, геометрия на отражение) в интервале углов 2θ = = 10°–80°. Теплоемкость измеряли автоматическим низкотемпературным адиабатическим калориметром БКТ-3 (АОЗТ “Термис”) с помощью температурной шкалы ITS-90. Методика измерений и сглаживания экспериментальных данных ортонормированными полиномами описана в работе [20]. Масса образца составила 2.93322 ± ± 0.00005 г. Молекулярную массу ортотанталата тербия (403.87083 г/моль) рассчитывали на основе рекомендаций [21]. Термический анализ выполняли с помощью установки синхронного термического анализа STA 449F1 Jupiter® фирмы Netzsch в атмосфере газообразного аргона высокой чистоты (99.9995%). Морфологию образцов наблюдали с помощью электронного микроскопа Cross Beam Zeiss N Vision 40. Химический состав определяли с помощью оптико-эмиссионного спектрометра с индуктивно-связанной плазмой Agilent 725.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
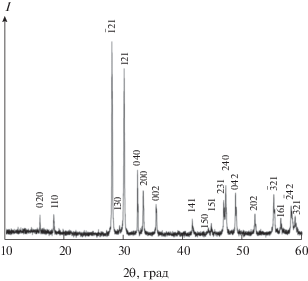
Для калориметрических измерений был синтезирован образец М-TbTaO4 стехиометрического состава (Tb : Ta = 1 : (1 ± 0.004)). Дифрактограмма порошка TbTaO4 приведена на рис. 1, а его морфология – на рис. 2. Рассчитанные параметры кристаллической решетки составляют: а = = 5.387(2), b = 11.023(3), c = 5.066(2) Å, β = 95.75(5)°, посторонние рефлексы отсутствуют. Полученные значения параметров кристаллической решетки хорошо совпадают с данными [1, 4] для моноклинной модификации М (пр. гр. I2/a, Z = 4).
Рис. 1.
Дифрактограмма образца М-TbTaO4: а = = 5.387(2), b = 11.023(3), c = 5.066(2) Å, β = 95.75(5)°.
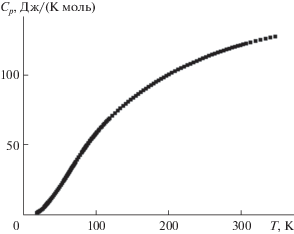
Экспериментальные измерения молярной теплоемкости были выполнены тремя сериями при 147 температурах в области 17.3–346.3 K (табл. 1), результаты приведены на рис. 3. Температурная зависимость теплоемкости имеет обычный S-образный вид, видимые аномалии отсутствуют.
Таблица 1.
Экспериментальные данные по измерению молярной теплоемкости TbTaO4. М.м. = 403.87083 г/моль, р = 101.3 кПа
| T, K | Cp, Дж/(K моль) | T, K | Cp, Дж/(K моль) | T, K | Cp, Дж/(K моль) | T, K | Cp, Дж/(K моль) |
|---|---|---|---|---|---|---|---|
| Серия 1 – гелий | 30.87 | 6.85 | 97.04 | 56.94 | 178.42 | 93.12 | |
| 17.33 | 2.339 | 32.55 | 8.15 | 99.31 | 58.35 | 181.91 | 94.23 |
| 18.23 | 2.441 | 34.22 | 9.45 | 102.19 | 60.09 | 185.4 | 95.32 |
| 19.02 | 3.018 | 36.10 | 11.63 | 105.7 | 62.15 | 189.0 | 96.42 |
| 19.89 | 3.165 | 37.74 | 12.68 | 109.2 | 64.12 | 192.52 | 97.47 |
| 20.81 | 3.481 | 39.36 | 13.74 | 112.73 | 66.04 | 196.02 | 98.49 |
| 22.39 | 4.092 | 41.00 | 14.84 | 116.22 | 67.88 | 199.52 | 99.48 |
| 24.04 | 4.626 | 42.66 | 15.98 | Серия 3 – азот | 203.45 | 100.6 | |
| 25.70 | 5.349 | 44.27 | 17.11 | 79.36 | 44.73 | 207.81 | 101.8 |
| 27.34 | 6.302 | 45.91 | 18.29 | 81.96 | 46.66 | 212.16 | 102.9 |
| 28.42 | 6.939 | 47.57 | 19.51 | 84.23 | 48.31 | 216.5 | 104.0 |
| 28.99 | 7.278 | 49.21 | 20.75 | 86.55 | 49.96 | 220.78 | 105.0 |
| 30.02 | 7.894 | 50.87 | 22.02 | 88.85 | 51.55 | 225.07 | 106.0 |
| 30.63 | 8.260 | 52.53 | 23.31 | 91.16 | 53.12 | 229.32 | 106.9 |
| 31.38 | 8.714 | 54.19 | 24.62 | 93.46 | 54.64 | 233.64 | 107.9 |
| 31.57 | 8.829 | 55.86 | 25.96 | 95.83 | 56.17 | 237.97 | 108.9 |
| 32.27 | 9.255 | 57.53 | 27.30 | 98.10 | 57.60 | 242.22 | 109.9 |
| 33.06 | 9.739 | 59.25 | 28.70 | 100.46 | 59.05 | 246.45 | 110.9 |
| 33.12 | 9.776 | 60.92 | 30.06 | 103.45 | 60.84 | 250.67 | 111.7 |
| 34.65 | 10.72 | 62.60 | 31.44 | 107.04 | 62.91 | 254.82 | 112.6 |
| 34.76 | 10.79 | 64.27 | 32.8 | 110.65 | 64.92 | 258.95 | 113.4 |
| 36.28 | 11.75 | 65.95 | 34.17 | 114.25 | 66.85 | 263.05 | 114.1 |
| 37.86 | 12.76 | 67.64 | 35.54 | 117.85 | 68.72 | 267.12 | 114.9 |
| 55.35 | 25.55 | 69.33 | 36.91 | 121.5 | 70.55 | 271.16 | 115.6 |
| 57.01 | 26.88 | 71.03 | 38.27 | 125.32 | 72.39 | 275.17 | 116.3 |
| 58.66 | 28.22 | 72.92 | 39.77 | 129.03 | 74.13 | 279.14 | 117.0 |
| 60.31 | 29.57 | 75.05 | 41.43 | 132.53 | 75.72 | 283.07 | 117.6 |
| 61.96 | 30.91 | 77.02 | 42.95 | 136.47 | 77.45 | 286.95 | 118.3 |
| 63.62 | 32.27 | 79.46 | 44.80 | 139.99 | 78.96 | 290.8 | 118.9 |
| 65.29 | 33.63 | 80.26 | 45.40 | 143.44 | 80.39 | 294.6 | 119.5 |
| 66.95 | 34.98 | 81.65 | 46.43 | 146.92 | 81.8 | 298.36 | 120.0 |
| 68.63 | 36.34 | 82.79 | 47.27 | 150.41 | 83.18 | 302.07 | 120.6 |
| 70.30 | 37.68 | 83.78 | 47.98 | 153.9 | 84.53 | 306.10 | 121.1 |
| Серия 2 – гелий | 85.01 | 48.87 | 157.39 | 85.84 | 312.19 | 122.0 | |
| 32.71 | 9.524 | 85.97 | 49.55 | 160.89 | 87.12 | 319.24 | 122.9 |
| 34.49 | 10.62 | 88.17 | 51.08 | 164.38 | 88.37 | 326.06 | 123.8 |
| 25.85 | 2.95 | 90.39 | 52.60 | 167.9 | 89.61 | 332.95 | 124.6 |
| 27.52 | 4.25 | 92.60 | 54.08 | 171.39 | 90.80 | 339.58 | 125.4 |
| 29.20 | 5.55 | 94.82 | 55.52 | 174.92 | 91.98 | 346.27 | 126.1 |
Рис. 3.
Экспериментальная зависимость молярной теплоемкости М-TbTaO4 от температуры. М.м. = = 403.87083 г/моль, p = 101.3 кПа.
Сглаженные ортонормированными полиномами значения молярной теплоемкости М-TbTaO4 и рассчитанные термодинамические функции без учета фазовых превращений, протекающих ниже 18 K, приведены в табл. 2.
Таблица 2.
Молярная теплоемкость и термодинамические функции М-TbTaO4. М.м. = 403.87083 г/моль, р = 101.3 кПа
| T, K | C°p, Дж/(K моль) | S°, Дж/(K моль) | H°(T) – H°(0), Дж/моль | Ф°, Дж/(K моль) |
|---|---|---|---|---|
| 18 | 2.446 | 0.8152 | 11.01 | 0.2038 |
| 20 | 3.182 | 1.110 | 16.62 | 0.2791 |
| 25 | 5.363 | 2.046 | 37.80 | 0.5338 |
| 30 | 7.950 | 3.247 | 70.94 | 0.8822 |
| 35 | 10.89 | 4.688 | 117.9 | 1.320 |
| 40 | 14.13 | 6.351 | 180.3 | 1.843 |
| 45 | 17.66 | 8.216 | 259.7 | 2.445 |
| 50 | 21.40 | 10.27 | 357.3 | 3.123 |
| 60 | 29.33 | 14.87 | 610.6 | 4.689 |
| 70 | 37.41 | 19.99 | 944.4 | 6.503 |
| 80 | 45.18 | 25.50 | 1358 | 8.531 |
| 90 | 52.35 | 31.24 | 1846 | 10.73 |
| 100 | 58.81 | 37.10 | 2402 | 13.08 |
| 110 | 64.59 | 42.98 | 3020 | 15.53 |
| 120 | 69.79 | 48.83 | 3692 | 18.06 |
| 130 | 74.53 | 54.60 | 4414 | 20.65 |
| 140 | 78.92 | 60.29 | 5181 | 23.28 |
| 150 | 83.00 | 65.87 | 5991 | 25.93 |
| 160 | 86.81 | 71.35 | 6841 | 28.60 |
| 170 | 90.37 | 76.72 | 7727 | 31.27 |
| 180 | 93.67 | 81.98 | 8647 | 33.95 |
| 190 | 96.74 | 87.13 | 9599 | 36.61 |
| 200 | 99.59 | 92.17 | 10 580 | 39.27 |
| 210 | 102.3 | 97.09 | 11 590 | 41.90 |
| 220 | 104.8 | 101.9 | 12 630 | 44.50 |
| 230 | 107.2 | 106.6 | 13 690 | 47.10 |
| 240 | 109.4 | 111.2 | 14 770 | 49.69 |
| 250 | 111.6 | 115.7 | 15 870 | 52.26 |
| 260 | 113.6 | 120.2 | 17 000 | 54.77 |
| 270 | 115.4 | 124.5 | 18 150 | 57.26 |
| 280 | 117.1 | 128.7 | 19 310 | 59.74 |
| 290 | 118.8 | 132.8 | 20 490 | 62.18 |
| 298.15 | 120.0 ± 0.1 | 136.2 ± 0.4 | 21460 ± 30 | 64.22 ± 0.29 |
| 300 | 120.3 | 136.9 | 21 680 | 64.62 |
| 310 | 121.7 | 140.9 | 22 890 | 67.02 |
| 320 | 123.0 | 144.8 | 24 120 | 69.38 |
| 330 | 124.3 | 148.6 | 25 350 | 71.73 |
| 340 | 125.4 | 152.3 | 26 600 | 74.04 |
| 346 | 126.1 | 154.5 | 27 360 | 75.40 |
Учесть вклад магнитного превращения из антиферромагнитного в парамагнитное состояние в термодинамические свойства ортотанталата тербия ниже 18 K не представляется возможным из-за отсутствия экспериментальных данных. Однако понятно, что для значения изменения энтальпии при комнатных температурах этот вклад будет малозаметной величиной, тогда как для энтропии и приведенной энергии Гиббса вклад магнитного превращения может оказаться довольно существенным [18, 22–24]. Наличие магнитных переходов в области низких температур подтверждено для ортониобата, ортованадата и ортофосфата тербия [25–27].
Аномалия Шоттки
В теплоемкости ортотанталата тербия присутствует заметный вклад аномалии Шоттки, характерный для всех соединений лантаноидов с парамагнитными ионами (от Ce3+ до Yb3+). Вклад аномалии Шоттки связан с термическим заселением f-электронных уровней, расщепленных под действием электрического поля кристалла (эффект Штарка). Этот процесс является некооперативным и происходит практически во всем диапазоне существования вещества. Исключением является теплоемкость соединений гадолиния, в которую вклад аномалии Шоттки фиксируется при очень низких температурах (ниже 25 K) [27]. Благодаря этой особенности теплоемкость парамагнитных соединений гадолиния выше 25 K ведет себя как теплоемкость диамагнитных лантаноидов. Вклад аномалии Шоттки может быть определен расчетом на основании спектроскопических данных по формуле [28]:
(1)
$\begin{gathered} {{C}_{x}}/R = \frac{{\sum\limits_i {\left( {{{g}_{i}}{{{\left( {{{E}_{i}}/kT} \right)}}^{2}}\exp \left( { - \frac{{{{E}_{i}}}}{{kT}}} \right)} \right)} }}{Q} - \\ - \,\,{{\left\{ {\frac{{\sum\limits_i {\left( {{{g}_{i}}\left( {{{E}_{i}}/kT} \right)\exp \left( { - \frac{{{{E}_{i}}}}{{kT}}} \right)} \right)} }}{Q}} \right\}}^{2}}, \\ \end{gathered} $(2)
${{C}_{p}}\left( {{\text{LnX, lat}}} \right) = \left( {1--f} \right){{C}_{p}}\left( {{\text{LaX}}} \right) + f{{C}_{p}}\left( {{\text{GdX}}} \right),$Отметим, что в работе [29] приведено иное уравнение для расчета относительного объема:
(3)
$\begin{gathered} f = \left[ {{{V}_{m}}\left\{ {{\text{Pr}}{{{\left( {{\text{OH}}} \right)}}_{3}}} \right\} - } \right. \\ {{\left. { - \,\,{{V}_{m}}\left\{ {{\text{La}}{{{\left( {{\text{OH}}} \right)}}_{{\text{3}}}}} \right\}} \right]} \mathord{\left/ {\vphantom {{\left. { - \,\,{{V}_{m}}\left\{ {{\text{La}}{{{\left( {{\text{OH}}} \right)}}_{{\text{3}}}}} \right\}} \right]} {\left[ {{{V}_{m}}\left\{ {{\text{La}}{{{\left( {{\text{OH}}} \right)}}_{3}}} \right\}} \right]}}} \right. \kern-0em} {\left[ {{{V}_{m}}\left\{ {{\text{La}}{{{\left( {{\text{OH}}} \right)}}_{3}}} \right\}} \right]}}, \\ \end{gathered} $Для оценки достоверности получаемых по способу Веструма значений решеточной теплоемкости рассмотрим теплоемкость ортониобатов лантаноидов со структурой фергюсонита, изоструктурных ортотанталатам LnTaO4 (Ln = Sm–Tm) и претерпевающих, как и ортотанталаты, структурный фазовый переход фергюсонит–шеелит в области высоких температур. Для этого рассчитаем теплоемкость ортониобата гадолиния GdNbO4 при температуре 298 K с помощью данных по теплоемкостям LaNbO4 [30] и LuNbO4 [31] и объемам элементарной ячейки при комнатной температуре: LaNbO4 (332.88 Å3), GdNbO4 (303.29 Å3), LuNbO4 (284.30 Å3), взятым из работы [32], и сравним ее с экспериментально измеренной температурной зависимостью молярной теплоемкости ниобата гафния Cp(GdNbO4) [33].
Для ортониобатов вследствие их изоструктурности можно использовать формулу, за основу которой принята модель Веструма:
(4)
$\begin{gathered} {{C}_{p}}\left( {{\text{LnNb}}{{{\text{O}}}_{{\text{4}}}}{\text{, lat}}} \right) = \left( {1 - f} \right){{C}_{p}}\left( {{\text{LaNb}}{{{\text{O}}}_{{\text{4}}}}} \right) + \\ + \,\,f{{C}_{p}}\left( {{\text{LuNb}}{{{\text{O}}}_{4}}} \right), \\ \end{gathered} $Для ортониобата гадолиния величина f при температуре 298 K равна:
В таком случае расчетная теплоемкость ортониобата гадолиния определяется как
Отклонение от измеренной величины составляет 117.28 – 118.30 = –1.02 Дж/(K моль) (–0.86%).
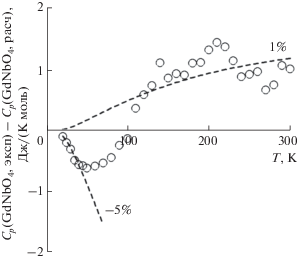
Для сравнения расчетных и экспериментальных величин теплоемкости в области температур 20–300 K определена разность Cp(GdNbO4)эксп – – Cp(GdNbO4)расч, которая показана на рис. 4.
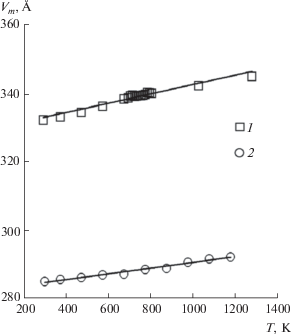
Видно, что в области температур выше 100 K разность составляет ∼1%, что свидетельствует о применимости модели. Отклонение при более низких температурах может быть связано с различием в изменении параметров кристаллической решетки для соединений лантана, гадолиния и лютеция при понижении температуры. Отсутствие информации по термическому расширению в области низких температур не позволяет выполнить более точный расчет. Для высоких температур такая информация более доступна [32]. Для ортониобатов лантана и лютеция зависимости мольного объема от температуры в области 300–1200 K практически параллельны (рис. 5), что позволяет применить модель Веструма в этом температурном диапазоне. Расчет решеточной теплоемкости ортониобата тербия может быть выполнен по уравнению (4) с использованием величины мольного объема Vm(TbNbO4) = 299.49 Å3.
Cp(TbNbO4, lat) = = (1 – f)Cp(LaNbO4) + fCp(LuNbO4),
где x = [Vm(LaNbO4) – Vm(TbNbO4)]/[Vm(LaNbO4) – – Vm(LuNbO4)] = (332.88 – 299.49)/(332.88 – ‒ 284.3) = 0.6873.
В этом случае теплоемкость ортониобата тербия при температуре 298.15 K составляет
Cp(TbNbO4) = (1–0.6873)Cp(LaNbO4) + + 0.6873(Cp(LuNbO4) = 0.3127 × 121.9 + 0.6873 × × 115.41 = 116.91Дж/(K моль).
Таким образом, при переходе от ортониобата гадолиния к ортониобату тербия происходит уменьшение теплоемкости на 117.28 – 116.91 = = 0.37 Дж/(K моль) (0.32%).
Для ортотанталата тербия оценка аномальной теплоемкости Шоттки по методу Веструма невозможна, поскольку структура TbTaO4 отличается от структуры как LaTaO4, так и LuTaO4. В связи с этим представляется целесообразным выполнить расчеты, предположив, что относительные изменения в решеточной теплоемкости при переходе от GdNbO4 к TbNbO4 и от GdTaO4 к TbTaO4 одинаковы.
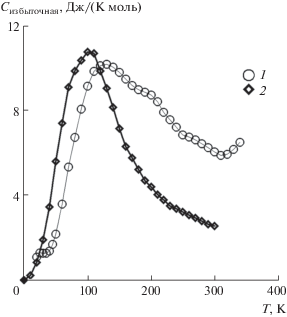
Как было показано выше, разность решеточной теплоемкости ортониобатов гадолиния и тербия составляет 0.32%. Если предположить, что эта зависимость соблюдается и для ортотанталатов, то решеточная теплоемкость TbTaO4 составляет 0.996845 от теплоемкости GdTaO4. Вид температурной зависимости аномальной теплоемкости TbTaO4, рассчитанной таким образом, показан на рис. 6.
Для сравнения на этом же рисунке показан вид температурной зависимости аномалии Шоттки для гидроксида тербия [28]. Отметим, что максимумы обеих кривых близки по величине. Разница в температуре максимумов объясняется различием в структурах этих соединений. Величина энтропии аномального вклада Шоттки для M-TbTaO4 при 298.15 K составляет 15.5 Дж/(K моль).
Поскольку достоверные значения объемов элементарной ячейки не всегда доступны, мы оценили возможность использования ионных радиусов для проведения расчетов в предположении, что для изоструктурных соединений в модели Веструма объем решетки может быть заменен на радиус иона с учетом координационного числа. Для проверки была построена зависимость объема кристаллических решеток ортониобатов лантаноидов от их ионного радиуса для КЧ = 8, которая оказалась практически линейной (R2 = 0.9978).
Если для расчета коэффициента f в уравнении Cp(GdNbO4, lat) = (1 – f)Cp(LaNbO4) + fCp(LuNbO4) использовать ионные радиусы [34], то его величина составит:
f = [r(La3+) – r(Gd3+)]/[r(La3+) – r(Lu3+)] = (1.216 – – 1.107)/(1.216–1.032) = 0.109/0.184 = 0.5924,
и расчетная теплоемкость ортониобата гадолиния при 298 K будет равна Cp(GdNbO4) = (1 – ‒ 0.5824)Cp(LaNbO4) + 0.5824Cp(LuNbO4) = = 0.4176 × 121.9 + 0.5824 × 115.41 = 50.905 + 67.214 = = 118.12 Дж/(K моль). Эта величина отличается от экспериментального значения 117.28 на ‒0.84 Дж/(K моль) (–0.7%) и также близка к полученной экспериментально величине 118.30 Дж/(K моль), что свидетельствует о возможности замены объемов элементарной ячейки на ионные радиусы в формуле Веструма.
ЗАКЛЮЧЕНИЕ
Представлены результаты измерения молярной теплоемкости M-ортотанталата тербия, выполненные методом адиабатической калориметрии при 18–346 K. Установлено отсутствие аномалий теплоемкости, которые могли бы свидетельствовать о протекании структурных превращений, в этой температурной области. Экспериментальные значения теплоемкости сглажены с помощью ортонормированных полиномов и рассчитаны стандартные термодинамические функции М-TbTaO4, значения которых при 298.15 K составили: $C_{p}^{^\circ }$ = 120.0 ± 0.1 Дж/(K моль), S° = = 136.2 ± 0.4 Дж/(K моль), H°(T) – H°(0) = 21 460 ± ± 30 Дж/моль, Ф° = 64.22 ± 0.29 Дж/(K моль).
Проведен анализ методов оценки вклада аномалии Шоттки в общую теплоемкость парамагнитных соединений лантаноидов и показана возможность использования для этих целей ионных радиусов лантаноидов. Из температурной зависимости молярной теплоемкости М-TbTaO4 выделен вклад аномалии Шоттки, захватывающий практически всю область температур 18–436 K и имеющий максимум ~11 Дж/(K моль) при ~100 K.
Список литературы
Рождественский Ф.А., Зуев М.Г., Фотиев А.А. Танталаты трехвалентных металлов. М.: Наука, 1986. 168 с.
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редкоземельных элементов. Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Dias A., Siqueira K.P., Moreira R.L. // J. Alloys Compd. 2017. V. 693. P. 1243. https://doi.org/10.1016/j.jallcom.2016.10.077
Brixner L.H., Chen H.-y. // J. Electrochem. Soc. 1983. V. 130. P. 2435. https://doi.org/10.1149/1.2119609
Forbes T.Z., Nyman M., Rodriguez M.A., Navrotsky A. // J. Solid. State Chem. 2010. V. 183. P. 2516. https://doi.org/101016/j.jssc.2010.08.024
Wang J., Chong X.Y., Zhou R., Feng J. // Scripta Mater. 2017. V. 126. P. 24. https://doi.org/10.1016/j.scriptamat.2016.08.019
Van Sluytman J.S., Krämer K., Tolpygo et al. // Acta Mater. 2015. V. 96. P. 133. https://doi.org/10.1016/j.actamat.2015.06.007
Poerschke D.L., Jackson R.W., Levi C.G. // Ann. Rev. Mater. Res. 2017. V. 47. P. 297. https://doi.org/10.1146/annurev-matsci-010917-105000
Westrum E.F.J. // Therm. Anal. 1985. V. 30. P. 1209. https://doi.org/10.1007/bf01914288
Kazakova L.I., Bykov I.S., Dubovsky A.B. // J. Lumin. 1997. V. 72–74. P. 211. https://doi.org/10.1016/s0022-2313(96)00268-2
Siqueira K.P., Carmo A.P., Bell M.J.V., Dias A. // J. Lumin. 2016. V. 179. P. 146. https://doi.org/10.1016/j.jlumin.2016.06.054
Iusupova E.N., Savchenko E.P., Panova T.I., Keller E.K. // Izv. AN SSSR, Neorgan. Mater. 1980. V. 16. P. 555. [Юсупова Е.Н., Савченко Е.П., Панова Т.И., Келлер Е.К. // Изв. АН СССР. Неорган. материалы. 1980. Т. 16. С. 555.]
Mather S.A., Davies P.K. // J. Am. Ceram. Soc. 1995. V. 78. P. 2737. https://doi.org/10.1111/j.1151-2916.1995.tb08049.x
Tyurin A.V., Khoroshilov A.V., Guskov V.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1583. [Тюрин А.В., Хорошилов А.В., Гуськов В.Н. и др. // Журн. неорган. химии. 2018. Т. 63. С. 1599.]https://doi.org/10.1134/S0036023618120215
Ryumin M.A., Sazonov E.G., Guskov V.N. et al. // Inorg. Mater. 2016. V. 52. P. 1149. [Рюмин M.A., Сазонов Е.Г., Гуськов В.Н. и др. // Неорган. материалы. 2016. Т. 52. С. 1223.] https://doi.org/10.1134/S0020168516110145
Khoroshilov A.V., Ashmarin A.A., Guskov V.N. et al. // Dokl. Phys. Chem. 2019. V. 484. Part 1. P. 12. [Хорошилов А.В., Ашмарин А.А., Гуськов В.Н. и др. // Докл. АН. 2019. Т. 484. С. 181. https://doi.org/10.31857/S0869-56524842181-183]https://doi.org/10.1134/S0012501619010032
Stubičan V.S. High-temperature transitions in rare-earth niobates and tantalates // J. Am. Ceram. Soc. 1954. V. 47. P. 55. https://doi.org/10.1111/j.1151-2916.1964.tb15654.x
Guskov V.N., Sazonov E.G., Tyurin A.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1041. [Гуськов В.Н., Сазонов Е.Г., Тюрин А.В. и др. // Журн. неорган. химии. 2019. Т. 64. С. 874. https://doi.org/10.1134/S0044457X19080051]https://doi.org/10.1134/S0036023619080059
Nikiforova G.E., Kondrat’eva O.N., Tyurin A.V. et al. // J. Alloys Compd. 2019. V. 803. P. 1016. https://doi.org/10.1016/j.jallcom.2019.06.354
Ryumin M.A., Nikiforova G.E., Tyurin A.V. et al. // Inorg. Mater. 2020. V. 56. P. 97. https://doi.org/10.1134/S0020168520010148 [Рюмин М.А., Никифорова Г.Е., Тюрин А.В. и др. // Неорган. материалы. 2020. Т. 56. С. 102] https://doi.org/10.1134/S0002337X20010145
Wieser M.E., Holden N., Coplen T.B. et al. // Pure Appl. Chem. 2013. V. 85. P. 1047. https://doi.org/10.1351/PAC-REP-13-03-02
Atomic weights and isotopic compositions with relative atomic masses. 2015. https://www.nist.gov/pml/atomic-weights-and-isotopic-compositions-relative-atomic-masses
Gavrichev K.S., Ryumin M.A., Nikiforova G.E. et al. // Russ. J. Gen. Chem. 2017. V. 87. P. 583. [Гавричев К.С., Рюмин М.А., Никифорова Г.Е. и др. // РХЖ. 2017. Т. 87. С. 13.]https://doi.org/10.1134/s1070363217030343
Ryumin M.A., SazonovE.G., Guskov V.N. et al. // Inorg. Mater. 2017. V. 53. P. 728. [Рюмин М.А., Сазонов Е.Г., Гуськов В.Н. и др. // Неорган. материалы. 2017. Т. 53. P. 737.]https://doi.org/10.1134/S0020168517070147
Cashion J.D., Cooke A.H., Leask M.J.M. et al. // J. Mater. Sci. 2017. V. 3. P. 402. https://doi.org/10.1007/bf00550984
Bleaney B., Pfeffer J.Z., Wells M.R. // J. Physics: Condens. Mater. 1997. V. 9. P. 7469. https://doi.org/10.1088/0953-8984/9/35/020
Mensinger H., Jakelski J., Kahle H.G. et al. // J. Phys.: Condens. Matter. V. 5. P. 935. https://doi.org/10.1088/0953-8984/5/7/021
Chirico R.D., Westrum E.F. // J. Chem. Thermodyn.1975. V. 12. P. 71. https://doi.org/10.1016/0021-9614(80)90118-4
Chirico R.D., Westrum E.F. // J. Chem. Thermodyn. 1980. V. 12. P. 311. https://doi.org/10.1016/0021-9614(80)90143-3
Westrum E.F., Komada N. // Thermochim. Acta. 1986. V. 109. P. 11. https://doi.org/10.1016/0040-6031(86)85004-3
Nikiforova G., Khoroshilov A., Tyurin A. et al. // J. Chem. Thermodyn. 2019. V. 132. P. 44. https://doi.org/10.1016/j.jct.2018.12.041
Кукуева Е.В. Дис. … канд. хим. наук. М., 2019. 160 с.
Kondrat'eva O.N., Nikiforova G.E., Tyurin A.V. et al. // Alloys Compd. 2019. V. 779. P. 660. https://doi.org/10.1016/j.jallcom.2018.11.272
Shannon R.D. // Acta Crystallogr. A. 1976. V. 32. P. 751. https://doi.org/10.1107/S0567739476001551
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии