Журнал неорганической химии, 2020, T. 65, № 5, стр. 635-642
Влияние габитуса частиц на теплоемкость и термодинамические функции EuPO4 в области температур 7–1600 K
К. И. Брюханова a, *, Г. Е. Никифорова a, А. В. Тюрин a, О. Н. Кондратьева a, К. С. Гавричев a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: bryuhanova@igic.ras.ru
Поступила в редакцию 19.11.2019
После доработки 04.12.2019
Принята к публикации 24.12.2019
Аннотация
Изучено влияние морфологии частиц на термодинамические свойства ортофосфата европия. Образец EuPO4, не содержащий адсорбированных примесей и воды, с хорошо ограненными частицами в виде вискеров длиной до 6 мкм и диаметром 0.15–0.30 мкм получен гидротермальным методом синтеза. Теплоемкость вискеров EuPO4 исследована в интервале температур 7.12–1319.3 K. Термодинамические функции рассчитаны во всем температурном диапазоне. На основании полученных данных определено влияние габитуса частиц на соотношение энтальпийного и энтропийного факторов и их вклад в свободную энергию ортофосфата европия. Оценен аномальный вклад в теплоемкость вискеров EuPO4 в температурном диапазоне 0–900 K.
ВВЕДЕНИЕ
В настоящее время большое количество исследований посвящено изучению свойств неорганических материалов в зависимости от размера, габитуса, морфологии частиц, а также от качества и состава поверхности вещества [1–7]. Уменьшение размера частиц по одному, двум или трем направлениям может привести к радикальному изменению характеристик материалов. Например, каталитические, оптические и термодинамические свойства металлов [6, 8, 9] или полупроводников [4, 10, 11] меняются при уменьшении кристаллитов по трем направлениям до нанометрового диапазона (0D-частицы). Изменение размера частиц по двум направлениям приводит к образованию удлиненных частиц (1D-частицы: whisker, wire, belt, rod) и позволяет варьировать, в частности, электронные [12], оптические [1, 13], механические [14] и другие свойства материалов [15, 16].
Ортофосфаты редкоземельных элементов (РЗЭ), выбранные в качестве объектов исследования, обладают рядом свойств, которые обеспечивают их применение в различных областях науки и техники [17]. Термо-, химическая и радиационная устойчивость ортофосфатов LnPO4 [18, 19] позволяет использовать их в качестве люминофоров [20, 21], в производстве лазерных материалов, катализаторов [22, 23] и теплозащитных покрытий [24], а также как матрицы для захоронения радиоактивных отходов [25]. Европий заметно отличается от других элементов в ряду лантаноидов. Особенности его электронной конфигурации [Xe]6s24f 7 и внутрицентровых f–f-переходов позволяют использовать европий в качестве флуоресцентных маркеров в биологических системах, а также в качестве примеси-активатора в решетке других соединений с целью повышения эффективности переноса энергии и изменения спектральных характеристик матрицы “хозяина” [20, 25, 26]. Кроме того, электронные конфигурации европия Eu и америция Am [Rn]7s25f 7, как одного из основных компонентов радиоактивных отходов [27], идентичны, а равенство ионных радиусов Eu и Am способствует взаимозаменяемости данных элементов в минералоподобных матрицах структурного типа монацит [28, 29].
Данное исследование направлено на выявление зависимости термодинамических характеристик ортофосфата европия от габитуса частиц, в которых соотношение размера по одному из направлений превышает два других на несколько порядков. Такой анализ полезен для определения термодинамической стабильности и механической целостности соединения в ряде научных и технологических процессов.
Для сравнения свойств использовали ранее изученный ортофосфат европия со сферическими частицами (далее sEuPO4) [30]. Настоящая работа дополнена анализом размера частиц образца и особенностей их поверхности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и исследование образца
Ортофосфат европия с частицами в виде вискеров (wEuPO4) получен гидротермальным методом при 200°С в течение 55 ч (pH 1, Ln : P = 1 : 1). Данная методика подробно изложена для LnPO4 (Ln = La, Pr, Nd, Sm) в работе [31].
Фазовый состав и степень закристаллизованности анализировали с помощью дифрактометра Bruker Advance D8 (CuKα, λср = 1.5418 Ǻ, геометрия на отражение, 2θ = 10°–60°, шаг 0.02°). Все рефлексы на дифрактограмме относятся к ортофосфату европия со структурой монацита и согласуются с базой данных ICDD PDF-2 (карточка JCPDS 84-0919), общая формула EuPO4 (пр. гр. P21/с). Высокое разрешение всех отражений на рентгенограмме позволяет судить о высокой степени кристалличности образца (рис. 1a). Параметры элементарной ячейки определены с помощью программы TOPAS 4.2.
Рис. 1.
Дифрактограмма (а) и кривые нагревания ДСК–ТГ (б) ортофосфата европия с призматическими частицами (wEuPO4).
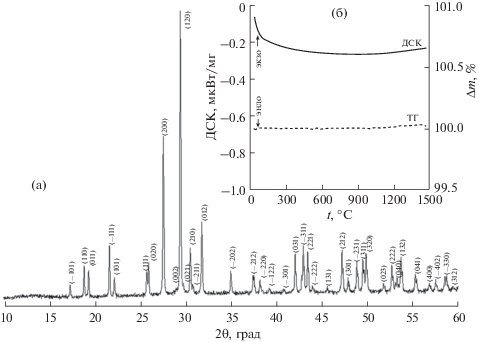
Отсутствие сорбированных примесей и воды, а также термическую устойчивость wEuPO4 вплоть до 1500°С (1773 K) подтверждали методом дифференциальной сканирующей калориметрии (ДСК) и с помощью термогравиметрического (ТГ) анализа (термовесы с чувствительностью 0.025 мкг) на установке синхронного анализа STA 449F1 Jupiter фирмы Netzsch (рис. 1б). В исследованном диапазоне температур на кривых ДСК и ТГ не наблюдается тепловых эффектов и потери массы соответственно. Отсутствие воды в объектах исследования является важным критерием при измерении теплоемкости соединений, поскольку, ранее (при исследовании свойств наночастиц) было показано, что сорбированная на поверхности вода оказывает существенное влияние на величины теплоемкости [2, 32].
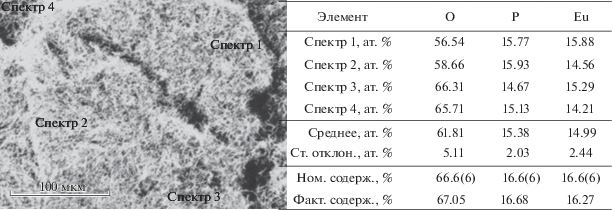
Морфологию поверхности, размер частиц и элементный состав оценивали с помощью растрового электронного микроскопа Carl Zeiss NVision 40 (U = 1 кВ), оснащенного рентгеноспектральным детектором Oxford X-Max (U = 20 кВ). Оба образца содержат хорошо ограненные и закристаллизованные частицы (рис. 2). Образец sEuPO4 содержит спеченные агломераты сферических частиц диаметром 0.4–0.6 мкм. Синтезированный в данной работе образец wEuPO4 содержит вытянутые призматические частицы (вискеры) диаметром 0.15–0.30 мкм и длиной до 6 мкм. Соотношение средней длины вискера к среднему диаметру L/D = 22. Фактическое содержание элементов (Eu, P и O) в вискерах определено по соотношению:
(1)
$\frac{{{\chi }\left( {\text{Э}} \right)}}{{{\chi }\left( {{\text{Eu}}} \right) + {\chi }\left( {\text{P}} \right) + {\chi }\left( {\text{O}} \right)}} \times 100{\text{\% }},$Рис. 2.
Микрофотографии ортофосфата европия с призматическими (а, в) и сферическими (б, г) частицами.

В табл. 1 приведены результаты расчета кристаллографических параметров и оценка размера частиц согласно микрофотографиям РЭМ для обоих образцов.
Таблица 1.
Параметры элементарной ячейки и оценка размера частиц для ортофосфата европия с призматическими (wEuPO4) и сферическими (sEuPO4) частицами
| Параметр | wEuPO4 | sEuPO4 |
|---|---|---|
| a, Å | 6.668 ± 0.004 | 6.647 ± 0.006 |
| b, Å | 6.866 ± 0.003 | 6.867 ± 0.006 |
| c, Å | 6.351 ± 0.004 | 6.337 ± 0.004 |
| β, град | 103.97 ± 0.05 | 103.66 ± 0.06 |
| V, Å3 | 282.2 ± 0.3 | 281.1 ± 0.1 |
| D, мкм | 0.15–0.30 | 0.4–0.6 |
| L, мкм | До 6 | – |
| L/D | ~22 | – |
Измерение теплоемкости
Низкотемпературные зависимости теплоемкости Cp(T) для wEuPO4 получены с помощью теплофизической установки БКТ-3 (“Термис”, Россия). Конструкция установки и методика измерений подробно описаны в [33]. Погрешность измерений теплоемкости стандартов составила ±2% при Т < 15 K, ±0.5% при 15 K < Т < 40 K и ±0.2% от 40 до 340 K.
Высокотемпературная зависимость теплоемкости Cp(T) для wEuPO4 получена на установке синхронного анализа STA 449F1 Jupiter (Netzsch), скорость нагрева 20 град./мин. Согласно калибровке прибора погрешность эксперимента не превышала 2.7%. Особенности съемки можно найти в работе [34].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Теплоемкость и термодинамические характеристики sEuPO4, опубликованные ранее в работе [30], использованы в этом исследовании в качестве данных для сравнительного анализа.
Температурная зависимость теплоемкости wEuPO4, полученная методом адиабатической калориметрии, определена в области 7.12–345.65 K в 121-й точке (табл. 2). Для сглаживания низкотемпературной зависимости Cp(T) использовали уравнение, представляющее линейную комбинацию ортонормированных полиномов (2):
(2)
${{C}_{p}} = \sum\limits_0^m {{{A}_{j}}{{U}^{j}}} ,\,\,\,\,{\text{где}}\,\,\,\,~U = 1 - {{e}^{{ - 0.001Т}}}.$Таблица 2.
Экспериментальные значения теплоемкости Cp [Дж/(моль K)] wEuPO4 в интервале температур 7.12–345.65 K
| № | T, K | Cp | № | T, K | Cp | № | T, K | Cp |
|---|---|---|---|---|---|---|---|---|
| 1 | 7.12 | 0.05798 | 42 | 55.66 | 20.83 | 83 | 155.14 | 75.12 |
| 2 | 7.61 | 0.1309 | 43 | 57.29 | 21.84 | 84 | 158.45 | 76.50 |
| 3 | 8.24 | 0.1811 | 44 | 58.93 | 22.87 | 85 | 161.76 | 77.76 |
| 4 | 8.89 | 0.2050 | 45 | 60.56 | 23.96 | 86 | 165.08 | 79.06 |
| 5 | 9.55 | 0.1756 | 46 | 62.20 | 25.15 | 87 | 168.39 | 80.25 |
| 6 | 10.22 | 0.1970 | 47 | 63.85 | 26.30 | 88 | 171.71 | 81.46 |
| 7 | 10.91 | 0.2628 | 48 | 65.49 | 27.52 | 89 | 175.02 | 82.56 |
| 8 | 11.61 | 0.3138 | 49 | 67.14 | 28.51 | 90 | 178.34 | 83.63 |
| 9 | 12.31 | 0.4605 | 50 | 68.79 | 29.57 | 91 | 181.66 | 84.65 |
| 10 | 13.03 | 0.6100 | 51 | 70.44 | 30.62 | 92 | 184.97 | 85.65 |
| 11 | 13.77 | 0.6414 | 52 | 72.32 | 31.93 | 93 | 188.28 | 86.55 |
| 12 | 14.52 | 0.7032 | 53 | 74.38 | 33.39 | 94 | 191.60 | 87.52 |
| 13 | 15.27 | 0.8478 | 54 | 76.44 | 35.03 | 95 | 194.91 | 88.42 |
| 14 | 16.09 | 1.0574 | 55 | 78.50 | 36.65 | 96 | 198.22 | 89.33 |
| 15 | 16.86 | 1.271 | 56 | 80.57 | 38.11 | 97 | 201.53 | 90.12 |
| 16 | 17.63 | 1.490 | 57 | 82.64 | 39.29 | 98 | 205.24 | 91.35 |
| 17 | 18.41 | 1.745 | 58 | 84.71 | 40.12 | 99 | 209.36 | 92.27 |
| 18 | 19.19 | 1.967 | 59 | 86.79 | 41.88 | 100 | 213.48 | 93.95 |
| 19 | 19.98 | 2.238 | 60 | 88.86 | 43.77 | 101 | 217.59 | 95.05 |
| 20 | 21.28 | 2.773 | 61 | 90.93 | 44.87 | 102 | 250.36 | 104.4 |
| 21 | 22.73 | 3.263 | 62 | 93.01 | 45.98 | 103 | 254.43 | 105.6 |
| 22 | 24.20 | 3.830 | 63 | 93.52 | 46.72 | 104 | 258.49 | 106.5 |
| 23 | 25.68 | 4.141 | 64 | 95.58 | 47.77 | 105 | 262.54 | 107.6 |
| 24 | 27.18 | 4.839 | 65 | 97.64 | 48.91 | 106 | 266.58 | 108.4 |
| 25 | 28.69 | 5.613 | 66 | 99.70 | 50.01 | 107 | 270.61 | 109.4 |
| 26 | 30.21 | 6.463 | 67 | 102.37 | 51.35 | 108 | 274.63 | 110.3 |
| 27 | 31.74 | 7.339 | 68 | 105.65 | 52.66 | 109 | 278.64 | 111.2 |
| 28 | 33.28 | 8.200 | 69 | 108.93 | 54.35 | 110 | 282.63 | 112.2 |
| 29 | 34.84 | 8.756 | 70 | 112.21 | 55.96 | 111 | 286.62 | 113.0 |
| 30 | 36.40 | 9.750 | 71 | 115.50 | 57.60 | 112 | 290.59 | 113.9 |
| 31 | 37.97 | 10.68 | 72 | 118.79 | 59.20 | 113 | 294.55 | 114.7 |
| 32 | 39.54 | 11.44 | 73 | 122.08 | 60.68 | 114 | 298.49 | 115.4 |
| 33 | 41.12 | 12.32 | 74 | 125.37 | 62.13 | 115 | 302.94 | 116.6 |
| 34 | 42.71 | 13.10 | 75 | 128.69 | 63.65 | 116 | 309.31 | 118.6 |
| 35 | 44.31 | 14.00 | 76 | 131.99 | 65.13 | 117 | 316.66 | 119.8 |
| 36 | 45.94 | 14.92 | 77 | 135.29 | 66.60 | 118 | 323.96 | 121.1 |
| 37 | 47.55 | 15.91 | 78 | 138.59 | 68.05 | 119 | 331.21 | 122.2 |
| 38 | 49.16 | 16.92 | 79 | 141.90 | 69.47 | 120 | 338.42 | 123.6 |
| 39 | 50.78 | 17.90 | 80 | 145.21 | 70.99 | 121 | 345.65 | 125.4 |
| 40 | 52.41 | 18.91 | 81 | 148.52 | 72.38 | |||
| 41 | 54.03 | 19.83 | 82 | 151.83 | 73.73 |
Значения коэффициентов полинома Aj представлены в табл. 3.
Таблица 3.
Коэффициенты Aj уравнения (2)
| j | Aj, Дж/(K моль) |
|---|---|
| 0 | 1.49 |
| 1 | –311.625 |
| 2 | 20 985.84 |
| 3 | –199 763.86 |
| 4 | 902 972.8 |
| 5 | –1 999 487 |
| 6 | 1 740 280 |
| σ2 | 0.122860 |
Экспериментальные зависимости Cp(T) wEuPO4, определенные методом ДСК в области температур 304.3–1319.3 K в 182 точках, могут быть описаны с помощью уравнения Майера–Келли (3):
(3)
$\begin{gathered} {{C}_{p}}\left( {w{\text{EuP}}{{{\text{O}}}_{4}}} \right) = 136.7114935 + \\ + \,\,0.03004466Т~--2.63451298 \times {{10}^{6}}{{Т}^{{ - 2}}}, \\ \end{gathered} $На сглаженной кривой температурной зависимости теплоемкости wEuPO4 в изученном интервале не наблюдается выраженных аномалий, а значения Cp закономерно увеличиваются с ростом температуры (рис. 4). Следует отметить увеличение полученных значений Cp(T) wEuPO4 по сравнению с данными [30] начиная от 280 K, разница при этом достигает 3 Дж/(моль K) (~3%) при комнатной температуре и увеличивается до 15 Дж/(моль K) (~10%) при 1600 K.
Рис. 4.
Теплоемкость ортофосфата европия с призматическими (1) и сферическими (2) частицами [30] в интервале температур 0–1600 K; разность между Cp(w) и Cp(s) (3).
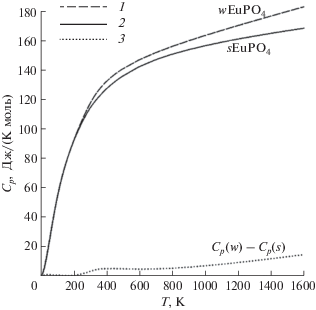
Стыковка низко- и высокотемпературной ветвей теплоемкости была проведена на участке 290–320 K. Значения производных теплоемкостей на этом участке оказались равны при 310 K с разницей 0.00021, поэтому эта температура была выбрана в качестве точки стыка.
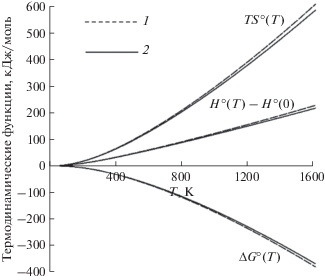
В изученном интервале температур на основании полученных данных по теплоемкости были рассчитаны термодинамические функции для wEuPO4: энтропия S°(T), приращение энтальпии ΔH°(T) и энергия Гиббса ΔG°(T). Стандартные термодинамические функции при T = 298.15 K для обоих образцов приведены в табл. 4. Влияние габитуса частиц на термодинамические характеристики ортофосфата европия представлено на рис. 5. Отмечено, что энтропия и приращение энтальпии wEuPO4 растут более интенсивно с повышением температуры. Разница энтропийного вклада достигает 22.2 кДж/моль, а энтальпийного – 10.7 кДж/моль при 1600 K. Преобладание энтропийного фактора при расчете энергии Гиббса увеличивает термодинамическую стабильность wEuPO4. Однако, как было отмечено в [34], можно говорить лишь об относительной стабильности вискеров, так как при высоких температурах будут преобладать кинетические и диффузионные процессы.
Таблица 4.
Стандартные термодинамические функции EuPO4 с призматическими (wEuPO4) и сферическими (sEuPO4) [30] частицами при 298.15 K
| Образец | $C_{p}^{^\circ }$, Дж/(K моль) | S°, Дж/(K моль)* | ΔH°, кДж/моль |
|---|---|---|---|
| wEuPO4 | 115.72 ± 0.18 | 125.22 ± 0.79 | 19.34 ± 0.10 |
| sEuPO4 | 113.05 ± 0.14 | 122.82 ± 0.67 | 19.10 ± 0.09 |
Рис. 5.
Термодинамические функции ТS°(T), ΔH°(T), ΔG°(T) [кДж/моль] для wEuPO4 (1) и sEuPO4 (2) [30].
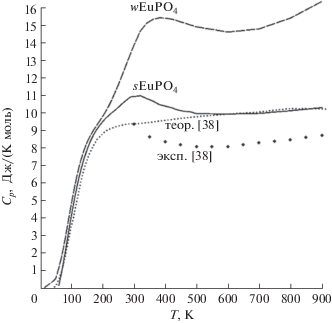
Аномальный вклад в теплоемкость был оценен как разность $C_{p}^{^\circ }(T)$ EuPO4 и решеточной теплоемкости этого соединения:
где Cp и Clat – измеренная и решеточная теплоемкость вещества соответственно.Для диамагнитных ортофосфатов лантана (4f 0) и лютеция (4f 14) эта аномалия отсутствует, а для гадолиния (4f 7) реализуется только при очень низких температурах (ниже 10 K), поэтому их теплоемкость может быть использована для оценки Clat. Решеточная теплоемкость была рассчитана по формуле Веструма [35] как линейная комбинация теплоемкостей изоструктурных соединений LaPO4 [36] и GdPO4 [37]:
(5)
$\begin{gathered} {{C}_{{lat}}}\left( {{\text{EuP}}{{{\text{O}}}_{4}}} \right) = f~{{C}_{p}}\left( {{\text{GdP}}{{{\text{O}}}_{4}}} \right) + \\ + \,\,\left( {1 - f} \right){{C}_{p}}\left( {{\text{LaP}}{{{\text{O}}}_{4}}} \right), \\ \end{gathered} $(6)
$f = \frac{{V\left( {{\text{EuP}}{{{\text{O}}}_{4}}} \right){\text{\;}}--{\text{\;}}V\left( {{\text{LaP}}{{{\text{O}}}_{4}}} \right)}}{{V\left( {{\text{GdP}}{{{\text{O}}}_{4}}} \right){\text{\;}}--{\text{\;}}V\left( {{\text{LaP}}{{{\text{O}}}_{4}}} \right)}} = 0.92884.$Полученные таким образом зависимости Can(T) для wEuPO4 и sEuPO4 [30] в интервале температур 0–900 K представлены на рис. 6. Для сравнения на рисунке приведены данные работы [38], полученные из высокотемпературных измерений приращения энтальпии (эксп) и рассчитанные исходя из расщепления энергетических f-подуровней Eu3+ (теор). Видно, что до ∼200 K температурные зависимости аномальной теплоемкости очень близки, а при более высоких температура наблюдается пологий максимум, температура и амплитуда которого для wEuPO4 и sEuPO4 существенно отличаются: 321 K, 10.9 Дж/(K моль), и 386 K, 15.5 Дж/(K моль) соответственно. Зависимость для sEuPO4 находится в удовлетворительном согласии с аналогичными литературными зависимостями [38]. Известно, что образцы, полученные в работе [38] золь-гель методом с последующим отжигом, содержат сферические частицы, как образец sEuPO4 и полученные аналогичным образом изоструктурные соединения LnPO4 [31].
ЗАКЛЮЧЕНИЕ
Подобрана методика гидротермального синтеза для получения ортофосфата европия с вытянутыми призматическими частицами (вискерами). Подтверждены фазовый и элементный состав полученного соединения, а также отсутствие адсорбированных примесей и воды. Изучение образца с помощью адиабатической и дифференциальной сканирующей калориметрии показало, что соединение wEuPO4 не имеет фазовых превращений в диапазоне температур 7.12–1319.3 K. Рассчитаны термодинамические функции в изученном интервале температур. Оценено влияние габитуса частиц на теплоемкость и термодинамические функции ортофосфата европия. Показано, что Cp(T) wEuPO4 увеличивается по сравнению с Cp(T) sEuPO4 начиная с 280 K, разница достигает 10%.
Результаты данной работы помогут исследователям оценить различные вклады в теплоемкость, а также значительно расширить термодинамические исследования по изучению влияние габитуса частиц на свойства материалов.
Список литературы
Acevedo-Pena P., Gonzalez I. // Procedia Chem. 2014. V. 12. P. 34. https://doi.org/10.1016/j.proche.2014.12.038
Spencer E.C., Ross N.L., Parker S.F. et al. // J. Phys. Chem. 2011. V. 115. P. 21 105. https://doi.org/org/10.1021/jp202518p
Zhang H., Zhu D., Grasso S. et al. // Ceram. Int. 2018. V. 44. P. 14 967. https://doi.org/10.1016/j.ceramint.2018.05.072
Alivisatos A.P. // Sci. 1996. V. 271. № 5251. P. 933. https://doi.org/10.1126/science.271.5251.933
Chen R., Jia W., Wang Yu. et al. // Mater. Lett. 2019. V. 243. P. 66. https://doi.org/10.1016/j.matlet.2019.02.018
Kim E.-H., Lee B.-J. // Met. Mater. Int. 2009. V. 15. P. 531. https://doi.org/10.1007/s12540-009-0531-8
Arinicheva Y., Clavier N., Neumeier S. et al. // J. Eur. Ceram. Soc. 2018. V. 38. P. 227. https://doi.org/10.1016/j.jeurceramsoc.2017.08.008
Bell A.T. // Sci. 2003. V. 299. P. 1688. https://doi.org/10.1126/science.1083671
Sun J., Simon S.L. // Thermodyn. Acta. 2007. V. 463. P. 32. https://doi.org/10.1016/j.tca.2007.07.007
Shenoi R.V., Attaluri R.S., Siroya A. et al. // J. Vac. Sci. Technol. B. 2008. V. 26. № 3. P. 1136. https://doi.org/10.1116/1.2835063
Gusev A.I., Sadovnikov S.I. // Thermodyn. Acta. 2018. V. 660. P. 1. https://doi.org/org/10.1016/j.tca.2017.12.013
Yu L., Song H., Liu Zh. et al. // J. Phys. Chem. B. 2005. V. 109. P. 11 450. https://doi.org/10.1021/jp045238e
Yu L., Li D., Yue M. et al. // Chem. Phys. 2006. V. 326. P. 478. https://doi.org/10.2478/s11696-010-0088-5
Gupta M., Dhawan P.K. Verma S.K. et al. // J. Acoustics. 2015. V. 5. P. 218. https://doi.org/10.4236/oja.2015.54017
Rajesh K., Shajesh P., Seidel O. et al. // Adv. Funct. Mater. 2007. V. 17. P. 1682. https://doi.org/10.1002/adfm.200600794
Zhang X.Y., Dai J.Y., Ong H.C. // J. Phys. Chem. 2011. V. 1. P. 6. https://doi.org/10.4236/ojpc.2011.11002
Clavier N., Podor R., Dacheux N. // J. Eur. Ceram. Soc. 2011. V. 21. P. 941. https://doi.org/10.1016/j.jeurceramsoc.2010.12.019
Firsching F.H., Brune S.N. // J. Chem. Eng. Data. 1991. V. 36. № 1. P. 93. https://doi.org/10.1021/je00001a028
Hikichi Y., Nomura T. // J. Am. Ceram. Soc. 1987. V. 70. № 10. P. C252. https://doi.org/10.1111/j.1151-2916.1987.tb04890.x
Ruan Y., Xiao Q., Luo W. // Nanotechnol. 2011. V. 22. P. 275 701. https://doi.org/10.1088/0957-4484/22/27/275701
Yang M., You H., Liu K. et al. // Inorg. Chem. 2010. V. 49. P. 4996. https://doi.org/10.1021/ic100099w
Onoda H., Nariai H., Moriwaki A. et al. // J. Mater. Chem. 2002. V. 12. P. 1754. https://doi.org/10.1039/b110121h
Nguyen T.T.N., Mauge V., Belliere-Baca V. et al. // Appl. Catal. A. 2015. V. 504. P. 4. https://doi.org/10.1016/j.apcata.2014.12.026
Sudre O.H., Marshall D.B., Morgan P.E.D. Monazite-based thermal barrier coatings, United States Patent (US 6,863,999 B1).
Wang X., Teng Yu., Huang Y. et al. // J. Nucl. Mater. 2014. V. 451. P. 147. https://doi.org/10.1016/j.jnucmat.2014.03.049
Di W., Ren X., Shirahata N. et al. // Cryst. Eng. Comm. 2011. V. 13. P. 5226. https://doi.org/10.1039/c1ce05473b
Oelkers E.H., Montel J.-M. // Elements. 2008. V. 4. P. 113. https://doi.org/10.2113/gselements.4.2.113
Romanchuk A.Yu., Gracheva N.N., Bryukhanova K.I. et al. // Mendeleev Commun. 2018. V. 28. P. 303. https://doi.org/10.1016/j.mencom.2018.05.025
Shannon R.D. // Acta Crystallogr. 1976. V. A32. P. 751. https://doi.org/10.1107/S0567739476001551
Gavrichev K.S., Ryumin M.A., Tyurin A.V. et al. // Chem. Thermodyn. Thermochem. 2009. V. 83. № 6. P. 1032. https://doi.org/10.1134/S0036024409060053
Bryukhanova K.I., Nikiforova G.E., Gavrichev K.S. // Nanosystems: Phys., Chem., Math. 2016. V. 7. № 3. P. 451. https://doi.org/10.17586/22208054201673451458
Shi Q., Boerio-Goates J., Woodfield K. et al. // J. Phys. Chem. 2012. V. 2012. P. 3910. https://doi.org/10.1021/jp2088862
Varushchenko R.M., Druzhinina A.I., Sorkin E.L. // J. Chem. Thermodyn. 1997. V. 29. P. 623. https://doi.org/10.1006/jcht.1996.0173
Bryukhanova K.I., Nikiforova G.E., Khoroshilov A.V. et al. // J. Chem. Thermodyn. 2018. V. 120. P. 79. https://doi.org/10.1016/j.jct.2018.01.012
Westrum Jr. E.F., Lecture R. // J. Chem. Thermodyn. 1983. V. 15. P. 305. https://doi.org/10.1016/0021-9614(83)90060-5
Gavrichev K.S., Ryumin M.A., Tyurin A.V. et al. // Thermochim. Acta. 2008. V. 474. P. 47. https://doi.org/10.1016/j.tca.2008.05.004
Gurevich V.M., Ryumin M.A., Tyurin A.V. et al. // Geochem. Itnern. 2012. V. 50. № 8. P. 702. https://doi.org/10.1134/S0016702912060031
Popa K., Konings R.J.M. // Thermochim. Acta. 2006. V. 445. P. 49. https://doi.org/10.1016/j.tca.2006.03.023
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии