Журнал неорганической химии, 2020, T. 65, № 4, стр. 475-481
Внутрикомплексные соединения диоксомолибдена(VI) с алкогольиминами ароматических о-оксиальдегидов. Кристаллическая структура 2-гидроксинафтилиденмоноэтанолимина (Н2L) и сольватированного комплекса [MoO2(L) · С5Н5N]
В. С. Сергиенко a, b, *, В. Л. Абраменко c, М. Д. Суражская a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119071 Москва, Ленинский пр-т, 31, Россия
b Всероссийский институт научной и технической информации РАН
125190 Москва, ул. Усиевича, 20, Россия
c Одесский национальный университет им. И.И. Мечникова
65082 Одесса, ул. Дворянская, 2, Украина
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 09.10.2019
После доработки 20.11.2019
Принята к публикации 27.11.2019
Аннотация
Синтезировано основание Шиффа, производное 2-гидроксинафтальдегида и моноэтаноламина (H2L), и внутрикомплексное соединение диоксомолибдена(VI) [MoO2(L) · С5Н5N] (I). Строение H2L и I установлено методами ИК-спектроскопии и РСА. В моноядерной молекуле I атом Мо имеет октаэдрическую координацию двумя оксолигандами (Мо=О 1.683(4) и 1.697(3) Å), двумя атомами О депротонированных гидроксогрупп спиртового (Мо–О(4) 1.919(4) Å) и альдегидного (Мо–О(3) 1.962(3) Å) фрагментов, а также атомом N тридентатного бис(хелатного) двухзарядного лиганда L2– (Mo–NL 2.262(4) Å) и атомом N молекулы пиридина (Mo–NPy 2.496(4) Å). Связи Mo–NL и Mo–NPy существенно удлинены вследствие структурного проявления трансвлияния кратносвязанных оксолигандов. Молекула H2L в свободном состоянии кристаллизуется в хиноидной (кето-аминной) таутомерной форме, а в комплексе I координирована в дважды депротонированной бензоидной (енол-иминной) форме.
ВВЕДЕНИЕ
Интерес исследователей к комплексным соединениям диоксомолибдена(VI) с азометинами – основаниями Шиффа – обусловлен возможностью их практического использования в качестве эффективных катализаторов в реакциях эпоксидирования олефинов при комнатной температуре [1–7], ингибиторов в реакциях окисления альдегидов кислородом воздуха [8], полифункциональных присадок к смазочным материалам [9, 10], а также в качестве моделей для изучения механизма действия молибденсодержащих энзимов в биосистемах [11–15]. В теоретическом плане оксиазометины представляют интерес как прототропные системы, позволяющие получать на их основе комплексы различного типа и строения [16].
Салицилиденалкогольимины (Н2L) – производные ароматических о-оксиальдегидов и аминоспиртов – представляют собой потенциально тридентатные двухосновные о-оксиазометины и при взаимодействии с солями d-металлов могут образовывать несколько типов внутрикомплексных соединений (ВКС) мономерного ([МLn], [М(НL)n]), ди- ([МLn]2) или олигомерного ([МLn]m) строения, проявляя при этом би- или тридентатную функцию [17–21]. Для диоксомолибдена(VI) с алкогольиминами к настоящему времени получены ВКС, в которых лиганд координирован центральным атомом тридентатно в дважды депротонированной форме.
В работе [22] детально рассмотрены методы получения комплексов диоксомолибдена(VI) с салицилиденалкогольиминами двух типов: МоО2L и МоО2L · Z, где Z – нейтральные донорные молекулы. На основании данных ИК- и ПМР-спектроскопии авторы [22] пришли к выводу, что комплексы МоО2L представляют собой полимеры с мостиковой связью Мо=О → Мо, легко разрушаемой при взаимодействии с Z с образованием мономеров МоО2L · Z. Отмечена подвижность лигандов Z – при нагревании на воздухе они отщепляются и при определенных условиях могут быть замещены на другие О- или N-доноры.
Позже [17, 18] по результатам РСА мы установлили, что сольватированные комплексы диоксомолибдена(VI) с замещенными салицилиденмоноэтанолиминами МоО2L · MeOH имеют цис-октаэдрическое строение с координацией лигандов через азометиновый атом азота и два атома кислорода депротонированных гидроксогрупп альдегидного и спиртового фрагментов. Шестую вершину в октаэдре занимает атом кислорода молекулы метанола. При этом молекулы в структурах ВКС попарно объединены в центросимметричные псевдодимеры почти линейными межмолекулярными водородными связями. К аналогичным выводам о строении сольватокомплексов МоО2L · Solv пришли авторы [23] на основании данных РСА ряда ВКС диоксомолибдена(VI) с монозамещенными салицилиденалкогольиминами. Для ВКС МоО2L методом РСА ими подтверждено линейное полимерное строение.
Данные РСА свидетельствуют о том, что связи донорных молекул Solv, в частности метанола, с атомом молибдена существенно удлинены (ослаблены) вследствие статистического трансвлияния кратносвязанных оксолигандов цис-МоО2-группы, что объясняет легкость десольватации комплексов с образованием олигомеров, разрушаемых при добавлении донорных растворителей [17, 18]. В настоящей работе представлены результаты ИК-спектроскопического и рентгеноструктурного исследования строения алкогольимина – производного 2-гидроксинафтальдегида и моноэтаноламина (H2L) – и нового сольватированного комплекса диоксомолибдена(VI) [MoO2L · С5Н5N] (I) (С5Н5N – молекула пиридина).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез Н2L проводили конденсацией 2-гидроксинафтальдегида и моноэтаноламина в кипящем этаноле. Выход соединения составил 78%. После перекристаллизации из этанола вещество представляет собой желтые иглы, tпл = 155–156°С.
ИК-спектры H2L (ν, см–1): 3310 ш, 1645, 1620, 1545, 1515, 1490, 1405, 1360, 1320, 1260, 1230, 1210, 1182, 1164, 1143, 1095, 1070, 1028, 970, 940, 874, 830, 743, 720, 635, 552, 535, 498, 440.
Синтез I осуществляли методом лигандного обмена между ацетилацетонатом молибденила и азометином в присутствии пиридина [18]. К горячему раствору 0.326 г (0.001 моля) МоО2(Асас)2 в 20 мл метанола добавляли по каплям метанольный раствор 0.001 моля азометина, кипятили реакционную смесь в течение 10–15 мин, добавляли 2–3 мл пиридина, упаривали раствор до объема 10 мл и оставляли при комнатной температуре для кристаллизации в эксикаторе над СаСl2. Выход комплекса составил 85%. При перекристаллизации комплекса [MoO2L · МеОН] из пиридина также образуется соответствующий кристаллический сольватокомплекс [MoO2L · С5Н5N] (I).
| С | Н | N | Мо | |
|---|---|---|---|---|
| Найдено, %: | 51.58; | 3.92; | 6.53; | 22.78. |
| Для С18Н16МоN2O4 | ||||
| вычислено, %: | 51.44; | 3.84; | 6.67; | 22.83. |
ИК-спектры [MoO2L · С5Н5N] (ν, см–1): 1634 пл, 1626, 1590, 1550, 1507, 1345, 1295, 1255, 1245, 1188, 1165, 1144, 1094, 1047, 982, 968, 928, 910, 900, 827, 794, 770, 752, 720, 700, 643, 575, 490, 450.
Элементный анализ комплекса на содержание молибдена проводили, как и в [17], по стандартной методике. Анализ соединений на содержание углерода, водорода и азота проводили на анализаторе Carlo-Erba 1106 Elemental Analyzer CHN.
ИК-спектры азометина и комплекса регистрировали на спектрометре ИКС-29 в области 3600–400 см–1 (суспензии в вазелиновом масле).
РСА H2L и I выполнен на автоматическом дифрактометре Enraf–Nonius CAD 4 при 293(2) K (СuKα-излучение, λ = 1.5418 Å, графитовый монохроматор, Ω-сканирование). Структуры расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов (SHELXL-97 [24]). Атомы Н(1N) и Н(2О) в структуре Н2L уточнены изотропно, остальные атомы водорода в обеих структурах помещены в рассчитанные позиции и уточнены по схеме “наездника”. Кристаллографические характеристики в структуре H2L и I приведены в табл. 1, основные длины связей и валентные углы – в табл. 2. Структурные характеристики для H2L и I депонированы в Кембриджском банке структурных данных (CCDC № 195 340 и 195 341 соответственно).
Таблица 1.
Кристаллографические характеристики, данные эксперимента и уточнения структуры H2L и I
| Параметр | H2L | I |
|---|---|---|
| М | 215.24 | 420.27 |
| Сингония, пр. гр. | Моноклинная, С2/с | Ромбическая, Р212121 |
| Параметры ячейки: | ||
| a, Å | 16.0332(10) | 6.3282(10) |
| b, Å | 4.9749(10) | 11.361(2) |
| c, Å | 28.0859(10) | 23.268(5) |
| β, град | 104.982(10) | |
| V, Å3 | 2164.1(5) | 1672.8(5) |
| Z, ρвыч, г/см3 | 8, 1.321 | 4, 1.669 |
| μ, мм–1 | 0.724 | 6.645 |
| F(000) | 912 | 848 |
| Размер кристалла, мм | 0.15 × 0.08 × 0.03 | 0.25 × 0.10 × 0.05 |
| θmin–θmax, град | 5.71–64.96 | 4.33–69.94 |
| Интервалы индексов: | –18 ≤ h ≤ 18 | –7 ≤ h ≤ 7 |
| –5 ≤ k ≤ 5 | –13 ≤ k ≤ 13 | |
| –33 ≤ l ≤ 33 | –28 ≤ l ≤ 28 | |
| Число отражений | ||
| измеренных | 6675 | 12237 |
| независимых | 1831 | 3166 |
| Rint | 0.1133 | 0.1704 |
| Комлектность по θ, % | 99.99 | 99.99 |
| GOOF | 0.972 | 1.048 |
| Тmin, Тmax | 0.8992, 0.9786 | 0.2874, 0.7323 |
| N (число уточняемых параметров) | 154 | 227 |
| Rhkl, I ≥ 2σ(I) | R1 = 0.0487, wR2 = 0.1061 | R1 = 0.0360, wR2 = 0.0887 |
| Rhkl (по всем отражениям) | R1 = 0.1029, wR2 = 0.1291 | R1 = 0.0385, wR2 = 0.0903 |
| Остаточная электронная плотность ρmax/ ρmin, e/Å3 | 0.199, –0.198 | 0.767, –0.989 |
Таблица 2.
Основные межатомные расстояния (Å) и валентные углы (град) в структуре соединений H2L и I
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| H2L | |||
| N(1)–C(3) | 1.294(3) | C(3)N(1)C(2) | 124.9(2) |
| N(1)–C(2) | 1.457(3) | N(1)C(3)C(4) | 124.0(2) |
| C(5)–O(1) | 1.283(3) | N(1)C(2)C(1) | 111.5(2) |
| C(1)–O(2) | 1.417(3) | O(1)C(5)C(4) | 122.4(2) |
| O(1)C(5)C(6) | 119.82(19) | ||
| O(2)C(1)C(2) | 109.5(16) | ||
| I | |||
| Mo(1)–O(2) | 1.683(4) | O(2)Mo(1)O(1) | 106.6(2) |
| Mo(1)–O(1) | 1.697(3) | O(2)Mo(1)O(4) | 100.23(17) |
| Mo(1)–O(4) | 1.919(4) | O(1)Mo(1)O(4) | 97.15(16) |
| Mo(1)–O(3) | 1.962(3) | O(2)Mo(1)O(3) | 99.97(16) |
| Mo(1)–N(2) | 2.262(4) | O(1)Mo(1)O(3) | 96.17(16) |
| Mo(1)–N(1) | 2.469(4) | O(4)Mo(1)O(3) | 151.44(15) |
| O(4)–C(16) | 1.426(5) | O(2)Mo(1)N(2) | 161.62(18) |
| N(1)–C(11) | 1.325(8) | O(1)Mo(1)N(2) | 91.70(16) |
| C(18)–N(2) | 1.294(5) | O(4)Mo(1)N(2) | 75.57(13) |
| N(2)–C(17) | 1.479(7) | O(3)Mo(1)N(2) | 78.90(14) |
| O(3)–C(2) | 1.340(5) | O(2)Mo(1)N(1) | 84.91(17) |
| O(1)Mo(1)N(1) | 168.28(15) | ||
| O(4)Mo(1)N(1) | 82.51(14) | ||
| O(3)Mo(1)N(1) | 79.40(14) | ||
| N(2)Mo(1)N(1) | 76.84(13) | ||
| C(2)O(3)Mo(1) | 139.5(3) | ||
| C(16)O(4)Mo(1) | 116.9(3) | ||
| O(4)C(16)C(17) | 107.1(4) | ||
| O(3)C(2)С(1) | 123.7(4) | ||
| O(3)C(2)C(3) | 115.3(4) | ||
| C(11)N(1)C(15) | 117.6(5) | ||
| C(11)N(1)Mo(1) | 120.9(3) | ||
| C(15)N(1)Mo(1) | 121.6(4) | ||
| N(2)C(18)C(1) N(1)C(11)C(12) |
124.1(5) 124.2(5) |
||
| N(1)C(15)C(14) | 121.4(6) | ||
| C(18)N(2)C(17) | 118.2(4) | ||
| C(18)N(2)Mo(1) | 130.7(4) | ||
| C(17)N(2)Mo(1) | 111.0(2) | ||
| N(2)C(17)C(16) | 106.1(4) | ||
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспериментально установлено, что состав комплекса I не зависит от соотношения реагирующих компонентов и природы растворителей. Проведение реакции в этилацетате, ацетонитриле или этаноле в присутствии пиридина приводит к образованию комплекса одного состава – [MoO2(L) · С5Н5N], представляющего собой кристаллы желто-лимонного цвета, нерастворимые в неполярных и малополярных растворителях, но растворимые при нагревании в диметилформамиде, диметилсульфоксиде, пиридине. Выдерживание комплекса в изотермическом режиме при 150°С приводит к его десольватации. При температуре свыше 300°С комплекс разлагается, не плавясь.
В ИК-спектре I наблюдается характерное для внутрикомплексных соединений металлов с азометинами низкочастотное смещение полосы валентных колебаний связи С=N на 11 см–1 по сравнению с ее положением в спектре свободного лиганда (1645 см–1). В области 3100–3600 см–1 в спектре I исчезает широкая интенсивная полоса поглощения валентных колебаний ОН-групп спиртового фрагмента с максимумом ~3300 см–1, что с учетом результатов элементного анализа указывает на участие в координации депротонированной спиртовой гидроксогруппы. В спектре комплекса наблюдается смещение серии полос в области ~1000–1605 см–1, отвечающих колебаниям связей гетерокольца координированной молекулы пиридина [25]. Интенсивные полосы при 928 и 900 см–1 относятся к симметричным и асимметричным валентным колебаниям связи Мо=О цис-МоО2-группы. В области низких частот в ИК-спектре комплекса I появляются новые полосы поглощения при 643 и 575 см–1, которые следует отнести к валентным колебаниям связей Мо–NL и Мо–ОL соответственно [18].
На основании экспериментальных результатов с учетом литературных данных [10, 17–19, 26–30] можно предположить, что комплекс I имеет типичное для диоксокатионов группы VIВ октаэдрическое строение с двумя кратносвязанными оксолигандами в цис-положении друг к другу. В транс-позициях к оксолигандам, в соответствии с “правилом самосогласованности” [26], расположены донорные атомы N азометиновой группы и координированной молекулы пиридина. Остальные две вершины октаэдра в ВКС занимают два атома О депротонированных гидроксогрупп альдегидного и спиртового фрагментов в цис-позициях к оксолигандам. Результаты РСА комплекса I подтверждают это предположение.
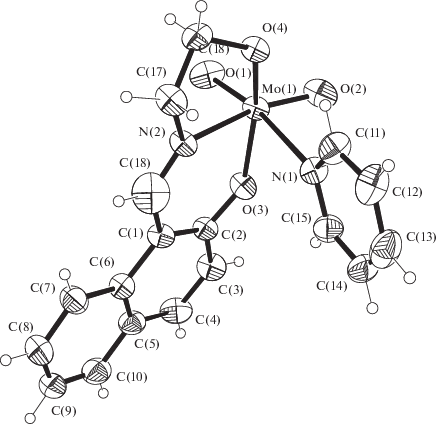
В моноядерной молекуле (рис. 1) атом молибдена имеет октаэдрическую координацию двумя оксолигандами О(1), О(2), двумя атомами кислорода О(3), О(4) и атомом азота N(2) тридентатного бис(хелатного) двухзарядного лиганда (L)2–, а также атомом N(1) молекулы пиридина (Pу). В транс-позициях к лигандам О(оксо) расположены, в соответствии с “правилом самосогласованности” [26], нейтральные атомы N(2) и N(1) лигандов L и Py соответственно. Связи Mo–N(2) (2.262(4) Å) и Мо–N(1) (2.469(4) Å) существенно удлинены вследствие структурного проявления трансвлияния кратносвязанных оксолигандов. При этом связи Мо–N(1) и Mo–N(2) до атомов азота пиридина и лиганда L существенно (на 0.207 Å) различаются по длине. Связи Мо–О(оксо) (1.683(4), 1.697(3) Å) типичны по длине и соответствуют увеличенной кратности. Связи Мо–О(3,4)(L)цис достаточно короткие – 1.962(4), 1.919(3) Å. Атом Мо смещен из центра октаэдра МоО4N2 к ребру О(1,оксо)–О(2,оксо): валентные углы О(оксо)Мо(О,N)цис, за исключением (О(2)МоN(1) 84.9(2)°), больше идеальной величины 90° (91.7(2)°–100.2(2)°), противолежащие углы (О,N)Mo(O,N) заметно меньше 90° (75.6(1)–82.5(1)°). Самый большой валентный угол в структуре I – О(1)МоО(2) (106.6°) – увеличен из-за отталкивания кратносвязанных оксолигандов. Углы между противолежащими донорными атомами лигандов О(1)МоN(1) (168.3(2)°), О(2)МоN(2) (161.6(2)°), O(3)MoO(4) (151.4(2)°) в разной степени отклоняются от идеального значения 180°. При координации тридентатного лиганда L с атомом металла замыкаются два сопряженных по связи Мо–N(2) хелатных цикла: шестичленный МоNC3O и пятичленный MoNC2O. В структуре I нет коротких межмолекулярных расстояний, меньших сумм ван-дер-ваальсовых радиусов соответствующих атомов.
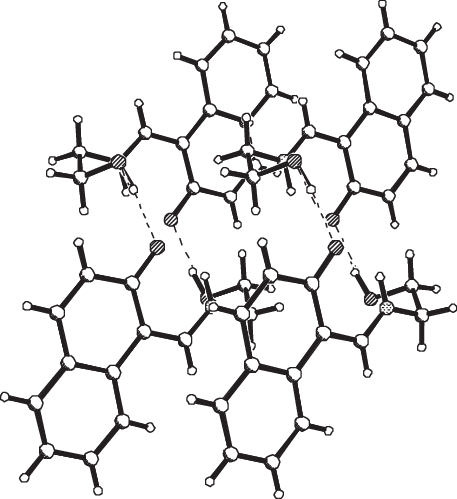
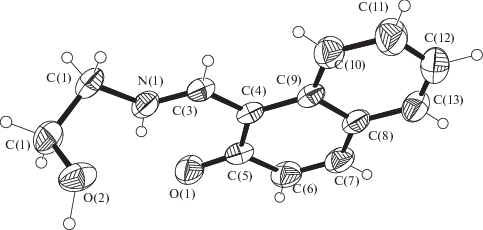
Строение молекулы H2L показано на рис. 2. В структуре имеется достаточно прочная внутримолекулярная водородная связь (ВВС) N(1)–H(1N)…O(1) (N(1)–H(1N) 0.93(3), H(1N)…O(1) 1.82(3), N(1)…O(1) 2.563(3) Å, угол N(1)H(1N)O(1) 136(2)°), замыкающая шестичленный Н-цикл NHOC3. Аналогичные ВВС N–H…O (и Н-циклы NHOC3) присутствуют в молекулах 3-метокси-5-бром-Х (HL1) и 3-нитро-Х (HL2) [31], где X = салицилиден-2-фурфурилимин (N–H 0.86 и 1.07, H…O 1.91 и 1.87, N…O 2.595 и 2.624 Å, углы NHO 135° и 124° для HL1 и HL2 соответственно). Отметим, что повышенная кратность связей N(1)–C(3) (1.294(3) Å) и О(1)–С(5) (1.283(3) Å) в структуре H2L свидетельствует о реализации таутомерной хиноидной (кето-аминной) формы. При координации дважды депротонированного лиганда L2– c металлом в комплексе I имеет место существенное изменение одного геометрического параметра. Связь О(3)–С(2) (1.340(5) Å) заметно (на 0.057 Å) удлиняется по сравнению с аналогичной связью О(1)–С(5) (1.283(3) Å) в молекуле H2L, что указывает на координацию лиганда в комплексе I в бензоидной (енол-иминной) форме. В кристалле H2L помимо вышеописанной ВВС имеют место прочные межмолекулярные ВС О(2)–Н(2О)…О(1)#1 (–x + 2, –y, –z + 1) (O(2)–H(2O) 0.98(3), H(2O)…O(1)#1 1.75(3), O(2)…O(1)#1 2.695(2) Å, угол О(2)Н(2О)O(1)#1 161(2)°), объединяющие молекулы в зигзагообразные 1D-цепочки (рис. 3).
Рис. 2.
Строение молекулы H2L. Эллипсоиды тепловых колебаний атомов приведены с 50%-ной вероятностью.
Результаты экспериментальных исследований и имеющиеся литературные данные позволяют сделать вывод об однотипном строении внутрикомплексных соединений диоксомолибдена(VI) с салицилиденалкогольиминами, в структуре которых лиганды координированы центральным атомом в дважды депротонированной енол-иминной таутомерной форме, проявляя, таким образом, тридентатную функцию. В комплексах молекулярного типа – аддуктах MoO2Cl2 · 2H2L–салицилиденалкогольимины, по данным ИК-спектроскопических исследований, напротив, координированы монодентатно через карбонильный атом кислорода хиноидной (кето-аминной) формы [32].
Список литературы
Schachner J.A., Mösch-Zanetti N.C., Peuronen A. et al. // Polyhedron. 2017. V. 134. P. 73.
Hossain Md.K., Schachner J.A., Haukka M. et al. // Polyhedron. 2017. V. 134. P. 275.
Sui Y., Zeng X., Fang X. et al. // J. Mol. Catal. A: Chem. 2007. V. 270. № 1–2. P. 61.
Bruno S.M., Balula S.S., Valente A.A. et al. // J. Mol. Catal. A: Chem. 2007. V. 270. № 1–2. P. 185.
Romanowski G., Kira J. // Polyhedron. 2016. V. 117. P. 352.
Sobczak J.M., Ziołkowski J. // Appl. Catal. A: Gen. 2003. V. 248. № 1–2. P. 261.
Głowiak T., Jerzykiewicz L., Sobczak J.M. et al. // Inorg. Chim. Acta. 2003. V. 356. P. 387.
Liimatainen J., Lehtonen A., Sillanpää R. // Polyhedron. 2000. V. 19. № 9. P. 1133.
Данилов А.М. Применение присадок в топливах для автомобилей. М.: Химия, 2000. 232 с.
Абраменко В.Л. Координационная химия оксо- и диоксогалогенидов молибдена(6+) и вольфрама(6+). Луганск: Изд-во ВНУ им. В. Даля, 2012. 204 с.
Cordas C.M., Moura J.J.G. // Coord. Chem. Rev. 2019. V. 394. P. 53.
Kazemi Z., Rudbari H., Sahihi M. et al. // Polyhedron. 2019. V. 170. P. 70.
Rakshit S., Palit D., Hazari S.K.S. et al. // Polyhedron. 2016. V. 117. P. 224.
Hussein M.A., Guan T.S., Haque R.A. et al. // Polyhedron. 2015. V. 85. P. 93.
Rudbari H.A., Khorshidifard A., Askari B. et al. // Polyhedron. 2015. V. 100. P. 180.
Гарновский А.Д., Васильченко И.С., Гарновский Д.А. Современные аспекты синтеза металлокомплексов. Основные лиганды и методы. Ростов-на-Дону: ЛаПО, 2000. 355 с.
Сергиенко В.С., Абраменко В.Л., Порай-Кошиц М.А., Гарновский А.Д. // Журн. структур. химии. 1990. Т. 31. № 5. С. 54.
Sergienko V.S., Abramenko V.L., Mikhailov Y.U. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 11. Р. 1259. [Сергиенко В.С., Абраменко В.Л., Михайлов Ю.Н., Суражская М.Д. // Журн. неорган. химии. 2014. Т. 59. № 11. С. 1503.]https://doi.org/10.1134/003602361411020
Sergienko V.S., Abramenko V.L., Churakov A.V. et al. // Crystallogr. Rep. 2014. V. 59. № 4. Р. 523. [Сергиенко В.С., Абраменко В.Л., Чураков А.В. и др. // Кристаллография. 2014. Т. 59. № 4. С. 589.]https://doi.org/10.1134/S106377451404018X
Kessisoglou D.P., Li X., Butler W.M. et al. // Inorg. Chem. 1987. V. 26. № 15. P. 2487.
Zabierowski P., Szklarzewicz J., Kurpiewska K. et al. // Polyhedron. 2013. V. 49. № 1. P. 74.
Rajan G.C., Chakravorty A. // Inorg. Chem. 1981. V. 20. № 3. P. 660.
Nakajima K., Yokoyama K., Kano T. et al. // Inorg. Chim. Acta. 1998. V. 282. № 2. P. 209.
Sheldrick G.M. // Acta Crystallogr. 2008. V. 64. № 1. P. 112.
Беллами Л. Инфракрасные спектры сложных молекул. М.: Изд-во иностр. литер., 1963. 592 с.
Пopaй-Koшиц M.A. // Izv. Jugosl. Cent. Kristallogr. 1974. V. 9. P. 19.
Sergienko V.S., Abramenko V.L., Gorbunova Y.E. // Russ. J. Inorg. Chem. 2017. V. 62. № 7. Р. 900. [Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е. // Журн. неорган. химии. 2017. Т. 62. № 7. С. 920.]https://doi.org/10.1134/S0036023617070208
Sergienko V.S., Abramenko V.L., Gorbunova Y.E., Churakov A.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 2. Р. 175. [Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е., Чураков А.В. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 180.]https://doi.org/10.1134/S00360236117020152
Sergienko V.S., Abramenko V.L., Gorbunova Y.E., Churakov A.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 12. Р. 1563. [Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е., Чураков А.В. // Журн. неорган. химии. 2017. Т. 62. № 12. С. 1569.]https://doi.org/10.1134/S003602361712019
Sergienko V.S., Abramenko V.L., Gorbunova Y.E. // Russ. J. Inorg. Chem. 2018. V. 63. № 1. Р. 28. [Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е. // Журн. неорган. химии. 2018. Т. 63. № 1. С. 32.]https://doi.org/10.1134/S003602361801014X
Sergienko V.S., Abramenko V.L., Gorbunova Y.E. // Crystallogr. Rep. 2019. V. 65. № 1. P. 43. [Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е. // Кристаллография. 2019. Т. 64. № 1. С. 53.]https://doi.org/10.1134/S002346120010233
Sergienko V.S., Abramenko V.L., Gorbunova Y.E. et al. // Russ. J. Coord. Chem. 2019. V. 65. № 12. P. 653. [Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е. и др. // Коорд. химия. 2019. Т. 45. № 12. С. 756.]https://doi.org/10.1134/S013234X19110070
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии