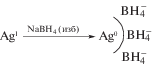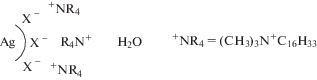Журнал неорганической химии, 2020, T. 65, № 4, стр. 542-548
Изменение спектральных свойств водных золей серебра под влиянием комплексообразования на поверхности наночастиц
a Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт геохимии и аналитической химии имени В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: olan@petrol.chem.msu.ru
Поступила в редакцию 26.09.2019
После доработки 31.10.2019
Принята к публикации 27.11.2019
Аннотация
Исследовано взаимодействие ионов Ag+, содержащихся на поверхности наночастиц серебра с комплексообразователями, такими как аммиак, роданид аммония, тиосульфат натрия. Как наличие в исходной реакционной смеси, так и последующее введение комплексообразователей в предварительно синтезированные золи наночастиц серебра приводит к небольшому смещению максимума полосы поглощения в длинноволновую область и существенному увеличению ее ширины. В обоих случаях наблюдается корреляция ширины полосы поглощения с логарифмом констант образования соответствующих комплексов серебра. Это может свидетельствовать об аналогичных химических процессах, происходящих на поверхности наночастиц. Поверхностное комплексообразование интересно как в фундаментальном понимании природы взаимодействий, так и в прикладном аспекте для определения комплексообразователей в водных системах.
ВВЕДЕНИЕ
Синтез и практическое использование золей наночастиц серебра и нанокомпозитов на их основе в настоящее время представляют одно из наиболее динамично развивающихся направлений, находящихся на стыке неорганической, аналитической, металлоорганической химии, материаловедения, катализа, биологии, медицины [1–7]. Несмотря на обилие работ, включающих описание серебряных наночастиц, формирование металлического остова и поверхностного слоя исследовано недостаточно. Как правило, авторы приводят характеристики конечного продукта, оставляя без внимания процессы формирования поверхности наночастиц, включая динамику взаимодействий компонентов реакционной массы. Именно они во многом обусловливают средний размер частиц конечного золя, наличие поверхностных зарядов, их распределение в пространстве.
Наночастицы, диспергированные в жидкости, содержат адсорбционный слой, а их структура может быть описана в терминах ядро–оболочка. Ковалентное взаимодействие в таких объектах способствует снижению избытка энергии, характерного для высокодисперсных коллоидов. При этом чем выше выигрыш в энергии, тем меньше средний размер частиц и выше их устойчивость.
Предельным случаем реализации систем ядро–оболочка следует рассматривать получение кластерных комплексов серебра, таких как [Ag8(DPPE)4(SC6H3F2)14]6–, Ag16(DPPE)4(SC6H3F2)14 и [Ag32(DPPE)5(SC6H4CF3)24], где DPPE = = Ph2P(CH2)2PPh2 [8]. В кластерном металлическом остове практически невозможно отделить поверхностные и объемные атомы. Оценка геометрических размеров кластерных соединений серебра, содержащих от 10 до 50 атомов, дает величины порядка 1–1.5 нм. Существенное отличие кластерных соединений серебра от наночастиц состоит в длине связи Ag–Ag. Если для наночастиц взаиморасположение атомов практически не отличается от кубической гранецентрированной решетки с параметром 0.409 нм при 293 K [9], то в кластерных соединениях, во-первых, длина связи существенно меньше (0.266–0.309 нм), а во-вторых, зависит от их геометрии и отличается для разных пар атомов [8]. Выигрыш в энергии за счет ковалентного взаимодействия метал–лиганд в кластерных соединениях очень высок, а попытки лигандного обмена в большинстве случаев безуспешны и приводят к их разрушению.
Нижняя граница размеров наночастиц, для которых возможен динамический лигандный обмен, лежит на уровне 3–4 нм. Прикидочные расчеты показывают, что такие наночастицы с удельной поверхностью ∼100 м2/г содержат 103–104 атомов, 1–3% которых выходят на поверхность. Доля поверхностных атомов достаточно велика, чтобы оказывать влияние на макроскопические свойства наночастиц серебра, в том числе спектральные. Известно, что положение максимума и ширина полосы поверхностного плазмонного резонанса (ППР) зависят от многих факторов, включающих размер и геометрию наночастиц [10–12], заряд их поверхности [12], характер взаимодействия поверхностных атомов с компонентами, содержащимися в окружающей среде [4, 5, 10, 13]. Комплексообразование наночастиц серебра с аммиаком [14], ионом роданида [15] может быть использовано в практических целях.
В настоящей работе предпринята попытка связать изменения в спектрах ПРР с комплексообразованием поверхностных атомов наночастиц серебра с анионными (бромид, роданид, тиосульфат) и электронейтральными (аммиак) лигандами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и используемые реагенты. В работе использовали: нитрат серебра (Реахим, 98%), бромид цетилтриметиламмония (Helicon Chemical Company, 99.5%), нитрат цетилтриметиламмония (Helicon Chemical Company, 98%), борогидрид натрия (Acros Organics, 99%), тиосульфат натрия (Реахим, 99%), роданид аммония (Реахим, ч. д. а.), 25%-ный гидрат аммиака (ООО “Сигма Тек”).
Реакции восстановления нитрата серебра, последующего химического модифицирования поверхности металлических наночастиц проводили в ультразвуковой ванне ПСБ-2855-05м (рабочий объем 1.5 л, частота 35 кГц, акустическая мощность 100 Вт).
Регистрацию спектров поглощения в УФ- и видимой областях излучения осуществляли на спектрофотометре Jenway 6310 в кварцевой кювете с толщиной слоя 1 см и рабочим диапазоном от 320 до 1000 нм. Образцы готовили путем разбавления исходных коллоидных растворов дистиллированной водой. Образцом сравнения во всех случаях служила дистиллированная вода. Исходные спектры регистрировали в единицах оптической плотности, в случае необходимости их нормировали. Ширину полосы поглощения поверхностного плазмонного резонанса определяли как разницу длин волн, соответствующих половине величины оптической плотности максимума.
Синтез золей наночастиц серебра. Золи наночастиц серебра получали восстановлением в вводной среде нитрата серебра боргидридом натрия в присутствии нитрата либо бромида цетилтриметиламмония. В типичном эксперименте навески нитрата серебра (34.0 мг, 0.2 ммоль), нитрата цетил-триметиламмония (86.5 мг, 0.25 ммоль) или бромида цетилтриметиламмония (91.1 мг, 0.25 ммоль) вносили в химический стакан объемом 50 мл, в котором содержалось 4 мл дистиллированной воды. После этого реакционную массу перемещали в ультразвуковую ванну и выдерживали в ней 10 мин. Затем равномерно при непрерывной ультразвуковой обработке порциями по 10 мкл в нее вводили 1 мл раствора, содержащего 14.4 мг (0.375 ммоль) боргидрида натрия.
Методики получения золей наночастиц серебра в присутствии комплексообразователей полностью аналогичны приводимым выше, но в исходные реакционные смеси до начала восстановления вводили либо 30.4 мг (0.4 ммоль) роданида аммония, либо 99.2 мг (0.4 ммоль) пятиводного тиосульфата натрия, либо 0.03 мл (0.4 ммоль в расчете на NH3) 25%-ного раствора аммиака.
По мере формирования коллоида цвет реакционной массы изменялся от темно-красного до коричневого. По окончании введения восстановителя коллоиды дополнительно выдерживали в ультразвуковой ванне в течение 20 мин. В дальнейшем их хранили на воздухе и использовали без дополнительной обработки.
Химическое модифицирование поверхности золей наночастиц серебра. Формирование комплексов на поверхности наночастиц серебра проводили двумя способами: непосредственно в момент синтеза или путем введения раствора комплексообразователя в предварительно синтезированный коллоид.
В первом случае в исходную реакционную массу вводили навеску либо 99.2 мг (0.4 ммоль) пятиводного тиосульфата натрия, либо 30.4 мг (0.4 ммоль) роданида аммония, либо 0.03 мл 25%-ного водного раствора (0.4 ммоль) аммиака. В случае использования кристаллогидратов или водных растворов пропорционально уменьшали исходный объем дистиллированной воды. Последующие операции проводили аналогично методике, описанной выше для получения коллоидов наночастиц серебра.
Для образования коллоидов, содержащих на поверхности хемосорбированные анионы Br–, в 1 мл свежеполученного золя наночастиц серебра вводили 5.2 мг (0.05 ммоль) бромида натрия.
Для химического модифицирования поверхности коллоидов в 1 мл предварительно полученного золя наночастиц серебра вводили навеску либо 19.8 мг (0.08 ммоль) пятиводного тиосульфата натрия, либо 6.1 мг (0.08 ммоль) роданида аммония, либо 0.06 мл 25%-ного водного раствора (0.08 ммоль) аммиака.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химия металлокомплексных и металлоорганических соединений AgI существенно богаче, чем Ag0. Поэтому немаловажным фактором является соотношение Ag0/AgI на поверхности наночастицы. Использование методик, основанных на вакуумном испарении [16–18] и лазерной абляции массивного металла [19, 20] или подобных ему, способствует формированию в бескислородной среде неокисленной поверхности серебряных наночастиц. Специфика химического восстановления соединений Ag+ состоит в том, что формирующийся металлический остов содержит два типа структурных единиц: нейтральную [Ag0–Ag0] и положительно заряженную [Ag0–AgI]. Первая образуется за счет конденсации фрагментов, содержащих два нейтральных кластера, а вторая — нейтрального и катионного кластеров серебра. В литературе есть описание обоих типов кластеров, таких как Ag2 [21, 22], Ag3 [21] или ${\text{Ag}}_{2}^{ + }$ [23–27], ${\text{Ag}}_{3}^{ + }$ [26], ${\text{Ag}}_{3}^{{2 + }}$ [25, 27], ${\text{Ag}}_{4}^{{2 + }}$ [24, 26–29]. Кроме того, молекулярный кислород, содержащийся в растворителе, способен окислять поверхностные атомы и формировать ионы Ag+, хемосорбированные на поверхности наночастиц. При оценке соотношения Ag0/Ag+ на поверхности следует также учитывать ярко выраженный размерный эффект реакции Ag0 – e– → Ag+ в области размеров частиц <20 нм [30].
В реакционную массу обычно вводится избыток по сравнению со стехиометрическим количеством борогидрида натрия. Это обусловлено тем, что наряду с целевой существует побочная реакция с водой, продуктом которой является молекулярный водород. Ее скорость невелика, однако вполне ощутима.
При восстановлении соединений Ag+ борогидридом натрия в водной или водно-органической среде непосредственно после окислительно-восстановительной реакции происходит электростатическая стабилизация металлических наночастиц за счет анионов ${\text{BH}}_{4}^{ - }$ [31, 32]. В дальнейшем в сорбционном слое возможен ионный обмен борогидрида на анионы, имеющие большее сродство к серебру, такие как бромид, роданид, тиосульфат.
Помимо соединения AgI и восстановителя исходная смесь содержит еще один компонент — стабилизатор. Кроме снижения избытка энергии поверхности за счет ковалентных взаимодействий его наличие способствует созданию пространственных затруднений или образованию заряженного слоя, препятствующих сближению и последующей коагуляции наночастиц.
В качестве стабилизатора в работе использовали катионные поверхностно-активные вещества (ПАВ), такие как нитрат и бромид цетилтриметиламмония (ЦТМА). Катионы ЦТМА способны к формированию самоупорядоченного двойного слоя в приповерхностной области наночастиц серебра [33]. Схематически межфазная граница аквазоля наночастиц серебра, образующихся в условиях синтеза, может быть представлена следующим образом:
Проницаемость поверхностного слоя, образованного катионами ЦТМА, до настоящего времени представляет предмет дискуссии. С одной стороны, на основании данных термогравиметрии, ЯМР, ИК-спектроскопии с преобразованием Фурье, компьютерного моделирования утверждается, что ионы ЦТМА образуют достаточно плотную оболочку [33], с другой — наночастицы серебра, стабилизированные катионными ПАВ, могут быть использованы в химическом анализе без дополнительной обработки, а также поддаются ковалентному модифицированию с участием поверхностных атомов [2–5].
Ионы серебра в водной среде образуют устойчивые комплексы состава [AgL2]. При формировании серебряных наночастиц или последующем их взаимодействии с молекулами (ионами) комплексообразователей, содержащимися в окружающей среде, возможен перенос электронной пары лиганда на незаполненную орбиталь хемосорбированного иона Ag+. В отличие от индивидуальных комплексных соединений серебра, координационное число центрального атома, понимаемое как соотношение L : M, равно 1. По аналогии с классическим лигандным обменом возможно вытеснение слабого лиганда L1 более сильным L2:
Равновесие в таких реакциях определяется соотношением констант устойчивости ${\text{Ag}}_{{(s)}}^{ + }{{{\text{L}}}_{1}}$ и ${\text{Ag}}_{{(s)}}^{ + }{{{\text{L}}}_{2}}$. В литературе не содержится данных о значениях Kуст комплексов, образованных хемосорбированными на поверхности наночастиц серебра ионами Ag+. Тем не менее общие закономерности их образования, направление и динамика лигандного обмена не должны качественно отличаться от аналогичных, существующих в гомогенных водных растворах.
Для образования поверхностных комплексов предварительно синтезированных золей серебра в расчете на 1 моль металла вводили 2 моль лиганда. Оценочные значения доли поверхностных атомов для наночастиц размером 10 нм дают величину порядка 1%, что соответствует молярному отношению Ag(s) : L ∼ 1 : 200. При таких формальных избытках комплексообразователя вероятность его донорно-акцепторных взаимодействий с хемосорбированными на поверхности ионами Ag+ довольно высока.
Для комплексов серебра с КЧ = 2 существует система из двух последовательных химических реакций, каждая стадия которых описывается собственной константой равновесия:
Константы равновесия kI и kII известны и содержатся в справочной литературе (например, в [34]). Для оценки устойчивости поверхностных комплексов мы можем использовать значения констант kI, тенденция изменения которых аналогична.
Введение соединения комплексообразователя может быть проведено двумя способами: непосредственно в исходную реакционную смесь и в уже сформированный устойчивый золь после реакции восстановления нитрата серебра. Кроме того, при взаимодействии иона Ag+ с некоторыми анионами формируются нерастворимые в воде соединения, что может сказаться на свойствах конечных продуктов. Поэтому состав реакционной смеси и порядок введения в нее компонентов имеют существенное значение. Исходной точкой считался золь, полученный путем восстановления нитрата серебра борогидридом натрия в присутствии нитрата ЦТМА. В дальнейшем изменением противоиона катионного ПАВ, введением в состав исходной реакционной смеси комплексообразователей и последующей обработкой готовых золей бромидом натрия, роданидом аммония, тиосульфатом натрия, аммиаком получены все возможные их комбинации.
Вне зависимости от метода введения молярное соотношение Ag : L во всех случаях составляло 1 : 2. В случае окислительно-восстановительной реакции при наличии лиганда в исходной реакционной смеси присутствует комплексное соединение серебра состава ML2. По мере прохождения реакции происходит формирование остова наночастицы, сопровождаемое высвобождением комплексообразователя, которое приводит к повышению его содержания по сравнению со стехиометрией исходного соединения.
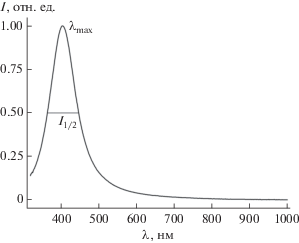
Благодаря интенсивному поглощению в области 400 нм, возникающему из-за эффекта поверхностного плазмонного резонанса, одним из основных методов исследования наночастиц серебра является оптическая спектроскопия. На рис. 1 приведен типичный спектр поглощения золя наночастиц серебра в воде. Кроме положения максимума (λmax) и интенсивности поглощения важной количественной характеристикой является ширина полосы на половине высоты (I1/2). При взаимодействии золей наночастиц серебра с соединениями, образующими ковалентные химические связи с поверхностными атомами, происходят изменения как интенсивности, так и положения максимума, а также ширины линии поглощения [13]. Комплексообразование поверхностных атомов наночастиц серебра относится к достаточно сильным ковалентным взаимодействиям и должно сказываться на спектральных параметрах конечных продуктов.
Для золей наночастиц серебра, стабилизированных нитратом цетилтриметиламмония, λmax находится при 403 нм, а I1/2 составляет 76 нм. Замена противоиона ПАВ на бромид приводит к незначительному смещению максимума и уширению полосы до 404 и 81 нм соответственно. Введение бромида натрия в предварительно полученный золь с использованием нитрата ЦТМА не вызывает изменения характеристик его полосы ППР.
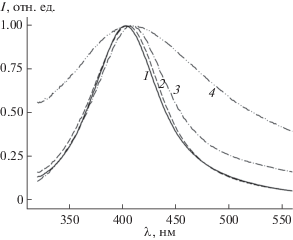
Введение в состав исходной реакционной смеси, содержащей нитрат ЦТМА, комплексообразователей, таких как аммиак, роданид аммония или тиосульфат натрия, приводит к смещению максимума поглощения и существенному уширению полосы (рис. 2). Наличие комплексообразователя практически не сказывается на положении максимума, смещая его до 408 нм в случае тиосульфата, но радикальным образом влияет на ширину полосы: 81, 88 и 227 нм для аммиака, роданида и тиосульфата соответственно. Обработка золя, полученного с использованием нитрата ЦТМА, растворами комплексообразователей имеет ту же тенденцию, но выраженную слабее. В этом случае сдвиг максимума поглощения не превышает 1 нм, а ширина линии на половине высоты составляет 77, 82 и 129 нм для аммиака, роданида и тиосульфата соответственно. Добавление раствора бромида натрия после получения золя, но перед обработкой его комплексообразователями также практически не сказывается на положении максимума, но способствует небольшому снижению ширины полосы (76, 81 и 123 нм для аммиака, роданида и тиосульфата соответственно).
Рис. 2.
Нормализованные спектры поглощения золей наночастиц серебра, полученных восстановлением без модификатора (1) и в присутствии аммиака (2), роданида аммония (3), тиосульфата натрия (4).
Использование бромида ЦТМА в качестве стабилизатора поверхности, с одной стороны, исключает введение NaBr, а с другой — заставляет принимать во внимание неизбежно синтезируемый золь бромида серебра, влияющий на конечный результат. Так, исходный коллоид серебра, полученный в аналогичных условиях с использованием бромида ЦТМА, имеет максимум поглощения при 404 нм с шириной линии на половине высоты 81 нм. Введение в состав исходной реакционной смеси комплексообразователя практически не сказывается на положении максимума и приводит к уширению полосы ППР (81, 92 и 229 нм для аммиака, роданида и тиосульфата соответственно). Обработка предварительно синтезированного золя растворами этих соединений также вызывает увеличение ширины линии на половине высоты до значений 80, 97 и 120 нм для аммиака, роданида и тиосульфата соответственно.
Корреляционные зависимости ширины полосы на половине высоты от логарифма константы комплексообразования приведены на рис. 3. Из приведенных данных видно, что чем устойчивее комплекс серебра, тем шире полоса поглощения поверхностного плазмонного резонанса. Это наблюдение дает основание полагать, что химические процессы как в случае введения комплексообразователя в исходную реакционную смесь, так и последующего взаимодействия его с предварительно синтезированным золем аналогичны.
Рис. 3.
Зависимость ширины линии поглощения на половине высоты от константы образования соответствующего комплекса серебра. Стабилизатор поверхности — нитрат (1, 3), бромид (2, 4) ЦТМА; комплексообразователь содержался в исходной реакционной смеси (1, 2), вводился в предварительно синтезированный золь (3, 4).
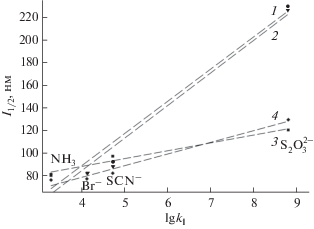
Значения ширины линии ППР на половине высоты для тиосульфата, вводимого в исходную реакционную смесь, в разы превышают аналогичные значения для других лигандов даже с учетом формирования более устойчивых комплексов. Возможное объяснение этому лежит в реакции восстановления, зафиксированной для алкилзамещенных тиосульфатов [31, 32], использованных в качестве стабилизаторов поверхности серебряных наночастиц.
Наличие двойного слоя ПАВ сдерживает процесс комплексообразования с хемосорбированными на поверхности наночастиц ионами Ag+ вне зависимости от природы вводимого лиганда.
ЗАКЛЮЧЕНИЕ
На основании полученных данных с достаточной степенью уверенности можно утверждать, что на поверхности наночастиц серебра происходят процессы лигандного обмена, которые могут быть зафиксированы методами оптической спектроскопии. Эти взаимодействия оказывают влияние как на положение максимума полосы поглощения золей, так и на ее ширину на половине высоты. Существует корреляция между шириной полосы поглощения и константами образования соответствующих комплексов. Наличие на поверхности наночастиц двойного слоя ПАВ в значительной степени препятствует комплексообразованию хемосорбированных ионов Ag+. Данные явления могут представлять интерес как для понимания природы процессов, происходящих в поверхностном слое наночастиц, так и для практического их использования в аналитической химии для определения комплексообразующих соединений в водных объектах.
Список литературы
Olenin A.Yu., Lisichkin G.V. // Russ. Chem. Rev. 2011. V. 80. № 7. P. 605. [Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2011. Т. 80. № 7. С. 635.]https://doi.org/10.1070/RC2011v080n07ABEH004201
Olenin A.Yu., Lisichkin G.V. // Russ. J. Appl. Chem. 2018. V. 91. № 9. P. 1393. [Оленин А.Ю., Лисичкин Г.В. // Журн. прикл. химии. 2018. Т. 91. № 9. С. 1219.]https://doi.org/10.1134/S107042721809001X
Apyari V.V., Arkhipova V.V., Dmitrienko S.G. et al. // J. Anal. Chem. 2014. V. 69. № 1. P. 1. [Апяри В.В., Архипова В.В., Дмитриенко С.Г. и др. // Журн. аналит. химии. 2014. Т. 69. № 1. С. 4.]https://doi.org/10.1134/S1061934814010031
Terenteva E.A., Apyari V.V., Kochuk E.V. et al. // J. Anal. Chem. 2017. V. 72. № 11. P. 1138. [Терентьева E.A., Апяри В.В., Кочук Е.В. и др. // Журн. аналит. химии. 2017. Т. 72. № 11. С. 978.]https://doi.org/10.1134/S1061934817110107
Olenin A.Yu. // J. Anal. Chem. 2019. V. 74. № 4. P. 355. [Оленин А.Ю. // Журн. аналит. химии. 2019. Т. 74. № 4. С. 254.]https://doi.org/10.1134/S1061934819040099
Soloveva A.Yu., Eremenko N.K., Obraztsova I.I. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 4. P. 444. [Соловьева А.Ю., Еременко Н.К., Образцова И.И. и др. // Журн. неорган. химии. 2018. Т. 63. № 4. С. 416.]https://doi.org/10.1134/S0036023618040204
Shevchenko G.P., Zhuravkov V.A., Tret’yak E.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 1. P. 16. [Шевченко Г.П., Журавков В.А., Третьяк Е.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 1. С. 19.]https://doi.org/10.1134/S0036023618010163
Yang H., Wang Y., Zheng N. // Nanoscale. 2013. V. 5. № 7. P. 2674. https://doi.org/10.1039/c3nr34328f
Suh I.-K. Ohta H., Waseda Y. // J. Mater. Sci. 1988. V. 23. № 2. P. 757. https://doi.org/10.1007/BF01174717
Szunerits S., Boukherroub R. // Chem. Commun. 2012. V. 48. № 72. P. 8999. https://doi.org/10.1039/c2cc33266c
Evanoff D.D.m Jr., Chumanov G. // ChemPhysChem. 2005. V. 6. № 7. P. 1221. https://doi.org/10.1002/cphc.200500113
Moores A., Goettmann F. // New J. Chem. 2006. V. 30. № 8. P. 1121. https://doi.org/10.1039/b604038c
Olenin A.Yu., Nizamov T.R., Lisichkin G.V. // Nanotechnol. Russ. 2014. V. 9. № 9–10. P. 467. [Оленин А.Ю., Низамов Т.Р., Лисичкин Г.В. // Рос. нанотехнол. 2014. Т. 9. № 9–10. С. 19.]https://doi.org/10.1134/S1995078014050103
Buccolieri A., Serra A., Giancane G. et al. // Beilstein J. Nanotechnol. 2018. V. 9. P. 499. https://doi.org/10.3762/bjnano.9.48
Zhao X., Chen D., Qayum A. et al. // Beilstein J. Nanotechnol. 2017. V. 8. P. 2781. https://doi.org/10.3762/bjnano.8.277
Zhang S., Wang Q., Deng C. et al. // J. Nanopart. Res. 2014. V. 16. № 10. Art. 2634. https://doi.org/10.1007/s11051-014-2634-5
Plyushchenko A.V., Mitusova K.A., Borovikova L.N. et al. // Opt. Spectrosс. 2018. V. 125. № 2. P. 243. [Плющенко А.В., Митусова К.А., Боровикова Л.Н. и др. // Опт. спектроскопия. 2018. Т. 125. № 2. С. 234.]https://doi.org/10.1134/S0030400X18080192
Vasil’kov A.Yu., Nikitin L.N., Naumkin A.V. et al. // Nanotechnol. Russ. 2009. V. 4. № 11–12. P. 834. [Васильков А.Ю., Никитин Л.Н., Наумкин А.В. и др. // Рос. нанотехнол. 2009. Т. 4. № 11–12. С. 128.]https://doi.org/10.1134/S1995078009110111
Ossi P.M., Neri F., Santo N. et al. // Appl. Phys. A. 2011. V. 104. № 3. P. 829. https://doi.org/10.1007/s00339-011-6422-0
Ullmann M., Friedlander S.K., Schmidt-Ott A. // J. Nanopart. Res. 2002. V. 4. № 6. P. 499. https://doi.org/10.1023/A:1022840924336
Ozin G.A., Huber H., Mitchell S.A. // Inorg. Chem. 1979. V. 18. № 10. P. 2932. https://doi.org/10.1021/ic50200a065
Mitchell S.A., Kenney-Wallace G.A., Ozin G.A. // J. Am. Chem. Soc. 1981. V. 103. № 20. P. 6030. https://doi.org/10.1021/ja00410a007
Ershov B.G., Janata E., Henglein A. et al. // J. Phys. Chem. 1993. V. 97. № 18. P. 4589. https://doi.org/10.1021/j100120a006
Pillai Z.S., Kamat P.V. // J. Phys. Chem. B. 2004. V. 108. № 3. P. 945. https://doi.org/10.1021/jp037018r
Janata E., Henglein A., Ershov B.G. // J. Phys. Chem. 1994. V. 98. № 42. P. 10888. https://doi.org/10.1021/j100093a033
Mulvaney P., Henglein A. // J. Phys. Chem. 1990. V. 94. № 10. P. 4182. https://doi.org/10.1021/j100373a056
Linnert T., Mulvaney P., Henglein A. et al. // J. Am. Chem. Soc. 1990. V. 112. № 12. P. 4657. https://doi.org/10.1021/ja00168a005
Rafey A., Shrivastavaa K.B.L., Iqbal S.A. et al. // J. Coll. Interface Sci. 2011. V. 354. P. 190. https://doi.org/10.1016/j.jcis.2010.10.046
Kapoor S., Joshi R., Mukherjee T. // Chem. Phys. Lett. 2004. V. 396. № 4–6. P. 415. https://doi.org/10.1016/j.cplett.2004.08.080
Ivanova O.S., Zamborini F.P. // J. Am. Chem. Soc. 2010. V. 132. № 1. P. 70. https://doi.org/10.1021/ja908780g
Shon Y.-S., Cutler E. // Langmuir. 2004. V. 20. № 16. P. 6626. https://doi.org/10.1021/la049417z
Mari A., Imperatori P., Marchegiani G. et al. // Langmuir. 2010. V. 26. № 19. P. 15561. https://doi.org/10.1021/la102062p
Sui Z.M., Chen X., Wang L.Y. et al. // Physica E. 2006. V. 33. № 2. P. 308. https://doi.org/10.1016/j.physe.2006.03.151
Справочник химика. М.: Химия, 1965. Т. 3. С. 119.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии