Журнал неорганической химии, 2020, T. 65, № 4, стр. 449-457
Синтез карбоната кальция в присутствии желчи, альбумина и аминокислот
О. А. Голованова a, *, С. С. Леончук a
a Омский государственный университет им. Ф.М. Достоевского
644077 Омск, пр-т Мира, 55а, Россия
* E-mail: golovanoa2000@mail.ru
Поступила в редакцию 27.09.2019
После доработки 30.10.2019
Принята к публикации 28.11.2019
Аннотация
Проведено термодинамическое и экспериментальное моделирование процесса кристаллизации карбоната кальция в модельном растворе желчи человека. Синтезированы образцы CaCO3, полученные в присутствии добавок при варьировании их концентраций. Методами РФА, ИК-Фурье-спектроскопии и оптической микроскопии определен фазовый и структурно-групповой состав синтезированных образцов. Установлено, что в присутствии по отдельности глицина, глутаминовой кислоты и альбумина в модельном растворе желчи человека преимущественно образуются аморфный карбонат кальция и кальцит. При совместном присутствии двадцати аминокислот и альбумина в максимально допустимых в организме человека концентрациях в качестве преобладающей фазы образуется ватерит. Показано различие в фазовом и структурно-групповом составе образцов в зависимости от параметров синтеза, высказано предположение о влиянии состава и концентрации используемых добавок на формирование определенной модификации карбоната кальция.
ВВЕДЕНИЕ
Изучение физико-химических условий кристаллизации карбоната кальция является важной задачей современной науки, несмотря на большое число исследований, посвященных этому соединению [1–7]. Актуальность исследований обусловлена широким использованием данного минерала во многих областях современной науки и техники. В частности, в экологии и метеорологии в ближайшее время планируется проведение эксперимента по снижению температуры планеты и устранению влияния парниковых газов путем распыления в стратосфере Земли отражающих солнечный свет частиц карбоната кальция [8]. Известно также, что в палеонтологии и климатологии по химическому и изотопному составу карбоната кальция определяют возраст различных исторических объектов и характеризуют климат Земли в разных временных промежутках прошлого [9, 10].
Более развитой и не менее актуальной на данный момент является проблема минералообразования в организме человека с участием карбоната кальция. Физико-химические причины и особенности этого явления, а также создание биокомпозитных материалов на основе карбоната кальция являются важными вопросами современной науки [4, 11–15]. Важна роль данного минерала в процессе формирования желчных камней и развитии холелитиаза (желчнокаменной болезни (ЖКБ)), поскольку это соединение входит в состав холелитов и в некоторых случаях составляет большую их часть [5, 16, 17]. В состав камней также входят холестерин, билирубин и различные другие органические соединения [5]. При этом холестерин, фосфолипиды, белки, аминокислоты и пигменты в составе желчи могут оказывать влияние на кристаллизацию карбоната кальция и, как следствие, на формирование желчных камней [2, 5, 7, 16]. Следует отметить, что ЖКБ в настоящее время представляет собой общемировую проблему, поскольку этим заболеванием страдает более 10% населения планеты, а установившиеся темпы роста заболеваемости могут увеличить данный показатель до 20% уже к 2050 г. [18–20].
Известно, что карбонат кальция характеризуется полиморфизмом – он может существовать в шести полиморфных модификациях: кристаллические кальцит (стабильная форма), арагонит и ватерит (метастабильные); гидраты моногидрокальцит и икаит (гексагидрат); а также аморфный кальцит [7]. В организме человека при формировании желчных камней в большей степени образуется именно метастабильная модификация карбоната кальция – ватерит (в чистом виде неустойчивая, с течением времени при старении осадка в растворе или при нагревании происходит монотропный фазовый переход в кальцит), что связано с условиями его кристаллизации [4, 5, 11, 21]. Такая особенность фазового состава неорганической составляющей холелитов представляет интерес, поскольку ее изучение может открыть истинные причины возникновения желчных камней и помочь в разработке новых лекарственных препаратов и способов профилактики данного заболевания.
Для исследования физико-химических условий кристаллизации и особенностей фазового состава полиморфных модификаций карбоната кальция, образующихся в реальных условиях в организме человека, в настоящее время представляется возможным использовать методы термодинамического моделирования [4, 22–24], а также синтез и изучение получаемых образцов [12, 24–26]. При этом для приближения создаваемой модели к реальным условиям и симулирования различных ее состояний в данном исследовании применяются концентрации рассматриваемых веществ, являющиеся нормой для здорового среднестатистического человека [5]. При этом варьирование данных концентраций может соответствовать различным патологическим изменениям состояния желчи человека.
Цель настоящей работы – термодинамическое и экспериментальное моделирование кристаллизации карбоната кальция из раствора желчи при варьировании его состава (осадкообразующие ионы, аминокислоты, альбумин) и условий эксперимента (концентрации вводимых в систему веществ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Термодинамическое моделирование
Для построения теоретической модели процесса образования твердой фазы в системе Ca2+–${\text{CO}}_{3}^{{2 - }}$ в желчи человека использовали гипотетический раствор, для которого содержание неорганических макрокомпонентов, pH, ионная сила и температура соответствовали усредненным значениям данных показателей для желчи взрослого среднестатистического здорового человека (табл. 1) [4, 24]. Влияние органических компонентов желчи на кристаллизацию не учитывалось.
Таблица 1.
Содержание ионов в желчи [4]
| Параметр | Значение | ||
|---|---|---|---|
| минимальное | среднее | максимальное | |
| pH | 6.5 | 7.25 | 8.0 |
| C, ммоль/л | |||
| Na+ | 130 | 205 | 280 |
| K+ | 2.7 | 8.85 | 15.0 |
| Ca2+ | 1.2 | 6.6 | 12.0 |
| Mg2+ | 1.3 | 2.15 | 3.0 |
| Cl− | 14.5 | 70.25 | 126 |
| ${\text{HCO}}_{3}^{ - }$ | 8.0 | 31.5 | 55 |
Теоретической характеристикой процесса образования карбоната кальция в виде твердой фазы в растворе являются справочные значения произведения растворимости при температуре 298 K, приведенные к 310 K по уравнению изобары Вант-Гоффа: $K_{{sp,310}}^{0}$ (ватерит) = 1.01 × 10–8 и $K_{{sp,310}}^{0}$ (кальцит) = 2.72 × 10–9 [27, 28].
Условные произведения растворимости рассчитывали с учетом коэффициентов активности ионов и протекания процессов протолиза и комплексообразования осадкообразующих ионов (вычисление их мольных долей проводили с использованием константы кислотности H2CO3 при 310 K и функции закомплексованности ионов Ca2+ вместе с константами устойчивости рассматриваемых комплексов):
(1)
$K_{{sp}}^{{0{\text{\;усл}}}} = \frac{{K_{{sp}}^{0}}}{{\gamma _{A}^{x}\gamma _{B}^{y}x_{A}^{x}x_{B}^{y}}}.$При этом коэффициенты активности рассчитывали по уравнению Дэвиса (в модели Дебая–Хюккеля):
(2)
$\lg {{{\gamma }}_{i}} = - 0.51z_{i}^{2}\left( {\frac{{\sqrt I }}{{1 + \sqrt I }} - 0.3I} \right).$Количественную оценку возможности образования малорастворимого соединения состава AxBy (CaCO3) в рассматриваемой системе проводили с использованием значений индексов пересыщения SI:
(3)
$SI = \lg \Omega = \lg {{\left[ {\frac{{a_{A}^{x}a_{B}^{y}}}{{{{{\left( {a_{A}^{x}a_{B}^{y}} \right)}}_{s}}}}} \right]}^{{\frac{1}{{x + y}}}}} = \lg {{\left[ {\frac{{a_{A}^{x}a_{B}^{y}}}{{K_{{sp}}^{{0{\text{\;усл}}}}}}} \right]}^{{\frac{1}{{x + y}}}}}.$Все исследуемые физико-химические процессы, имеющие место в изучаемой системе, считали равновесными и изотермическими (Т = 310 K).
Все необходимые расчеты осуществляли в программе Microsoft Excel 2013, а построение диаграммы – в OriginPro 2018.
Синтез карбоната кальция
Общая схема синтеза. Медицинскую консервированную желчь (ООО “САМСОН-МЕД”, эмульсия для наружного применения) объемом 250 мл делили на две равные части (по 125 мл). Далее в первую часть вводили определенные количества ${\text{HCO}}_{3}^{{2 - }}$ и добавки, а во вторую – Ca2+ (табл. 2). После растворения введенных веществ первый раствор с добавкой из бюретки со скоростью ~0.15 мл/с приливали ко второму раствору в стакане, термостатируемому при 310 ± 1 K при постоянном перемешивании. После их полного смешения перемешивание полученного раствора (250 мл) продолжали еще в течение 30 мин. Реакция осаждения протекает в соответствии со схемой:
(3)
$\begin{gathered} {\text{CaC}}{{{\text{l}}}_{2}} + 2{\text{NaHC}}{{{\text{O}}}_{3}} = \\ = {\text{CaC}}{{{\text{O}}}_{3}} + 2{\text{NaCl}} + {\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{2}}{\text{O}}. \\ \end{gathered} $Таблица 2.
Содержание основных компонентов и добавок, используемых в синтезе
| № образца | Компонент, моль | Добавка | |
|---|---|---|---|
| CaCl2 · 2H2O | NaHCO3 | ||
| 1 | 1.65 × 10–3 | 7.88 × 10–3 | Глицин, 6.25 × 10–5 моль |
| 2 | Глутаминовая кислота, 2.86 × 10–5 моль | ||
| 3 | Альбумин, 0.21 г | ||
| 4 | Альбумин, 0.42 г | ||
| 5 | 3.00 × 10–3 | 13.8 × 10–3 | 20 НАК (по табл. 1) и альбумин, 0.35 г |
Синтез в присутствии глицина и глутаминовой кислоты. При этом количество вводимых ионов Ca2+ и ${\text{CO}}_{3}^{{2 - }}$, глицина и глутаминовой кислоты рассчитывали из усредненных значений концентраций ионов Ca2+, ${\text{CO}}_{3}^{{2 - }}$ в желчи (табл. 1) и аминокислот в плазме крови человека (табл. S1) в пересчете на 250 мл конечного раствора [29].
Синтез CaCO3 в присутствии альбумина. Массу вводимого альбумина варьировали, исходя из данных о среднем содержании протеинов в желчи (от 0.025 до 0.14% в целом, т.е. 0.083% в среднем по массе) и в удвоенной средней концентрации [5].
Синтез CaCO3 в присутствии альбумина и двадцати незаменимых аминокислот (НАК). Количество вводимых CaCl2 · 2H2O, NaHCO3 и НАК рассчитывали в соответствии с максимальными значениями из табл. 1 и S1 соответственно в пересчете на 250 мл конечного раствора.
Полученные растворы помещали в шкаф-термостат БИАТРОН при температуре 310 ± 1 K (температура организма человека) на 120 ч. Полученные осадки фильтровали, промывали и высушивали при комнатной температуре до постоянной массы и полного удаления химически несвязанной воды. Затем твердую фазу взвешивали и исследовали методами рентгенофазового анализа, ИК-Фурье-спектроскопии и оптической микроскопии. Всего таким образом было получено и проанализировано пять образцов твердой фазы карбоната кальция.
Рентгенофазовый анализ полученных образцов осуществляли на рентгеновском дифрактометре D8 Advance (Bruker). Дифрактограммы снимали в интервале углов 2θ 5°–80°. Качественный анализ фазового состава образцов проводили по данным порошковой дифрактометрии PDF-2 и по справочной литературе [7, 30, 31].
ИК-Фурье-спектроскопию твердых фаз осуществляли на спектрофотометре ФТ-801 (СИМЕКС, Россия). В ходе исследования образец в виде порошка массой 0.5 мг смешивали с 50 мг KBr и прессовали в дискообразную таблетку диаметром 3 мм при комнатной температуре. Спектры регистрировали с разрешением 4 см–1, общее число сканирований – 32. Спектры исследуемых образцов записывали в области от 400 до 4000 см–1. Обработку ИК-спектров осуществляли с использованием программы OriginPro 2018 и литературных данных о положении максимумов полос поглощения различных атомных группировок [7, 25, 32, 33].
Оптической микроскопией полученных порошков c помощью микроcкопa XSP-104 (АРМЕД, Россия) проводили исследование морфологии частиц твердых фаз. Пробы образцов наносили тонким слоем на предметное стекло и изучали материал под микроскопом с увеличением ×640. Микрофотографии получали с помощью программы и оборудования Toup View.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
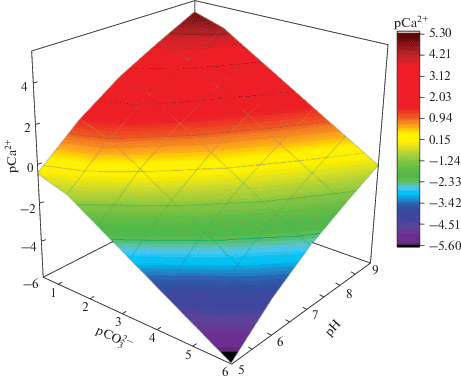
Термодинамическое моделирование процесса образования твердой фазы в системе Ca2+–${\text{CO}}_{3}^{{2 - }}$ изначально проводили без учета комплексообразования ионов Ca2+, а только с учетом протолитических взаимодействий иона ${\text{CO}}_{3}^{{2 - }}$ для кальцита и ватерита. При этом было построено поле устойчивости карбоната кальция в виде зависимости pCa2+ = f(${\text{pCO}}_{3}^{{2 - }};$ pH). Это трехмерные диаграммы (поверхности), описывающие равновесие процесса осадкообразования при SI = 0, выше которых любая фигуративная точка рассматриваемой системы описывает ее состояние в виде идеального раствора (твердая фаза не образуется, SI < 0), а ниже данной поверхности – состояние с SI > 0 (образуется осадок). Диаграмма, полученная для кальцита, представлена на рис. 1. Отмечено, что качественных различий между полем устойчивости кальцита и ватерита не выявлено, однако все значения pCa2+, полученные для ватерита, сдвинуты в отрицательную сторону примерно на 0.35 единиц. Это свидетельствует о том, что образование ватерита в модельном растворе требует более высокой концентрации осадкообразующих ионов, чем кальцит, при прочих равных условиях. При pH 7.25 и ${\text{pCO}}_{3}^{ - }$ = ${\text{pHCO}}_{3}^{ - }$ = 1.50 (минеральный состав желчи человека, табл. 1) критической точке (точке на поле устойчивости) для кальцита соответствует значение pCa2+ ≈ 2.13, для ватерита – pCa2+ ≈ 1.78 [4, 24].
В связи с тем, что в реальных условиях на кристаллизацию карбоната кальция в желчи могут оказывать влияние присутствующие в ней аминокислоты, были проведены аналогичные расчеты с учетом комплексообразования ионов Ca2+ с глицином и глутаминовой кислотой (раздельно) с использованием их средних концентраций в плазме крови и с двадцатью незаменимыми аминокислотами в пересчете на их максимально допустимые концентрации в плазме крови (табл. S1). При этом для расчета функции закомплексованности использовали значения констант устойчивости ионов Ca2+ с аминокислотами [34].
Отмечено, что качественных изменений при образовании малорастворимого соединения (CaCO3) нет и, соответственно, вид поля устойчивости глицин и глутаминовая кислота в концентрациях, создаваемых в модельном растворе, не меняют. Уменьшение значения pCa2+, соответствующего критической точке, происходит менее чем на 0.0005 единиц. Аналогично, рассматривая случай, когда в модельный раствор вводятся все незаменимые аминокислоты в их максимальной концентрации, качественных изменений не наблюдается. При этом также для pH 7.25 и ${\text{pCO}}_{3}^{ - }$ = = ${\text{pHCO}}_{3}^{ - }$ = 1.50 критической точке на диаграмме соответствует значение pCa2+ ≈ 2.13, которое всего лишь на 0.003 единицы pCa2+ меньше, чем это же значение в отсутствие комплексообразования, поэтому вид поля устойчивости CaCO3 практически идентичен рис. 1.
Фигуративная точка с координатами pH 7.25, pCa2+ 2.18 и ${\text{pHCO}}_{3}^{ - }$ 1.50 описывает состояние модельного раствора желчи человека со средними значениями соответствующих показателей. Данная точка лежит выше поля устойчивости. Для нее SI ∼ –0.4, т.е. система в данном состоянии представляет собой истинный раствор, который, однако, очень близок к состоянию равновесия осадок–раствор (особенно в случае с кальцитом). Поэтому сместить равновесие в рассматриваемой системе в сторону образования твердой фазы можно, вводя в нее избыточное количество ионов Ca2+ и ${\text{HCO}}_{3}^{ - }$ в концентрациях, равных средним физиологическим (табл. 1), что и было сделано при последующем синтезе карбоната кальция.
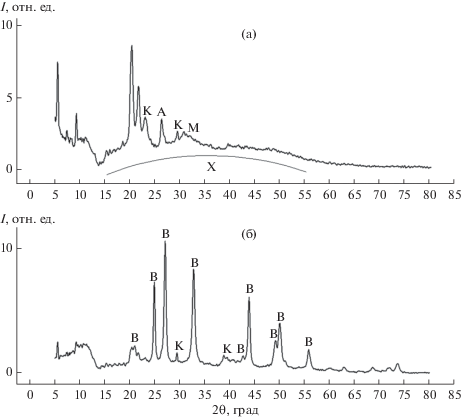
РФА полученных образцов показал, что фазовые составы образцов 1–4 практически не отличаются друг от друга, в то время как образец 5 имеет отличия. Для наглядности на рис. 2 представлены дифрактограммы образцов 3 и 5. Видно, что для образца 3, полученного в присутствии альбумина (0.083 мас. %), наблюдается широкая полоса (от 15° до 55°), соответствующая аморфному CaCO3 (преобладающая фаза), а также пики, характерные для примесей кальцита (23.0°, 29.4°), арагонита (26.3°) и моногидрокальцита (32.0°). На дифрактограмме образца 5 преобладающей фазой является ватерит (21.0°, 24.9°, 27.0°, 32.7°, 44.5°, 49.0°, 50.0°, 56.0°), слабо выражены пики, характерные для примеси кальцита (29.4°, 39.5°) [7, 30]. Пики, расположенные при 21.7°, 20.3° и левее их, соответствуют органическим солям кальция и соединениям, адсорбирующимся на поверхности CaCO3 [35].
Рис. 2.
Рентгенограммы образцов 3 (а) и 5 (б): А – арагонит, В – ватерит, К – кальцит, М – моногидрокальцит, Х – аморфный карбонат кальция.
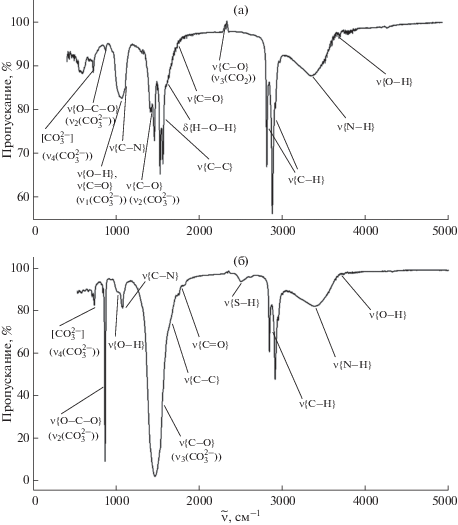
Результаты исследования полученных образцов карбоната кальция методом ИК-Фурье-спектроскопии коррелируют с данными РФА. Почти идентичный вид имеют спектры порошков 1–4 (рис. 3). В ИК-спектрах перечисленных образцов присутствуют полосы валентных колебаний связи C–C при 1540–1580 см–1 и узкие полосы при 2850–2920 см–1, соответствующие валентным колебаниям связи C–H. Такие колебания характеризуют присутствие молекул органических соединений в порошке в виде солей кальция с органическими кислотами и пигментами, входящими в состав желчи или адсорбирующимися на поверхности кристаллизующихся частиц. Валентные колебания связи N–H с широкой полосой в области 3400 см–1 соответствуют колебаниям аминогруппы в билирубине, аминокислотах или протеинах, адсорбированных на поверхности карбоната кальция. При этом полоса при 1050–1100 см–1 описывает валентные колебания связей O–H и C–N соответственно в пигментах желчи и холестерине, входящих в ее состав. На валентные асимметричные колебания C–O в CO2 указывает пик при 2350 см–1. В спектрах наблюдаются также валентные (1650 см–1) и деформационные (3740 см–1) колебания связей в молекуле воды. В спектрах четырех образцов присутствуют идентичные по положению и интенсивности полосы колебаний, соответствующих группировке атомов в ионе ${\text{CO}}_{3}^{{2 - }}$. Это невырожденное симметричное изменение длин валентных связей (ν1(${\text{CO}}_{3}^{{2 - }}$)) при 1068 см–1, дважды вырожденное состояние деформации противолежащих углов между связями (ν2(${\text{CO}}_{3}^{{2 - }}$)) при 866–875 см–1, трижды вырожденные асимметричные изменения длин валентных связей (ν3(${\text{CO}}_{3}^{{2 - }}$)) при 1420–1475 см–1, трижды вырожденные асимметричные изменения длины одной из связей с изменением валентных углов (ν4(${\text{CO}}_{3}^{{2 - }}$)) при 720 см–1 [33]. Такой набор характеристических частот в ИК-спектре образцов указывает на присутствие в них кальцита и аморфного CaCO3 [7].
Таким образом, изменений в структурно-групповом составе между образцами 1–4 не выявлено. При сравнении образцов 3 и 4, полученных в присутствии альбумина разной концентрации, установлено, что при двукратном увеличении концентрации альбумина незначительно возрастает интенсивность поглощения – на 3400 см–1 (связь N–H), что свидетельствует об усилении разного рода взаимодействий между альбумином и карбонатом кальция.
В сравнении с рассмотренными выше образцами спектр образца 5 имеет отличия. При 2500 см–1 выявлена полоса, соответствующая валентным колебаниям связи S–H в молекулах серосодержащих аминокислот (цистеин, метионин), вероятно, также адсорбированных на поверхности порошка. Колебания ν3(${\text{CO}}_{3}^{{2 - }}$) сформировали узкую полосу высокой интенсивности при 1440–1490 см–1, в отличие от таковых в предыдущих образцах. При 875 см–1 наблюдается четкий пик колебаний ν2(${\text{CO}}_{3}^{{2 - }}$). Отмечено смещение колебаний ν4(${\text{CO}}_{3}^{{2 - }}$) в область 745 см–1. Совокупность полученных значений характеристических частот для ${\text{CO}}_{3}^{{2 - }}$ свидетельствует о том, что полученный образец 5 представлен фазой ватерита [7].
Результаты оптической микроскопии синтезированных порошков находятся в согласии с данными РФА и ИК-спектроскопии (рис. 4). Анализ морфологии полученных кристаллов осуществляли сравнением с литературными данными [7], при этом наблюдали сходство формы частиц полиморфных модификаций карбоната кальция. Для образцов 1–4 отмечено присутствие кристаллов неправильной формы, часто сросшихся между собой (такие кристаллы характерны для аморфного CaCO3), а также наличие в смеси кристаллов кубической или ромбоэдрической формы (структура кальцита). Качественные отличия отмечены для образца 5: кристаллы имеют сферическую форму (характерно для ватерита), больший размер и число.
Таким образом, по результатам РФА, ИК-Фурье-спектроскопии и оптической микроскопии можно сделать вывод о том, что природа и концентрация добавок, вводимых в желчь, а также величина пересыщения осадкообразующих ионов могут оказывать влияние на природу кристаллизующихся фаз карбоната кальция. Отмечено, что качественные изменения в фазовом составе происходят в присутствии всех НАК и альбумина в совокупности при их максимально допустимой физиологической концентрации в желчи человека. Некоторые авторы [36] указывают на то, что присутствие аспарагиновой кислоты и холестерина при осаждении карбоната кальция из водных растворов стимулирует образование ватерита наряду с кальцитом, однако при выдержке в растворе в течение 96 ч образующийся метастабильный ватерит почти полностью превращается в кальцит, в то время как в полученном образце 5 ватерит представлен в качестве основной фазы карбоната кальция и остается устойчивым даже после выдержки в модельном растворе в течение 120 ч. Поэтому можно предположить, что особое влияние на фазообразование и устойчивость карбоната кальция оказывает какая-то одна из вводимых НАК либо комбинация нескольких таких аминокислот между собой, с альбумином или же с компонентами желчи.
Полученные в работе результаты указывают на актуальность и важность исследования минералообразования в желчи человека на модельных системах для выявления механизмов, установления функциональных зависимостей и определения причин образования желчных камней.
ЗАКЛЮЧЕНИЕ
В результате термодинамического и экспериментального моделирования процесса кристаллизации карбоната кальция в модельном растворе желчи человека установлено, что НАК практически не влияют на образование малорастворимого соединения (CaCO3), однако изменяют качественный фазовый состав образующихся порошков. При средних физиологических концентрациях глицин, глутаминовая кислота и альбумин по отдельности не вносят изменений в состав синтезируемых образцов по сравнению с карбонатом кальция, полученным в модельном растворе только желчи. Однако при увеличении их концентрации до максимально допустимой в условиях совместного присутствия они способствуют образованию метастабильной модификации карбоната кальция – ватерита в качестве преобладающей фазы.
Список литературы
Butler M.F., Glaser N., Weaver A.C. et al. // Cryst. Growth Des. 2006. V. 6. № 3. P. 781. https://doi.org/10.1021/cg050436w
Lee T., Chen J.G. // Cryst. Growth Des. 2009. V. 9. № 8. P. 3737. https://doi.org/10.1021/cg900440p
Tlili M.M., Amor M.B., Gabrielli C. et al. // J. Raman Spectrosc. 2001. V. 33. P. 10. https://doi.org/10.1002/jrs.806
Леончук С.С., Голованова О.А. // Вестник Омск. ун-та. 2019. Т. 24. № 2. С. 66. https://doi.org/10.25513/1812-3996.2019.24(2).66-73
Голованова О.А. Желчные камни: монография. Омск: Наука, 2012. 126 с.
Киселев М.М., Вартанян М.А., Кирсанова С.В. и др. // Успехи в химии и хим. технологии. 2015. Т. 29. № 7. С. 41.
Al Omari M.M.H., Rashid I.S., Qinna N.A. et al. // Profiles of Drug Substances, Excipients and Related Methodology / Ed. Brittain H.G. V. 41. Burlington: Academic Press, 2016. P. 31. https://doi.org/10.1016/bs.podrm.2015.11.003
Tollefson J. // Nature. 2018. V. 563. P. 613. https://doi.org/10.1038/d41586-018-07533-4
Griffith E.M., Paytan A., Caldeira K. et al. // Science. 2008. V. 322. P. 1671. https://doi.org/10.1126/science.1163614
Ваганов Е.А., Круглов В.В., Васильев В.Г. Природные индикаторы изменений климата: учебное пособие. Красноярск: Изд-во СФУ, 2008. 151 с.
Машина Е.В., Макеев Б.А., Филиппов В.Н. // Изв. Томск. политехн. ун-та. 2015. Т. 326. № 1. С. 34.
Golovanova O.A. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1530. https://doi.org/10.1134/S0036023618120094
Golovanova O.A., Chikanova E.S. // Crystallogr. Reports. 2015. V. 60. № 6. P. 970.
Korolkov V., Golovanova O., Kuimova M. // Biogenic – Abiogenic Interactions in Natural and Anthropogenic Systems. https://doi.org/10.1007/978-3-319-24987-2
Acalovschi M., Lammert F. // World Gastroenterology News. 2012. V. 17. № 4. P. 6.
Тихонов Д.Г. // Якутский медицинский журнал. 2015. № 4. С. 91.
Njeze G.E. // Nigerian J. Surgery. 2013. V. 19. № 2. P. 49. https://doi.org/10.4103/1117-6806.119236
Вахрушев Я.М., Хохлачева Н.А. // Архив внутренней медицины. 2016. Т. 29. № 3. С. 30. https://doi.org/10.20514/2226-6704-2016-6-3-30-35
Stinton L.M., Shaffer E.A. // Gut and Liver. 2012. V. 6. № 2. P. 172.
Stinton L.M., Myers R.P., Shaffer E.A. // Gastroenterology Clinics of North America. 2010. V. 39. № 2. P. 157.
Pal'chik N.A., Stolpovskaya V.N., Moroz T.N. et al. // Russ. J. Inorg. Chem. 2003. Т. 48. № 12. С. 1921. [Пальчик Н.А., Столповская В.Н., Мороз Т.Н. и др. // Журн. неорган. химии. 2003. Т. 48. № 12. С. 2080.]
Vedantam S., Ranade V.V. // Sadhana. 2013. V. 38. № 6. P. 1287.
Valavi M. Crystallisation thermodynamics: Master’s thesis submitted to … Limerick. Ireland, 2016. P. 62.
Корольков В.В. Физико-химические закономерности образования дисперсий в системе CaCl2–(NH4)2C2O4–H2O: дис. … канд. хим. наук. Омск, 2018. 132 с.
Fadeeva T.V., Golovanova O.A. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 690.
Izmailov R.R., Golovanova O.A., Tserikh Y.V. et al. // Russ. J. Inorg. Chem. 2016. Т. 61. № 7. С. 817. [Измайлов Р.Р., Голованова О.А., Церих Ю.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 7. С. 856.]
Haynes A.-W. Xu, Dong W.-F., Antonietti M., Colfen H. // Adv. Funct. Mater. 2008. V. 18. № 8. P. 1307.
Koniqsberqer E., Koniqsberqer L. // Pure Appl. Chem. 2001. V. 73. № 5. P. 785.
Solodyankina A., Nikolaev A., Frank-Kamenetskaya O. et al. // J. Mol. Struct. 2016. V. 1119. P. 484. https://doi.org/10.1016/j.molstruc.2016.04.080
Almarshad H.A., Badawy S.M., Alsharari A.F. // Combinatorial Chem. High Throughput Screening. 2018. V. 21. P. 495.
Hayakawa S., Hajima Y., Qiao S. et al. // Anal. Sci. 2008. V. 24. P. 835.
Страхов А.В., Гордецов А.С. // Клиническая медицина. 2012. Т. 2. С. 86.
Егоров Н.Б., Шагалов В.В. Инфракрасная спектроскопия редких и рассеянных элементов. Томск, 2012. 20 с.
Golovanova O.A., Tomashevsky I.A. // J. Phys. Chem. 2019. V. 93. № 1. P. 11. [Голованова О.А., Томашевский И.А. // Журн. физ. химии. 2019. Т. 93. № 1. С. 11.]
Gonen M., Ozturk S., Balkose D. et al. // Ind. Eng. Chem. Res. 2010. V. 49. P. 1732.
Франке В.Д., Бочаров С.Н. Морфология кристаллов карбоната кальция в присутствии аспарагиновой кислоты, желатина и холестерина. Докл. на XI Съезде РМО. СПб, 2010. С. 160.
Дополнительные материалы
- скачать Golovanova.docx
- Таблица S1. Содержание аминокислот в плазме крови человека [29].
Инструменты
Журнал неорганической химии