Журнал неорганической химии, 2020, T. 65, № 4, стр. 528-533
Исследование фазовых равновесий в трехкомпонентных системах RbCl–RbI–Rb2CrO4 и CsCl–CsI–Cs2CrO4
Е. М. Егорова a, *, И. К. Гаркушин a, И. М. Кондратюк a, О. А. Тарасова a
a Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: dvoryanova_kat@mail.ru
Поступила в редакцию 05.11.2019
После доработки 21.11.2019
Принята к публикации 27.11.2019
Аннотация
Методом дифференциального термического анализа исследованы трехкомпонентные системы MCl–MI–M2CrO4 (M = Rb, Cs) и определены характеристики (температура плавления, содержание компонентов) сплавов составов, отвечающих точкам нонвариантных равновесий. Изученные системы относятся к ряду однотипных систем, которые образуются при замене катиона щелочного металла в соответствии с увеличением порядкового номера в Периодической системе. Все двухкомпонентные системы, входящие в трехкомпонентные системы, образуют эвтектики. На основании элементов огранения высказано предположение об образовании в трехкомпонентных системах эвтектических точек. Низкоплавкие эвтектические смеси из галогенидов и хроматов щелочных металлов обладают химической стойкостью даже в расплавленном состоянии, низкой вязкостью и малой летучестью, что делает их пригодными для использования в качестве теплоаккумулирующих материалов или электролитов для химических источников тока. При рассмотрении систем MCl–MI–M2CrO4 (M = Li, Na, K, Rb, Cs) cделан вывод о том, что замена в них катиона щелочного металла не влияет на морфологию ликвидуса.
ВВЕДЕНИЕ
Применению физико-химического анализа для разработки материалов функционального назначения посвящено множество работ. Солевые смеси, обладающие существенной электропроводностью, могут использоваться для получения расплавляемых электролитов [1, 2]. Системы из солей щелочных металлов могут также служить смесями для органического синтеза и электролитического выделения веществ [3, 4]. Ведутся работы по усовершенствованию антигололедных составов [5], а также систематические исследования многокомпонентных конденсированных систем, в частности из галогенидов и кислородсодержащих солей щелочных металлов [6–9]. Важной областью исследований фазовых равновесий и ионного обмена является качественное и количественное прогнозирование термодинамических характеристик, активностей ионов, типов ликвидусов трех- и более компонентных систем [10–12].
Цель настоящей работы – экспериментальное исследование трехкомпонентных систем из солей рубидия и цезия, принадлежащих ряду систем MCl–MI–M2CrO4 (M = Li, Na, K, Rb, Cs). Две системы данного ряда – NaCl–NaI–Na2CrO4 и KCl–KI–K2CrO4 – изучены ранее [13].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проводили методом дифференциального термического анализа в стандартном исполнении [14]. Использовали реактивы марки “х. ч.” (RbCl, RbI, Rb2CrO4, CsCl, Cs2CrO4) и “ч. д. а.” (CsI). Все реактивы были предварительно обезвожены. Температуры плавления и полиморфного превращения (Тα ⇄ β(Rb2CrO4) = 730°С, Тα ⇄ β(Cs2CrO4) = 800°С) индивидуальных солей соответствовали справочным данным [15]. Составы выражены в молярных долях эквивалентов (экв. %).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
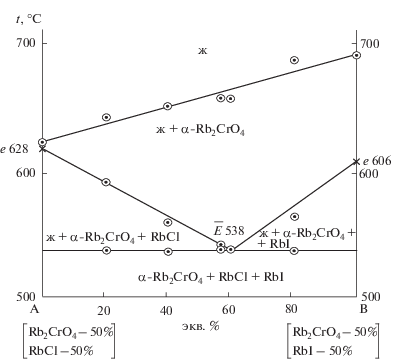
Треугольник составов исследованной трехкомпонентной системы RbCl–RbI–Rb2CrO4 представлен на рис. 1. Системы RbCl–Rb2CrO4, RbCl–RbI и RbI–Rb2CrO4 исследованы ранее в работах [16, 17].
Рис. 1.
Треугольник составов трехкомпонентной системы RbCl–RbI–Rb2CrO4 и расположение политермического разреза AB.
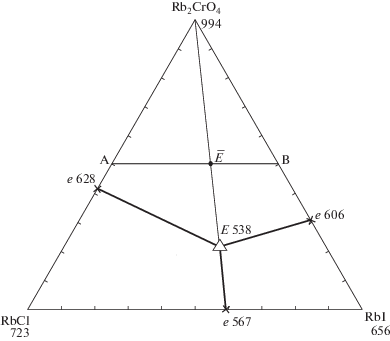
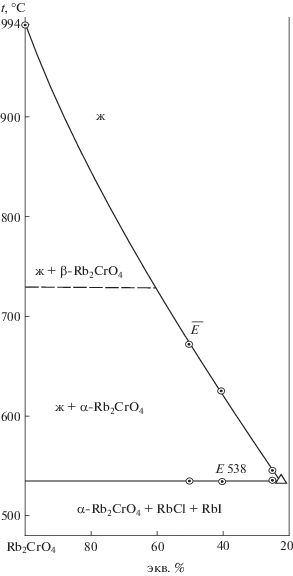
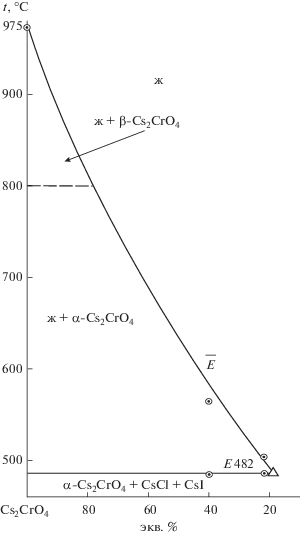
Изученный экспериментально политермический разрез, выбранный в поле соединения хромата рубидия, имеет соотношение компонентов в точках: A [Rb2CrO4 – 50%, RbCl – 50%], B [Rb2CrO4 – 50%, RbI – 50%]. Из Т–х-диаграммы разреза (рис. 2) выявлено соотношение хлорида и иодида рубидия (точка $\bar {E}$) в тройной эвтектике Е и ее температура плавления. Последующим изучением разреза Rb2CrO4 → Е → E (рис. 3) определен состав тройной эвтектики Е: 538°С, Rb2CrO4 – 22%, RbCl – 31%, RbI – 47%.
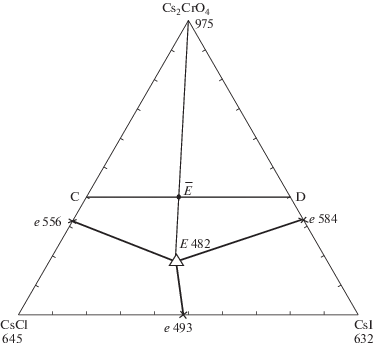
Треугольник составов трехкомпонентной системы CsCl–CsI–Cs2CrO4 показан на рис. 4. Ограняющие системы CsCl–CsI и CsCl–Cs2CrO4 исследованы в [16]. Справочные данные по двухкомпонентной системе CsI–Cs2CrO4 отсутствуют. Экспериментальное исследование показало образование в этой системе эвтектики с температурой плавления 584°С и содержанием CsI 67%.
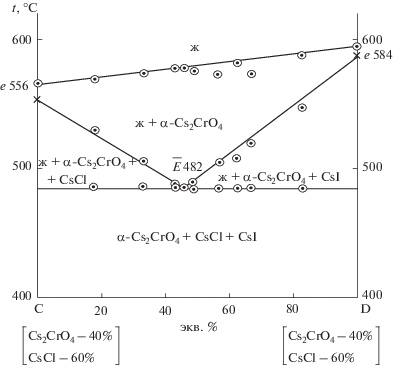
Изученный экспериментально политермический разрез, выбранный в поле соединения хромата цезия, имеет соотношение компонентов в точках: C [Cs2CrO4 – 40%, CsCl – 60%], D [Cs2CrO4 – 40%, CsI – 60%]. Из Т–х-диаграммы разреза (рис. 5) выявлено соотношение хлорида и иодида цезия (точка $\bar {E}$) в тройной эвтектике Е и ее температура плавления. В ходе изучения разреза Cs2CrO4 → Е → E (рис. 6) определен состав тройной эвтектики Е: 482°С, Cs2CrO4 – 18%, CsCl – 45%, CsI – 37%.
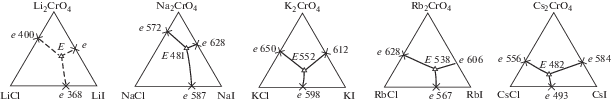
На рис. 7 представлен массив трехкомпонентных систем MCl–MI–M2CrO4 (M = Li, Na, K, Rb, Cs). В данном ряду все ограняющие двухкомпонентные системы являются эвтектическими, и, как следствие, во всех трехкомпонентных системах наблюдается образование эвтектик, что подтверждают экспериментальные исследования. Единственная система, образованная солями лития, не изучена вследствие гигроскопичности иодида лития. Обезводить иодид лития сложно, так как он возгоняется и плавится в виде кристаллогидратов. Поэтому работать с безводным иодидом лития необходимо в инертной атмосфере или в токе иодоводорода [18].
Существует ряд методик и подходов, позволяющих провести качественный прогноз ликвидуса трехкомпонентной системы [19–21]. Анализ ряда систем позволяет с большой вероятностью спрогнозировать характер ликвидуса в системе LiCl–LiI–Li2CrO4. Поскольку все системы ряда эвтектические, в литиевой системе также прогнозируется образование трехкомпонентной эвтектики. На рис. 7 прогноз моновариантных линий нанесен пунктиром.
Таким образом, полученные в настоящей работе экспериментальные данные дополняют информацию по системам MCl–MI–M2CrO4 и являются справочным материалом по фазовым равновесиям в конденсированных системах с общим катионом – щелочным металлом.
Поверхность кристаллизации в системе RbCl–RbI–Rb2CrO4 представлена полями хлорида, иодида и хромата рубидия, линии моновариантных кривых сходятся в трехкомпонентной эвтектике. В системе CsCl–CsI–Cs2CrO4 наблюдается аналогичный ликвидус с полями кристаллизации хлорида, иодида и хромата цезия.
Фазовые равновесия элементов трехкомпонентных систем представлены в табл. 1.
Таблица 1.
Фазовые реакции, протекающие в трехкомпонентных системах RbCl–RbI–Rb2CrO4 и CsCl–CsI–Cs2CrO4
| Элемент диаграммы | Фазовая реакция |
|---|---|
| RbCl–RbI–Rb2CrO4 | |
| Точка E | ж ⇄ RbCl + RbI + α-Rb2CrO4 |
| Моновариантные линии: | |
| e628–E538 | ж ⇄ RbCl + α-Rb2CrO4 |
| e606–E538 | ж ⇄ RbI + α-Rb2CrO4 |
| e567–E538 | ж ⇄ RbCl + RbI |
| CsCl–CsI–Cs2CrO4 | |
| Точка E | ж ⇄ CsCl + CsI + α-Cs2CrO4 |
| Моновариантные линии: | |
| e556–E482 | ж ⇄ CsCl + α-Cs2CrO4 |
| e584–E482 | ж ⇄ CsI + α-Cs2CrO4 |
| e493–E482 | ж ⇄ CsCl + CsI |
Список литературы
Masset P., Poinso J.-Y., Schoeffert S. et al. // J. Electrochem. Soc. 2005. V. 152. № 2. P. A405. https://doi.org/10.1149/1.1850861
Sveinbjörnsson D., Christiansen A.S., Viskinde R. et al. // J. Electrochem. Soc. 2014. V. 161. № 9. P. A1432. https://doi.org/10.1149/2.1061409jes
Semwal R., Ravi C., Kumar R. et al. // J. Org. Chem. 2019. V. 84. № 2. P. 792. https://doi.org/10.1021/acs.joc.8b02637
Ge J., Wang S., Hu L. et al. // Carbon. 2016. V. 98. P. 649. https://doi.org/10.1016/j.carbon.2015.11.065
Danilov V.P., Frolova E.A., Kondakov D.F. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 1165. [Данилов В.П., Фролова Е.А., Кондаков Д.Ф. и др. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 984.]https://doi.org/10.1134/S0036023619090067
Rasulov A.I., Akhmedova P.A., Gamataeva B.Yu. // Russ. J. Inorg. Chem. 2019. V. 64. № 1. P. 135. https://doi.org/10.1134/S0036023619010169 [Расулов А.И., Ахмедова П.А., Гаматаева Б.Ю. // Журн. неорган. химии. 2019. Т. 64. № 1. С. 99.
Ignat’eva E.O., Dvoryanova E.M., Garkushin I.K. // Russ. J. Inorg. Chem. 2017. V. 62. № 2. P. 236. [Игнатьева Е.О., Дворянова Е.М., Гаркушин И.К. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 245.]https://doi.org/10.1134/S0036023617020073
Ghosh S., Ganesan R., Sridharan R. et al. // J. Phase Equilibria Diffusion. 2018. V. 39. № 6. P. 916. https://doi.org/10.1007/s11669-018-0695-3
Ghosh S., Ganesan R., Sridharan R. et al. // Thermochim. Acta. 2017. V. 653. P. 16. https://doi.org/10.1016/j.tca.2017.03.024
Garcia E., Rodriguez L., Ferro V. et al. // Fluid Phase Equilibria. 2019. V. 498. P. 132. https://doi.org/10.1016/j.fluid.2019.07.002
Cui R.Z., Li W., Dong Y.P. // J. Chem. Eng. Data. 2019. V. 64. № 10. P. 4206. https://doi.org/10.1021/acs.jced.9b00271
Si H.J., Jiang Y.X., Tang Y. et al. // J. Magnesium Alloys. 2019. V. 7. № 3. P. 501. https://doi.org/10.1016/j.jma.2019.04.006
Likhacheva S.S., Dvoryanova E.M., Garkushin I.K. // Russ. J. Inorg. Chem. 2016. V. 61. № 1. P. 99. [Лихачева С.С., Дворянова Е.М., Гаркушин И.К. // Журн. неорган. химии. 2016. Т. 61. № 1. С. 105.]https://doi.org/10.1134/S0036023616010149
Егунов В.П. Введение в термический анализ. Самара, 1996. 270 с.
Термические константы веществ. Справочник / Под ред. Глушко В.П. М.: ВИНИТИ, 1981. Вып. X. Ч. 2. 300 с.
Посыпайко В.И., Алексеева Е.А. Диаграммы плавкости солевых систем. Ч. III. Двойные системы с общим катионом. М.: Металлургия, 1979. 204 с.
Burchakov A.V., Dvoryanova E.M., Kondratyuk I.M. // Russ. J. Inorg. Chem. 2015. V. 60. № 4. P. 511. [Бурчаков А.В., Дворянова Е.М., Кондратюк И.М. // Журн. неорган. химии. 2015. Т. 60. № 4. С. 572.]https://doi.org/10.1134/S0036023615040038
Коровин С.С., Зимина Г.В., Резник А.М. и др. Редкие и рассеянные элементы. Химия и технология. М.: МИСИС, 1996. Кн. I. 376 с.
Громаков С.Д. // Журн. физ. химии. 1981. Т. 24. № 6. С. 641.
Луцык В.И. Анализ поверхности ликвидуса тройных систем. М.: Наука, 1987. 150 с.
Гаркушин И.К., Кондратюк И.М., Дворянова Е.М. и др. Анализ, прогнозирование и экспериментальное исследование рядов систем из галогенидов щелочных и щелочноземельных элементов. Екатеринбург: УрО РАН, 2006. 148 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии