Журнал неорганической химии, 2020, T. 65, № 4, стр. 495-516
Структурное разнообразие катионных комплексов меди(II) с нейтральными азотсодержащими органическими лигандами в соединениях с кластерными анионами бора и их производными (обзор)
В. В. Авдеева a, *, Е. А. Малинина a, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 02.11.2019
После доработки 02.12.2019
Принята к публикации 04.12.2019
Аннотация
Обобщены сведения об известных на настоящий момент комплексных соединениях меди(II) с нейтральными азотсодержащими лигандами (2,2'-бипиридил, 1,10-фенантролин, 2,2'-бипиридиламин, аминогуанидин, аммиак, производные пиридинов и др.) с кластерными анионами бора, в том числе содержащими мостиковые группы ОН–, ${\text{CO}}_{3}^{{2 - }}$ и др. Рассмотрены моно-, ди-, три-, тетраядерные и полимерные комплексы меди(II), обсуждена геометрия координационных полиэдров меди(II), особенности строения комплексных соединений и способы их получения. В качестве противоионов выбраны кластерные анионы бора [B10H10]2–, [B12H12]2–, [B10Cl10]2–, [B20H18]2– и их производные (замещенные производные, карбораны, металлокарбораны).
ВВЕДЕНИЕ
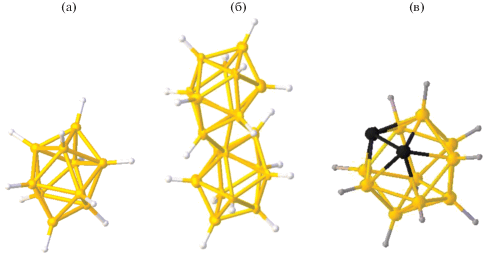
Высшие полиэдрические бороводородные анионы [BnHn]2– (n = 6–12), а также их аналоги (карбораны и металлокарбораны [1–4]) относятся к уникальным объектам современной неорганической и элементоорганической химии [5]. Особенности их геометрического и электронного строения позволяют выделить этот класс соединений в самостоятельный раздел химии бора. Элементарный бор способен образовывать полиядерные и каркасные структуры, и это свойство проявляется в огромном многообразии образуемых им боратов (производные борной кислоты, классификация которых описана в недавнем обзоре [6]) и боргидридов (кластерные анионы бора) [1–4]. Строение представителей кластерных анионов бора, рассмотренных в настоящей работе, а именно декагидро-клозо-декаборатного аниона [B10H10]2– и его димерного аналога октадекагидро-эйкозаборатного аниона [B20H18]2–, а также строение о-карборана представлено на рис. 1.
Изучению химической связи в кластерных анионах бора посвящено большое количество статей и обзоров как в отечественной, так и в зарубежной литературе. Рассмотрение всех подходов к решению этой задачи выходит за рамки настоящей работы. Отметим, что особенности химического поведения кластерных анионов бора и их производных (кинетическая стабильность, термическая устойчивость, многообразие реакций замещения с сохранением борного остова) связаны в первую очередь с трехмерной ароматичностью этих объектов [7–9].
Наиболее изучаемыми направлениями использования кластерных анионов бора и их производных традиционно считались области науки, связанные с высокой энергоемкостью гидридных соединений бора. Позднее интерес к кластерным соединениям бора вырос вследствие высокой нейтронопоглощающей способности атома бора, поэтому кластерные анионы бора было предложено использовать для создания прочных термостойких полимерных нейтронозащитных покрытий с хорошей адгезией к различным материалам, нейтронозащитных тканей и материалов [10–12] и контрастных агентов для МРТ-диагностики [13]. Кроме того, комплексные соединения металлов с кластерными анионами бора могут использоваться как экстрагенты тяжелых металлов, прекурсоры металлоборидных соединений сложного состава, координационные полимеры, соединения с высокой энергоемкостью и т.д. [14–17].
Проблемы химии кластерных анионов бора, их строения, некоторые теоретические вопросы, физико-химические свойства, способность к замещению экзо-полиэдрических атомов водорода на различные функциональные группы с сохранением борного остова описаны в недавних обзорах [18–21]. Изучение координационной способности кластерных анионов бора показало, что они образуют комплексы с металлами, которые относятся к “мягким кислотам” по Пирсону [22] (такие как медь(I), серебро(I), золото(I), свинец(II) [23, 24]), тогда как с металлами-комплексообразователями в высоких степенях окисления (например, Fe(III), Co(III)) кластерные анионы выступают в роли восстановителя, снижая степень окисления металла, а в некоторых случаях приводя к получению замещенных производных [25].
Среди металлов-комплексообразователей медь(II) изучается особенно интенсивно (см., например, работы [26–31]). Этот легко доступный и весьма распространенный металл в степени окисления +2 образует огромное число комплексных соединений различного состава и строения, включая моно-, би-, три-, тетраядерные комплексы и другие многоядерные соединения, в том числе полимерные, гетеровалентные и гетерометалические соединения. Некоторые классы комплексных соединений меди(II) и особенности их строения и магнитных свойств обобщены в недавних обзорах [32–35].
Координационная способность кластерных анионов бора в реакциях комплексообразования меди(II) в настоящее время активно изучается, и те немногие сведения, которые встречаются в вышеперечисленных обзорах, не могут охватить современные результаты, связанные с решением проблем синтеза новых структур, содержащих атомы меди(II), и их физико-химических свойств.
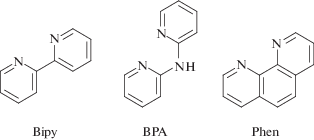
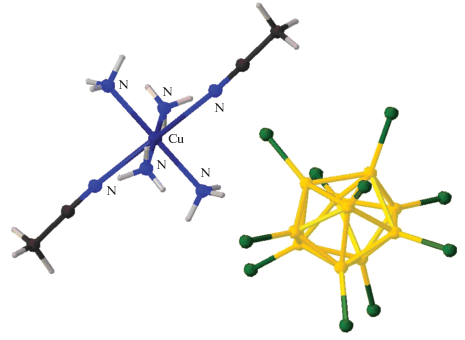
В настоящем обзоре мы ограничились рассмотрением комплексов меди(II) с кластерными анионами бора и их производными (замещенными производными, карборанами, металлоборанами) с нейтральными N-содержащими лигандами. Чаще всего в качестве лигандов для получения комплексных соединений используют азагетероциклы 2,2'-бипиридил (Bipy), 1,10-фенантролин (Phen) и 2,2'-бипиридиламин (BPA), строение которых представлено на рис. 2. Строение других органических лигандов, описываемых в работе, представлено на рисунках соответствующих комплексов.
Отметим, что в Кембриджской базе данных CCDC [36] присутствует более 4500 соединений меди с тремя выбранными лигандами: более 2100 для Bipy, более 2200 для Phen и около 400 для BPA. Понимание основных принципов формирования комплексных соединений, разнообразия их геометрии, влияния методов синтеза на их строение и свойства предоставляет неограниченные возможности направленного синтеза соединений меди(II) с заданными свойствами.
В настоящем обзоре рассмотрены моно-, би-, три- и тетраядерные комплексные соединения меди(II) с кластерными анионами бора и их производными. Несмотря на то что кластерные анионы бора не образуют прямых связей с атомами меди(II), в силу природы кластерных анионов бора в структурах рассматриваемых комплексов зачастую встречаются вторичные взаимодействия CuII…H(B) с ВН-группами анионов [BnHn]2–, что влияет на строение соединений и может приводить к образованию полимерных структур или супрамолекулярных ассоциатов.
МОНОЯДЕРНЫЕ КОМПЛЕКСЫ МЕДИ(II) С ЛИГАНДАМИ L
В литературе описано большое число моноядерных комплексов меди(II) с нейтральными лигандами L (L = Bipy, BPA, Phen) различного состава и строения. В образуемых соединениях атомы меди(II) имеют КЧ = 4, 5 и 6. Моноядерные комплексы с бидентатными лигандами L можно разделить на плоскоквадратные [CuL2]2+ (КЧ = 4), трис-хелатные [CuL3]2+ (КЧ = 6) и смешанолигандные комплексы [CuLx${\text{L}}_{y}^{'}$]. В последних комплексах в качестве лиганда L' могут выступать не только бидентатные лиганды, но и галогенид-ионы, молекулы растворителя, производные халькогенов и другие N-донорные лиганды (КЧ = 4, 5, 6).
Комплексы меди(II) с КЧ = 5
Для меди(II) характерно образование комплексных соединений с КЧ = 5. В этом случае координационный полиэдр атома меди представляет собой тригональную бипирамиду или тетрагональную пирамиду. Поскольку в настоящем обзоре мы в основном рассматриваем бидентатные лиганды L, образование моноядерных комплексов с КЧ = 5 возможно в случае присутствия монодентатного лиганда L' в составе соединения (например, атома Cl–).
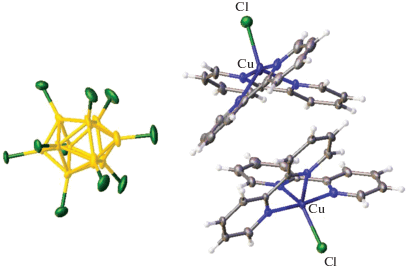
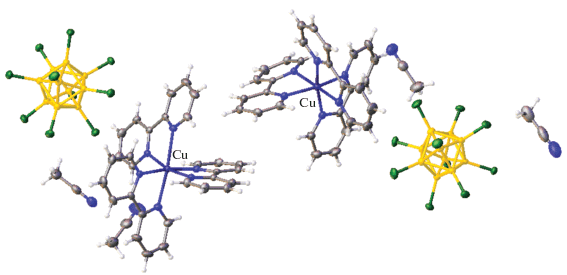
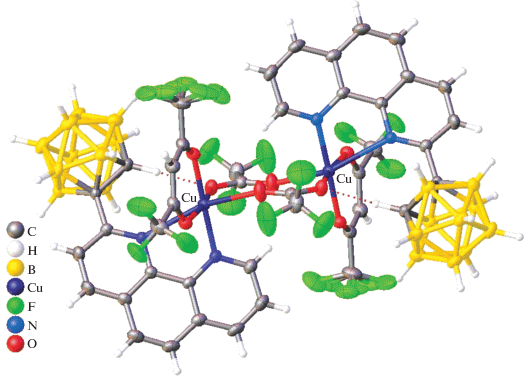
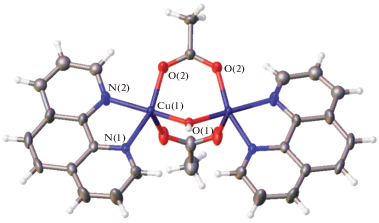
Ранее методом РСА было установлено строение комплексных соединений [CuL2Cl][An] (L = = Bipy, Phen) с кластерными анионами бора [B12H12]2–, [B20H18]2– и [B10Cl10]2– состава [Cu(Phen)2Cl]2[B12H12] [37], [Cu(Bipy)2Cl]2[B12H12] · · 2DMF [38], [Cu(Bipy)2Cl]2[B10Cl10] · 2DMF [39], [Cu(Phen)2Cl]2[B10Cl10] · DMSO · 1.25H2O [39]. В полученных соединениях атом меди(II) находится в тригонально-бипирамидальном окружении. Катионные комплексы [CuL2Cl]2+ образуются при взаимодействии CuCl с двукратным избытком L на воздухе и выводятся из реакционных растворов с соответствующими кластерными анионами бора. Строение комплекса [Cu(Bipy)2Cl]2[B10Cl10] · 2DMF показано на рис. 3.
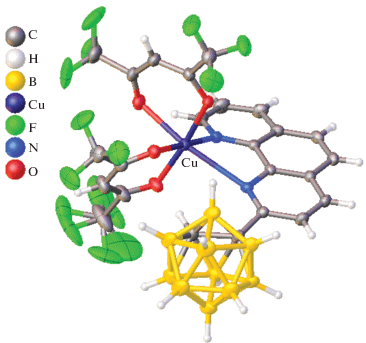
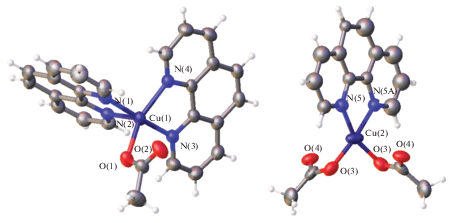
Отметим, что наличие борных кластеров в соединениях меди(II) не приводит к образованию связей между атомами металла и борным кластером. Этот факт можно объяснить с позиций теории жестких и мягких оснований Пирсона: связь между ВН-группой борного кластера, который относится к мягким основаниям по Пирсону, реализуется с мягкими кислотами, такими как медь(I) [23, 24], тогда как с медью(II) кластеры бора либо не образуют контактов, либо участвуют в нековалентных взаимодействиях. Между тем введение кислородсодержащих функциональных групп в борный кластер приводит к образованию связей между борным кластером и атомом меди(II) за счет функциональных групп заместителя. Так, в работе [40] описан синтез и строение комплексов меди(II) с карборанилкарбоксилатным лигандом [1,2-C2B10H10(1-CH3)(2-COO)]– и пиридином (py). Тетрагонально-пирамидальное окружение атома меди(II) образовано двумя атомами кислорода карбоксилатной группы заместителя, двумя атомами азота молекул py и атомом кислорода координированной молекулы воды, которая находится в вершине пирамиды (рис. 4). В структуре наблюдается дополнительная стабилизация за счет внутримолекулярных водородных связей.
Комплексы меди(II) с КЧ = 6
При КЧ = 6 в случае образования трис-хелатных комплексов координационный полиэдр вокруг атома меди(II) представляет собой октаэдр (либо искаженный октаэдр, тетрагональную бипирамиду). Среди моноядерных комплексов меди(II) с кластерными анионами бора известны трис-хелатные комплексы [Cu(Phen)3][B12H12] · · 0.45CH2I2 · 1.55CH3CN [38], [Cu(Bipy)3][B20H18] [41], [Cu(Bipy)3][B10Cl10] · 2Bipy [39]. Соединения образуются при взаимодействии CuSO4 и трехкратного избытка лиганда L (Bipy или Phen) в присутствии кластерного аниона. Если снизить соотношение L : Cu до 2 : 1 или 1 : 1, образуются смешанолигандные комплексы [Cu(BPA)2(DMF)2][B12H12] · · DMF и [Cu(Bipy)(DMF)4][B12H12] [37], в которых внутренняя координационная сфера металла достраивается молекулами растворителя. Комплексы состоят из катионных комплексов меди(II) октаэдрической геометрии и соответствующих кластерных анионов бора. Для перхлорированного аниона [B10Cl10]2– изучено строение [Cu(Bipy)3][B10Cl10] · · 2CH3CN (рис. 5) [39]. В отличие от других представленных соединений меди(II), в этом соединении присутствует по два кристаллографически неэквивалентных катиона [Cu(Bipy)3]2+ и аниона [B10Cl10]2– и четыре молекулы ацетонитрила (рис. 5). Кластерный анион бора не влияет на строение катионной части и выступает в качестве противоиона.
Катионный комплекс [Cu(Phen)3]2+ присутствует в составе соединения с металлокарбораном [Cu(Phen)3][Co(C2B9H11)2]2 ∙ CH3CN, которое получено при взаимодействии водных растворов соли меди(II) c раствором Phen в ацетатном буфере в присутствии металлокарборана Cs[Co(C2B9H11)2] [42] (рис. 6). Позднее авторы провели низкотемпературное исследование соединения методом РСА и уточнили его структуру [43].
Кроме того, комплекс [Cu(Phen)3]2+ входит в состав гетеровалентных смешанокатионных соединений меди(I)/меди(II) с кластерными анионами бора общей формулы [CuI(Phen)2]2[CuII(Phen)3][BnHn]2 (n = 10 [44], 12 [38]), которые образуются при взаимодействии соли меди(I) c Phen в ацетонитриле в присутствии кластерного аниона бора [B10H10]2– или [B12H12]2–. Методом РСА установлено, что соединения изоструктурны и состоят из комплексных катионов меди(II) состава [CuII(Phen)3]2+ (октаэдрическое окружение меди), меди(I) состава [(CuI(Phen)2]+ (тетраэдрическое окружение меди) и кластерного аниона бора [В10Н10]2– или [B12H12]2– соответственно.
Комплексы меди(II) с КЧ = 4 + 2
Для меди характерно получение комплексных соединений, в которых происходит искажение координационного полиэдра (октаэдра) и его вытягивание вдоль аксиальной оси. Обычно это явление наблюдается, если лиганды, образующие плоскоквадратное окружение атома меди, и аксиальные лиганды имеют разную природу. Подобного рода комплексы получены для ряда соединений с кластерными анионами бора. Для аниона [B10Cl10]2– описано соединение [Cu(NH3)4(CH3CN)2][B10Cl10] (рис. 7) [39], в котором медь находится в плоскоквадратном окружении, образованном молекулами аммиака, а молекулы ацетонитрила достраивают координационную сферу атома меди до 4 + 2. Комплекс получен при взаимодействии ацетата меди(II) и аммиака в системе H2O/CH3CN в присутствии соли (Et3NH)2[B10Cl10].
Для фенантролинилзамещенного 1,2-клозо-карборана получен комплекс меди(II) с гексафторацетилацетонатными лигандами {[1-Phen-1,2- C2B10H10]Cu(Hfac)2}, в котором окружение меди образовано атомами азота фенантролинового заместителя и четырьмя атомами кислорода двух ацетилацетонатных лигандов. Расстояния Cu…O и Cu…N в плоскости квадрата составляют 1.9641(17)–1.9494(17) и 1.9997(2) Å соответственно, тогда как расстояния Cu…O и Cu…N в аксиальном направлении составляют 2.2902(18) и 2.643 Å (рис. 8) [45].
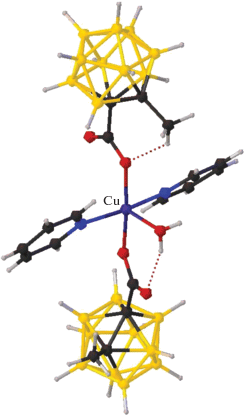
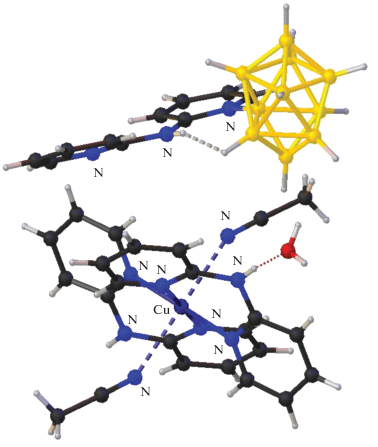
Среди комплексов меди(II) с замещенными производными кластерных анионов бора описан комплекс [Cu(BPA)2(NCCH3)2][2-B10H9BPA]2 ∙ 2H2O, полученный при взаимодействии [Cu2[B10H10]] с лигандом BPA в ацетонитриле при проведении реакции на воздухе при низкой температуре (–20°С) [46, 47]. В роли заместителя в борном кластере выступает азагетероциклический лиганд L, участвующий в реакции комплексообразования. Установлено, что замещенное производное [2-B10H9BPA]– (рис. 9) находится во внешней сфере смешанолигандного моноядерного катионного комплекса Cu(II). Атом меди находится в плоскоквадратном окружении, образованном молекулами хелатирующих лигандов BPA, а молекулы ацетонитрила достраивают координационную сферу металла до 4 + 2.
Рис. 9.
Строение смешанолигандного моноядерного комплекса меди [Cu(BPA)2(NCCH3)2][2-B10H9BPA]2 ∙ 2H2O.
Достраивание координационной сферы металла может происходить за счет взаимодействий с ВН-группами кластерных анионов бора. При этом моноядерные комплексы меди(II) в плоскоквадратном окружении за счет вторичных взаимодействий между атомами меди(II) и ВН-группами кластерных анионов бора образуют полимерные цепи. На рис. 10а представлено строение полимерного комплекса {[Cu(Phen)2][B10H10]}n [44], полученного при взаимодействии CuSO4 и избытка Phen в присутствии соли клозо-декаборатного аниона в системе DMF/Н2О. Установлено, что атомы Cu(II) находятся в плоскоквадратном окружении, образованном двумя молекулами Phen, а анионы [B10H10]2– достраивают КЧ атома меди(II) до 4 + 2. Каждый клозо-декаборатный анион координирует два атома меди(II), соединяя фрагменты [Cu(Phen)2]2+ в бесконечные цепи. Расстояния Cu…B и Cu…H составляют 3.545(17) и 2.85(19) Å соответственно.
Рис. 10.
Фрагмент структур полимерных комплексов {[Cu(Phen)2][B10H10]}n (а) и {[Cu(Phen)2][B12H12]}n (б).
Аналогичный комплекс получен для клозо-додекаборатного аниона {[Cu(Phen)2][B12H12]}n [38] (рис. 10б). Атом меди координирует четыре атома азота двух молекул Phen. Координационный полиэдр атома меди(II) дополнен двумя атомами водорода BH-групп аниона [B12H12]2–, образуя слабые взаимодействия В(1)–H(1)…Cu (H…Cu 2.85 Å, B…Cu 3.765(7) Å, угол BHCu 131°), которые связывают катионы и анионы в полимерные цепи. Отметим, что для аниона [B12H12]2– получен аналогичный полимерный комплекс меди(II) с лигандом BPA состава [Cu(BPA)2][B12H12]]n [38], имеющий сходное строение.
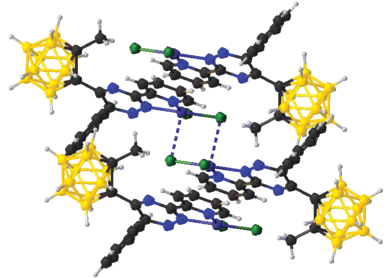
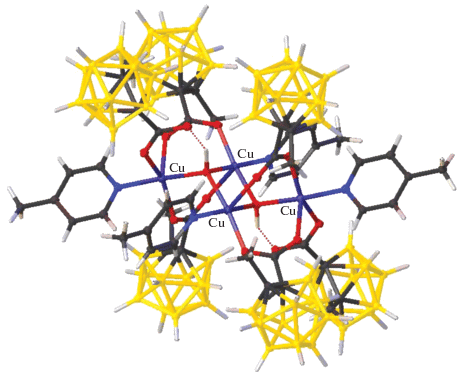
Аналогичные вторичные связи обнаружены в полимерном комплексе меди(II) с аминогуанидином (Agu) и анионом [B12H12]2– (рис. 11). При взаимодействии (НAgu)2[B12H12] с CuSO4 в воде получен полимерный комплекс сложного состава {[Cu0.61H0.78(Agu)2][B12H12]}n [48]. Структура соединения построена из сокристаллизующихся соединений [Cu(Agu)2[B12H12]] и (HAgu)2[B12H12]. Плоскоквадратное окружение атома Cu(II) образуют атомы N(1) и N(4) двух молекул органического лиганда Agu, замыкающих пятичленные хелатные циклы. В структуре комплексные катионы [Cu(Agu)2]2+ и анионы [B12H12]2– за счет взаимодействий Сu…H(1) между атомами меди(II) и ВН-группами объединены в полимерные цепи. Кроме того, между катионами и анионами осуществляются многочисленные вторичные взаимодействия (N)H…H(B), формирующие трехмерный каркас. Таким образом, образование комплекса [Cu0.61H0.78(Agu)2][B12H12] можно рассматривать как результат изоморфного замещения двух ионов Н+ на один ион меди Cu2+.
Комплексы меди(II) с КЧ = 4
Примеров комплексных соединений меди(II) в плоскоквадратном окружении с нейтральными органическими лигандами и кластерными анионами бора в качестве противоионов в базе данных CCDC сравнительно немного. Это обусловлено тенденцией атома меди(II) достраивать координационную сферу до более высоких значений КЧ = 5 или 6, которые рассмотрены выше. Реализация КЧ = 4 происходит в случае стерических затруднений, не позволяющих атому меди(II) достроить координационную сферу до более высокого КЧ.
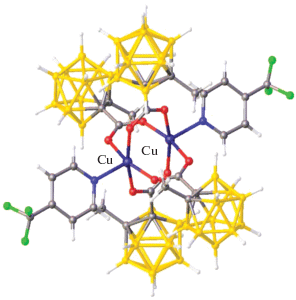
В литературе известно смешанокатионное соединение меди(II)/меди(II) с анионом [B10Cl10]2– в качестве противоиона [Cu(Phen)2(CH3CO2)]2[B10Cl10] ∙ ∙ [Cu(Phen)(CH3CO2)2] [49]. Это соединение состоит из нейтрального комплекса меди(II) [Cu(Phen)(CH3CO2)2], в котором атом меди(II) находится в плоскоквадратном окружении, построенном молекулой Phen и ацетатными группами, и катионного комплекса меди(II) [Cu(Phen)2(CH3CO2)]+, в котором медь находится в тригонально-бипирамидальном окружении, образованном двумя молекулами Phen и ацетатной группой. Вид обоих комплексов меди в составе соединения представлен на рис. 12.
Рис. 12.
Молекулярная структура катионных комплексов меди в составе соединения [Cu(Phen)2(CH3CO2)]2[B10Cl10] ∙ ∙ [Cu(Phen)(CH3CO2)2].
Для карборанов описан комплекс меди(II) с замещенным производным карборана и 2,6-диметилпиридином (рис. 13) [40, 50]. Плоскоквадратное окружение меди(II) образовано атомами азота органического лиганда (Cu–N 2.022 Å) и атомами кислорода карбоксилатной группы (Cu–O 1.942 Å). В структуре можно отметить образование внутримолекулярных водородных связей. Аналогичный комплекс для незамещенного пиридина описан в работе [51].
Авторам [52] удалось синтезировать комплекс меди(II), содержащий производное тетрабензопорфирина с о-карбораном (рис. 14). Полученное соединение растворяется в воде и, как оказалось, нетоксично по отношению к клеткам фибробластов легких хомяка V79. Аналогичный комплекс меди(II) получен авторами [53] с производным порфирина, содержащим фенильное производное о-карборана. В обоих комплексах медь(II) находится в вынужденном плоскоквадратном окружении.
БИЯДЕРНЫЕ КОМПЛЕКСЫ МЕДИ(II) С ЛИГАНДАМИ L
Биядерные комплексы меди(II) c нейтральными лигандами L и кластерными анионами бора в качестве противоионов представлены комплексами меди(II) с одной, двумя, тремя и четырьмя мостиковыми группами. При этом КЧ атома меди равно 5 или 6, координационный полиэдр вокруг атома меди представляет собой искаженную тетрагональную пирамиду или тригональную бипирамиду (КЧ = 5) либо октаэдр или тетрагональную бипирамиду (КЧ = 6).
Биядерные комплексы меди(II) с одной мостиковой группой
Для кластерных анионов бора синтезированы биядерные комплексы меди с мостиковой CO3-группой [Cu2(Phen)4(μ-CO3)]2+ и кластерными анионами бора [B10H10]2– и [B12H12]2– в качестве противоионов [44, 54, 55]. В силу особенностей строения мостиковая CO3-группа может по-разному координироваться к атомам меди, приводя к реализации изомеров с анти,анти- и анти,син-конфигурацией в катионном комплексе.
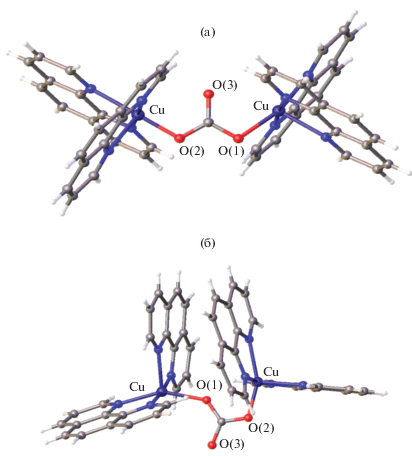
Для аниона [B10H10]2– подобраны условия селективного синтеза комплексов с анти,анти- и анти,син-конфигурацией мостиковой CO3-группы. Комплексы [Cu2(Phen)4(μ-CO3)][B10H10] ∙ 4DMF и [Cu2(Phen)4(μ-CO3)][B10H10] ∙ 2.5DMSO ∙ 2H2O [54] получены в результате окисления меди(I) при взаимодействии комплекса меди(I) [Cu2[B10H10]] и Phen на воздухе в смеси CH3CN/DMF или CH3CN/DMSO соответственно. Источником СО3-группы являлся СО2 воздуха. Катионная часть комплексов содержит анти,анти- (для системы CH3CN/DMF, рис. 15а) или анти,син- (для системы CH3CN/DMSO, рис. 15б) изомеры соответственно. Комплекс с анти,анти-конфигурацией мостиковой CO3-группы [44] синтезирован также в виде сольвата [Cu2(Phen)4(μ-CO3)][B10H10] ∙ ∙ 3.5DMF ∙ 1.25H2O в результате направленного синтеза из предварительно полученного комплекса меди(II) состава [Cu2(Phen)4(μ-CO3)]Cl2, содержащего CO3-группу в анти,анти-конфигурации. В комплексах основными структурными элементами являются димерные комплексные катионы [(Phen)2Cu(μ-CO3)Cu(Phen)2]2+ и анионы [В10Н10]2–. В структурах ион ${\text{CO}}_{3}^{{2 - }}$ служит мостиком между двумя комплексами [Cu(Phen)2]2+. Расстояния Cu…Cu в димерах с анти,син-конфигурацией (4.441 Å) существенно короче, чем в димерах с анти,анти-конфигурацией (5.288 Å), что приводит к существенному различию в свойствах. По данным ЭПР, атомы Cu(II) в комплексе [Cu2(Phen)4(μ-CO3)][B10H10] · 2.5DMSO · 2H2O с анти,анти-конфигурацией CO3-группы проявляют себя как индивидуальные “мономерные” комплексы, не связанные какими-либо обменными взаимодействиями. Спектр ЭПР соединения [Cu2(Phen)4(μ-CO3)][B10H10] ∙ 4DMF с анти,син-конфигурацией CO3-группы имеет признаки, присущие спектрам обменно-связанных димеров, включая “запрещенный” переход в “половинном” магнитном поле. При снижении температуры от 300 до 2 K магнитный момент, рассчитанный на один атом меди, снижается от 1.65 до 1.36 М.Б., что свидетельствует о слабом магнитном взаимодействии атомов меди. На основании данных ЭПР и магнитной восприимчивости [44] сделан вывод о наличии слабого магнитного взаимодействия атомов меди в комплексе с анти,син-конфигурацией CO3-группы.
Рис. 15.
Строение комплексного катиона [(Phen)2Cu(µ-CO3)Cu(Phen)2]2+ в димерах [Cu2(Phen)4(μ-CO3)][B10H10] ∙ ∙ 4DMF (а) и [Cu2(Phen)4(μ-CO3)] [B10H10] · 2.5DMSO · 2H2O (б) с анти,анти- и анти,син-конфигурацией мостиковой СО3-группы соответственно.
Для клозо-додекаборатного аниона получены аналогичные катионные комплексы меди(II) с анти,анти-конфигурацией мостиковой CO3-группы [Cu2(μ-CO3)(Bipy)4][B12H12] ∙ CH3CN, [Cu2(μ-CO3)(Bipy)4][B12H12] ∙ 2DMF ∙ H2O, [Cu2(μ-CO3)(Phen)4][B12H12] ∙ DMF ∙ H2O [55]. Комплексы содержат биядерные катионные комплексы [(CuL2)2(μ-CO3)]2+ с мостиковыми СО3-группами (L = Bipy и Phen), анионы [B12H12]2– и молекулы растворителей. В окружение атомов Cu входят четыре атома N двух молекул L и атом кислорода мостикового карбонатного аниона. Полиэдры атомов меди представляют собой искаженные вытянутые квадратные пирамиды с атомом азота в апикальной вершине. Расстояния Cu(1)…Cu(2) в катионном комплексе с Phen (5.107 Å) существенно короче, чем в комплексах с Bipy (5.460 и 5.361 Å).
Биядерные комплексы меди(II) с двумя мостиковыми группами
Среди биядерных комплексов меди с кластерными анионами бора описаны комплексы с двумя мостиковыми ОН-группами. Комплекс меди(II) с лигандом BPA состава [Cu2(BPA)2(μ-OH)2[B10H10]] получен при взаимодействии [Cu2[B10H10]] с BPA на воздухе в ацетонитриле [46]. Комплекс построен из димерных катионных комплексов [Cu(μ-OH)BPA]22+ и анионов [В10Н10]2– (рис. 16). Комплексный катион имеет уплощенное центросимметричное строение. Расстояние Cu(1)…Cu(1') в димере составляет 2.9180(14) Å. Окружение атома Cu2+ в форме искаженного квадрата образуют два атома N молекулы BPA и атомы О двух групп ОН–. Атомы Н(2) и Н(4) аниона [B10H10]2– образуют с атомами меди(II) контакты длиной 2.73 и 2.63 Å, достраивая координацию атома Cu2+ до 4 + 2. Взаимодействия Cu…H(B) объединяют катионы и анионы в цепочки. NH-группы молекул BPA вовлечены во взаимодействия с ВН-группами кластерного аниона бора, которые формируют в структуре слои.
Для фенантролинилзамещенного 1,2-клозо-карборана получен биядерный комплекс меди(II) с гексафторацетилацетонатными лигандами и трифторацетатным мостиком {[1-Phen-1,2-C2B10H10]Cu(Hfac)(CF3COO)}2, строение которого показано на рис. 17. Соединение представляет собой биядерный комплекс, в котором в окружение каждого металла входят атомы азота молекулы фенантролинового заместителя при карборане, атомы кислорода молекул гексафторацетилацетоната и атомы кислорода двух трифторацетатных групп, которые выступают в роли мостиковых лигандов [45].
Биядерный комплекс меди(II) получен для замещенного карборана [Cu[1-CH3-2-(Ph-C8H4N4)-1,2-клозо-C2B10H10]2Cl2], который в качестве заместителя содержит молекулу аза-производного 2,2'-бипиридила (рис. 18) [56]. Полученное соединение представляет собой димер, координационный полиэдр металла – плоскоквадратная пирамида, которая образована атомами азота лиганда, двумя атомами хлора, связанными с атомом меди, и координированным атомом хлора соседнего монономерного фрагмента. Замещенный карборан выступает в роли нейтрального хелатирующего лиганда.
Биядерные комплексы меди(II) с тремя мостиковыми группами
Примером биядерного комплекса меди(II) с тремя мостиковыми группами и нейтральными лигандами L является комплекс [Cu2(Phen)2(μ-CH3CO2)2(μ-OH)]2[B10Cl10] ∙ 3DMSO ∙ 0.5H2O [48], который получен из системы, содержащей ацетат меди(II), Phen и соль кластерного аниона бора [B10Cl10]2–. Комплекс получен в ходе длительного кипячения реагентов в DMSO (рис. 19). В полученном катионном комплексе [(Cu(Phen)(μ-CH3CO2))2(µ-OH)]+ координационный полиэдр каждого атома меди представляет собой квадратную пирамиду, образованную атомами кислорода ОН- и CH3COO-групп и атомами азота молекулы Phen с атомом О(2) в вершине пирамиды, тогда как атом Cu(1) сдвинут от основания пирамиды N2O2 на 0.242(3) Å. Расстояние Cu–O с атомом кислорода гидроксогруппы составляет 1.903(3) Å, соответствующее расстояние для двух ацетатных групп составляет 1.961(4) и 2.166(4) Å. Расстояние Cu…Cu равно 3.234(2) Å, угол CuOCu 116.1(3)°.
Биядерные комплексы меди(II) с четырьмя мостиковыми группами
Среди биядерных комплексов меди(II) получен ряд соединений с производным орто-дикарборана [1-CH3-2-CO2H-1,2-клозо-C2B10H10] и замещенными производными пиридина (L = Py, p-CF3-Py, p-CH3-Py, Pz и 4,4'-Bipy), которые выступают в качестве нейтральных терминальных лигандов [40, 50]. Взаимодействие солей меди(II) и дикарборана при комнатной температуре с лигандами L приводит к получению ряда структурно подобных биядерных комплексов Cu(II) состава [Cu2[1-CH3-2-COO-1,2-клозо-C2B10H10]4L2] (структура комплекса с L = p-CH3-Py представлена на рис. 20). В этом случае атомы меди связаны четырьмя мостиками, образованными производными дикарборана. Координационный полиэдр атома меди(II) представляет собой квадратную пирамиду, КЧ = 5.
ТРЕХЪЯДЕРНЫЕ КОМПЛЕКСЫ МЕДИ(II) С ЛИГАНДАМИ L
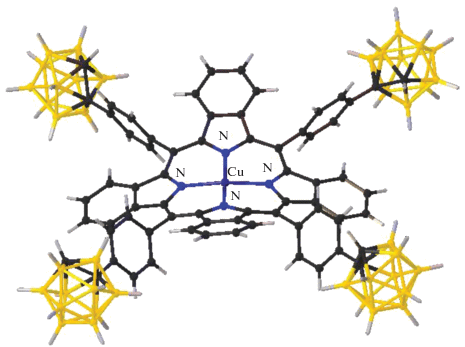
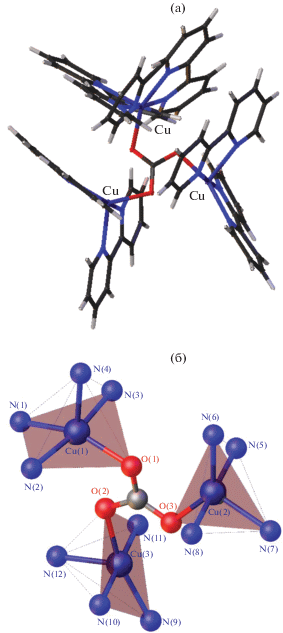
Единственный трехъядерный комплекс меди(II), содержащий кластерный анион бора в качестве противоиона, представляет собой соединение [Cu3(Bipy)6(μ3-CO3)][B12H12]2 ∙ 4.5DMF ∙ 2H2O, которое содержит мостиковую CO3-группу [57]. Соединение получено при взаимодействии [Ag2B12Н12] с хлоридом меди CuCl и лигандом Bipy при проведении реакции на воздухе в DMF. Соединение построено из трехъядерного катионного комплекса [Cu3(Bipy)6(μ3-CO3)]4+, аниона [B12H12]2– и сольватных молекул растворителей (DMF и воды) (рис. 21). Каждый атом О мостикового карбонатного аниона связан с одним атомом меди(II) за счет μ3-η1η1η1-координации. Катион имеет син,анти-конфигурацию по отношению ко всем связям С–O. Расстояния Cu–Cu в трехъядерном комплексе составляют 4.663, 4.666 и 4.888 Å. Пятикоординационное окружение атомов Cu(1), Cu(2) и Cu(3) состоит из четырех атомов N молекул Bipy и атома О карбонатной группы. По форме искаженные полиэдры атомов Cu(1) и Cu(3) ближе к тетрагональным пирамидам соответственно с атомами N(4) и N(12) в апикальных вершинах. Полиэдр атома Cu(2) лучше всего аппроксимируется тригональной бипирамидой с атомами N(5) и N(8) в апикальных вершинах.
Рис. 21.
Строение трехъядерного катионного комплекса меди(II) в соединении [Cu3(Bipy)6(μ3-CO3)][B12H12]2 ∙ 4.5DMF ∙ 2H2O.
Согласно Кембриджскому банку структурных данных [36], описаны кристаллические структуры шести соединений, которые содержат аналогичный катионный комплекс меди(II) Cat = = [Cu3(Bipy)6(μ3-CO3)]4+: Cat(BF4)4 ∙ EtOH ∙ 3H2O [58], Cat(ClO4)4 ∙ 0.5H2O [59], Cat(ClO4)4 ∙ 4EtOH ∙ ∙ 2H2O [60], Cat(ClO4)4 ∙ MeOH ∙ 2H2O [60], Cat(F3CSO3) ∙ 0.5H2O [61], и Cat(PF6)4 ∙ H2O [60]. В соединениях Cat(ClO4)4 ∙ MeOH ∙ 2H2O и Cat(PF6)4 ∙ H2O карбонатный лиганд связан с атомами меди μ3-η2η2η2- и μ3-η2η1η1-способами. В остальных четырех соединениях способ координации такой же, как и в рассматриваемом соединении c анионом [B12H12]2–. В катионных комплексах меди(II) всех перечисленных соединений форма двух полиэдров CuON4 лучше всего аппроксимируется тетрагональной пирамидой, а третьего — тригональной бипирамидой. Отметим, что для Phen известен аналогичный трехъядерный катионный комплекс меди(II) [Cu3(Phen)6(μ3-CO3)](CF3SO3) ∙ 0.5H2O [61]. В комплексном катионе [Cu3(Phen)6(μ3-CO3)]4+ все три сильно искаженных полиэдра CuON4 аппроксимируются тригональной бипирамидой.
ТЕТРАЯДЕРНЫЕ КОМПЛЕКСЫ МЕДИ(II) С ЛИГАНДАМИ L
Можно выделить ряд основных методов, которые авторы используют для синтеза тетраядерных комплексов меди с органическими лигандами L. Как правило, синтез включает следующие стадии: синтез солей меди(II) с неорганическим анионом (катионный обмен на ионообменной смоле); взаимодействие солей меди(II) с неорганическими анионами и органическими лигандами L при нагревании (гидротермальный метод); введение в реакционный раствор реагентов, обеспечивающих pH среды 8–9 (Na2CO3, OH–); длительная кристаллизация искомых соединений от 1 до 10 нед. Например, по описанной методике получены тетраядерные комплексы меди состава [Cu4(L)4(μ-OH)4](An)4 ∙ nH2O (L = Bipy, Phen; An = C6H5COO– [62], ClO4– [63], Cl– [64]).
Другой способ получения тетраядерных комплексов меди(II) заключается в окислении предварительно полученных комплексов меди(I), содержащих соответствующие лиганды L. Например, окислением комплекса меди(I) [Cu(CH3CN)4]BF4 в присутствии (pyMe)Et2TAC (Py — пиридин, TAC — триазациклогексан) на воздухе выделен комплекс меди(II) кубанового типа [((2-PyMe)Et2TAC)Cu(OH)]4(BF4)4 [65]. Сведения о комплексах кубанового типа, их классификация и способы получения подробно обсуждены в обзоре [35].
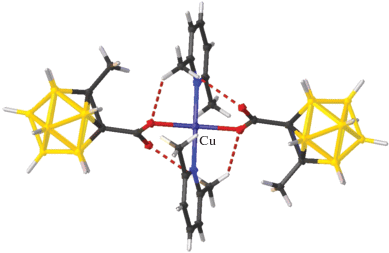
Среди соединений, содержащих кластерные анионы бора в качестве противоионов, есть всего пара примеров тетраядерных комплексов меди(II), которые имеют двухпалубное строение Z-типа (открытый кубан). Синтез, строение и магнитные свойства комплекса [Cu4(Bipy)4(μ-OH)4[B10H10]2(DMSO)2] описаны в работе [66]. Комплекс получен в ходе окислительно-восстановительной реакции при взаимодействии комплекса меди(I) состава [Cu2[B10H10]] с Bipy в смеси CH3CN/DMSO на воздухе. Данное соединение построено из тетраядерных комплексных катионов [Cu4(Bipy)4(μ-OH)4]4+, анионов [B10H10]2– и молекул DMSO (рис. 22a). Катион имеет центросимметричное двухпалубное строение Z-типа (рис. 22б). Атомы меди(II) имеют уплощенное окружение из двух атомов азота и двух атомов кислорода. Координацию двух атомов меди(II) в составе одной палубы до 4 + 1 дополняет атом Н(B) полиэдрического аниона или атом О гидроксогруппы соответственно. Комплекс изучен методом ЭПР-спектроскопии [66], приведена температурная зависимость магнитной восприимчивости в диапазоне температур от комнатной до температуры кипения жидкого азота.
Рис. 22.
Строение тетраядерного комплекса [Cu4(Bipy)4(μ-OH)4[B10H10]2(DMSO)2] (молекулы DMSO разупорядочены) (а); катионная часть [Cu4(Bipy)4(μ-OH)4]4+ (б).
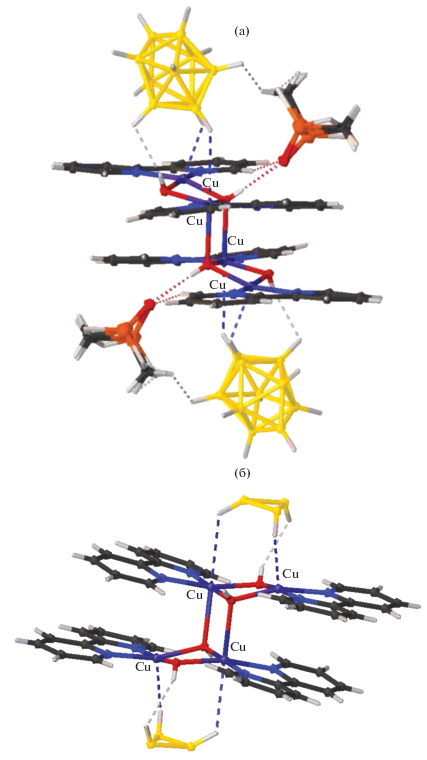
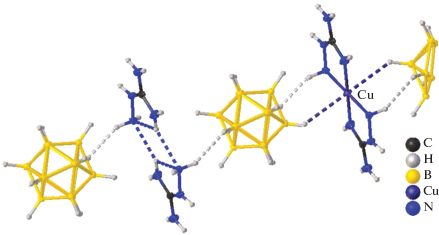
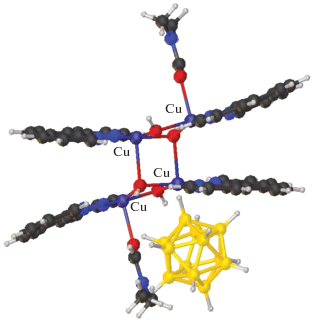
Описан синтез и строение смешановалентного комплекса меди(I)/меди(II) {[CuII4(Bipy)4(µ-OH)4][CuI2(B10H10)3]} ∙ 4СН3СN [67]. Это соединение получено по аналогичной реакции при взаимодействии комплекса меди(I) [Cu2[B10H10]] с Bipy при проведении реакции в ацетонитриле на воздухе. Анионная часть комплекса [CuI2[B10H10]3]4– представляет собой линейный олигомер, в котором оба атома меди(I) образуют по две трехцентровые связи (CuHB) с центральным и концевым анионами [В10Н10]2– (Cu–В(H) 2.139–2.205(8), Cu–H(В) 1.69–2.01 Å) (рис. 23). Комплексный катион [CuII4(Bipy)4(µ-OH)4]4+ имеет двухпалубное строение. В окружение каждого иона Cu2+ входит бидентатная молекула Bipy и две или три мостиковые ОН-группы, которые формируют квадрат или тетрагональную пирамиду. Группы ВН концевых анионов [B10H10]2– олигомера [CuI2[B10H10]3]4– достраивают координацию атомов Cu(II) до квадратной пирамиды (4+1) или до квадратной бипирамиды (4+1+1). Взаимодействия CuII…B(H) объединяют катионы [CuII4(Bipy)4(µ-OH)4]4+ и анионы [CuI2[B10H10]3]4– в цепочки. Концевые ВН-группы олигомера связывают металлоцентры, образуя мостики CuII…[В10Н10]2––CuI.
Рис. 23.
Фрагмент структуры смешановалентного комплекса меди(I)/меди(II) {[CuII4(Bipy)4(µ-OH)4][CuI2[B10H10]3]} ∙ ∙ 4СН3СN.
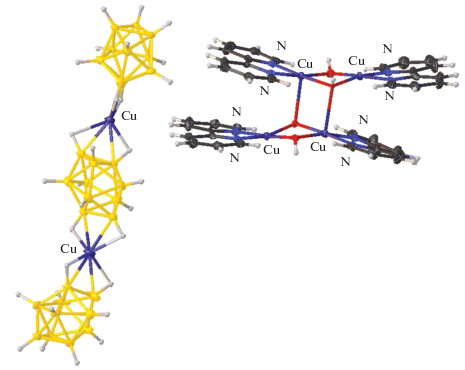
Получение и строение аналогичного тетраядерного комплекса меди(II) с анионом [B12H12]2– в качестве противоиона описано в [37]. Использование в качестве исходных реагентов комплекса [AgCs[B12H12]], хлорида меди CuCl и Phen приводит к выделению в качестве основного продукта тетраядерного комплекса [Cu4(μ-OH)4(Phen)4(DMF)2][B12H12]2. Соединение состоит из центросимметричных биядерных комплексных катионов [(Сu(Phen))(OH)2(Cu(Phen)DMF)]2+ и анионов [B12H12]2–. Каждая палуба построена из фрагментов [Cu(Phen)] и [Cu(Phen)DMF], которые соединены двумя OH-мостиками (рис. 24). Расстояние Cu(1)…Cu(2) 2.9402(3) Å является самым коротким расстоянием Cu–Cu в ядре комплексного катиона. Расстояния Cu(1)…Cu(1)' и Cu(1)…Cu(2)' составляют 3.1609(3) и 3.6374(4) Å.
Совершенно иное строение имеет тетраядерный комплекс с замещенным карборанилкарбоксилатным лигандом {[Cu4(Bipy)4(µ-OH)4] · [1,2-С2B10H10(1-CH3)(2-COO)]6(4-CH3-Py)4} (рис. 25). В соединении четыре атома меди(II) связаны друг с другом двумя мостиковыми ОН-группами и четырьмя мостиковыми карборанилкарбоксилатными лигандами, тогда как два других лиганда [С2B10H10(CH3)(COO)]– и молекулы аминопиридина выполняют роль терминальных лигандов [40].
ПОЛИЯДЕРНЫЕ ГЕТЕРОМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ФРАГМЕНТЫ КОМПЛЕКСОВ МЕДИ(II) С ЛИГАНДАМИ L
В литературе описан ряд гетерометаллических полиядерных соединений меди(II) с другими металлами (такими как родий и иридий), в которых можно выделить фрагменты комплексов меди(II). Координационные полиэдры меди(II) в них такие же, как в вышеописанных соединениях, в основном это тетрагональная пирамида (КЧ = 5) и искаженный октаэдр (4 + 2).
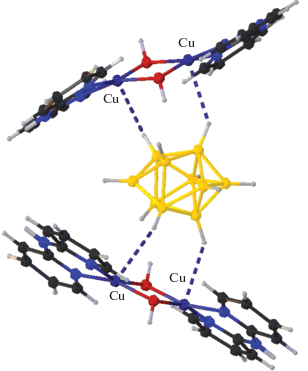
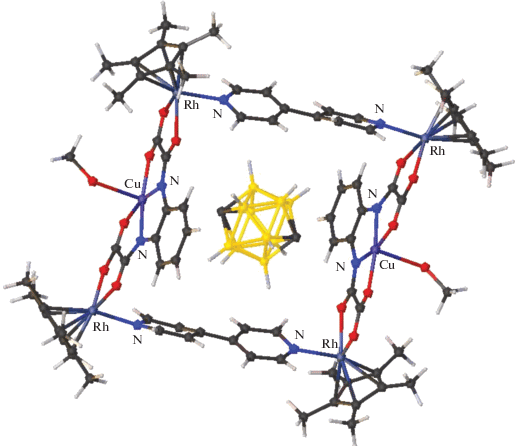
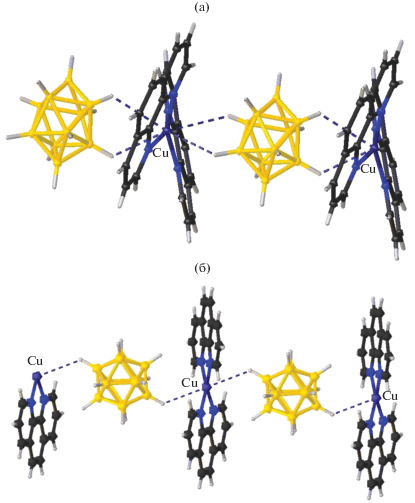
Авторы [68] разработали метод получения молекулярных колец Борромео, содержащих атомы меди и родия, путем самосборки без использования темплатного синтеза. Варьирование длины лигандов позволяет авторам синтезировать кольца различной длины, что позволяет внедрять в них молекулы различного диаметра, в том числе синтезирован комплекс с внедренной молекулой о-карборана (рис. 26).
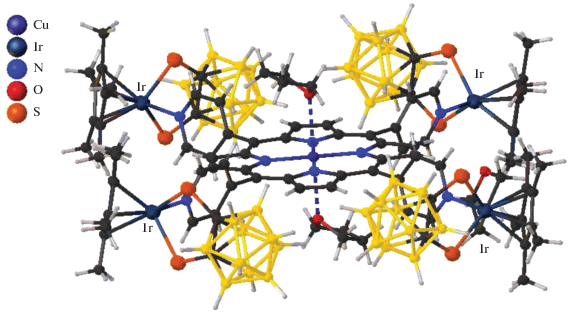
Порфиринкарборановые производные описаны в статье [69]. Авторы синтезировали четырехъядерный комплекс иридия с циклопентадиенильными лигандами, который координирует атомы серы дитиолатопроизводного 1,2-дикарборана и порфириновый комплекс меди(II), в котором вынужденное плоскоквадратное окружение меди, обусловленное строением органического лиганда, достраивается до КЧ = 6 двумя молекулами тетрагидрофурана (рис. 27). Комплекс синтезирован при взаимодействии моноядерного комплекса иридия Ir(Cp)S2[C2B10H10] и порфиринового комплекса меди(II) в THF.
ЗАКЛЮЧЕНИЕ
В настоящем обзоре обобщены сведения об известных на настоящий момент комплексах меди(II) с нейтральными органическими N-содержащими лигандами и кластерными анионами бора, их замещенными производными и аналогами (карборанами, металлокарборанами) в качестве противоионов. Описаны методы синтеза комплексных соединений и обсуждены особенности их строения, показано их структурное разнообразие.
Список литературы
Muetterties E.L., Balthis J.H., Chia Y.T. et al. // Inorg. Chem. 1964. V. 3. P. 444. https://doi.org/10.1021/ic50013a030
Muetterties E.L., Knoth W.H. Polyhedral Boranes. New York: Dekker, 1968.
Greenwood N.N., Earnshaw A. Chemistry of the Elements. Butterworth-Heinemann, 1997.
Boron Science: New Technologies and Applications / Ed. Hosmane N.S. CRC Press, 2012.
Abakumov G.A., Piskunov A.V., Cherkasov V.K. et al. // Russ. Chem. Rev. 2018. V. 87. № 5. P. 393. https://doi.org/10.1070/RCR4795
Topnikova A.P., Belokoneva E.L. // Russ. Chem. Rev. 2019. V. 88. № 2. P. 204. https://doi.org/10.1070/RCR4835
Bruce King R. // Chem. Rev. 2001. V. 101. № 5. P. 1119. https://doi.org/10.1021/cr000442t
Chen Z., King R.B. // Chem. Rev. 2005. V. 105. P. 3613. https://doi.org/10.1021/cr0300892
Кузнецов Н.Т., Ионов С.П., Солнцев К.А. Развитие концепции ароматичности: полиэдрические структуры. М.: Наука, 2009. 488 с.
Sivaev I.B. // Chem. Heterocycl. Comp. 2017. V. 53. P. 638. https://doi.org/10.1007/s10593-017-2106-9
Knoth W.H. Polyamides and Polyesters of Polyhedral Boron Compounds. Pat. 3354121 (USA).
Скачкова В.К., Грачев А.В., Гоева Л.В. и др. Пат. RU 2550156 C1 (10.05.2015).
Goswami L.N., Ma L., Chakravarty Sh. et al. // Inorg. Chem. 2013. V. 52. P. 1694. https://doi.org/10.1021/ic3017613
Plesek J. // Potential applications of the boron cluster compounds // Chem. Rev. 1992. V. 92. P. 269.
Sivaev I.B., Bregadze V.I., Kuznetsov N.T. // Russ. Chem. Bull. 2002. V. 51. P. 1362.
Sivaev I.B., Bregadze V.I. // Eur. J. Inorg. Chem. 2009. P. 1433.
Teixidor F., Viñas C., Demonceau A., Núñez R. // Pure Appl. Chem. 2003. V. 75. P. 1305. https://doi.org/10.1351/pac200375091305
Kuznetsov N.T. // Russ. J. Inorg. Chem. 2002. V. 47. P. 68.
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Sivaev I.B., Prikaznov A.V., Naoufal D. // Coll. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1021/cr050548u
Sivaev I.B., Bregadze V.I., Sjöberg S. // Coll. Czech. Chem. Commun. 2002. V. 67. P. 679. https://doi.org/10.1135/cccc20020679
Пирсон Р.Дж. // Успехи химии. 1971. Т. 40. № 7. С. 1259.
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. № 5. P. 60. https://doi.org/10.3390/cryst6050060
Avdeeva V.V., Malinina E.A., Goeva L.V., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2148. https://doi.org/10.1134/S0036023610140032
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Cherkasova T.G., Pervukhina N.V., Kurateva N.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 459. https://doi.org/10.1134/S0036023619040077
Chizhova N.V., Shinkarenko A.V., Zav’yalov A.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 732. https://doi.org/10.1134/S0036023618060062
Dyukova I.I., Kuz’menko T.A., Komarov V.Y. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 755. https://doi.org/10.1134/S107032841812014X
Pulya A.V., Seifullina I.I., Skorokhod L.S. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1472. https://doi.org/10.1134/S003602361811013X
Uraev A.I., Vlasenko V.G., Burlov A.S. et al. // Mendeleev Commun. 2018. V. 28. № 2. P. 205.
Tupolova Y.P., Shcherbakov I.N., Tkachev V.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 132. https://doi.org/10.1134/S1070328418020112
Пестов А.В., Слепухин П.А., Чарушин В.Н. // Успехи химии. 2015. Т. 84. С. 310. [Pestov A.V., Slepukhin P.A., Charushin V.N. // Russ. Chem. Rev. 2015. V. 84. № 3. P. 310.] https://doi.org/10.1070/RCR4461
Ardizzoia G., Brenna S. // Coord. Chem. Rev. 2016. V. 311. P. 53. https://doi.org/10.1016/j.ccr.2015.11.013
Adhikary Ch., Koner S. // Coord. Chem. Rev. 2010. V. 254. P. 2933.
Seppala P., Sillanpaa R., Lehtonen A. // Coord. Chem. Rev. 2017. V. 347. P. 98.
Groom C.R., Allen F.H. // Angew. Chem. Int. Ed. 2014. V. 53. P. 662. https://doi.org/10.1002/anie.201306438
Malinina E.A., Kochneva I.K., Polyakova I.N. et al. // Inorg. Chim. Acta. 2018. V. 477. P. 284. https://doi.org/10.1016/j.ica.2018.03.024
Malinina E.A., Kochneva I.K., Avdeeva V.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 10. P. 1210. https://doi.org/10.1134/S0036023619100085
Avdeeva V.V., Kravchenko E.A., Gippius A.A. et al. // Polyhedron. 2017. V. 127. P. 238. https://doi.org/10.1016/j.poly.2017.02.015
Fontanet M., Popescu A.-R., Teixidor F. et al. // Chem. Eur. J. 2011. V. 17. P. 13217. https://doi.org/10.1002/chem.201101929
Avdeeva V.V., Vologzhanina A.V., Buzin M.I. et al. // Chem. Eur. J. 2017. V. 23. № 66. P. 16 819. https://doi.org/10.1002/chem.201703285
Polyanskaya T.M., Volkov V.V., Drozdova M.K. // J. Struct. Chem. 2003. V. 44. № 4. P. 632. https://doi.org/10.1023/B:JORY.0000017939.50919.77
Polyanskaya T.M., Drozdova M.K., Volkov V.V. // J. Struct. Chem. 2010. V. 51. № 6. P. 1139, 2010. https://doi.org/10.1007/s10947-010-0173-1
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Inorg. Chim. Acta. 2015. V. 430. P. 74. https://doi.org/10.1016/j.ica.2015.02.029
Kozhevnikov D.N., Rusinov V.L., Chupakhin O.N. et al. // Organometallics. 2006. V. 25. P. 2972.
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2011. V. 440. P. 253. https://doi.org/10.1134/S0012500811090035
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2013. V. 58. P. 657. https://doi.org/10.1134/S003602361306003X
Polyakova I.N., Malinina E.A., Drozdova V.V. et al. // Crystallogr. Rep. 2009. V. 54. P. 831. https://doi.org/10.1134/S1063774509050149
Avdeeva V.V., Kravchenko E.A., Gippius A.A. et al. // Inorg. Chim. Acta. 2019. V. 487. P. 208. https://doi.org/10.1016/j.ica.2018.12.008
Fontanet M., Rodriguez M., Fontrodona X. et al. // Dalton Trans. 2015. V. 44. P. 10 399.
Huang S.-L., Weng L.-H., Jin G.-X. // Dalton Trans. 2012. V. 41. P. 11 657. https://doi.org/10.1039/c2dt30708a
Ongayi O., Gottumukkala V., Fronczek F.R. et al. // Bioorg. Med. Chem. Lett. 2005. V. 15. P. 1665.
Luguya R., Fronczek F.R., Smith K.M. et al. // Appl. Radiat. Isot. 2004. V. 61. P. 1117.
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2013. V. 58. P. 1527. https://doi.org/10.1134/S0036023614010045
Kochneva I.K., Polyakova I.N., Avdeeva V.V. et al. // Dokl. Chem. 2017. V. 474. P. 137. https://doi.org/10.1134/S0012500817060015
Galliamova L.A., Varaksin M.V., Chupakhin O.N. et al. // Organometallics. 2015. V. 34. P. 5285. https://doi.org/10.1021/acs.organomet.5b00736
Malinina E.A., Kochneva I.K., Polyakova I.N. et al. // Inorg. Chim. Acta. 2018. V. 479. P. 249. https://doi.org/10.1016/j.ica.2018.04.059
Albada G.A., Matikainen I., Roubeau O.S. et al. // Eur. J. Inorg. Chem. 2000. P. 2179.
Huang W., Sun P.-Y., Fang J.-L. et al. // Trans. Met. Chem. 2003. V. 28. P. 925.
Peng U.-X., Xu F., Yin G. et al. // J. Coord. Chem. 2012. V. 65. P. 3949.
Wannarit N., Chaichit N., Pakawatchai C. et al. // Russ. J. Coord. Chem. 2010. V. 36. P. 778. https://doi.org/10.1134/S107032841010009X
Zhou Y., Tian Y., Wu J. // Hecheng Huaxue (Chin.) (Chin. J. Synth. Chem.) 2010. V. 18. P. 40.
Li Y.-T., Li X.-W., Wu Z.-Y. et al. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 2020. V. 66. P. 211.
Zheng Y.-Q., Lin J.-L. // Z. Anorg. Allg. Chem. 2002. V. 628. P. 203
Köhn R.D., P. Zhida, Mahon M.F. et al. // Dalton Trans. 2003. P. 2269.
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2012. V. 442. P. 1. https://doi.org/10.1134/S0012500812010016
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Dokl. Chem. 2011. V. 437. P. 79. https://doi.org/10.1134/S001250081104001X
Huang S.-L., Lin Y.-J., Li Z.-H. et al. // Angew. Chem., Int. Ed. 2014. V. 53. P. 11218.
Wang J.-Q., Ren Ch.-X., Weng L.-H. et al. // Chem. Commun. 2006. P. 162.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии