Журнал неорганической химии, 2020, T. 65, № 3, стр. 403-412
Синтез биоактивного В-содержащего стекла и стеклокерамических материалов путем пиролиза жидкой органической фазы
Д. Н. Грищенко a, М. А. Медков a, Е. К. Папынов a, *, А. Б. Слободюк a, Е. Б. Меркулов a, Ю. Е. Скурихина b
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
b Тихоокеанский государственный медицинский университет Минздрава России
690002 Владивосток, пр-т Острякова, 2, Россия
* E-mail: papynov@mail.ru
Поступила в редакцию 03.10.2019
После доработки 24.10.2019
Принята к публикации 28.10.2019
Аннотация
В работе представлен оригинальный способ синтеза биоактивного стекла 45S5 Bioglass и стеклокерамики на его основе, легированных 5, 15, 25 и 60 мас. % бора, путем пиролиза смеси органических прекурсоров тетраэтоксисилана, трибутилфосфата, олеата натрия и олеата кальция в жидкой фазе. Высокое содержание бора (>25 мас. %) достигнуто замещением части SiO2 на B2O3 в составе образцов за счет использования высококонцентрированного органического раствора бора, полученного жидкостно-твердофазной экстракцией. Состав и физико-химические характеристики полученных биообразцов исследованы методами ИК-спектроскопии, ЯМР на ядрах 31Р, 11В, 29Si, РФА, РЭМ и ЭДС. Проведена оценка антибактериальных свойств биостекол при формировании на их поверхности биопленок условно-патогенных бактерий Pseudomonas aeruginosa различной морфологии в зависимости от концентрации бора в составе образцов. Перспектива представленного метода заключается в возможности синтеза биосовместимых борсодержащих стекол в виде объемных материалов, а также тонкослойных покрытий на поверхности и внутрипористом объеме инертных керамик, что позволит решать задачи в области костной имплантологии современной медицины.
ВВЕДЕНИЕ
Потребность медицины в материалах, используемых для замены или регенерации костной ткани, служит стимулом для разработки различных биоматериалов, в том числе и биоактивных стекол [1–4]. Биоактивные стекла относятся к классу керамики, способной взаимодействовать с костными тканями организма. Биостекло запускает реакции организма, отвечающие за восстановление костного дефекта за счет медленного растворения компонентов биостекла. Продукты растворения стимулируют пролиферацию остеогенных клеток, что способствует воспроизводству новых тканей. В процессе растворения на поверхности биостекла формируется биологически активный слой нанокристаллического гидроксиапатита, который обеспечивает прочную связь искусственного материала с костью и мягкими тканями [4–6].
Состав биостекол с оптимальными биосовместимыми свойствами (отсутствие токсичности, биоактивность в процессах остеокондукции и остеоиндукции, биорезорбируемость и др.) предложен Л. Хенчом под маркой “45S5 Bioglass” и включает в мас. %: 45 SiO2, 24.5 Na2O, 24.5 CaO, 6 P2O5 [7]. Однако в ряде исследований доказано, что биоактивные стекла, легированные бором, имеют еще более высокую биологическую активность, улучшенную биосовместимость и антибактериальные свойства по сравнению с традиционным биостеклом [8, 9]. Роль бора в организме человека определяется его участием в обмене жиров, углеводов, гормонов и витаминов. Кроме того, регулируя паратиреоидный гормон, бор косвенно воздействует на обмен магния, кальция, фосфора и витамина D, а также вовлечен в метаболизм костных тканей и принимает активное участие в ее формировании. Более того, бор влияет на жизненно важные процессы, включая эмбриогенез, рост костей и психомоторные навыки [10, 11]. Известно, что борсодержащее биостекло вызывает повышенную пролиферацию остеобластов в клетках [10], а контролируемое высвобождение бора из биостекла способствует улучшенной регенерации костных тканей [12, 13].
Для получения биостекол, в том числе содержащих бор, чаще используют золь-гель методы [12, 14, 15]. Однако процесс приготовления золя из исходных реагентов является достаточно длительным и занимает от одного дня [16] до одной недели [15]. Применяют также метод получения стекол в расплаве [17, 18]. Для этого используют смеси из SiO2, H3BO3, CaCO3, Na2CO3 и NaH2PO4 · 2H2O или SiO2, Na2O, CaO, P2O5, B2O3, которые плавят при 1300–1450°С. Указанные методы не позволяют получать покрытия из биоактивного стекла, повторяющие форму пор на пористых биоинертных носителях. В частности, предложенным в [16] методом получают порошок биоактивного стекла, поскольку пропитать гелем пористую керамику невозможно.
Метод пиролиза органических растворов был использован в работе [12] для получения каркасов из борсодержащих биоактивных стекол. Для этого готовили растворы, содержащие тетраэтилортосиликат, нитрат кальция, трибутилборат, триэтилфосфат и соляную кислоту в этаноле. Этим раствором несколько раз пропитывали полиуретановую губку и обжигали при температуре 700°С. В результате были получены пористые структуры содержащие мезо- и макропоры. Таким образом, использование органических растворов, содержащих компоненты стекла, позволяет пропитывать пористые структуры и получать биоактивные слои или каркасы. Но необходимо отметить, что в составе стекла, предложенного в работе [12], отсутствует такой важный компонент костной ткани, как натрий.
В связи с этим очевидный интерес может представлять способ прямого пиролиза органических растворов широкого компонентного состава, оригинальность которого заключается в возможности синтеза как объемных биостекол, так и тонкослойных биопокрытий на инертных керамических носителях с глубоким проникновением в их пористый объем, представляющих практический интерес в костной имплантологии.
Целью настоящего исследования явилась разработка способа синтеза биоактивных стекол состава 45S5 Bioglass, легированных 5, 15, 25 и 60 мас. % бора, и тонкослойных биопокрытий на их основе на пористой инертной керамике пиролизом органических прекурсоров в жидкой фазе. Оценка антибактериальных свойств биостекол в зависимости от содержания бора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Для получения биостекол использовали олеат натрия (C18H33O2Na, 98%), олеат кальция (C36H66O4Ca, 98%), скипидар (сульфатный, очищенный для органического синтеза), тетраэтоксисилан (C8H20O4Si, 99.5%), трибутилфосфат (C12H27O4P, 99%), бензол (C6H6, 99.8%). Для получения органического раствора бора использовали борную кислоту (H3BO3, 99.8%), три-н-октиламин (C24H51N, 98%) и 1-октанол (C8H18O, 99%).
Методика снтеза. В органический раствор, содержащий олеат натрия в скипидаре и тетраэтоксисилан, добавляли органический раствор олеата кальция в скипидаре с бензолом и трибутилфосфатом. Борную кислоту растворяли при температуре 180°С в смеси три-н-октиламина (ТОА) и 1-октанола (Ос) с соотношением ТОА : Ос = 1 : 1. Далее органический раствор, содержащий бор, в заданных пропорциях смешивали с раствором, содержащим остальные компоненты стекла. Борсодержащее биоактивное стекло получено замещением части SiO2 на B2O3 в составе биостекла 45S5 Bioglass (табл. 1).
Таблица 1.
Состав стекла 45S5
| Состав | Содержание, мас. % | Реагент | Количество, г |
|---|---|---|---|
| Na2O | 24.5 | C18H33O2Na | 2.088 |
| SiO2 | 45 | C8H20O4Si | 1.354 |
| CaO | 24.5 | C36H66O4Ca | 2.285 |
| P2O5 | 6 | C12H27O4P | 0.195 |
После смешивания всех необходимых компонентов выполняли отгонку растворителя при температуре 150–200°С. Полученную массу (прекурсор) переносили в тигель, подвергали пиролизу, нагревая в муфельной печи до 1300°С со скоростью 7 град/мин и выдерживали при этой температуре в течение 20 мин. После этого образец переносили в камеру отжига с температурой 520–550°С, выдерживали при этой температуре 2 ч, а затем охлаждали до комнатой температуры.
Микробиологические исследования. Микробиологические исследования (антибактериальная активность) заключались в оценке степени нарастания бактериальной пленки Pseudomonas aeruginosa на поверхности образцов биостекол с содержанием 0, 5, 15 мас. % B2O3. Образцы размещали в жидкой питательной среде с бактериальной культурой. Культивирование проводили при 37°С в течение 48 ч. Фиксацию биопленки на образце осуществляли путем промывки в 4%-ном формальдегиде с 1%-ным раствором фосфатного буфера и последующим воздействием 1%-ным раствором тетраоксида осмия в течение 1 ч. Обезвоживание проводили с помощью последовательной обработки в этаноле различной концентрации и при соответствующей экспозиции (30% – 10 мин, 50% – 10 мин, 70% – 10 мин, 96% – 10 мин, 100% – 20 мин), а затем в ацетоне 20 мин. Морфологию сформированных биопленок изучали с помощью электронной микроскопии на приборе Carl Zeiss Ultra 55 (Германия) c катодом на полевой эмиссии при ускоряющих напряжениях 1–5 кВ и токе пучка I ≈ 100 pA.
Методы исследования. Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре D8 Advance Bruker AXS (Германия) в CuKα-излучении с графитовым монохроматором. Кристаллические фазы образующихся на разных стадиях синтеза стекол определяли с использованием программы поиска EVA по базе порошковых данных PDF-2. Для исследования качественного и количественного элементарного состава, а также морфологии образцов использовали метод растровой электронной микроскопии (РЭМ). РЭМ-изображения образцов получали на электронном сканирующем микроскопе S5500 Hitachi (Япония). ИК-спектры регистрировали на вакуумном ИК-спектрометре Vertex 70V фирмы Bruker (Германия) при помощи приставки нарушенного полного внутреннего отражения (НПВО или ATR) в диапазоне частот 350–4000 см–1. Спектры ЯМР и MAS ЯМР 11B, 29Si, 31P регистрировали на спектрометре Avance AV-300 Bruker (Германия) при температуре 305 K. Частота вращения образца в MAS-экспериментах составляла 7 кГц. Измерение химических сдвигов (ХС) резонансных линий проводили методом замещения с использованием в качестве стандарта (C2H5O)2 ∙ BF3 (11B), тетраметилсилана (29Si) и 85%-ной H3PO4 (31P). Ошибка измерения ХС составляла 1.0 м.д. Разложение спектра на компоненты гауссовой формы проводили в самостоятельно разработанной программе с использованием модифицированного метода минимизации Ньютона. Ошибка подгонки кривой не превышала 8% от ее площади. Температуру стеклования Tg определяли методом дифференциальной сканирующей калориметрии на калориметре DSC-204 Netzch (Германия) в температурном интервале 30–650°С в платиновых тиглях, скорость нагревания 10 град/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее для получения биостекол нами был предложен метод пиролиза органических растворов [19, 20]. В качестве растворимых в органических растворителях компонентов стекла были использованы тетраэтоксисилан, трибутилфосфат и олеаты натрия и кальция. Отмечен ряд преимуществ получения биостекол этим методом. Метод позволяет вводить в стекло допирующие компоненты. Их удобно вводить в виде экстрактов в органических растворителях [21]. Для получения борсодержащего биостекла метод жидкостной экстракции не применялся, так как бор плохо экстрагируется из водных растворов. В связи с этим нами разработан метод жидкостно-твердофазной экстракции бора: борную кислоту растворяли в смеси ТОА с Ос при нагревании. При этом установлено что в Ос борная кислота не растворяется, но с ТОА она образует полибораты триоктиламмония с мольным отношением В : ТОА > 3. Именно они растворяются в органических растворителях, в частности в Ос. Метод жидкостно-твердофазной экстракции позволяет получить высококонцентрированный органический раствор бора: до 40 мас. % H3BO3 в смеси ТОА с Ос.
В настоящей работе исследованы условия получения и некоторые свойства борсодержащей стеклокерамики, полученной методом пиролиза органических растворов. Получены образцы с содержанием оксида бора 5, 15, 25 и 60 мас. %.
Рентгенофазовый анализ при обжиге прекурсоров с различным содержанием B2O3 в зависимости от температуры выявил фазы, представленные в табл. 2. Начиная с 500°С наряду с аморфной фазой образуются фосфаты натрия, кальция и комбеиты, среди которых, в соответствии с [22], соединение Na4Ca4Si6O18, которое может рассматриваться как предшественник фазы (Na15.78Ca3(Si6O12)).
Таблица 2.
Обжиг прекурсоров при различных температурах
| Состав прекурсора, мас. % | Фазы при обжиге | |||
|---|---|---|---|---|
| 500°С | 700°С | 1000°С | 1300°С | |
| 45 SiO2, 24.5 Na2O, 24.5 CaO, 6 P2O5 | р/а* Na2CaSi3O8 Na3PO4 Ca2SiO4 · Ca3(PO4)2 |
р/а Na2CaSi3O8 Na3PO4 Ca2SiO4 · Ca3(PO4)2 |
р/а Na2CaSi3O8 Na3PO4 Ca2SiO4 · Ca3(PO4)2 |
р/а |
| 40 SiO2, 24.5 Na2O, 24.5 CaO, 6 P2O5, 5 B2O3 | р/а Ca2SiO4 Na4Ca4(Si6O18) |
р/а Ca2SiO4 Na4Ca4(Si6O18) |
р/а Ca2SiO4 Na4Ca4Si6O18 |
р/а |
| 30 SiO2, 24.5 Na2O, 24.5 CaO, 6 P2O5, 15 B2O3 | р/а Ca2SiO4 Na15.78Ca3(Si6O12) |
р/а Ca2SiO4 Na15.78Ca3(Si6O12) |
р/а Ca2SiO4 Na15.78Ca3(Si6O12) |
р/а |
| 20 SiO2, 24.5 Na2O, 24.5 CaO, 6 P2O5, 25 B2O3 | р/а | р/а Na6Ca3Si6O18 Ca10(PO4)6(OH)2 |
р/а Na6Ca3Si6O18 Ca10(PO4)6O |
р/а Рефлексы Ca10(PO4)6O |
| 13.2 SiO2, 7.4 Na2O, 15.6 CaO, 3.8 P2O5, 60 B2O3 | р/а | р/а Ca10(PO4)6(OH)2 |
р/а Ca10(PO4)6O |
р/а Рефлексы Ca10(PO4)6O |
Предлагаемый метод позволяет варьировать содержание бора в широком диапазоне и получать стекла или стеклокерамику различных составов. При увеличении содержания бора в стекле, вероятно, происходит вытеснение фосфатного аниона из силикатной сетки стекла. Об этом свидетельствуют данные РФА для стекол с содержанием оксида бора >25% (табл. 2). Следует отметить появление в стекле фазы гидроксиапатита Ca10(PO4)6(OH)2, который является основной минеральной составляющей костной ткани, также активно синтезируется и исследуется учеными в качестве биоматериала [23]. При повышении температуры обжига гидроксиапатит трансформируется в оксиапатит, который впоследствии при взаимодействии со средой организма снова переходит в гидроксиапатит.
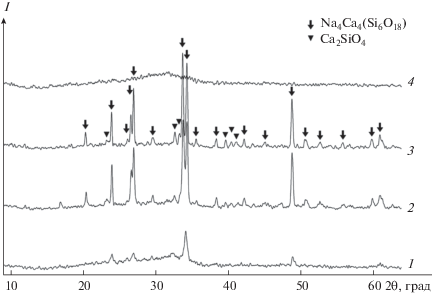
В качестве примера на рис. 1 приведены дифрактограммы продуктов обжига прекурсора с 5%-ным содержанием B2O3 при различных температурах. В интервале температур 500–1000°С в продуктах обжига на фоне рентгеноаморфной фазы присутствуют в основном две фазы: Ca2SiO4 и Na4Ca4(Si6O18), а при увеличении содержания бора в стекле появляются фазы фосфатов кальция, что, вероятно, говорит о вытеснении последних из силикатной сетки стекла. Это, как будет показано ниже, подтверждается данными MAS ЯМР 31P.
Рис. 1.
Дифрактограммы прекурсора с 5%-ным содержанием B2O3 после обжига при различных температурах: 1 – 500, 2 – 700, 3 – 1000, 4 – 1300°С.
Температура стеклования образцов колеблется в пределах 520–550°С (табл. 3). Для снятия напряжений и предотвращения растрескивания образцов полученные стекла во время охлаждения подвергали изотермической выдержке при температуре 520–550°С. Полученные при 1300°С стекла обнаруживают тенденцию к кристаллизации при дополнительной изотермической выдержке выше 650°С. Основной наблюдаемой фазой в продуктах кристаллизации стекла является Na6Ca3Si6O18, а при повышении содержания В2О3 > 5% дополнительно кристаллизуется Na6Ca3(PO4)5/2. При изотермической выдержке полученных образцов в камере отжига с температурой 700–750°С в зависимости от времени выдержки возможно получение как керамики, так и стеклокерамики, содержащей фазы фосфатов и силикатов кальция (табл. 3), что должно повышать их биоактивность.
Таблица 3.
Характеристики борсодержащего стекла
| B2O3, мас. % | Температура стеклования Tg, °С | Отжиг стекла при температуре, °С | Фазы после отжига |
|---|---|---|---|
| 0 | 539 | 750 | Na6Ca3Si6O18 |
| 5 | 527 | 750 | Na6Ca3Si6O18 |
| 15 | 519 | 750 | Na6Ca3Si6O18 Na6Ca3(PO4)5/2 |
| 25 | 533 | 700 | Na6Ca3Si6O18 Na6Ca3(PO4)5/2 |
| 60 | 546 | 700 | Рентгеноаморфная Na6Ca3Si6O18 Ca10(PO4)6O |
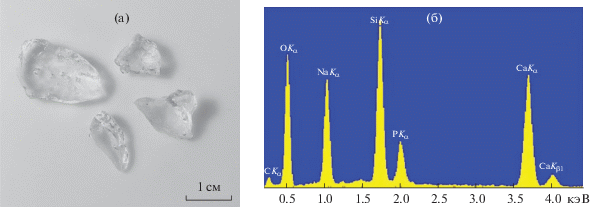
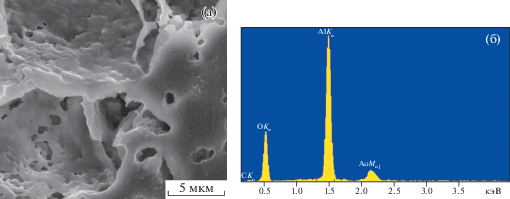
Стекла, содержащие 5, 15, 25 мас. % оксида бора, прозрачны (рис. 2), рентгеноаморфны и содержат все компоненты: кремний, кислород, натрий, кальций, фосфор и бор. В энергодисперсионном спектре бор дает очень слабый сигнал. Например, пик углерода на рис. 2б соответствует 0.282 кэВ с интенсивностью 100 усл. ед., 15% оксида бора в образце дают сигнал, соответствующий 0.185 кэВ с интенсивностью 20 усл. ед. Таким образом, он практически сливается с фоновым сигналом.
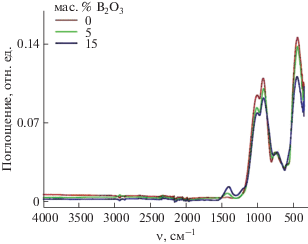
В ИК-спектрах стекол в области 900–1100 см−1 имеются две интенсивные полосы поглощения с максимумами при 941 и 1045 см−1, относящиеся к колебаниям ν3 связей Si–O (рис. 3). Колебания ν2 связей Si–O представлены интенсивной полосой при 474 см–1, а колебания ν1 – двумя полосами с максимумами при 721 и 768 см−1. Расщепление полосы валентных колебаний ν3 связей Si–O свидетельствует о наличии в составе стекла различных тетраэдров [SiO4]. Известно, что чем больше степень связности тетраэдров друг с другом, тем в более высокочастотной области будет находиться основной максимум поглощения. У силикатов с островной структурой тетраэдры [SiO4] непосредственно не связаны друг с другом и основной максимум поглощения находится в области 880–950 см−1. У каркасных силикатов с наиболее высокой степенью полимеризации кремнекислородных тетраэдров эта полоса сдвигается в высокочастотную область до 1100–1120 см−1. Таким образом, на основании данных ИК-спектроскопии можно сделать заключение, что в составе полученного нами стекла имеются тетраэдры [SiO4] с различной степенью полимеризации.
В ИК-спектрах (рис. 3) стекол присутствует также полоса поглощения с максимумом при 1375 см−1, которая относится к асимметричным валентным колебаниям ν3 связей В–O. С увеличением содержания бора в стекле интенсивность этой полосы возрастает, а полос, относящихся к колебаниям связей Si–O, снижается. В соответствии с [24], полосы поглощения, отвечающие валентным колебаниям ν3 связей B–O, при тригональном окружении бора находятся вблизи 1300 cм−1, в то время как при тетраэдрическом окружении это поглощение смещено в область более низких частот (800−1100 cм−1), которая перекрывается полосами поглощения с участием колебаний связей Si–O. На основании этого можно сделать вывод о наличии в составе полученных нами стекол тригонально-координированных боратных групп.
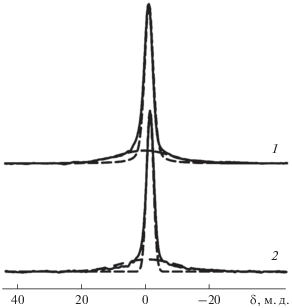
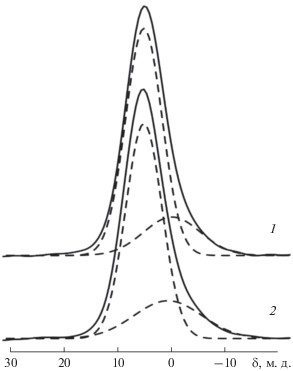
Спектры MAS ЯМР 11B биостекол, содержащих 5 и 15 мас. % B2O3 (рис. 4), имеют по две компоненты различной ширины. Узкие компоненты гауссовой формы со сдвигами –0.6 и –1.2 м.д., имеющие полуширину ∼300 Гц, можно отнести к атомам бора B(4) в тетраэдрическом окружении мостиковых атомов кислорода [25]. Широкие компоненты, имеющие тот же сдвиг, вероятно, соответствуют атомам B(3) группировок ${\text{BO}}_{{\text{3}}}^{{{\text{3}} - }},$ для которых высокие значения градиента электрического поля приводят к эффектам второго порядка в спектрах ЯМР 11B. Поскольку интенсивность компонент невелика, их форма также моделировалась гауссовыми кривыми, полуширина которых составляла ~2 кГц. Отношение интегральных интенсивностей узкой и широкой компонент, взятое без учета боковых линий от вращения образца, составило 30 : 70 для биостекла с 15%-ным содержанием B2O3 и 40 : 60 для биостекла с 5%-ным содержанием B2O3. Полученные отношения можно считать оценкой относительного содержания упомянутых групп в стеклах.
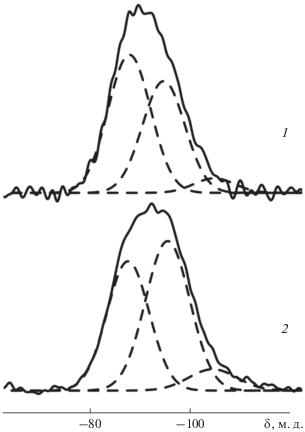
Спектры MAS ЯМР 29Si (рис. 5) могут быть разложены на три компоненты с ХС –88, –95 и –105 м.д., соответствующими группировкам Si(2), Si(3) и Si(4) [25]. Соотношение интегральных интенсивностей сигналов приведено в табл. 4. Наблюдаемое распределение интенсивностей характерно для стекол, содержащих наряду с SiO2 несколько стеклообразователей [24, 25].
Таблица 4.
Интегральные интенсивности (I) сигналов в спектрах MAS ЯМР 29Si исследованных стекол
| B2O3, мас. % | I(Si(2)) | I(Si(3)) | I(Si(4)) |
|---|---|---|---|
| % | |||
| 15 | 52 | 42 | 6 |
| 5 | 41 | 51 | 8 |
В спектрах MAS ЯМР 31P (рис. 6) наблюдаются сигналы с ХС 5.5 и 1 м.д., соответствующие полностью деполимеризованным группировкам ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ (P(0)) и группировкам P(1), сохраняющим связь P–O–P и входящим в состав фосфатной стекольной сетки. Соотношения интегральных интенсивностей сигналов составляют 79 : 21 и 75 : 25 для стекол 45B15S5 и 40S5B5 соответственно. Положения и интенсивности сигналов согласуются с литературными данными для стекол близкого состава: 24.6Na2O–26.7CaO–27.7SiO2–18.4B2O3–2.6P2O5 и 24.6Na2O–26.7CaO–41.5SiO2–4.6B2O3–2.6P2O5 [22]. Поскольку концентрация P2O5 в исследованных нами составах выше, содержание групп P(1) также более высокое, а сигналы несколько смещены в область сильного поля. Можно отметить, что, как и в работе [26], имеется тенденция к компенсации одного стеклообразователя другим: при уменьшении содержания B2O3 в стекле относительная концентрация мостиковых фосфатных групп возрастает.
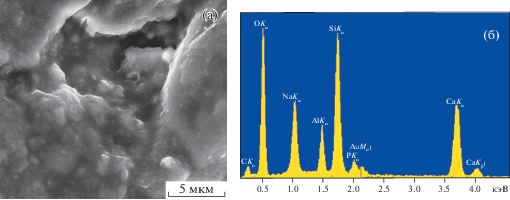
Как известно, биостекола по своим механическим свойствам уступают костной ткани (низкая прочность на растяжение и сопротивление к удару, хрупкость и др.). Для костного эндопротезирования лучше использовать прочную пористую биоинертную керамику, аналогичную предложенной в работе [27], пропитанную органическим раствором, содержащим все компоненты биоактивного стекла. На рис. 7 и 8 приведены микрофотографии и энергодисперсионные спектры исходной керамики из γ-Al2O3 и керамики, пропитанной биостеклом, с содержанием оксида бора 15% с последующим обжигом при 1300°С. В энергодисперсионном спектре появились линии компонетов стекла, а интенсивность сигнала алюминия значительно снизилась. Из приведенных рисунков видно, что после нанесения биостекла на поверхность образца и его прокаливания на керамике образуется тонкий биоактивный слой стекла, не нарушающий морфологию поверхности носителя. Такой биоактивный слой должен способствовать возникновению анатомической взаимосвязи между изменяющейся живой костью и поверхностью импланта. Необходимо подчеркнуть, что, как показано выше, при дополнительном отжиге при температуре 700–750°С на поверхности керамики в составе стеклофазы могут быть сформированы кристаллы фосфатов кальция, что должно способствовать повышению биоактивности покрытий.
Существуют литературные данные по исследованию биоактивности и цитотоксичности стекла 45S5B, полученного золь-гель методом [15]. Было установлено, что цитотоксичность этого стекла не превышает цитотоксчность стекла 45S5, что указывает на его безопасность для применения в биомедицинской области. Исследования разных авторов показывают, что биостекла имеют большой потенциал в лечении хронического остеомиелита, например, S53P4 обладает выраженной антибактериальной активностью в отношении штаммов возбудителей хронического остеомиелита MRSA, MRSE, Pseudomonas aeruginosa и Acinetobacter baumannii, эффект обусловлен влиянием биостекла на микробные биопленки. Стекло S53P4 оказывает сильное ингибирующее действие на все протестированные патогены. Стекло CaPSiO2 показывает умеренные антибактериальные свойства [28–30].
В настоящем исследовании нами изучена способность различных составов борсодержащего биоактивного стекла влиять на формирование бактериальной биопленки, образуемой на исследуемом материале мультирезистентным бактериальным штаммом Pseudomonas aeruginosa. Обнаружена заметная разница в антибиопленочной активности образцов. Данные сканирующей микроскопии свидетельствуют о значительном уменьшении биомассы и уменьшении общего объема клеток в биопленках P. aeruginosa с увеличением процентного содержания в образцах B2O3 (рис. 9).
Рис. 9.
РЭМ-изображения бактериальной пленки на образцах биостекол: а – 0 мас. % B2O3; б – 5 мас. % B2O3; в – 15 мас. % B2O3.

На образце, представленном на рис. 9a, наблюдаются участки толстой биопленки, и даже единичные клетки развивают выраженные пили адгезии. На следующем образце (рис. 9б) биопленка гораздо более тонкая, разреженная, адгезивные пили практически не видны, много деформированных, по-видимому, погибших клеток. На образце, показанном на рис. 9в, биопленка не сформирована, видны не связанные между собой одиночные бактериальные клетки, пилей нет. Скорее всего, это не активное начало образования биопленки, а просто случайно оставшиеся бактерии из питательной среды. Можно сделать вывод, что B2O3 в составе биостекла обладает антибактериальными и антибиопленочными свойствами. B2O3 можно рассматривать как эффективный компонент биоактивных стекол для профилактики и лечения связанных с биопленками инфекций протезов костей и суставов.
ЗАКЛЮЧЕНИЕ
Реализован оригинальный способ синтеза борсодержащего биостекла “45S5 Bioglass” и стеклокерамики на его основе, который заключается в пиролизе смеси органических прекурсоров тетраэтоксисилана, трибутилфосфата, олеата натрия и олеата кальция в жидкой фазе. Получены образцы биостекла объемного типа и в виде тонкослойных покрытий на пористом керамическом носителе γ-Al2O3 с содержанием оксида бора 5, 15, 25 и 60 мас. %. Введение бора в состав образцов достигнуто использованием высококонцентрированного органического раствора бора, приготовленного жидкостной твердофазной экстракцией. По результатам РФА показано, что состав образцов включает кальцийфосфатные биокомпоненты в виде апатита и гидроксиапатита, формируемые в зависимости от температурных режимов прокаливания. По данным ИК-спектроскопии установлено, что биостекла имеют тетраэдры [SiO4] с различной степенью полимеризации, а бор организуется в виде тригонально-координированных боратных групп. Наличие, тип и соотношение кремнийфосфатных и бороксидных группировок в составе образцов определено методом ЯМР на ядрах 31Р, 11В, 29Si. Выявлена тенденция к компенсации одного стеклообразователя другим, например, увеличение концентрации мостиковых фосфатных групп в структуре стекла при уменьшении количества вводимого в синтез бора. Методом РЭМ изучена морфология покрытий биостекла на пористом γ-Al2O3 отмечено наличие плотного слоя биостекла на внутренней поверхности пор, содержащего кальций и фосфор по данным ЭДС. Исследованы антибактериальные свойства борсодержащих биостекол. Установлено, что повышение концентрации B2O3 в составе образцов препятствует образованию бактериальных пленок Pseudomonas aeruginosa на его поверхности.
Показано, что предлагаемый пиролизный способ формирования биостекол из органических растворов в виде объемного материала и тонкослойных покрытий на пористой поверхности керамических носителей является простым и менее длительным по сравнению с золь-гель процессом, а получаемые образцы представляют перспективу для костной имплантологии современной медицины.
Список литературы
Rahaman M.N., Day D.E., Bal B.S. et al. // Acta Biomater. 2011. V. 7. № 6. P. 2355. https://doi.org/10.1016/j.actbio.2011.03.016
Gerhardt L.-C., Boccaccini A.R. // Materials (Basel). 2010. V. 3. № 7. P. 3867. https://doi.org/10.3390/ma3073867
Kaur G., Pandey O.P., Singh K. et al. // J. Biomed. Mater. Res.: A. 2014. V. 102. № 1. P. 254. https://doi.org/10.1002/jbm.a.34690
Chen Q.Z., Thompson I.D., Boccaccini A.R. // Biomaterials. 2006. V. 27. № 11. P. 2414. https://doi.org/10.1016/j.biomaterials.2005.11.025
El-Rashidy A.A., Roether J.A., Harhaus L. et al. // Acta Biomater. 2017. V. 62. P. 1. https://doi.org/10.1016/j.actbio.2017.08.030
Medkov M.A., Rudnev V.S., Grishchenko D.N. et al. // Bioglass: Properties, Functions and Applications. Nova Science Publisher, Inc. 2016. P. 55.
Hench L.L. // Biomed. Glass. 2015. V. 1. № 1. P. 1. https://doi.org/10.1515/bglass-2015-0001
Balasubramanian P., Buttner T., Miguez P.V. et al. // J. Eur. Ceram. Soc. 2018. V. 38. № 3. P. 855. https://doi.org/10.1016/j.jeurceramsoc.2017.11.001
Wu C., Chang J. // J. Control Release. 2014. V. 193. P. 282. https://doi.org/10.1016/j.jconrel.2014.04.026
Rico P., Rodrigo-Navarro A., Salmerón-Sánchez M. // Tissue Eng.: A. 2015. V. 21. № 21–22. P. 2662. https://doi.org/10.1089/ten.tea.2015.0044
Sych O., Gunduz O., Pinchuk N. et al. // J. Austral. Ceram. Soc. 2016. V. 52. P. 103. https://austceram.com/wp-content/uploads/2016/06/13-JACS-52-2-Faiki-103-110.pdf
Wu C., Miron R., Sculean A. et al. // Biomaterials. 2011. 32. № 29. P. 7068. https://doi.org/10.1016/j.biomaterials.2011.06.009
Yang Q., Chen S., Shi H. et al. // Mater. Sci. Eng.: C. 2015. V. 55. P. 105. https://doi.org/10.1016/j.msec.2015.05.049
Deliomanli A.M., Yildirim M. // J. Australian Ceramic Soc. 2016. V. 52. № 2. P. 9. https://pdfs.semanticscholar.org/90bb/521db626c2cad31bcd4888574c8273e1f85c.pdf
Furlan R.G., Correr W.R., Costa Russi A.F. et al. // J. Sol-Gel Sci. Technol. 2018. V. 88. № 1. P. 181. https://doi.org/10.1007/s10971-018-4806-8
Jie Q., Lin K., Zhong J. et al. // J. Sol-Gel Sci. Technol. 2004. V. 30. № 1. P. 49. https://doi.org/10.1023/B:JSST.0000028196.09929.a3
Huang W., Day D.E., Kittiratanapiboon K. et al. // J. Mater. Sci.: Mater. Med. 2006. V. 17. № 7. P. 583. https://doi.org/10.1007/s10856-006-9220-z
Sakthi Prasad, Susmit Datta, Tarun Adarsh et al. // J. Non-Cryst. Solids. 2018. V. 498. P. 204. https://doi.org/10.1016/j.jnoncrysol.2018.06.027
Medkov M.A., Grishchenko D.N., Rudnev V.S. et al. // Glass Ceram. 2014. V. 70. Iss. 11-12. P. 417. https://doi.org/10.1007/s10717-014-9593-2
Медков М.А., Грищенко Д.Н., Стеблевская Н.И. и др. // Хим. технология. 2013. Т. 14. № 5. С. 257.
Medkov M.A., Grishchenko D.N., Kuryavyi V.G. et al. // Glass Ceram. 2018. V. 75. Iss. 7–8. P. 322. https://doi.org/10.1007/s10717-018-0079-5
Volzone C., Stábile FM. // New J. Glass Ceramics. 2013. V. 3. P. 53. https://doi.org/10.4236/njgc.2013.31009
Solonenko A.P., Blesman A.I., Polonyankin D.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 993. https://doi.org/10.1134/S0036023618080211
Shmurak S.Z., Kedrov V.V., Kiselev A.P. et al. // Phys. Solid State. 2015. V. 57. P. 1588. https://doi.org/10.1134/S1063783415080326
Eckert H. // J. Sol-Gel Sci. Technol. 2018. V. 88. № 2. P. 263. https://doi.org/10.1007/s10971-018-4795-7
Yu Y., Edén M. // RSC Adv. 2016. V. 6. № 103. P. 101 288. https://doi.org/10.1039/c6ra15275a
Yamanovskaya I.A., Gerasimova T.V., Agafonov A.V. // Russ. J. Inorg. Chem. 2018. V. 63. № 9. P. 1125. https://doi.org/10.1134/S0036023618090218
Andersson O.H., Rosenquist J., Karlsson K.H. // J. Biomed. Mater. Res. 1993. V. 27. P. 941. https://doi.org/10.1002/jbm.820270713
Drago L., Romanò D., De Vecchi E. et al. // BMC Infect Dis. 2013. V. 13. P. 584. https://doi.org/10.1186/1471-2334-13-584
Drago L., Vassena C., Fenu S. et al. // Future Microbiol. 2014. V. 9 № 5. P. 593. https://doi.org/10.2217/fmb.14.20
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии