Журнал неорганической химии, 2020, T. 65, № 2, стр. 230-236
Определение эффективности химических реагентов для предупреждения образования и ликвидации газовых гидратов
Н. А. Шостак a, *, Е. П. Запорожец a
a Кубанский государственный технологический университет
350072 Краснодар, ул. Московская, 2, Россия
* E-mail: nikeith@mail.ru
Поступила в редакцию 05.09.2019
После доработки 18.09.2019
Принята к публикации 27.09.2019
Аннотация
Предметом исследования является предупреждение образования и/или диссоциации газовых гидратов под воздействием неорганических химических реагентов: растворов солей, окислителей и гидроксидов. Цель исследований – создание метода для определения эффективности растворов реагентов. Методология проведения работы основана на физико-математическом моделировании процессов гидратообразования в водных растворах реагентов различной концентрации. В основе моделирования лежит процесс абсорбции реагентами водного компонента из паровой, жидкой и твердых фаз. С помощью математических зависимостей, полученных в результате моделирования, можно рассчитать концентрацию и количество водных растворов реагентов для предупреждения и ликвидации газовых гидратов, а также время протекания этих процессов. Получен безразмерный критерий антигидратной эффективности реагентов. На основе математических зависимостей построены графики для экспресс-анализа уменьшения температуры гидратообразования от концентрации водных растворов реагентов. Модели подвергали верификации путем сравнения расчетных и экспериментальных параметров. Их расхождение составляло <5%. Это позволяет утверждать, что разработанная модель обладает достаточной степенью достоверности и может быть использована для предупреждения и ликвидации техногенных газовых гидратов, а также для добычи газа из природных гидратов.
ВВЕДЕНИЕ
Решение многих технологических и технических задач химической промышленности, связанных с предупреждением образования и ликвидацией газовых гидратов (в дальнейшем просто гидратов) путем применения антигидратных неорганических реагентов, например растворов солей, окислителей и гидроксидов, требует умения рассчитывать:
– изменение величин термобарических параметров образования и диссоциации гидратов от действия водных растворов реагентов;
– их оптимальные концентрации и расход;
– скорость диссоциации гидратов;
– антигидратную эффективность реагентов.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
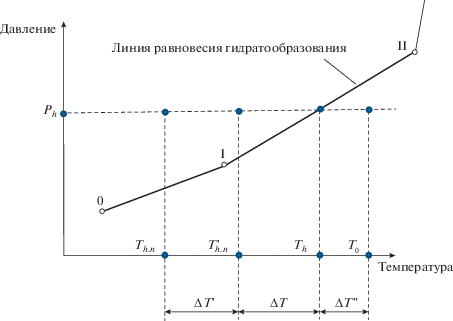
Разработанный метод расчета базируется на математическом моделировании снижения равновесных термобарических условий образования (диссоциации) гидратов в процессе поглощения водного компонента неорганическими растворами реагентов в системах газ-гидратообразователь (в дальнейшем просто газ)–водяной пар–вода (в жидком или твердом состоянии). При этом равновесные термобарические параметры образования (диссоциации) гидратов в системе газ–водяной пар–твердая фаза воды (лед) представлены диапазоном на кривой (рис. 1) между точками 0 и I. В точке I, называемой квадрупольной, существуют четыре фазы: гидрат, газ, водяной пар и лед из чистой воды. В системе газ–водяной пар–жидкая фаза чистой воды равновесные термобарические параметры находятся в диапазоне между квадрупольными точками I и II. В точке II существуют: гидрат, газ, водяной пар и чистая жидкая вода. Равновесные термобарические параметры гидратообразования на кривой после точки II отражают существование гидрата, газа в критических и сверхкритических условиях, водяного пара и жидкой воды.
Введение водного раствора реагента в гидратообразующую систему при постоянном давлении приводит к изменению равновесных термических условий образования гидратов. Эти изменения происходят за счет поглощения реагентом водного компонента из паровой, жидкой и твердых фаз (льда и гидратов). При этом образуется новая система, состоящая из фаз с уменьшенным содержанием водного компонента и реагента, разбавленного водой от исходной концентрации X до концентрации Xr:
где m – количество реагента с исходной концентрацией X, кг; mw – общее количество воды, абсорбируемой реагентом, кг.В новой системе равновесная температура гидратообразования Th уменьшается в сторону более низкой величины $T_{{h.n}}^{'}$ (рис. 1). Величина снижения равновесной температуры зависит только от разности концентраций реагента в системах. Принимается, что в обеих системах процессы гидратообразования, при которых молекулы газов заключаются в льдоподобные ассоциаты молекул воды, идентичны. В условиях постоянного давления льдоподобные ассоциаты молекул чистой воды образуются при температуре Tw, а ассоциаты из раствора реагента – при более низкой температуре Tr, зависящей от концентрации реагента.
Учитывая, что в процессе формирования гидратных полостей одновременно происходит образование льдоподобных ассоциатов и поглощение ими молекул газа, разность температур Th и $T_{{h.n}}^{'}$ принимается примерно равной разности температур Tw и Tr:
Температура образования льдоподобных ассоциатов молекул воды Tw зависит от давления Phw и компонентного состава газа в гидратообразующей системе. В первом приближении величину Tw в зависимости от давления Phw можно определять по справочным данным [1, 2]. Более точные значения Tw в диапазоне давлений 0.00061173–212.9 МПа в зависимости от природы газа рассчитываются по полученной авторами зависимости [3]:
(3)
${{T}_{{\text{w}}}} = 273.16 - \frac{{{{M}_{a}}}}{{{{M}_{g}}}}\left( {0.0731{{P}_{{h{\text{w}}}}} + 0.0002P_{{h{\text{w}}}}^{2}} \right),$Некоторые значения температуры образования льдоподобных ассоциатов молекул воды Tri в растворе реагента содержатся в справочной литературе [4–8]. В зависимости от концентрации Xri раствора в диапазонах, указанных в табл. 1, температуры Tri рассчитываются по следующей зависимости:
где a, b, c – коэффициенты из табл. 1.Таблица 1.
Коэффициенты уравнения (4)
| Реагент | Концентрация реагента в растворе Xri, мас. % | Коэффициенты | ||
|---|---|---|---|---|
| a | b | c | ||
| Растворы солей | ||||
| LiCl | 0.05–0.25 | –1130.70 | 19.79 | 270.55 |
| MgCl2 | 0.014–0.206 | –840.22 | 16.46 | 271.84 |
| NaCl | 0.015–0.224 | –212.97 | –45.24 | 272.86 |
| CaCl2 | 0.059–0.284 | –840.90 | 126.63 | 263.66 |
| Ca(MnO4)2 | 0.05–0.42 | –295.6 | 48.35 | 269.16 |
| Са(NО3)2 | 0.02–0.35 | –102.86 | –16.29 | 272.86 |
| Ca(NO2)2– Са(NО3)2 (1 : 1) | 0.02–0.35 | –204.47 | –6.58 | 271.94 |
| Ca(NO2)2–Са(NО3)2–CaCl2 (1 : 1 : 2) | 0.02–0.30 | –575.18 | 24.63 | 270.62 |
| Растворы окислителей | ||||
| HNO3 | 0.02–0.33 | –332.73 | –14.39 | 271.75 |
| H2SO4 | 0.04–0.38 | –618.46 | 50.86 | 269.68 |
| HCl | 0.012–0.239 | –1479.60 | 57.50 | 269.69 |
| H2O2 | 0.05–0.50 | –87.73 | –65.31 | 274.14 |
| Растворы щелочей | ||||
| KOH | 0.02–0.32 | –670.91 | 25.91 | 270.26 |
| NaOH | 0.02–0.19 | –498.06 | –46.32 | 272.43 |
| NH4OH | 0.02–0.33 | –937.69 | 28.37 | 268.27 |
Для экспресс-анализа на рис. 2–4 представлены расчетные графические зависимости ΔT от массовой концентрации реагентов Xri.
Рис. 2.
Понижение равновесной температуры гидратообразования от массовой концентрации разбавленных растворов солей.
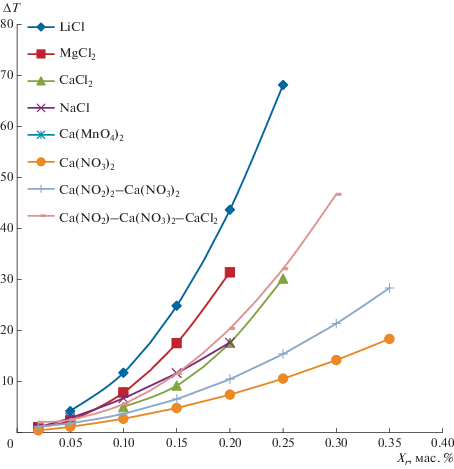
Рис. 3.
Понижение равновесной температуры гидратообразования от массовой концентрации разбавленных растворов окислителей.
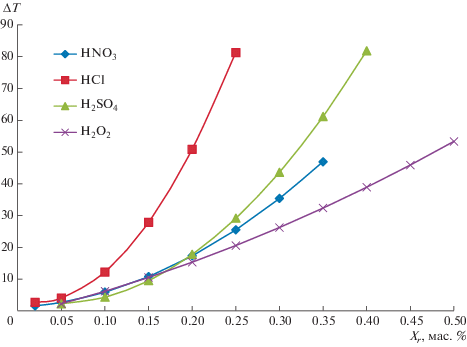
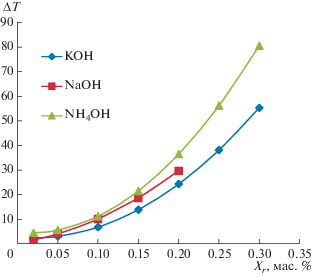
Рис. 4.
Понижение равновесной температуры гидратообразования от массовой концентрации разбавленных растворов щелочей.
Величина температуры замерзания реагента, состоящего из нескольких химических компонентов, определяется по формуле:
В некоторых растворах реагентов температура образования льдоподобных ассоциатов молекул воды не имеет строго фиксированных значений. Авторы [9] отмечают, что существует диапазон температур от появления первых ассоциатов и до окончательной кристаллизации.
Зависимость (4) предназначена для расчета температуры появления первых ассоциатов. Разница между этими температурами ∆T' (рис. 1) возрастает до 5°–7° с увеличением концентрации реагента Xri в растворе.
С учетом диапазона ∆T ' расчетная формула для температуры окончания образования гидрата в новой системе имеет вид:
где Th – равновесная температура гидратообразования при установленном давлении Ph в системе газ–чистая вода, которая определяется по методике [10].Согласно уравнению (6), по графику, представленному на рис. 1, в диапазоне температур от T0 > Th до $T_{{h.n}}^{'}$ при давлении Ph в системе газ–разбавленный реагент гидраты не существуют. Таким образом, можно утверждать, что введение реагента смещает область гидратообразования в сторону более низких температур и тем самым обеспечивает возможность предупреждения образования и ликвидации гидратов в этих условиях.
Расчет предупреждения образования гидратов
Совместное решение уравнений (1)–(6) дает формулу расчета оптимальной концентрации разбавленного реагента Xr1, обеспечивающей предупреждение образования гидратов в температурном диапазоне от T0 до Th.n (рис. 1):
(7)
${{X}_{{{{r}_{1}}}}} = \frac{{ - b\, \pm \,\sqrt {{{b}^{2}}\, - \,4a\left( {c\, - \,{{T}_{w}}\, + \,{{T}_{0}} - \Delta T{\kern 1pt} '' - {{T}_{{h.n}}} - \Delta T{\kern 1pt} '} \right)} }}{{2c}}.$Чередование знаков в уравнении (7) объясняется применением знакопеременных параметров a и b из табл. 1.
Необходимую массу реагента с исходной концентрацией X для предупреждения образования гидратов рассчитывают по формуле:
(8)
${{m}_{1}} = {{m}_{{{{{\text{w}}}_{{\text{1}}}}}}}\frac{{{{X}_{{{{r}_{1}}}}}}}{{\left( {X - {{X}_{{{{r}_{1}}}}}} \right)}},$(9)
${{m}_{{{{{\text{w}}}_{{\text{1}}}}}}} = {{m}_{{{{{\text{w}}}_{{\text{l}}}}}}} + V\left( {{{\Omega }_{1}} - {{\Omega }_{2}}} \right).$В уравнении (9) ${{m}_{{{{{\text{w}}}_{{\text{l}}}}}}}$ – масса воды в жидкой и/или твердой фазах в исходной системе, кг; V – количество газа в статической системе, нм3; Ω1 и Ω2 – содержание (кг/нм3) паров воды в газе при давлении Ph и температурах T0 и Th.n соответственно [11].
Если система находится в динамике, то необходимый расход L1 реагента с исходной концентрацией X для предупреждения гидратообразования в рассматриваемой газоводяной системе рассчитывается по формуле:
где G и Lw – расход в системе газа и воды; τ1 – время; Ka – коэффициент, учитывающий условия протекания процесса поглощения водного компонента раствором реагента (Ka = 1 – идеальное перемешивание контактирующих фаз, в других случаях Ka < 1).Расчет диссоциации существующих гидратов
Совместное решение уравнений (1)–(6) дает формулу для расчета оптимальной концентрации разбавленного реагента ${{X}_{{{{r}_{2}}}}},$ обеспечивающей диссоциацию гидратов в температурном диапазоне от Th до Th.n (рис. 1):
(13)
${{X}_{{{{r}_{2}}}}} = \frac{{ - b \pm \sqrt {{{b}^{2}} - 4a\left( {c - {{T}_{w}} + {{T}_{h}} - {{T}_{{h.n}}} - \Delta T{\kern 1pt} '} \right)} }}{{2a}}.$Точные значения величин ω определяются по методике [12] в зависимости от типов гидратов, компонентного состава газов, гидратных чисел, молярных масс и плотностей. Поскольку эти расчеты сложны, для упрощения определения величины ω авторами были выполнены расчетные исследования, которые показали, что содержание воды в гидратах различных газовых смесей находится в пределах от 0.86 до 0.94. Указанный диапазон величин ω приемлем для расчетов с точностью до 5%.
Необходимую массу реагента m2 с исходной концентрацией X для полной диссоциации гидрата массой mh рассчитывают по формуле:
(15)
${{m}_{2}} = {{m}_{h}}{\omega }\frac{{{{X}_{{{{r}_{2}}}}}}}{{\left( {X - {{X}_{{{{r}_{2}}}}}} \right)}}.$Скорость процесса диссоциации:
где L2 – расход реагента; τ2 – время; Kd – коэффициент процесса диссоциации, учитывающий условия массообмена между реагентом и гидратом (при идеальном взаимодействии Kd = 1, в других случаях Kd < 1). Величины этого коэффициента можно определить с помощью справочной литературы по массообмену или экспериментально.Определение эффективности антигидратных химических реагентов
Предупреждение образования и диссоциации гидратов зависит от эффективности воздействия на них химических реагентов. Некорректное определение эффективности ингибитора гидратообразования в конечном итоге приводит к повышенным или пониженным расходам регентов. Повышенные расходы приводят к увеличению эксплуатационных затрат, а пониженные – к осложнениям и авариям в технико-технологических системах, которые также влекут за собой дополнительные затраты на ликвидацию их последствий.
Антигидратную эффективность реагентов предлагается оценивать от их результирующего действия в системе газ–их водные растворы по следующему критерию:
Величина критерия означает:
– ηr = 0 – отсутствие реагента в системе;
– ηr > 0 – его присутствие, причем чем больше величина ηr, тем он эффективнее.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно разработанной модели, от воздействия на гидраты химических реагентов условия существования гидрата смещаются от температуры на линии равновесия при постоянном давлении среды в сторону более низких температур на величину ΔT. Эта величина зависит от:
– давления и природы среды, окружающей гидрат;
– температуры образования льдоподобных ассоциатов молекул воды;
– типа реагента;
– концентрации X исходного реагента и его концентрации Xr при разбавлении водой.
В связи с тем, что величина ΔT зависит от многих факторов, она была выбрана реперным параметром, по которому определяли достоверность разработанного метода. Ее определяли путем сравнения величин ΔT, полученных расчетным и экспериментальным путями. Их расхождения, представленные в табл. 2, не превышают 5%. Это позволяет утверждать, что разработанный метод обладает достаточной степенью достоверности.
Таблица 2.
Величины ΔT, полученные расчетным путем и известные из литературных источников
| Антигидратный реагент (формула) | Концентрация разбавленного реагента, мас. % | Величины смещения температуры образования гидратов ΔT | Литература | Расхождение, % | |
|---|---|---|---|---|---|
| расчетная | известная | ||||
| LiCl | 0.10 0.15 |
12.1 23.3 |
12.0 23.0 |
[13] | 0.8 1.3 |
| MgCl2 | 0.11 0.18 |
8.7 26 |
8.5 27 |
[14] [13] |
2.3 3.8 |
| NaCl | 0.01 0.03 0.05 0.10 |
1.8 1.9 2.8 6.3 |
1.8 1.9 2.7 6.0 |
[15] [16] [17] [18] |
0.0 0.0 3.6 4.9 |
| 0.15 | 20.1 | 21.0 | [13] | 5.0 | |
| CaCl2 | 0.05 | 3.7 | 3.7 | [17] | 0.0 |
| 0.10 0.17 |
5.3 11.7 |
5.5 11.8 |
[19] [20] |
4.1 0.9 |
|
| 0.20 0.25 |
17.4 25.9 |
17.0 24.7 |
[13] [18] |
2.3 4.7 |
|
ЗАКЛЮЧЕНИЕ
С помощью разработанного метода можно рассчитать оптимальную концентрацию и расход реагентов в зависимости от цели их применения, а также интенсивность диссоциации (скорость ликвидации) гидратов от действия реагентов.
Разработанные аналитические зависимости достаточно просты, в них не используются поправочные коэффициенты, основанные на экспертных оценках, что позволяет использовать их при решении прикладных инженерных задач без особых затруднений.
Список литературы
Wagner W., Saul A., Pruss A. // J. Phys. Chem. Ref. Data. 1994. V. 23. № 3. P. 515. https://doi.org/10.1063/1.555947
The International Association for the Properties of Water and Steam. Plzeň, Czech Republic. 2011. 7 p.
Шостак Н.А., Запорожец Е.П. Расчеты гидратных процессов. Краснодар: Издательский Дом – Юг, 2018. 204 с.
Мельник Б.Д. Инженерный справочник по технологии неорганических веществ. Графики и номограммы. М.: Химия, 1975. 544 с.
Haghighi H. Phase Equilibria Modelling of Petroleum Reservoir Fluids Containing Water, Hydrate Inhibitors and Electrolyte Solutions. Submitted for the degree of Doctor of Philosophy in Petroleum Engineering. Heriot-Watt University, 2009. 187 p.
General Chemistry: Principles and Modern Applications / Eds. Petrucci R.H. et al. Pearson Canada Inc., 2016. 1488 p.
Najibi H., Kamali Z., Mohammadi A.H. // Fluid Phase Equilibria. 2013. V. 342. P. 71. https://doi.org/10.1016/j.fluid.2013.01.001
Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии. Киев: Наук. думка, 1987. 833 с.
Pauling L., Pauling P. Chemistry. San Francisco: W.H. Freeman and Company, 1975. 792 p.
Zaporozhets E.P., Shostak N.A. // Chem. Petrol. Engineer. 2019. P. 1. https://doi.org/10.1007/s10556-019-00567-z
Rabinovich V.A., Beketov V.C. Moist gases: thermodynamic properties. New York: Begell House Inc, 1995. 294 p.
Zaporozhets E.P., Shostak N.A. // Russ. J. Phys. Chem. A. 2016. V. 90. № 9. P. 1843. https://doi.org/10.1134/S0036024416090338
Добыча, подготовка и транспорт природного газа и конденсата / Под ред. Коротаева Ю.П., Маргулова Р.Д. М.: Недра, 1984. Т. 1. 360 с.
Kamari A., Hashemi H., Babaee S. et al. // Fluid Phase Equilibria. 2013. V. 342. P. 71. https://doi.org/10.1016/j.jct.2017.07.030
Schneider G.R., Farrar J. U.S. Dept. of Interior, Res. Dev. Report № 292. January 1968. P. 37.
Rouher O.S. The n-Butane and Iso-Butane Hydrates. M.S. Thesis. Syracuse University, 1968.
Kalacheva L.P., Rozhin I.I., Portnyagin A.S. // IOP Conf. Series: Earth and Environ. Sci. 2018. № 193. P. 012 026. https://doi.org/10.1088/1755-1315/193/1/012026
Ho-Van S., Bouillot B., Douzet J. et al. // AIChE. 2018. V. 64. № 6. P.2207. https://doi.org/10.1002/aic.16067
Kalacheva L.P., Rozhin I.I., Fedorova A.F. // SOCAR Proceedings. 2017. № 2. P. 56. https://doi.org/10.5510/OGP20170200315
Aregbe A.G., Sun B., Chen L. // J. Chem. Eng. Data. 2019. V. 64. № 7. P. 2929. https://doi.org/10.1021/acs.jced.8b01173
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии