Журнал неорганической химии, 2020, T. 65, № 2, стр. 171-178
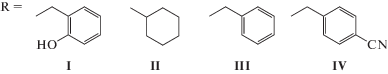
Дицианодибромоаураты алкилтрифенилфосфония [Ph3PAlk][Au(CN)2Br2], Alk = CH2C6H4(OH)-2, CH2C6H11-cyclo, CH2Ph, CH2C6H4CN-4
В. В. Шарутин a, О. К. Шарутина a, Н. М. Тарасова a, *, А. Н. Ефремов a
a Южно-Уральский государственный университет
454080 Челябинск, пр-т им. В.И. Ленина, 76, Россия
* E-mail: tarasovanm@susu.ru
Поступила в редакцию 09.04.2019
После доработки 08.05.2019
Принята к публикации 29.09.2019
Аннотация
Из дицианодибромоаурата калия и хлоридов алкилтрифенилфосфония в воде синтезированы кристаллические комплексы желтого цвета [Ph3PAlk][Au(CN)2Br2], где Alk = CH2C6H4(OH)-2 (I), CH2C6H11-cyclo (II ⋅ 1/2PhH), CH2Ph (III), CH2C6H4CN-4 (IV), строение которых установлено методом рентгеноструктурного анализа. В кристаллах I−IV присутствуют тетраэдрические катионы алкилтрифенилфосфония (CPC 104.8(2)°−114.1(2)°, P−С 1.782(6)−1.825(5) Å). В квадратных анионах [Au(CN)2Br2]−транс-углы СAuC и BrAuBr равны 178.8(2)°−180.0(5)° и 178.38(3)°−180.00(3)°, связи Au−C и Au−Br – 2.001(7)−2.205(9) Å и 2.4086(14)−2.4276(18) Å соответственно. В формировании структуры кристаллов участвуют слабые водородные связи N⋅⋅⋅Н−С и прочные связи N⋅⋅⋅Н−О в комплексе I, контакты Br⋅⋅⋅Н−С в кристаллах дицианодибромидов I, III и IV.
ВВЕДЕНИЕ
В настоящее время интерес исследователей вызывают комплексы дицианидов металлов в связи с их использованием при получении полупроводниковых и оптически и магнитно-активных материалов, которые приобретают при этом разнообразные свойства [1–7]. Кроме того, некоторые из них являются препаратами-метаболитами лекарств на основе Au(I) [8]. Формирование олигомерных структур из анионов [Au(CN)2]− приводит к появлению люминесцентных свойств [4, 9–12]. Однако комплексы дицианодигалогенидов с различными катионами, демонстрирующие подобные свойства [13–15], мало исследованы. Известно несколько цианидных комплексов Au(I) [16, 17] и цианодигалогенидных комплексов Au(III) c аммонийными катионами [18–21], однако информация о комплексах [Kat]+[Au(CN)2Hal2]− с элементоорганическими катионами в литературе отсутствует.
C целью установления особенностей синтеза и строения дицианодибромоауратных комплексов тетраорганилфосфония в настоящей работе впервые синтезированы и структурно охарактеризованы дицианодибромоаураты алкилтрифенилфосфония [Ph3PAlk][Au(CN)2Br2], где Alk = CH2C6H4(OH)-2 (I), CH2C6H11-cyclo (II ⋅ 1/2PhH), CH2Ph (III), CH2C6H4CN-4 (IV).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
К[Au(CN)2Br2] получали по методике [18], комплексы I−IV – смешением водных растворов хлоридов алкилтрифенилфосфония с раствором дицианодибромида калия [17].
[Ph3PCH2C6H4(OH-2)]+[Au(CN)2Br2]– (I) кристаллизовали из 13 мл смеси MeCN с i-PrOH (8 : 5). При медленном испарении растворителя наблюдали образование ярко-желтых кристаллов. Выход 95%, tпл = 160.1°С. ИК-спектр (ν, см−1): 3267 (ОН), 3055 (CAr−H); 2931, 2902, 2852, 2179 (CN); 1909, 1822, 1788, 1597, 1585, 1510, 1502, 1483, 1456, 1436 (Р–Ph); 1382, 1359 (СAr–ОН); 1315 (СAr–ОН); 1274, 1247, 1234 (СAr–ОН); 1178 (СAr–ОН); 1159 (СAr–ОН); 1111, 1087, 1043, 1026, 999 (Р–Ph); 935, 867, 860, 815, 771, 758, 750, 723, 709, 690, 655, 615, 599, 553, 518, 503, 497, 489, 449, 428.
Аналогично синтезировали соединения II–IV (в случае соединения II вместо i-PrOH добавляли 5 мл бензола).
[Ph3PC6H10-cyclo][Au(CN)2Br2] (II) ⋅ 1/2С6Н6: желтые кристаллы, выход 89%, tпл = 188.5°С. ИК-спектр (ν, см−1): 3086 (CAr−H); 3057 (CAr−H); 3030 (CAr−H); 2935, 2897, 2856, 2210 (CN); 2176 (CN); 1973, 1826, 1587, 1485, 1454 (Р–Ph); 1438 (Р–Ph); 1340, 1323, 1298, 1271, 1215, 1193, 1176, 1163, 1122, 1109, 1026, 997 (Р–Ph); 918, 887, 850, 823, 748, 723, 690, 543, 526, 516, 497, 464, 449, 426.
[Ph3PCH2Ph][Au(CN)2Br2] (III): желтые кристаллы, выход 91%, tпл = 166.2°С. ИК-спектр (ν, см−1): 3062 (CAr−H); 3039 (CAr−H); 2949, 2912, 2852, 2214 (CN); 2168 (CN); 1982, 1913, 1832, 1600, 1585, 1573, 1496, 1485, 1456 (Р–Ph); 1436 (Р–Ph); 1400, 1336, 1317, 1232, 1188, 1159, 1134, 1111, 1070, 1028, 997 (Р–Ph); 972, 916, 850, 831, 785, 756, 750, 719, 696, 688, 580, 513, 503, 497, 449, 424.
[Ph3PCH2-C6H4-CN-4][Au(CN)2Br2] (IV): желтые кристаллы, выход 93%, tпл = 155.3°С.
ИК-спектр (ν, см−1): 3088 (CAr−H); 3062 (CAr−H); 3039 (CAr−H); 2951, 2910, 2852, 2239 (Ph–CN); 2227 (Ph–CN); 2166 (CN); 1606, 1587, 1506, 1483, 1436 (Р–Ph); 1406, 1340, 1321, 1236, 1188, 1163, 1141, 1111, 1024, 997, 850, 839, 829, 771, 746, 736, 719, 688, 563, 528, 503, 493, 466, 449, 422.
Дифференциальную сканирующую калориметрию (ДСК) соединений I−IV проводили на комплексе синхронного термического анализа Netzsch 449C Jupiter.
ИК-спектры (400–4000 см–1) комплексов I–IV регистрировали на ИК-фурье-спектрометре Shimadzu IR Affinity-1S (таблетирование с KBr).
РСА (дифрактометр Bruker D8 QUEST, MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) кристаллов I–IV (CCDC 1 899 748 (I), 1 899 750 (II ⋅ 1/2PhH), 1899752 (III), 1 899 758 (IV); deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk) проводили при 296(2) K с использованием для обработки данных программ SMART и SAINT-Plus [22], SHELXL/PC [23], OLEX2 [24].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Комплексы соединений I−IV моментально образовывались при смешении водных растворов соответствующих солей:
После удаления воды и кристаллизации вещества из смеси MeCN с i-PrOH (8 : 5) или бензолом (для комплекса II ⋅ 1/2PhH) (8 : 5) получали прозрачные кристаллы желтого цвета. Выделенные кристаллы устойчивы на воздухе, хорошо растворяются в хлороформе, дихлорметане и ацетонитриле, не растворяются в воде и спиртах при комнатной температуре. Из данных ДСК следует, что все соединения стабильны до 150°С. На кривых ДСК соединений I, III, IV присутствуют эндотермические пики плавления комплексов при 160.1, 166.2 и 155.3°С соответственно. Для комплекса II ⋅ 1/2PhH наблюдается эндотермический пик при 103.8°С, соответствующий разложению сольвата II ⋅ 1/2PhH с потерей массы ∼4%, а также эндотермический пик плавления при 188.5°С без уменьшения массы.
Известно, что полосы поглощения цианогрупп органических и неорганических соединений вследствие отсутствия значительного влияния окружения на колебания этих связей находятся в достаточно узком интервале: 2200−2000 см–1 [25] и легко обнаруживаются в ИК-спектрах. Также отмечается, что для дицианопроизводных Au(III) наблюдается значительное снижение интенсивности данных полос поглощения по сравнению с дицианопроизводными Au(I) [26, 27]. Так, для соединений I–III полосы валентных колебаний CN-групп имеют низкую интенсивность и располагаются при 2179, 2210; 2176, 2214 и 2168 см–1 соответственно. Для комплекса IV наблюдается полоса средней интенсивности при 2239 см–1, относящаяся, очевидно, к цианогруппе ароматического кольца катиона, а также слабые полосы цианогрупп аниона при 2227 и 2166 см–1. Колебаниям связей P−СAr в спектрах соединений I, II ⋅ 1/2PhH, III, IV соответствуют полосы при 1436, 1438, 1436, 1436 см–1, попадающие в область 1450−1435 см–1, охарактеризованную ранее для подобных производных [25]. Кроме того, в спектре I наблюдается полоса поглощения при 3267 см–1, связанная с валентными колебаниями ОН-группы, и ряд полос, отвечающих колебаниям связи С–ОН, наиболее интенсивными из которых являются полосы при 1234, 1315 и 1359 см–1 [25].
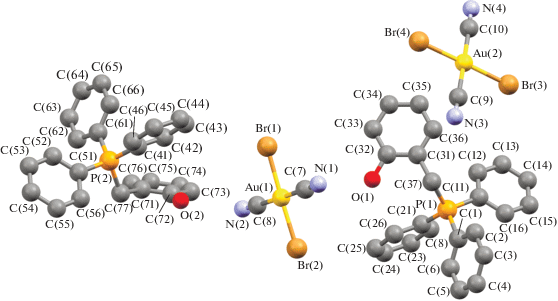
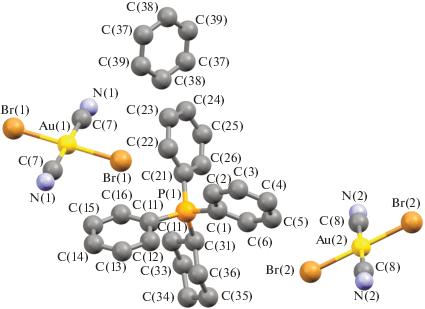
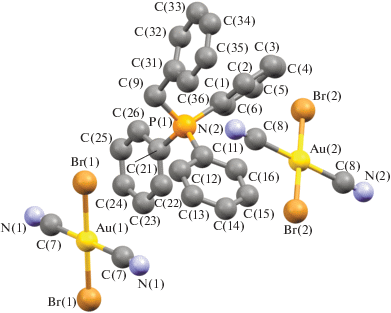
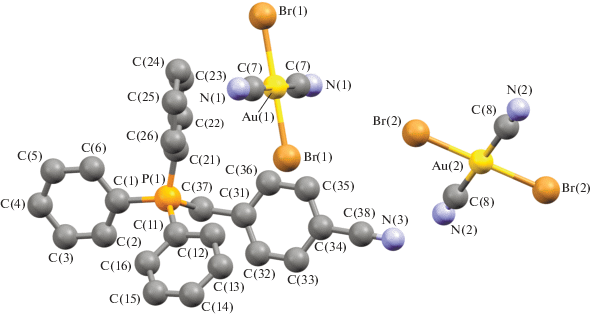
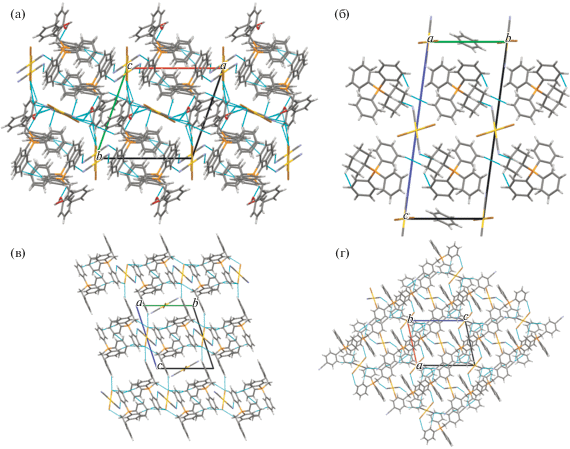
Несмотря на похожее строение молекул и общую для всех комплексов I−IV триклинную сингонию (табл. 1), имеются существенные отличия в их кристаллической структуре. Для соединения I характерны два типа кристаллографически независимых катионов [Ph3PR]+ и мономерных дицианодибромоауратных анионов, а для соединений II ⋅ 1/2PhH−IV – катионы алкилтрифенилфосфония и по два типа центросимметричных кристаллографически независимых анионов. Анионы первого типа участвуют в образовании решеток кристаллов, располагаясь на ребрах и по центру граней кристаллических ячеек соединений II ⋅ 1/2PhH и III соответственно и образуя водородные связи с катионами. Анионы второго типа удалены от других частиц в решетке и не образуют с ними контактов, располагаясь в узлах (I) и на гранях (III) кристаллической ячейки. Кроме того, дибромдицианопроизводное II ⋅ 1/2PhH содержит сольватные молекулы бензола, не участвующие в формировании кристаллической структуры (рис. 1–4).
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–IV
| Параметр | Значение | |||
|---|---|---|---|---|
| I | II ⋅ 1/2PhH | III | IV | |
| М | 778.21 | 793.30 | 762.22 | 787.23 |
| Сингония | Триклинная | Триклинная | Триклинная | Триклинная |
| Пр. гр. | Р$\bar {1}$ | Р$\bar {1}$ | Р$\bar {1}$ | Р$\bar {1}$ |
| a, Å | 12.672(9) | 7.834(7) | 9.726(8) | 10.452(5) |
| b, Å | 12.729(7) | 9.857(9) | 11.636(9) | 10.699(8) |
| c, Å | 18.303(9) | 20.990(15) | 13.549(10) | 13.798(7) |
| α, град | 105.14(2) | 94.58(3) | 67.30(3) | 69.05(3) |
| β, град | 102.34(3) | 97.06(3) | 71.11(3) | 74.741(19) |
| γ, град | 104.72(3) | 110.96(4) | 70.08(3) | 78.23(3) |
| V, Å3 | 2629(3) | 1489(2) | 1296.9(17) | 1379.8(14) |
| Z | 2 | 2 | 2 | 2 |
| ρвыч, г/см3 | 1.966 | 1.770 | 1.952 | 1.895 |
| μ, мм−1 | 8.718 | 7.699 | 8.833 | 8.306 |
| F(000) | 1480.0 | 762.0 | 724.0 | 748.0 |
| Размер кристалла, мм | 0.24 × 0.16 × 0.08 | 0.2 × 0.15 × 0.08 | 0.44 × 0.14 × 0.1 | 0.13 × 0.13 × 0.1 |
| Область сбора данных по 2θ, град | 5.86−61.14 | 5.76−54.72 | 6.24−56.84 | 5.98– 64.24 |
| Интервалы индексов отражений | −18 ≤ h ≤ 18, −18 ≤ k ≤ 18, −26 ≤ l ≤ 26 |
−9 ≤ h ≤ 10, −12 ≤ k ≤ 12, −26 ≤ l ≤ 26 |
−13 ≤ h ≤ 12, −15 ≤ k ≤ 15, −18 ≤ l ≤ 18 |
−15 ≤ h ≤ 15, −15 ≤ k ≤ 15, −20 ≤ l ≤ 20 |
| Измерено отражений | 160 074 | 31 522 | 36 900 | 89 930 |
| Независимых отражений | 16 036 (Rint = 0.0790) |
6627 (Rint = 0.0515) |
6469 (Rint = 0.0448) |
9619 (Rint = 0.0848) |
| Отражений с I > 2σ(I) | 10766 | 4665 | 4808 | 5517 |
| Переменных уточнения | 615 | 319 | 301 | 319 |
| GOOF | 1.023 | 1.071 | 1.116 | 1.012 |
| R-факторы по F2 > 2σ(F2) | R1 = 0.0415, wR2 = 0.0728 |
R1 = 0.0385, wR2 = 0.0836 | R1 = 0.0440, wR2 = 0.1056 |
R1 = 0.0454, wR2 = 0.0657 |
| R-факторы по всем отражениям | R1 = 0.0849, wR2 = 0.0860 |
R1 = 0.0686, wR2 = 0.0933 | R1 = 0.0687, wR2 = 0.1166 | R1 = 0.1178, wR2 = 0.0795 |
| Остаточная электронная плотность (max/min), e/Ǻ3 | 2.89/−2.04 | 0.87/−1.42 | 2.58/−1.26 | 0.67/−0.92 |
Геометрия атомов фосфора в катионах несколько искажена и отличается от тетраэдрической: углы CPC испытывают отклонения от теоретического значения и составляют 104.8(2)°−114.1(2)°, 105.2(2)°−113.0(2)° (I), 106.0(3)°−110.8(3)° (II ⋅ 1/2PhH), 106.8(3)°−110.8(3)° (III), 107.44(17)°−111.44(18)° (IV); длины связей P−СPh (1.791(5)−1.800(5), 1.790(4)−1.796(5) Å (I), 1.791(6)−1.799(6) Å (II ⋅ ⋅ 1/2PhH), 1.782(6)−1.811(7) Å (III), 1.792(4)−1.797(4) Å (IV)) близки между собой, как и расстояния Р−САlk (1.825(5), 1.825(4) Å (I), 1.806(7) Å (II ⋅ 1/2PhH), 1.799(7) Å (III), 1.818(4) Å (IV)). Связи золото–углерод в анионах [Au(CN)2Br2]− отклоняются от линейной конфигурации, углы СAuC равны 179.0(2)°, 178.8(2)° (I), 180.0(5)°, 180.0(5)° (II ⋅ 1/2PhH), 180.0(5)°, 179.999(1)° (III), 180.0(4)°, 179.999(1)° (IV). Расстояния Au−C в анионах I отличаются друг от друга существенно: 2.009(6), 2.205(9) Å и 2.015(7), 2.001(7) Å. В центросимметричных анионах длины связей Au−C (2.070(8), 2.070(8) и 2.142(8), 2.142(8) в II ⋅ 1/2PhH, 2.065(8), 2.065(8) и 2.065(10), 2.065(10) в III, 2.065(8), 2.065(8) и 2.065(10), 2.065(10) Å в IV) близки к сумме ковалентных радиусов атомов (2.05 Å [28]). Длины связей Au−Br в дицианодибромоауратных анионах равны 2.4086(14)−2.4259(16) Å (I), 2.412(2)−2.4276(18) Å (II ⋅ 1/2PhH), 2.412(2)−2.4228(18) Å (III), 2.4138(13)−2.4254(12) Å (IV).
Ассоциация анионов за счет контактов Au⋅⋅⋅Au и Au⋅⋅⋅Br⋅⋅⋅Au [13, 14] в кристаллах отсутствует, что, вероятно, объясняется большим объемом фосфорорганических катионов, исключающим возможность сближения анионов и образования из них полимерных цепей. Слабые взаимодействия N⋅⋅⋅Н−С между катионами и анионами (2.00−2.65 Å (I), 2.53 Å (II ⋅ 1/2PhH), 2.69 Å (III), 2.54−2.85 Å (IV)) и Br⋅⋅⋅Н−С (2.80−3.20 Å (I), 2.93−3.03 Å (III), 2.85 Å (IV)) структурируют их в единое целое. Кроме того, за формирование структуры комплекса I отвечают контакты Br⋅⋅⋅СAr (3.41 Å) и прочные водородные связи аниона с гидроксильной группой катиона N⋅⋅⋅Н−О (2.05 Å, 77% от суммы ван-дер-ваальсовых радиусов) [29] (рис. 5а–5г). Наименьшее число контактов наблюдается в кристалле комплекса II ⋅ ⋅ 1/2PhH, решетка которого характеризуется наименее плотной упаковкой: ρвыч = 1.770 г/см3. Анионы данного комплекса, в отличие от остальных, не образуют контактов Br⋅⋅⋅Н−С. Более плотная упаковка наблюдается у дицианодибромидов I и III: ρвыч = 1.966 и 1.952 г/см3 соответственно. Плотность кристаллической упаковки соединения IV составляет ρвыч = 1.895 г/см3.
Список литературы
Xiaobo L., Patterson H. // Materials. 2013. V. 6. P. 2595. https://doi.org/10.3390/ma6072595
Dechambenoit P., Ferlay S., Kyritsakas N. et al. // Cryst. Eng. Comm. 2011. V. 13. P. 1922. https://doi.org/10.1039/C0CE00607F
Hill J.A., Thompson A.L., Goodwin A.L. // J. Am. Chem. Soc. 2018. V. 138. P. 5886. https://doi.org/10.1021/jacs.5b13446
Assefaa Z., Haireb R.G., Sykorac R.E. // J. Solid State Chem. 2008. V. 181. P. 382. https://doi.org/10.1016/j.jssc.2007.11.036
Brown M.L., Ovens J.S., Leznoff D.B. // Dalton Trans. 2017. V. 46. P. 7169. https://doi.org/10.1039/C7DT00942A
Chorazy S., Wyczesany M., Sieklucka B. // Molecules. 2017. V. 22. P. 1902. https://doi.org/10.3390/molecules22111902
Shaw C.F. // Chem. Rev. 1999. V. 99. № 9. P. 2589. https://doi.org/10.1021/cr980431o
Rawashdeh-Omary M.A., Omary M.A., Patterson H.H. // J. Am. Chem. Soc. 2000. V. 122. № 42. P. 10371. https://doi.org/10.1021/ja001545w
Rawashdeh-Omary M.A., Omary M.A., Shankle G.E. et al. // J. Phys. Chem. B. 2000. V. 104. № 26. P. 6143. https://doi.org/10.1021/jp000563x
Colis J.C.F., Larochelle C., Ferna’ndez E.J. et al. // J. Phys. Chem. B. 2005. V. 109. № 10. P. 4317. https://doi.org/10.1021/jp045868g
Assefaa Z., Kalachnikova K., Hairec R.G. et al. // J. Solid State Chem. 2007. V. 180. P. 3121. https://doi.org/10.1016/j.jssc.2007.08.032
Roberts R.J., Le D., Leznoff D.B. // Inorg. Chem. 2017. V. 56. № 14. P. 7948. https://doi.org/10.1021/acs.inorgchem.7b00735
Ovens J.S., Leznoff D.B. // Dalton Trans. 2011. V. 40. P. 4140. https://doi.org/10.1039/c0dt01772h
Ovens J.S., Truong K.N., Leznof D.B. // Dalton Trans. 2012. V. 41. P. 1345. https://doi.org/10.1039/c1dt11741f
Ovens J.S., Leznoff D.B. // Chem. Mater. 2015. V. 27. № 5. 1465. https://doi.org/10.1021/cm502998w
Cambridge Crystallographic Data Center. 2018. deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk
Sharutin V.V., Popkova M.A., Tarasova N.M. // Bulletin of the South Ural State University. Ser. Chemistry. 2018. V. 10. № 1. P. 55. [Шарутин В.В., Попкова М.А., Тарасова Н.М. // Вестник Южно-Уральского гос. ун-та. Сер. “Химия”. Т. 10. № 1. С. 55.] https://doi.org/10.14529/chem180107
Ovens J.S., Geisheimer A.R., Bokov A.A. et al. // Inorg. Chem. 2010. V. 49. P. 9609. https://doi.org/10.1021/ic101357y
Pitteri B., Bortoluzzi M., Bertolasi V. // Trans. Met. Chem. 2008. V. 33. P. 649. https://doi.org/10.1007/s11243-008-9092-9
Marangoni G., Pitteri B., Bertolasi V. et al. // J. Chem. Soc., Dalton Trans. 1987. № 1. P. 2235. https://doi.org/10.1039/DT9870002235
Ovens J.S., Truong K.N., Leznoff D.B. // Inorg. Chim. Acta. 2013. V. 403. P. 127. https://doi.org/10.1016/j.ica.2013.02.011
Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. М.: Мир, 2006. 440 с.
Jones L. // Inorg. Chem. 1964. V. 3. № 11. P. 1581. https://doi.org/10.1021/ic50021a024
Shorrock C.J., Jong H., Batchelor R.J. et al. // Inorg. Chem. 2003. V. 42. P. 3917. https://doi.org/10.1021/ic034144
Cordero B., G’omez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. P. 2832. https://doi.org/10.1039/b801115j
Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. P. 5806. https://doi.org/10.1021/jp8111556
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии