Журнал неорганической химии, 2020, T. 65, № 2, стр. 179-187
Особенности катион-индуцированной агрегации тетра-краун-замещенных фталоцианинатов алюминия(III)
Л. А. Лапкина a, *, Г. А. Киракосян a, b, В. Е. Ларченко c, А. Ю. Цивадзе a, b, Ю. Г. Горбунова a, b
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский пр-т, 31, корп. 4, Россия
c АО Научный центр “Малотоннажная химия”
107564 Москва, Краснобогатырская ул., 42, стр. 1, Россия
* E-mail: lapkina.lu@mail.ru
Поступила в редакцию 01.10.2019
После доработки 01.10.2019
Принята к публикации 05.10.2019
Аннотация
Методом спектроскопии ЯМР 1H изучен процесс катион-индуцированной димеризации тетра-(15-краун-5)-замещенного фталоцианината Al(III) с солями Na+, K+, Rb+ в растворе. Установлено сосуществование двух типов супрамолекулярных димеров в соответствии с наличием как мономерной, так и кислородно-мостиковой димерной форм исходного комплекса Al(III). С привлечением масс-спектрометрии (MALDI-TOF и HR-ESI) показано, что монофталоцианинат Al(III) [(OH)AlR4Pc] образует супрамолекулярные димеры состава {[M4(XAlR4Pc)2]4+(X−)4}, тогда как µ-оксодифталоцианинат Al(III) [(AlR4Pc)2(μ-O)] – кислородно-мостиковые супрадимеры {[M4(XAlR4Pc)2(μ-O)]2+(X−)2}.
ВВЕДЕНИЕ
Несмотря на токсичность алюминия [1, 2], комплексы этого металла с макроциклическими лигандами являются объектами исследования и практического использования в области диагностики и терапии онкологических заболеваний [3–5]. Комплексы алюминия с фталоцианинами как фотосенсибилизаторы второго рода при облучении красным светом генерируют синглетный кислород, относящийся к активным формам кислорода и окисляющий клеточные макромолекулы (липиды, нуклеиновые и аминокислоты), что приводит к их гибели [6]. Для повышения эффективности фотогенерации синглетного кислорода и снижения токсичности фотосенсибилизаторов используются гибридные комбинации фталоцианинов с наночастицами, например, золота, графена, полупроводниковых квантовых точек [7–9], карбоната кальция [10], диоксидов металлов [11]. Синергетический эффект фотодинамической терапии с использованием фталоцианиновых комплексов повышается также в комбинационной терапии [12].
Благодаря фотоактивности и эффективности генерации зарядов пленки фталоцианината хлоралюминия используются в солнечных батареях и органических электронных устройствах [13, 14]. Фталоцианинаты трехвалентных металлов, обладающие аксиальной лигандной координатой, предоставляют дополнительные возможности функционализации, что используется для усовершенствований в области органической фотовольтаики [15]. Перспективным органическим фотопроводящим материалом также является кислородно-мостиковый фталоцианинат алюминия [16, 17].
В биохимии одной из главных проблем является распознавание и транспорт биологически активных катионов щелочных металлов. В частности, лучшее понимание взаимодействия с макромолекулами будет способствовать созданию моделей новых антибиотиков [18, 19]. Использование с этой целью краун-содержащих тетрапиррольных лигандов является многообещающим подходом к пониманию природных супрамолекулярных ансамблей [20, 21]. С другой стороны, эти исследования способствуют созданию новых приемов при разработке материалов с уникальными свойствами [22–24].
Ранее нами были выделены монокристаллы супрамолекулярного димерного комплекса краун-фталоцианината алюминия с никотинатом рубидия, пригодные для исследования рентгеноструктурным методом [25]. Уникальность молекулярной структуры супрамолекулярного димера заключается в сочетании четырех “сэндвичевых” связей между краун-эфирами и катионами рубидия с наличием дополнительной кислородно-мостиковой связи между атомами алюминия. Интерес к изучению образования супрамолекулярных комплексов краун-фталоцианинатов с катионами щелочных металлов на примере краун-фталоцианината Al(III) обусловлен возможностью его существования как в мономерной [26], так и в кислородно-мостиковой димерной форме [27].
Цель настоящей работы – изучение спектральными методами взаимодействия краун-фталоцианината алюминия с солями щелочных металлов для выяснения условий образования кислородно-мостиковой связи в катион-индуцированном димерном комплексе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электронные спектры поглощения (ЭСП) были записаны в кварцевых кюветах с длиной оптического пути 0.1 и 10 мм на спектрофотометре Cary-100 (Varian).
Масс-спетры MALDI-TOF-MS были получены на спектрометре Bruker Daltonics Ultraflex в режиме положительных ионов в диапазоне m/z от 500 до 5000 ат. ед., в качестве матрицы использовали дигидробензойную кислоту (DHB). Масс-спектрометрия высокого разрешения (HR ESI MS) была выполнена на аналитической платформе университета Бургундии (Plateforme d’Analyses Chimiques et de Synthèse Moléculaire de l’Université de Bourgogne – Pôle Chimie Moléculaire”, the technological platform for chemical analysis and molecular synthesis (http://www.wpcm.fr). Спектры высокого разрешения (HRMS) были записаны на спектрометре Orbitrap ESI-TOF в режиме положительных ионов. Спектры ЯМР 1H были получены на спектрометре Bruker Avance III (600 MГц) при комнатной температуре в смеси CDCl3–CD3OD с использованием в качестве внутреннего стандарта тетраметилсилана (δ = 0.00 м.д.).
Использовали свежеперегнанный (над CaH2) хлороформ. Дейтерорастворители CDCl3 и CD3OD марки Aldrich не подвергали дополнительной очистке. Очистку комплексов проводили колоночной хроматографией в стеклянных колонках, заполненных нейтральной окисью алюминия (Merck, 0.063–0.2 мм). Использовали соли щелочных металлов (RbNic, KPiv, NaPiv, Rb2CO3) коммерческого происхождения (Acros, Merck, Aldrich).
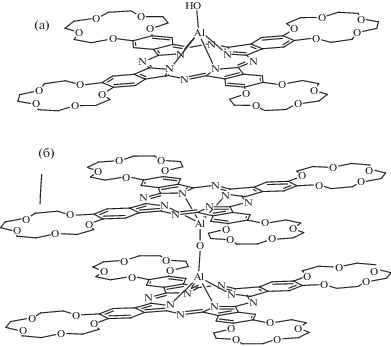
Тетра-15-краун-5-фталоцианинат Al(III) [(HO)AlR4Pc] был синтезирован по ранее описанной методике [28]. Характеристика комплекса с помощью физико-химических методов приводится в соответствии с данными [28]: MALDI-TOF-MS, m/z: найдено 1318.28 [M + H]+, рассчитано для C64H73O21N8Al – 1318.33. ЯМР 1H, м.д. (400 MГц, CDCl3/DMSOd6 2 : 1): 9.07–9.01 (м, 8H, Har ); 4.75 (ш. с, 16H, α-CH2); 4.14 (ш.с, 16H, β-CH2), 3.85 (ш. м, 32H, γ,δ-CH2); UV-vis (λ, нм (lg ε)), в CHCl3: 690 (4.88), 656 (4.14), 622 (4.19), 423 (4.21), 346 (4.47), 298 (4.30).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как было установлено ранее [29], при хроматографической очистке краун-замещенного фталоцианината алюминия (рис. 1а), полученного по методике [28], наблюдалась зависимость вида ЭСП элюата от состава элюента. При увеличении доли метанола в элюенте CHCl3–MeOH от 4 до 10 об. % в ЭСП элюата наряду с Q-полосой поглощения мономерной формы комплекса (λmax = 690 нм) появляется дополнительная узкая Q-полоса при λmax = = 645–647 нм, отвечающая коаксиальной димеризации мономерной формы, причем доля димерной формы растет по мере увеличения концентрации МеОН в элюенте. Полученные при элюировании переменным количеством метанола в элюенте образцы имеют, согласно ЭСП, разное соотношение мономерной и димерной форм комплекса. Мы предположили, что димерная форма представляет собой кислородно-мостиковый комплекс состава R4PcAlOAlR4Pc, поскольку в спектрах MALDI-TOF-MS наблюдаются сигналы, соответствующие молекулярному иону [(AlR4Pc)2(μ-O)]+(2616 D). В масс-спектрах образцов, полученных при элюировании комплексов Al(III) возрастающим количеством (об. %) MeOH в элюенте, четко прослеживается увеличение доли сигнала m/z = 2616 D (табл. 1). Поскольку выделить димерную форму комплекса в индивидуальном состоянии не удалось, при изучении особенностей катион-индуцированной супрамолекулярной агрегации краун-замещенного фталоцианината алюминия, связанных с наличием двух исходных форм, были выбраны образцы, содержащие преимущественно мономерную форму (условное обозначение Al-M), а также смеси обеих неразделяемых на колонке форм с меньшей (Al-M-D) и большей (Al-D-M) долями μ-оксодимера. На рис. 2а–2в приведены электронные спектры разбавленных (С ~ 5 × 10–6 моль/л) растворов выбранных исходных образцов в хлороформе.
Таблица 1.
Соотношение основных молекулярных форм в исходных образцах комплекса Al(III) по данным MALDI-TOF-MS (DHB), приведенные к сигналу μ-оксодимера
| Образец | [HOAlR4Pc]+ | [DHBAlR4Pc]+ | [(AlR4Pc)2(μ-O)]+ |
|---|---|---|---|
| Al-M | 5 | 30 | 1 |
| Al-M-D | 2.5 | 2.5 | 1 |
| Al-D-M | 1 | 0.4 | 1 |
Рис. 2.
ЭСП образцов: Al-M (a), Al-M-D (б), Al-D-M (в), CHCl3, l = 1 см; ЭСП соответствующих им супрамолекулярных комплексов с МХ (M = K+, Rb+; Х = Piv–, Nic–) (г), CDCl3–CD3OD, l = 0.1 мм.
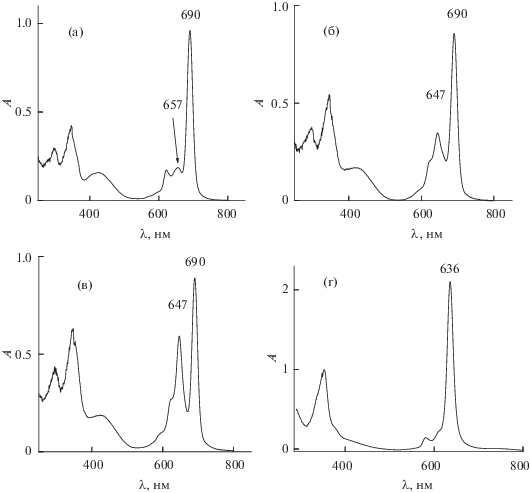
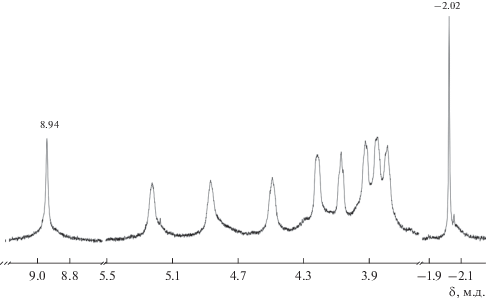
Исследование методом ЯМР 1H растворов в СDCl3–CD3OD трех образцов (Al-M, Al-M-D, Al-D-M) в присутствии десятикратного избытка RbNic показало, что во всех случаях в ароматической области наблюдается по два основных сигнала ароматических протонов HAr: δ = 8.89 и 8.94 м.д. (рис. 3). В то же время электронные спектры всех трех образцов идентичны и имеют одинаковые Q-полосы поглощения при λmax = 636 нм (рис. 2г).
Рис. 3.
Спектры ЯМР 1H образцов Al-M (1), Al-M-D (2), Al-D-M (3) в присутствии избытка RbNic, CDCl3–CD3OD. Сигналы протонов некоординированных Nic– исключены для ясности восприятия.
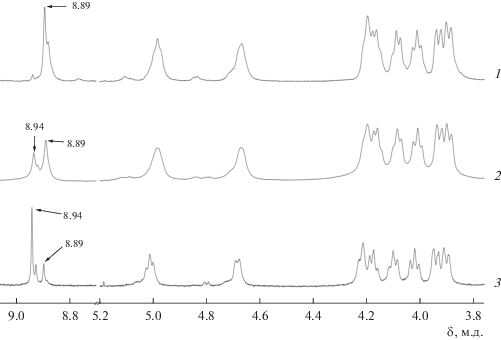
Наличие двух сигналов ароматических протонов позволяет предположить, что они соответствуют двум возможным супрамолекулярным димерам, основу которых составляют тетракатион [Rb4(NicAlR4Pc)2]4+ ([I]4+) и дикатион [Rb4(NicAlR4Pc)2(μ-O)]2+ ([Iμ]2+). Структура мостикового супрадимера была решена методом РСА на основе кристаллов {[Rb4(NicA lR4Pc)2(μ-O)]2+(Nic−)2} ∙ 2.36HNic ∙ 11H2O [25].
В области сигналов протонов краун-эфирных групп для [I]4+ и [Iμ]2+ наблюдаются характерные для протонов метиленовых групп [20] мультиплеты при одних и тех же значениях химических сдвигов. В этой же области проявляются сигналы протонов экстралигандов, координированных Nic− (рис. 3), которые попадают в конусы экранирования кольцевых токов двух молекул фталоцианинa [30]. Однако относительно малая интенсивность мультиплетов протонов координированного алюминием Nic− и их частичное перекрывание с сигналами протонов краун-эфирных групп не дают возможности провести полное отнесение.
Гораздо более информативным с точки зрения спектроскопии ЯМР 1H является использование в качестве возможного экстралиганда неароматического аниона пивалевой кислоты Piv−. На рис. 4 представлены фрагменты спектров ЯМР 1H растворов краун-фталоцианинатов алюминия в присутствии избытка KPiv.
Рис. 4.
Фрагменты спектров ЯМР 1H образцов Al-M (1), Al-M-D (2) и Al-D-M (3) в присутствии избытка KPiv, CDCl3–CD3OD. Значения отношений интегральных интенсивностей сигналов ароматических протонов (8.91 и 8.95 м.д.): –30 (1), –5 (2), –1.3 (3).
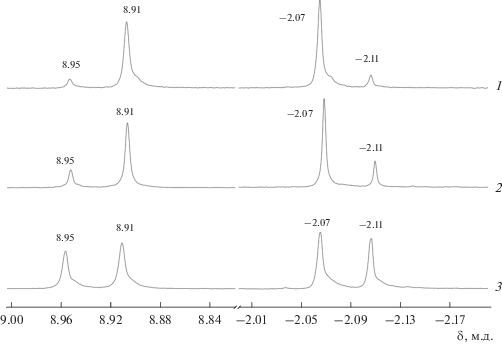
Сигналы протонов экстралигандов в этом случае лежат в отрицательной области δ (в шкале ТМС) [30]. Сигнал с δ = −2.07 м.д. относится к Piv−, координированному алюминием в комплексном катионе [K4(PivAlR4Pc)2]4+ ([II]4+), так же как и сигнал Har с δ = 8.91 м.д. в ароматической области спектра. Кроме того, в тех же областях спектра наблюдаются и сигналы катиона супра-μ-оксодимера [K4(PivAlR4Pc)2(μ-O)]2+ ([IIμ]2+) (δ = −2.11 и 8.95 м.д.). Таким образом, как и в случае RbNic, для KPiv всегда наблюдается сосуществование супрадимера и супра-μ-оксодимера. Соотношения интегральных интенсивностей сигналов ароматических протонов (8.91 и 8.95 м.д.) следующие: 30 : 1, 5 : 1 и 1.3 : 1 для AlL-M–KPiv, AlL-M-D–KPiv, AlL-D-M–KPiv соответственно (рис. 4).
Таким образом, метод 1H ЯМР по сравнению с ЭСП предоставляет более детальную информацию при изучении супрамолекулярной организации краунфталоцианината Al(III) в присутствии солей ЩМ.
Следует отметить, что для всех систем, содержащих комплексы [II]4+, [IIμ]2+, так же как и для [I]4+, [Iμ]2+, в ЭСП наблюдается Q-полоса при 636 нм. Химсдвиги сигналов некоторых ди- и тетракатионов приведены в табл. 2. Величины химсдвигов ароматических протонов Pc (Har) для супра-µ-оксодимеров всегда больше химических сдвигов Har супрадимеров, и хотя разность невелика (0.04–0.05 м.д.), она всегда воспроизводится для каждой из пар комплексов ([I]4+–[Iμ]2+, [II]4+–[IIμ]2+). Сигналы протонов Piv− для супра-µ-оксодимеров всегда находятся в более сильном поле по сравнению с сигналами супрадимеров и с той же разностью в 0.04 м.д. (рис. 4).
Таблица 2.
Химические сдвиги (м.д.) сигналов супрамолекулярных комплексов краун-замещенного фталоцианината Al(III) c никотинатом Rb+ (I, Iμ) и пивалатами K+ (II, IIμ), Na+ (III)
| Комплекс | δHar | δHPiv |
|---|---|---|
| [I]4+ | 8.89 | − |
| [Iμ]2+ | 8.94 | − |
| [II]4+ | 8.91 | –2.07 |
| [IIμ]2+ | 8.95 | −2.11 |
| [III]4+ | 8.94 | −2.02 |
Благодаря методу ЯМР 1H (рис. 5) нами впервые установлено, что в присутствии NaPiv также образуется супрамолекулярный димер, поскольку в спектре AlL-M–NaPiv присутствует узкий сигнал в ароматической области (δ = 8.94 м.д.). Наблюдаемое характерное расщепление сигналов протонов краун-эфирных групп и наличие сигнала протонов пивалат-иона в отрицательной области (δ = −2.02 м.д.) подтверждают существование супрамолекулярного димера с катионами натрия. Ранее считалось, что непременным условием образования супрамолекулярных комплексов является превышение размера катиона над размером полости краун-эфира. В связи с этим сэндвичевые димеры фталоцианинов с 15-краун-5-заместителями могут образовывать только катионы K+, Rb+, Cs+, но не Na+ [20, 21], тем не менее в концентрированном растворе образца методом ЯМР 1H был зафиксирован супрамолекулярный комплекс с катионами натрия. Q-полоса в ЭСП соответствующего образца (C ~ 10–3 моль/л, l = 0.1 мм) имела максимум поглощения при 639 нм. Однако при разбавлении хлороформом супрамолекулярный катион [Na4(PivAlR4Pc)2]4+ ([III]4+) диссоциировал, что проявлялось в ЭСП уменьшением поглощения в максимуме Q-полосы димера (639 нм) и, соответственно, увеличением поглощения в максимуме Q-полосы мономера (687 нм). Следует отметить, что супрамолекулярные димеры с катионами калия и рубидия, в отличие от натрийсодержащего, не диссоциируют при разбавлении концентрированных растворов не только хлороформом, но и метанолом.
В общем случае образование супрадимеров и супра-μ-оксодимеров можно представить следующей схемой:
(1)
$2[{\text{HOAl}}{{{\text{R}}}_{{\text{4}}}}{\text{Pc}}] + 4{\text{MX}} \to \{ {{[{{{\text{M}}}_{{\text{4}}}}{{{\text{(XAl}}{{{\text{R}}}_{{\text{4}}}}{\text{Pc}})}_{2}}]}^{{4 + }}}{{({{{\text{X}}}^{ - }})}_{4}}\} ,$(2)
$[{{{\text{R}}}_{{\text{4}}}}{\text{PcAlOAl}}{{{\text{R}}}_{{\text{4}}}}{\text{Pc}}] + 4{\text{MX}} \to \{ {{[{{{\text{M}}}_{{\text{4}}}}{{{\text{(XAl}}{{{\text{R}}}_{{\text{4}}}}{\text{Pc}})}_{2}}(\mu {\text{ - O}})]}^{{2 + }}}{{({{{\text{X}}}^{ - }})}_{2}}\} ,$Схема 1.
Предложенная схема образования двух форм супракомплексов для краун-фталоцианината Al(III) подтверждается, на наш взгляд, тем обстоятельством, что в спектрах ЯМР 1H, например, образцов Al-M/RbNic и Al-D-M/RbNic не менялось соотношение интегралов двух сигналов в ароматической области в течение длительного (1 мес.) периода времени. Таким образом, в концентрированных растворах (С ~ 10−3 моль/л), согласно данным спектроскопии ЯМР 1H, во времени сосуществуют две независимые формы супракомплексов Al(III).
Тетракатионы [M4(XAlR4Pc)2]4+ формируются по механизму катион-индуцированной димеризации [(HO)AlR4Pc] [20], тогда как мостиковые дикатионы [M4(XAlR4Pc)2(μ-O)]2+ – путем встраивания катионов щелочных металлов в предорганизованные полости, образуемые краун-эфирами, в высокосимметричном [(AlR4Pc)2(μ-O)]. Это обобщение подкрепляется корреляцией данных по составу исходных форм комплекса Al(III) (табл. 1) с количественными данными метода ЯМР 1H.
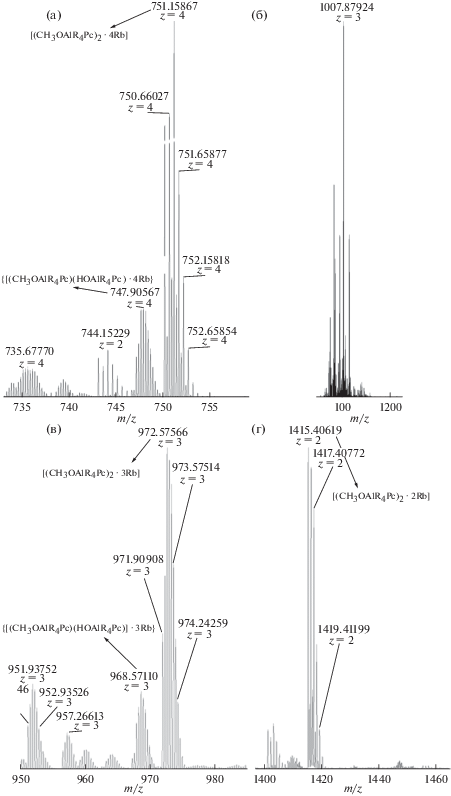
Если для супра-μ-оксодимера мы располагаем структурными данными [25], то существование немостикового супрадимера косвенно подтверждается масс-спектрометрическими данными. Кристаллы (в форме игл), выделенные из образца (Al-M)–Rb2CO3–CDCl3–CD3OD, исследованного методом ЯМР 1H, были проанализированы методом HR-ESI-MS из раствора в CH3OH–H2O. Полученные масс-спектры (рис. 6а, 6в, 6г) преимущественно содержали сигналы молекулярных ионов с m/z = 751.15867 D, 972.57566 D, 1415.40619 D, соответствующих супрамолекулярным димерам состава [Rbn(CH3OAlR4Pc)2]n+, n = 4–2. Помимо этого в спектрах также наблюдались менее интенсивные сигналы с m/z = 747.90567, 968.5711 D, отвечающие молекулярным ионам немостиковых димеров с различающимися экстралигандами {Rbn[(CH3OAlR4Pc)(HOAlR4Pc)]}n+, n = 4–3. Полученные методом HR-ESI-MS данные указывают как на образование немостиковых супрамолекулярных димеров {[M4(XAlR4Pc)2]4+(X−)4} в результате катион-индуцированной сборки мономерного краун-фталоцианината Al(III), так и на возможность замены экстралиганда в условиях эксперимента. Следует отметить, что величина напряжения поля, приложенного на распылительный капилляр, сказывалась на составе детектируемых катионированных молекулярных ионов. С ростом напряжения в полученных масс-спектрах наряду с перечисленными сигналами присутствовал также сигнал с m/z = 1007.87924 D (рис. 6б), отвечающий трехзарядному катиону мостикового супрадимера состава [Rb4(CH3OAlR4Pc)2(μ-OH)]3+. Относительная интенсивность данного сигнала возрастала в 4 раза при переходе от 3400 к 16100 В. Эти результаты могут указывать на возможность образования мостикового супрадимера в условиях ESI эксперимента.
Рис. 6.
Фрагменты ESI(+) масс-спектра раствора (H2O–MeOH), содержащего супрамолекулярные комплексы [HOAlR4Pc] с Rb2CO3: a – [(CH3OAlR4Pc)2 ∙ 4Rb]4+: C130H150Al2N16O42Rb4 – MW = 3004.498 D; [(CH3OAlR4Pc)(HOAlR4Pc) ∙ 4Rb]4+: C129H148Al2N16O42Rb4 – MW = 2990.604 D; б – [Rb4(CH3OAlR4Pc)2(μ-OH)]3+: C130H151Al2N16O43Rb4 – MW = 3021.51; в – [(CH3OAlR4Pc)2 ∙ 3Rb]3+: C130H150Al2N16O42Rb3 – MW = 2919.030 D; [(CH3OAlR4Pc)(HOAlR4Pc) ∙ 3Rb]3+: C129H148Al2N16O42Rb3 – MW = 2905.004 D; г – [(CH3OAlR4Pc)2 ∙ 2Rb]2+: C130H150Al2N16O42Rb2 – MW = 2833.563 D.
Таким образом, в концентрированных растворах (С ~ 10−3 моль/л) образуются два типа супрамолекулярных комплексов (схема 1). Следует подчеркнуть, что при исследовании описываемых систем метод ЯМР 1H, в отличие от ЭСП, позволяет определить их соотношение (с точностью определения интегральных интенсивностей сигналов в спектрах ЯМР 1H).
ЗАКЛЮЧЕНИЕ
Методом спектроскопии ЯМР 1H на основании существования двух наборов сигналов в области резонанса как ароматических протонов фталоцианина, так и протонов экстралигандов – анионов солей ЩМ, показано, что в результате взаимодействия краун-фталоцианинатов Al(III) с катионами калия и рубидия могут образовываться два типа супрамолекулярных димеров: {[M4(XAlR4Pc)2]4+(X−)4} и {[M4(XAlR4Pc)2(μ-O)]2+(X−)2}. Соотношение интегральных интенсивностей сигналов, отвечающих каждому типу супрамолекулярных димеров, коррелирует с составом исходных образцов краун-фталоцианината Al(III), полученных на различных стадиях колоночной хроматографии при изменении полярности элюента. Совокупность данных спектральных методов (ЭСП, MALD-TOF-MS, HR-ESI и ЯМР 1H) позволила провести отнесение сигналов NMR 1H к каждому типу супрамолекулярного комплекса и предложить их строение. Уникальная особенность взаимодействия краун-замещенного фталоцианината Al(III) с солями щелочных металлов заключается в образовании двух типов супрадимеров вследствие наличия двух исходных форм комплекса Al(III) – мономера и µ-оксо-димера, получаемых в различных соотношениях при изменении полярности элюента в процессе колоночной хроматографии на Al2O3.
Список литературы
Rubini P., Lakatos A., Champmartin D. et al. // Coord. Chem. Rev. 2002. V. 228. P. 137.
Kiss T., Enyedy É.A., Jakusch T. // Coord. Chem. Rev. 2017. V. 352. P. 401. https://doi.org/10.1016/j.ccr.2016.12.016
Mohammed I., Oluwole D.O., Nemakal M. et al. // Dyes and Pigments. 2019. V. 170. P. 107592. https://doi.org/10.1016/j.dyepig.2019.107592
Shin D., Nguyen L., Le M. et al. // Photodiagnosis and Photodynamic Therapy. 2019. V. 26. P. 442. https://doi.org/10.1016/j.pdpdt.2019.05.005
Crous A., Kumar S.S.D., Abrahamse H. // Photochemistry & Photobiology, B: Biology. 2019. V. 194. P. 96. https://doi.org/10.1016/j.jphotobiol.2019.03.018
Guo H., Qian H., Idris N.M. et al. // Nanomedicine: Nanotechnology, Biol. Med. 2010. V. 6. № 3. P. 486.
Gvozdev D.A., Maksimov E.G., Strakhovskaya M.G. et al. // J. Photochem. Photobiol., B, Biol. 2018. V. 187. P. 170. https://doi.org/10.1016/j.jphotobiol.2018.08.003
Xu Yong-Kui, Hwang Sekyu, Kim Sungjee et al. // ACS Appl. Mater. Interfaces. 2014. V. 6. № 8. P. 5619. https://doi.org/10.1021/am500106c
Achadu O.J., Nyokong T. // Spectrochim. Acta, Part A. 2017. V. 174. P. 339. https://doi.org/10.1016/j.saa.2016.11.043
Svenskaya Yu., Parakhonskiy B., Haase A. et al. // Biophys. Chem. 2013. V. 182. P. 11. https://doi.org/10.1016/j.bpc.2013.07.006
Shekunova T.O., Lapkina L.A., Shcherbakov A.B. et al. // Photochemistry & Photobiol. A: Chem. 2019. V. 382. P. 111 925. https://doi.org/10.1016/j.jphotochem.2019.111925
Alia S., Muhammada S., Khurshid A. et al. // Photodiagnosis and Photodynamic Therapy. 2018. V. 22. P. 51. https://doi.org/10.1016/j.pdpdt.2018.02.010
Lessard B.H., AL-Amar M., Grant T.M. et al. // J. Mater. Chem. A. 2015. V. 3. № 9. P. 5047. https://doi.org/10.1039/c4ta06759b
Suga T., Isoda S., Moriguchi S. et al. // Mol. Cryst. Liq. Cryst. 2001. V. 370. № 1. P. 253. https://doi.org/10.1080/10587250108030082
Raboui H., AL-Amar M., Abdelrahmana A.I. et al. // RSC Adv. 2015. V. 5. № 57. P. 45 731. https://doi.org/10.1039/c5ra04919a
Yamasaki Y., Takaki K. // Dyes and Pigments. 2006. V. 70. № 2. P.105. https://doi.org/10.1016/j.dyepig.2005.04.017
Basova T., Plyashkevich V., Petraki F. et al. // J. Chem. Phys. 2011. V. 134. № 12. P. 124703. https://doi.org/10.1063/1.3569860
Poonia N.S., Bajaj A.V. // Chem. Rev. 1979. V. 79. № 5. P. 389. https://doi.org/10.1021/cr60321a002
Gokel G.W., Daschbach M.M. // Coord. Chem. Rev. 2008. V. 252. № 8–9. P. 886. https://doi.org/10.1016/j.ccr.2007.07.026
Gorbunova Y.G., Martynov A.G., Tsivadze A.Y. // Handbook of porphyrin science / Eds. Kadish K.M., Smith K.M., Guilard R. Singapore: World Scientific Publishing Company, 2012. V. 25. P. 271.
Even P., Boitrel B. // Coord. Chem. Rev. 2006. V. 250. № 3–4. P. 519. https://doi.org/10.1016/j.ccr.2005.09.003
Martynov A.G., Gorbunova Y.G., Tsivadze A.Y. // Russ. J. Inorg. Chem. 2014. V. 59. № 14. P. 1635. https://doi.org/10.1134/S0036023614140046
Gorbunova Y.G., Grishina A.D., Martynov A.G. et al. // J. Mater. Chem. C. 2015. V. 3. № 26. P. 6692. https://doi.org/10.1039/C5TC00965K
Safonova E.A., Martynov A.G., Nefedov S.E. et al. // Inorg. Chem. 2016. V. 55. № 5. P. 2450. https://doi.org/10.1021/acs.inorgchem.5b02831
Lapkina L.A., Larchenko V.E., Kirakosyan G.A. et al. // Inorg. Chem. 2018. V. 57. № 1. P. 82. https://doi.org/10.1021/acs.inorgchem.7b01983
Lapkina L. A., Nefedov S.E., Gorbunova Y.G., Tsivadze A.Y. // Russ. Chem. Bull. 2013. V. 62. № 8. P. 1930. https://doi.org/10665285/13/6208-1930 [Лапкина Л.А., Нефедов С.Е., Горбунова Ю.Г., Цивадзе А.Ю. // Изв. Академии наук. Сер. хим. 2013. Т. 62. № 8. С. 1930.]
Wynne K.J. // Inorg. Chem. 1985. V. 24. № 9. P. 1339. https://doi.org/10.1021/ic00203a015
Lapkina L.A., Konstantinov N.Yu., Larchenko V.E. et al. // J. Porphyrins Phthalocyanines. 2009. V. 13. № 8–9. P. 859. https://doi.org/10.1142/S108842460900005X
Lapkina L.A., Gorbunova Yu.G., Larchenko V.E. et al. // Prot. Met., Phys. Chem. Surf. 2015. V. 51. № 2. P. 204. [Лапкина Л.А., Горбунова Ю.Г., Ларченко В.Е. и др. // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 2. С. 151.]https://doi.org/10.1134/S2070205115020112
Karásková M., Rakušan J., Lyčka A. et al. // Tetrahedron Lett. 2012. V. 53. № 32. P. 4056. https://doi.org/10.1016/j.tetlet.2012.05.098
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии