Журнал неорганической химии, 2020, T. 65, № 2, стр. 243-251
Агрегация и молекулярное комплексообразование бифункционально замещенных фталоцианинатов кобальта в водных средах
А. А. Филиппова a, *, А. А. Кернер a, С. А. Знойко a, Т. В. Тихомирова a, А. С. Вашурин a
a Ивановский государственный химико-технологический университет
153460 Иваново, пр-т Шереметевский, 7, Россия
* E-mail: anna.filippova96@gmail.com
Поступила в редакцию 13.09.2019
После доработки 23.09.2019
Принята к публикации 27.09.2019
Аннотация
Рассмотрены процессы ассоциации и экстракоординации водорастворимых комплексов кобальта с моно- и бифункционально замещенными фталоцианинатами в водных растворах с монодентатными лигандами – пиридином и пиперидином. Соотнесена способность замещенных производных фталоцианината кобальта координировать малые органические молекулы с природой их периферических заместителей. Определен тип и константы устойчивости образующихся в водных средах ассоциатов.
ВВЕДЕНИЕ
В последние годы большое внимание уделяется созданию супрамолекулярных систем на основе макроциклических молекул в связи с их возможным применением в молекулярной электронике [1], нелинейной оптике [2], медицине [3]. Среди множества различных структур наиболее подходящими представляются тетрапиррольные макрогетероциклические соединения. Значительное число работ [4–9] посвящено процессам самосборки подобных молекул, поскольку слабые π–π*-взаимодействия и водородные связи являются ключевым фактором для построения всевозможных функциональных систем. В связи с этим получение жидкофазных материалов и систем с заданным набором полезных функций на основе металлокомплексов фталоцианинов является достаточно перспективным. Важнейшие свойства фталоцианиновых макроциклов заключаются в возможности модификации терминальных фрагментов периферии [10, 11], способности к осуществлению координационных взаимодействий центрального катиона металла с различными малыми электронодонорными лигандами [12, 13], а также к самоорганизации [14, 15]. Самоассоциация фталоцианинов в растворах (как процесс образования надмолекулярных ансамблей) обусловлена нековалентными взаимодействиями (ван-дер-ваальсовы силы, π–π*-взаимодействия, водородные связи) между двумя или более макроциклическими молекулами, а также эффектами среды (сольватофобные взаимодействия). На ассоциацию фталоцианинов оказывают влияние следующие факторы: геометрия периферических заместителей [16], добавки различных органических растворителей [17], сульфирование [18], введение молекулярных лигандов [12, 13].
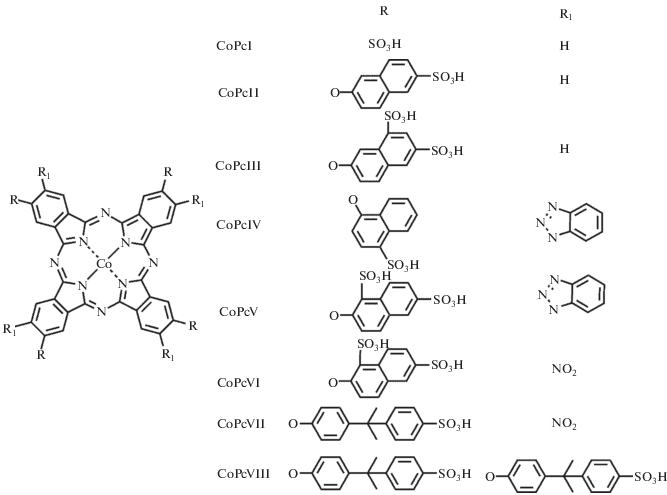
Настоящая работа является продолжением исследований [19–21] и посвящена установлению закономерностей влияния периферических заместителей сульфированных производных фталоцианинатов Со(II) (рис. 1) на процессы их самоассоциации в растворах путем введения малых азотсодержащих лигандов (пиридин, пиперидин), что открывает путь к созданию жидкофазных систем и материалов с заданными параметрами для молекулярных устройств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тетрасульфофталоцианинат кобальта (СоРсI) синтезировали по известной методике [22, 23]. В электронном спектре поглощения (ЭСП) водного раствора СоРсI (рН 7.2) регистрируются два максимума поглощения (λmax) при 625 (димер) и 665 нм (мономер).
ИК-спектр (КBr, ν, см–1): 1720, 1632, 1502, 1452, 1489, 1409, 1379, 1134, 1049, 935, 770, 618. Интенсивные полосы при 700, 1032–1035, 1192–1197 см–1 обусловлены наличием в молекуле сульфогрупп. Поглощение в области 839–855 см–1 связано с колебаниями С–Н 1,2,4-трехзамещенных ядер бензола, присоединенных к порфиразиновому кольцу.
ЯМР 1Н (CDCl3, δ, м.д.): 7.82 (Ar–H); 8.31 (Ar–H); 8.49 (Ar–H).
Тетра-4-[(6-сульфо-2-нафтил)окси]фталоцианинат кобальта (СоРсII) синтезировали по методике [24] из соответствующего нитрила. Смесь калиевой соли 4-[(6-сульфо-2-нафтил)окси]фталонитрила (0.78 г) и безводного хлорида кобальта (0.065 г) при перемешивании нагревали до 190–195°С в течение 60 мин. Образовавшийся фталоцианинат кобальта экстрагировали из реакционной массы диметилсульфоксидом и осаждали из экстракта абсолютным этанолом. Полученный осадок отфильтровывали, промывали этанолом в аппарате Сокслета. Заключительную очистку проводили хроматографией на силикагеле М60 (элюент – ДМФА : вода в объемном соотношении 1 : 1). Выход 0.39 г (54%). Продукт представляет собой порошок сине-зеленого цвета, хорошо растворимый в воде, в смеси ДМФА/вода, ДМСО, водном растворе щелочи. Проведен его элементный анализ:
| С | Н | N | S | |
| Найдено, %: | 58.42; | 2.70; | 7.62; | 8.80. |
| Для C72H40N8S8O16Со | ||||
| вычислено, %: | 59.22; | 2.74; | 7.68; | 8.80. |
ИК-спектр (KBr, ν, см–1): 1045 (–S=O), 1103 (–S=O), 1205 (Ar–O–Ar).
Тетра-4-[(6,8-дисульфо-2-нафтил)окси]фталоцианинат кобальта (СоРсIII) получали по приведенной выше методике, используя 1.01 г дикалиевой соли 4-[(6,8-дисульфо-2-нафтил)окси]фталонитрила. Выход 0.53 г (59%). Продукт представляет собой порошок сине-зеленого цвета, хорошо растворимый в воде, в смеси ДМФА/вода, ДМСО, водном растворе щелочи. Проведен его элементный анализ:
| С | Н | N | S | |
| Найдено, %: | 48.32; | 2.20; | 6.23; | 14.43. |
| Для C72H40N8S8O28Со | ||||
| вычислено, %: | 48.57; | 2.25; | 6.30; | 14.39. |
ИК-спектр (KBr, ν, см–1): 1039 (–S=O), 1103 (‒S=O), 1210 (Ar–O–Ar).
Тетра-4-[(4-сульфо-1-нафтил)окси]-тетра-5-(1-бензотриазолил)фталоцианинат кобальта (СоРсIV) синтезировали по известной методике [25, 26] путем сульфирования исходного фталоцианина. Навеску 160 мг (0.1 ммоль) тетра-4-[(1-нафтил)окси]-тетра-5-(1-нафтокси)фталоцианината кобальта растворяли в смеси 2 мл (18 ммоль) хлорсульфоновой кислоты и 2 мл (18 ммоль) тионилхлорида и перемешивали при температуре 293 K в течение 2 ч. Далее реакционную массу выливали на лед, смешанный с хлоридом натрия (0.1 мас. часть). Полученный осадок собирали на фильтре Шотта и сушили в эксикаторе над концентрированной H2SO4 в течение 72 ч. Экстракцию сульфохлоридов проводили ацетоном, затем препарат высушивали. Далее осуществляли гидролиз сульфохлоридов путем кипячения в воде. Выход конечного продукта составил 82–85%. Дополнительную очистку проводили с помощью хроматографии (сорбент – силикагель М60, элюент – ДМФА). Ниже представлены результаты элементного анализа:
| С | H | N | S | |
| Найдено, %: | 52.00; | 4.05; | 12.43; | 5.36. |
| Для C98H52N20S4O16Со ⋅ 16Н2О | ||||
| вычислено, %: | 52.01; | 3.82; | 12.64; | 5.78. |
ИК-спектр (KBr, ν, см–1): 745 (C–N), 1045 (N=N), 1230 (Ar–O–Ar), 1060 (С–S), 1150–1190 (S=O в SO3H).
MALDI-TOF m/z: 1932.71 [M + 4H]+.
ЯМР 1Н (ДМСО-d6, δ, м.д.): 7.45 (Ar–5H), 7.94 (Ar–4H), 8.07 (Ar–6H), 8.29 (Ar–3H) – триазольная группа, 7.64 (Ar–8H), 7.73 (Ar–7H), 7.85 (Ar–11H), 8.18 (Ar–10H), 8.53 (Ar–9H), 8.85 (Ar–12H) – нафтоксигруппа, 8.97 (SO3H).
Тетра-4-[(1,6-дисульфо-2-нафтил)окси]-тетра-5-(1-бензотриазолил)фталоцианинат кобальта (СоРсV) синтезировали по методике, аналогичной для СоРсIV. В качестве исходного макроцикла для сульфирования был взят тетра-4-[(2-нафтил)окси]-тетра-5-(1-нафтокси)фталоцианинат кобальта. Ниже приведены результаты элементного анализа:
| С | H | N | S | |
| Найдено, %: | 42.29; | 4.42; | 9.73; | 9.36. |
| Для C96H52N20S8O28Со ⋅ 32Н2О | ||||
| вычислено, %: | 42.29; | 4.14; | 9.91; | 9.08. |
ИК-спектр (KBr, ν, см–1): 741 (C–N), 1049 (N=N), 1262 (Ar–O–Ar), 1091 (С–S), 1158 (S=O в SO3H).
MALDI-TOF m/z: 2248.82 [M]+.
ЯМР 1Н (ДМСО-d6, δ, м.д.): 7.48(Ar–5H), 7.75 (Ar–4H), 7.94 (Ar–6,7H), 8.14 (Ar–3H) – триазольная группа, 8.33 (Ar–2H) – макрокольцо, 8.72 (Ar–8,9,11H) – нафтоксигруппа, 8.83, 8.81 (SO3H).
Тетра-4-[(1,6-дисульфо-2-нафтил)окси]-тетра-5-(нитро)фталоцианинат кобальта (СоРсVI) синтезировали по методике, аналогичной для СоРсIV. В качестве исходного макроцикла для сульфирования был взят тетра-4-[(2-нафтил)окси]-тетра-5-(нитро)фталоцианинат кобальта. Выход 167.2 мг (85%). Проведен его элементный анализ:
| C | N | H | S | O | |
| Найдено, %: | 40.78; | 11.96; | 2.63; | 11.88; | 33.59. |
| Для C72H52CoN12O44S8 | |||||
| вычислено, %: | 41.09; | 7.99; | 2.49, | 12.19, | 33.45. |
MALDI-TOF: [M + 2Na + 2H]+ = 2008.22, рассчитано: 1960.55 (2104.67 для гидратированной молекулы).
ИК-спектр (KBr, ν, см–1): 741 (C–N), 1049 (N=N), 1262 (Ar–O–Ar), 1091 (С–S), 1158 (S=O в SO3H). Полученные данные свидетельствуют о наличии восьми молекул воды, являющихся частью макроцикла C72H36CoN12O36S8 · 8H2O.
Тетра-4-{4-[1-метил-1-(4-сульфофенил)этил]фенокси}-тетра-5-(нитро)фталоцианинат кобальта (CoPcVII) синтезировали по методике, аналогичной для СоРсIV. В качестве исходного макроцикла для сульфирования был взят тетра-4-[4-(1-метил-1-фенилэтил)фенокси]-тетра-5-(нитро)фталоцианинат кобальта. Выход 137 мг (72%). Результаты элементного анализа представлены ниже:
| C | N | H | S | |
| Найдено, %: | 57.71; | 8.56; | 3.96; | 6.38. |
| Для C92H68CoN12O24S4 | ||||
| вычислено, %: | 57.77; | 8.79; | 3.58; | 6.70. |
ИК-спектр (KBr, ν, см–1): 1020 (C–S), 1174 (S=O), 1340 (NO2), 1504 (NO2), 2852, 2919 (CH3).
Окта-4,5-{4-[1-метил-1-(4-сульфофенил)этил] фенокси}фталоцианинат кобальта (CoPcVIII) синтезировали по методике, аналогичной для СоРсIV. В качестве исходного макроцикла для сульфирования был взят окта-4,5-[4-(1-метил-1-фенилэтил)фенокси]фталоцианинат кобальта. Выход 273 мг (94%). Проведен его элементный анализ:
ИК-спектр (KBr, ν, см–1): 1039 (C–S), 1122 (S=O), 1238 (Ar–O–Ar), 2921 (CH3).
Лиганды пиридин (Py) и пиперидин (Pip) перед использованием очищали по методике, рекомендованной в [27].
Исследование процессов комплексообразования проводили спектрофотометрическими методом. ЭСП регистрировали в кварцевых кюветах на спектрофотометре Unico 2800 в спектральном диапазоне 300–900 нм. При проведении эксперимента ячейку термостатировали.
Расчет константы устойчивости молекулярного комплекса проводили на основании изменения плотности поглощения раствора в области Q-полосы.
(1)
${{K}_{y}} = \frac{{\left[ {{\text{CoPc}} \cdot {\text{L}}} \right]}}{{\left[ {{\text{CoPc}}} \right] \cdot \left[ {\text{L}} \right]}}.$Равновесную концентрацию молекулярного комплекса рассчитывали по уравнению:
(2)
${{C}_{{{\text{CoPc}}\, \cdot \,{\text{L}}}}} = C_{{{\text{CoPc}}}}^{0}\frac{{\left( {{{A}_{0}} - {{A}_{P}}} \right)~}}{{\left( {{{A}_{0}} - {{A}_{k}}} \right)}}.$(3)
${{C}_{{\text{L}}}} = {{C}_{{\text{L}}}} - C_{{{\text{CoPc}}}}^{0}\frac{{\left( {{{A}_{0}} - {{A}_{P}}} \right)~}}{{\left( {{{A}_{0}} - {{A}_{k}}} \right)}}.$С учетом уравнений (1) и (2) уравнение для расчета константы устойчивости примет вид:
(4)
${{K}_{y}} = \frac{{\left[ {{{\left( {{{A}_{0}} - {{A}_{P}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{A}_{0}} - {{A}_{P}}} \right)} {\left( {{{A}_{P}} - {{A}_{k}}} \right)}}} \right. \kern-0em} {\left( {{{A}_{P}} - {{A}_{k}}} \right)}}} \right]}}{{\left[ {C_{{\text{L}}}^{0} - C_{{{\text{CoPc}}}}^{0}{{\left( {{{A}_{0}} - {{A}_{P}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{A}_{0}} - {{A}_{P}}} \right)} {\left( {{{A}_{0}} - {{A}_{k}}} \right)}}} \right. \kern-0em} {\left( {{{A}_{0}} - {{A}_{k}}} \right)}}} \right]}}.$Исследование проводили в условиях избытка лиганда по отношению к металлофталоцианину, поэтому равновесную концентрацию лиганда полагали равной его исходной концентрации, что упрощало процедуру вычисления Ky:
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
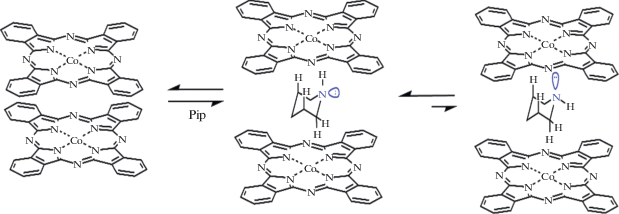
Металлокомплексы фталоцианинов с кобальтом (CoPc) за счет координационно-ненасыщенного металла-комплексообразователя способны присоединять дополнительные молекулы в пятое и шестое координационное положение СоII [28]. Взаимодействием центрального катиона металла фталоцианинового макроцикла с различными гетероциклическими лигандами можно получить разные супрамолекулярные комплексы. Перспективными в этом направлении являются азотсодержащие шестичленные гетероциклы. С одной стороны, малый размер позволяет легко встраиваться в структуру агрегатов, образованных как face-to-face (H-агрегаты) или edge-to-face (J-агрегаты), а с другой – наличие гетероатома является благоприятным фактором при формировании экстракомплексов различного строения.
H- и J-ассоциаты являются основными типами агрегатов, характерных для красителей. Спектральное определение структур основано на наблюдении сдвига максимума поглощения относительно соответствующей полосы поглощения мономера [29]. Так, для H-типа характерно гипсохромное смещение, в то время как для J-типа – батохромное. В работах [19–21, 30, 31] нами установлено, что в водных средах комплексы CoPcI–CoPcVII находятся в ассоциированном состоянии, при этом в растворе образуются H-ассоциаты или смесь H- и J-ассоциатов. Кроме того, в водном растворе реализуется равновесие мономер–агрегат:
(6)
$n\left( {{\text{CoP}}{{{\text{c}}}_{{{\text{I}} - {\text{VII}}}}}} \right) \rightleftarrows {{\left( {{\text{CoP}}{{{\text{c}}}_{{{\text{I}} - {\text{VII}}}}}} \right)}_{n}}.$Установлено, что для макроцикла CoPcVIII при бифункциональном замещении объемными электронодонорными заместителями, повышающими электронную плотность в сопряженной системе макроцикла, в водно-щелочном растворе характерно смещение равновесия (6) в сторону мономерных форм.
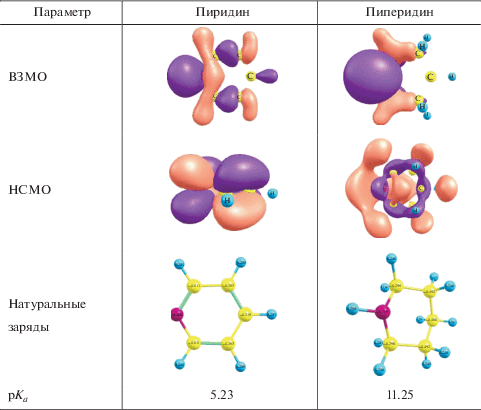
Ключевой особенностью при рассмотрении процессов координации металлофталоцианинами гетероциклических лигандов является анализ электронного строения последних. Из литературы [32] известно, что шестичленные циклы, в частности пиперидин, в растворе находятся преимущественно в конформации “кресло”. При этом неподеленная электронная пара атома N пиперидина в растворе имеет аксиальную ориентацию [33] (рис. 2). Экваториальное расположение неподеленной электронной пары приводит к увеличению объема молекулы по сравнению с аксиальным, поскольку связывающая два атома (N–Н) электронная пара занимает меньший объем, чем объем облака неподеленной электронной пары [34], что увеличивает вероятность встраивания в ассоциаты фталоцианинов.
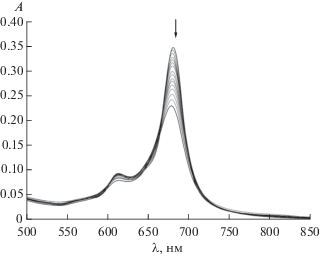
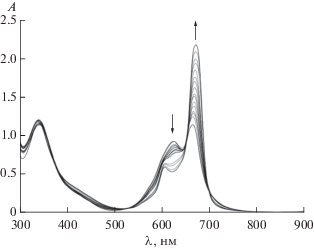
На рис. 3 представлены электронные спектры поглощения водного раствора СоРсI при спектрофотометрическом титровании пиперидином. Исходный спектр в видимой области имеет два интенсивных максимума при 625 и 665 нм, соответствующих π–π*-переходам (а1u (π) ВЗМО–eg (π*) НСМО) π-электронной системы макроцикла. Металлокомплекс в воде имеет выраженную тенденцию к агрегации. Однако добавление пиперидина и дальнейшее увеличение концентрации лиганда в растворе до 3.89 моль/л приводят к существенным изменениям. В спектрах наблюдается увеличение интенсивности полосы при 665 нм и ее батохромный сдвиг на 7 нм, при этом полоса при 625 нм, напротив, претерпевает уменьшение интенсивности и гипсохромный сдвиг на 19 нм. Протекающие изменения связаны с процессами перехода агрегированных форм СоРсI в воде в мономерные. Аксиальное расположение неподеленной электронной пары в молекуле пиперидина (рис. 2) позволяет достаточно легко входить малому N-лиганду в полость агрегированной структуры, приводя к диссоциации димерных структур. Наличие изобестических точек в ЭСП подтверждает протекание равновесных процессов в растворе. Для оценки количества присоединившихся лигандов был применен полулогарифмический метод Бэнта–Фрэнча (по величине тангенса угла наклона графических зависимостей lg[(A0 – Ap)/(Ap – Aк)] от lg СL). Значение тангенса угла наклона прямой, построенной по данному уравнению для CoPcI, дает состав аксиального комплекса CoPcI : Pip = 1 : 1. Расчет Kу полученных комплексов проведен из данных ЭСП на аналитических длинах волн. Для данной системы lg Kу = 3.74.
Рис. 3.
Изменения в ЭСП при титровании водного раствора CoPcI (C = 4.2 × 10–5 моль/л) пиперидином (СPip конеч = = 3.9 моль/л) при 298.15 K.
При замене пиперидина на пиридин в ЭСП для СоРсI наблюдаются аналогичные изменения. Состав комплексов в системе CoPcI : Py = 1 : 1, а lg Ку = 3.68. Следует отметить, что для всех металлокомплексов, кроме CoPcIV и CoPcV, наблюдается увеличение устойчивости при переходе от пиридина к пиперидину, вероятно, за счет высокой электронной плотности на донорном атоме азота данного лиганда. Это подтверждается квантово-химическими расчетами, проведенными с помощью программного пакета GAUSSIAN 09 методом PM6 [35]. В рамках NBO-анализа (HF/6-21G) были получены данные по распределению электронной плотности для исследуемых соединений (табл. 1). При помощи программного пакета ChemCraft проведена визуализация оптимизированных структур. Отсутствие мнимых частот подтверждает тот факт, что геометрия всех представленных макроциклов соответствует минимуму на поверхности потенциальной энергии. В табл. 1 представлены натуральные орбитали и заряды в лигандах пиридин и пиперидин.
В работах [19, 21] нами показано, что устойчивость комплексов состава CoPc : L = 1 : 1 при титровании пиридином возрастает в ряду CoPcII < < CoPcIII < CoPcIV. Замена триазольного фрагмента в CoPcV на NO2-группу (CoPcVI) приводит к существенным изменениям спектральной картины. Для водно-щелочного раствора CoPcV при добавлении пиридина (рис. 4) на первом этапе наблюдаются увеличение максимума поглощения и его батохромный сдвиг, что приводит к трансформации H-агрегатов и формированию комплексов CoPcV : Py состава 1 : 2 (табл. 2). Спектральные изменения для водно-щелочного раствора CoPcVI также характеризуются двумя этапами (рис. 5). Однако увеличение концентрации пиридина в системе приводит к гипсохромному смещению максимума поглощения, что, вероятно, вызвано разрушением агрегатов J-типа, образованных за счет координации между кислородом в нафтоксигруппе одной молекулы фталоцианинового макроцикла с CoII другой молекулы. В результате такого взаимодействия происходит компенсация частичного положительного заряда на центральном катионе металла, при этом рассчитанный состав комплексов составляет CoPcVI : Py = = 1 : 1.5, что в пересчете на целую молекулу лиганда составляет CoPcVI : Py = 2 : 3 с lg Ку = 3.78. Дальнейшее увеличение концентрации пиридина в растворе также приводит к гипсохромному сдвигу максимума поглощения на 3 нм. При этом в системе могут наблюдаться равновесия:
(7)
${{\left( {{\text{CoPc}}} \right)}_{2}} + {\text{Py}} \rightleftarrows {\text{CoPc}} \cdot {\text{Py}} + {\text{CoPc,}}$(8)
${{\left( {{\text{CoPc}}} \right)}_{2}} + 2{\text{Py}} \rightleftarrows 2{\text{CoPc}} \cdot {\text{Py}}{\text{.}}$Рис. 4.
Изменения в ЭСП при титровании водно-щелочного раствора CoPсV (C = 5.1 × 10–5 моль/л) пиридином (СPyконеч = 6.5 моль/л) при 298.15 K.
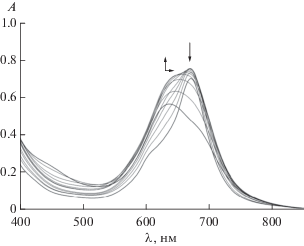
Таблица 2.
Константы устойчивости молекулярных комплексов для водных растворов при 298.15 K
| Макроцикл | Pip состав комплекса CoPc : L (lg Ky) |
Py состав комплекса CoPc : L (lg Ky) |
|---|---|---|
| CoPcI | 1 : 1 (3.74) | 1 : 1 (3.68) |
| CoPcII | 1 : 2 (3.74) | 1 : 1 (3.20) |
| CoPcIII | 1 : 2 (3.79) | 1 : 1 (3.40) |
| CoPcIV | 1 : 2 (3.69) | 1 : 1 (3.97) |
| CoPcV | 1 : 3 (3.66) | 1 : 2 (4.04) |
| CoPcVI | 2 : 3 (3.88) | 2 : 3 (3.78) |
| CoPcVII | 1 : 2 (3.77) | 1 : 1 (3.73) |
| CoPcVIII | 1 : 2 (3.84) | 2 : 3 (3.73) |
Рис. 5.
Изменения в ЭСП при титровании водно-щелочного раствора CoPсVI (C = 4.4 × 10–5 моль/л) пиридином при 298.15 K: CPy = 0–0.8 моль/л (а); СPy = 0.8–8.2 моль/л (б).
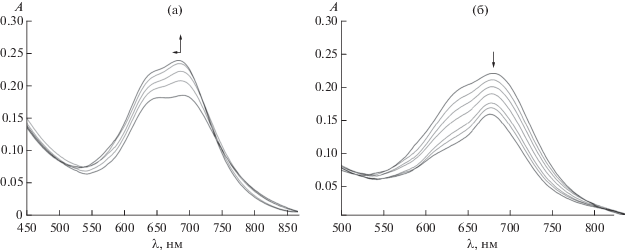
Замена ароматического гетероцикла на насыщенный, например пиперидин, не приводит к значительным изменениям в спектральной картине водно-щелочной среды, однако на первом этапе образуются более устойчивые (lg Kу = 3.88) комплексы состава CoPcVI : Pip = 2 : 3.
Поскольку пиперидин является более сильным основанием, чем пиридин, устойчивость образующихся комплексов с пиперидином должна быть выше. Однако установлено уменьшение константы устойчивости молекулярных комплексов с Pip в водных растворах для CoPcIV и CoPcV. Данный факт, вероятно, обусловлен наличием бензотриазольного фрагмента в составе макромолекул, что способствует перераспределению электронной плотности в макромолекуле.
Увеличение объема периферических заместителей путем введения в аннелированные бензольные кольца фталоцианинового макроцикла 1-метил-1-фенилэтил-феноксигрупп (при этом образуется симметрично замещенный октапроизводный макроцикл CoPcVIII) приводит к увеличению значимости геометрического фактора периферических заместителей, что способствует мономеризации макроцикла (рис. 6). При добавлении аксиальных лигандов образуются “сэндвичевые” ассоциаты различного строения, в которые включены малые органические основания (табл. 2).
ЗАКЛЮЧЕНИЕ
Установлено, что геометрия лиганда и электронные эффекты заместителей фталоцианиновых макроциклов играют важную роль при формировании комплексов различного состава. Переход от пиридина к пиперидину сопровождается увеличением констант устойчивости. Введение бензотриазольного фрагмента способствует обратному эффекту.
Список литературы
Gorbunov A.V., Garcia Iglesias M., Guilleme J. et al. // Sci. Adv. 2017. V. 3. № 9. https://doi.org/10.1126/sciadv.1701017
Shehzad F.K., Zhou Y., Zhang L. et al. // J. Phys. Chem. 2018. V. 1280. № 2. P. 1280. https://doi.org/10.1021/acs.jpcc.7b11244
Gontero D., Lessard-Viger M., Brouard D. et al. // Microchem. J. 2017. P. 316. https://doi.org/10.1016/j.microc.2016.10.007
Du X., Fan R., Wang X. et al. // Cryst. Growth Des. 2015. V. 316. № 5. P. 2402. https://doi.org/10.1021/acs.cgd.5b0019
Bartlett G.J., Newberry R.W., VanVeller B. et al. // J. Am. Chem. Soc. 2013. V. 135. № 49. P. 18682. https://doi.org/10.1021/ja4106122
Bottari G., Suanzes J.A., Trukhina O. et al. // J. Phys. Chem. Lett. 2011. V. 2. № 8. P. 905. https://doi.org/10.1021/jz200241k
Liu J., Postupalenko V., Lörcher S. et al. // Nano Lett. 2016. V. 16. № 11. P. 7128. https://doi.org/10.1021/acs.nanolett.6b03430
Cirera B., Trukhina O., Björk J. et al. // J. Am. Chem. Soc. 2017. V. 139. № 40. P. 14129. https://doi.org/10.1021/jacs.7b06406
Berezin D.B., Solodukhin T.N., Shukhto O.V. et al. // Russ. Chem. Bull. 2018. V. 67. № 7. P. 1273. https://doi.org/10.1007/s11172-018-2212-6
Vashurin A.S., Maizlish V.E., Kuzmin I.A. et al. // J. Porphyr. Phthalocyanines. 2017. V. 21. № 1. P. 37. https://doi.org/10.1142/S108842461750002X
Tikhomirova T., Nalimova K., Kerner A. et al. // J. Porphyrins Phthalocyanines. 2019. V. 23. P. 575. https://doi.org/10.1142/S1088424619500251
Stymne B., Sauvage F.X., Wettermark G. // Spectrochim. Acta, Part A. 1980. V. 36. № 4. P. 397. https://doi.org/10.1016/0584-8539(80)80152-8
Chandra B.K.C., D’Souza F. // Coord. Chem. Rev. 2016. V. 322. P. 104. https://doi.org/10.1016/j.ccr.2016.05.012
Zhang X.-F., Xi J., Zhao Q. // J. Mater. Chem. 2010. V. 20. № 32 P. 6726. https://doi.org/10.1039/C0JM00695E
Snow A. Porphyr. Handb. Phthalocyanines Prop. Mater. 17, 129 (200AD).
Цивадзе А.Ю. // Успехи химии. 2004. Т. 73. № 1. С. 6. https://doi.org/10.1070/RC2004v073n01ABEH000862
Ogunsipe A., Durmuş M., Atilla D. et al. // Synth. Met. 2008. V. 158. № 21–24. P. 839. https://doi.org/10.1016/j.synthmet.2008.06.007
Nyokong T. // Coord. Chem. Rev. 2007. V. 251. № 13. P. 1707. https://doi.org/10.1016/j.ccr.2006.11.011
Воронина А.А., Кузьмин И.А., Вашурин А.С. и др. // Журн. общ. химии. 2014. V. 84. № 9. С. 1540.
Voronina A.A., Filippova A.A., Znoyko S.A. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 11. P. 1537. [Воронина А.А., Филиппова А.А., Знойко С.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 11. С. 1537.] https://doi.org/10.7868/S0044457X15110239
Filippova A.A., Voronina A.A., Vashurin A.S. // Russ. J. Inorg. Chem. 2015. V. 62. № 6. P. 1537. [Филиппова А.А., Воронина А.А., Вашурин А.С. // Журн. неорган. химии. 2017. Т. 62. № 6. С. 794.] https://doi.org/10.7868/S0044457X1706006X
Weber J.H., Busch D.H. // Inorg. Chem. 1965. V. 4. P. 472. https://doi.org/10.1021/ic50026a007
Dumoulin F., Durmuş M., Nyokong T. et al. // Coord. Chem. Rev. 2010. V. 254. P. 2792. https://doi.org/10.1016/j.ccr.2010.05.002
Кулинич В.П., Шапошников Г.П., Бадаукайте Р.А. // Макрогетероциклы. 2010. Т. 3. № 1. С. 23. https://doi.org/10.6060/mhc2010.1.23
Vashurin A.S., Filippova A.A., Znoyko S.A. et al. // J. Porphyrins Phthalocyanines. 2015. V. 19. № 8. P. 983. https://doi.org/10.1142/S1088424615500753
Sakamoto K., Ohno-Okumura E. // Materials. 2009. V. 2. № 3. P. 1127. https://doi.org/10.3390/ma2031127
Weissberger A., Proskauer E.S., Riddick J.A. et al. Organic Solvent: Physical Properties and Methods of Purification. New York: Inter. Science Publishers Inc., 1955.
Шапошников Г.П., Кулинич В.П., Майзлиш В.Е. Модифицированные фталоцианины и их структурные аналоги. М.: КРАСАНД, 2012. С. 480.
Mamardashvili G.M., Chizhova N.V., Kaygorodova Ye.Yu. et al. // Russ. J. Inorg. Chem. 2018. V. 62. № 3. P. 296. [Мамардашвили Г.М., Чижова Н.В., Кайгородова Е.Ю. и др. // Журн. неорган. химии. 2018. Т. 62. № 3. С. 296.] https://doi.org/10.7868/S0044457X17030126
Filippova A., Vashurin A., Znoyko S. et al. // J. Mol. Struct. 2017. V. 1149. P. 17. https://doi.org/10.1016/j.molstruc.2017.07.086
Voronina A., Filippova A., Razumov M. et al. // Eur. Chem. Bull. 2015. V. 4. P. 335. https://doi.org/10.17628/ecb.2015.4.335-339
Джоуль Д., Смит Г. Основы химии гетероциклических соединений. М.: Мир, 1975.
Сергеев Н.М. Спектроскопия ЯМР. М.: Изд-во Моск. ун-та, 1981.
Гиллеспи Р. Геометрия молекул. М.: Мир, 1975.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09, Revision A.01. Gaussian, Inc. Wallingford CT, 2009.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии