Журнал неорганической химии, 2020, T. 65, № 2, стр. 218-223
Квазибинарный разрез Ag2SnS3–AgSbS2
Ш. Г. Мамедов a, *, А. Н. Мамедов a, b, Р. Д. Курбанова a
a Институт катализа и неорганической химии им. академика М.Ф. Нагиева НАН Азербайджана
Баку, AZ1143, пр-т Г. Джавида, 113, Азербайджан
b Азербайджанский технический университет
AZ1073 Баку, пр-т Г. Джавида, 25, Азербайджан
* E-mail: inorg.chem.mat@gmail.com
Поступила в редакцию 22.04.2019
После доработки 10.06.2019
Принята к публикации 27.08.2019
Аннотация
Впервые методами дифференциального термического, рентгенофазового и микроструктурного анализов, а также измерением микрoтвердости и плотности изучены фазовые равновесия в квазитройной системе Ag2S–SnS2–Sb2S3 по сечению Ag2SnS3–AgSbS2. Установлено, что система Ag2SnS3–AgSbS2 является квазибинарным разрезом эвтектического типа, построена ее диаграмма состояния. Координаты эвтектики равны 30 мол. % Ag2SnS3 и температуре 700 K. Определены узкие области твердых растворов на основе исходных компонентов. Границы твердых растворов при 300 K соответствуют 12 мол. % AgSbS2 (со стороны Ag2SnS3) и 5 мол. % Ag2SnS3 (со стороны AgSbS2). Область растворимости при эвтектической температуре простирается до 19 и 8 мол. % соответственно. Твердые растворы на основе тройного сульфида Ag2SnS3 кристаллизуются в моноклинной сингонии. С увеличением содержания AgSbS2 параметры моноклинной решетки увеличиваются от a = 6.270, b = 5.793, c = 13.719 Å (для чистого Ag2SnS3) до a = 6.278, b = 5.799, c = 13.726 Å (для сплава, содержащего 12 мол. % AgSbS2). Эти твердые растворы относятся к типу замещения. Границы твердых растворов уточнены с помощью температурно-концентрационной зависимости свободной энергии Гиббса в рамках модифицированного варианта модели регулярных растворов.
ВВЕДЕНИЕ
Халькостаннаты серебра широко используются как перспективные функциональные материалы, обладающие полупроводниковыми, термоэлектрическими и фотоэлектрическими свойствами [1–14].
Боковые системы, составляющие квазитройную систему Ag2S–SnS2–Sb2S3, подробно изучены в работах [15–28]. Авторы [15] установили существование в системе Ag–Sn–S трех соединений серебра: Ag8SnS6, Ag2SnS3 и Ag2Sn2S5.
Соединение Ag2SnS3 характеризуется конгруэнтным плавлением при 936 K и кристаллизуется в моноклинной сингонии с параметрами: а = 6.27, b = 5.793, с = 13.719 Å, β = 93.27°, пр. гр. Pna21 [15]. Соединение Ag2Sn2S5 образуется по перитектической реакции при 955 K [15]. При изучении квазибинарной системы Ag2S–SnS2 авторы [16, 17] установили, что в системе образуются соединения Ag4Sn3S8, Ag8SnS6 и Ag2SnS3.
Соединение AgSbS2, встречающееся в природе в виде минерала (миаргирит), получено в лабораторных условиях авторами [18, 19] при исследовании разреза Ag2S–Sb2S3. По данным [19], этот разрез квазибинарный и образует два конгруэнтно плавящихся соединения: Ag3SbS3 и AgSbS2; последнее кристаллизуется в моноклинной сингонии с параметрами а = 12.861, b = 4.409, с = 13.282 Å, β = = 98.21° [20].
Тройное соединение AgSbS2 (миаргирит) существует в двух формах: кубической высокотемпературной модификации (β) и моноклинной модификации (α), устойчивой при комнатной температуре. В работе [21] методами ДТА и порошковой рентгеновской дифракции детально изучено соединение AgSbS2, синтезированное из элементов. Данные о температуре плавления соединения согласуются c данными [21, 22] в пределах ±1 K, в то время как для перехода α → β приведены несколько различающиеся данные: 653 [21], 648 [22] и 643 K [23]. Трудно осуществляется обратный переход β → α [24, 21]. Структура α-модификации полностью не определена, параметры решетки AgSbS2 (a = 13.227, b = 4.411, c = 12.880 Å, β = 98.48° [21]) аналогичны полученным в результате рентгеновского исследования природных [25] и синтетических [26] образцов. Для β-AgSbS2 структура определена как тип NaCl [21, 23, 27]. Значения параметра кубической решетки β-AgSbS2, определенные в этих работах, мало отличаются от усредненной величины a = 5.651 Å.
Система SnS2–Sb2S3 изучена в работе [28], авторы которой установили, что разрез является квазибинарным сечением тройной системы Sn–Sb–S. В системе обнаружено соединение SnSb2S5, плавящееся инконгруэнтно при 735 K.
В связи с практической ценностью материалов на основе халькогенидов серебра возникает необходимость более глубокого изучения их взаимодействия.
В настоящей работе представлены результаты исследования разреза Ag2SnS3–AgSbS2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования системы Ag2SnS3–AgSbS2 синтезировали 14 сплавов. При синтезе использовали элементы (серебро марки “ос. ч.” 16, олово квалификации В4, сурьму Су4 и серу В-5) по меньшей мере 99.99 мас. % чистоты и предварительно синтезированные соединения Ag2SnS3 и AgSbS2. Расчет рентгенограммы AgSbS2 показал, что нами получена кубическая модификация с параметром решетки а = 5.6523 Å (табл. 1).
Таблица 1.
Состав, результаты ДТА, плотность и микроструктура сплавов разреза Ag2SnS3–AgSbS2
| Состав, мол. % | Термический эффект, K | Плотность, г/см3 | Фазовой состав | ||
|---|---|---|---|---|---|
| Ag2SnS3 | AgSbS2 | солидуса | ликвидуса | ||
| 100 | 0.00 | – | 935 | 4.60 | Однофазный |
| 95 | 5.0 | 765 | 930 | 4.63 | α |
| 90 | 10 | 865 | 920 | 4.66 | α |
| 80 | 20 | 700 | 895 | 4.71 | a + β |
| 70 | 30 | 700 | 865 | 4.77 | a + β |
| 60 | 40 | 700 | 835 | 4.83 | a + β |
| 50 | 50 | 700 | 805 | 4.89 | a + β |
| 40 | 60 | 700 | 765 | 4.95 | a + β |
| 30 | 70 | 700 | 700 | 5.01 | a + β |
| 20 | 80 | 700 | 735 | 5.08 | a + β |
| 15 | 85 | 700 | 750 | 5.12 | a + β |
| 10 | 90 | 725 | 770 | 5.16 | a + β |
| 5 | 95 | 755 | 775 | 5.21 | β |
| 0.00 | 100 | – | 785 | 5.25 | Однофазный |
Сплавы системы Ag2SnS3–AgSbS2 синтезировали из лигатур ампульным методом в вертикальной печи. Максимальная температура синтеза сплавов составляла 1140 K. Синтез продолжался 4 ч с применением механического перемешивания, затем проводили медленное охлаждение. Отжиг сплавов системы Ag2SnS3–AgSbS2 проводили в вакуумированных и запаянных кварцевых ампулах при 500–700 K в течение 300 ч. Отожженные образцы закаляли в холодной воде. Взаимодействие в системе Ag2SnS3–AgSbS2 изучали методами дифференциального термического (ДТА), рентгенофазового (РФА) и микроструктурного (МСА) анализов, а также измерением микротвердости и определением плотности. РФА проводили на рентгеновском приборе модели Д2 PHASER (CuKα-излучение, Ni-фильтр). ДТА выполняли на пирометре НТР-73 в температурном интервале 298–1000 K. Скорость нагрева составляла 15 град/мин. В качестве стандарта использовали окись алюминия. Дифрактограммы снимали на установке D2 Phaser (CuKα-излучение, Ni-фильтр). МСА проводили на микроскопе МИМ-7, а микротвердость образцов измеряли на микротвердомере ПМТ-3 при нагрузках, выбранных в результате измерения микротвердости каждой фазы. Плотность определяли пикнометрическим методом.
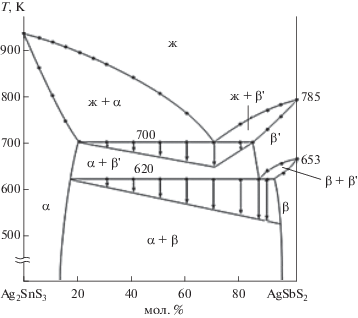
Фазовая диаграмма системы Ag2SnS3–AgSbS2 (рис. 1) построена на основании результатов физико-химического анализа (ДТА, МСА, РФА, измерение микротвердости и плотности) с привлечением термодинамических расчетов.
Синтезированные и отожженные сплавы подвергали ДТА. По данным ДТА, на термограммах сплавов, содержащих 12–95 мол. % AgSbS2, имеется по три тепловых эффекта. Все тепловые эффекты обратимые, эндотермические. Установлено, что взаимодействие между соединениями Ag2SnS3 и AgSbS2 имеет несложный характер, его диаграмма состояния относится к эвтектическому типу. Результаты термического анализа сплавов системы Ag2SnS3–AgSbS2 свидетельствуют о наличии тепловых эффектов при 653 и 700 K (табл. 1).
Исследование микроструктуры показало, что отожженные сплавы разреза Ag2SnS3–AgSbS2 двухфазные, за исключением сплавов вблизи исходных компонентов: 0–12 и 95–100 мол. % AgSbS2. Вышеуказанные сплавы имеют структуру твердых растворов.
Результаты РФА сплавов исследуемой системы согласуются с данными ДТА и подтверждают существование твердых растворов на основе Ag2SnS3 и AgSbS2. Сравнение дифрактограмм сплавов состава 0–12 мол. % AgSbS2 показало, что они идентичны дифрактограмме Ag2SnS3 (рис. 2). Следовательно, сплавы являются твердыми растворами на основе Ag2SnS3. Дифрактограммы сплавов состава 95–100 мол. % AgSbS2 идентичны дифрактограмме AgSbS2, т.е. сплавы являются твердыми растворами на основе AgSbS2. На диаграмме Ag2SnS3–AgSbS2 наблюдаются две изотермические линии (653, 700 K). Изотермическая линия при 653 K соответствует полиморфному превращению соединения AgSbS2. Для определения границ твердых растворов были синтезированы сплавы 90, 91, 93, 95, 98 мол. % исходных компонентов (Ag2SnS и AgSbS2), которые отжигали в течение 350 ч при 650 и 450 K, затем закаляли. После тщательного изучения микроструктуры этих сплавов находили границы растворимости. Структурные и оптические свойства определяли для монокристаллических образцов сплавов. Монокристаллы были выращены методами направленной кристаллизации и химических транспортных реакций. Для выращивания монокристаллов (Ag2SnS3)1 – x(AgSbS2)х предварительно синтезировали поликристаллические сплавы в количестве 7–10 г, которые потом измельчали, переносили в ампулу с зауженным дном, вакуумировали и помещали в двухзонную печь с заранее установленным градиентом температур. Печь перемещалась со скоростью 3 мм/ч, тогда как ампула оставалась неподвижной. В ходе неоднократных опытов уточняли температуры зон печи и скорость ее движения (табл. 2). В результате получены совершенные монокристаллы стехиометрического состава, пригодные для структурных и оптических измерений.
Рис. 2.
Дифрактограммы сплавов системы Ag2SnS3–AgSbS2: 1 – AgSbS2, 2 – 95, 3 – 20, 4 – 12 мол. % AgSbS2, 5 – Ag2SnS3.
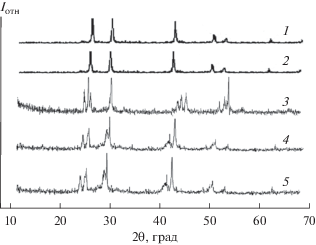
Таблица 2.
Оптимальный режим выращивания монокристаллов твердых растворов (Ag2SnS3)1– x(AgSbS2)x, 800–900 K
| Состав | Скорость перемещения печи, мм/ч | Масса монокристаллов, г | Размер монокристаллов, мм |
|---|---|---|---|
| (Ag2SnS3)0.998(AgSbS2)0.002 | 3.0 | 7.2 | 7 × 18 |
| (Ag2SnS3)0.996(AgSbS2)0.004 | 3.0 | 7.3 | 7 × 18 |
| (Ag2SnS3)0.994(AgSbS2)0.006 | 3.5 | 7.3 | 7 × 20 |
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
Границы твердых растворов α (Ag2SnS3) и β (AgSbS2) в квазибинарных разрезах Ag2SnS3–AgSbS2 уточняли с помощью температурно-концентрационной зависимости свободной энергии Гиббса. Соединения Ag2SnS3 и AgSbS2 существенно отличаются по составу и кристаллографическим данным [16, 21]. Поэтому для термодинамических расчетов использовали модифицированный вариант модели регулярных растворов, учитывающий зависимость параметра смешения от состава и температуры по уравнению, которое успешно апробировано в [29–32]:
(1)
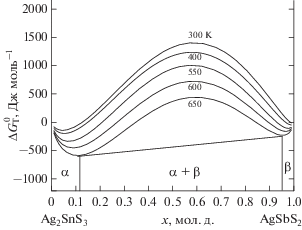
$\begin{gathered} \Delta G_{T}^{0} = [a + b{{(1 - x)}^{2}}](1 - x)x + \\ + \,\,RT[x\ln (x) + (1 - x)\ln (1 - x)]. \\ \end{gathered} $Здесь первое слагаемое представляет энтальпию смешения твердых растворов в рамках асимметричного варианта модели регулярных растворов, второе слагаемое – конфигурационную энтропию смешения твердых растворов в рамках модели немолекулярных соединений. Постоянные а и b в уравнении (1) определены по экспериментальным данным ДТА для температур 700 и 620 K. Результаты расчета по уравнению (1) применительно к системе Ag2SnS3–AgSbS2 приведены на рис. 3 (кривые границ твердых растворов α и β). Расчеты выполнены и визуализированы с помощью программы OriginLab2018.
Рис. 3.
Зависимости свободной энергии смешения Гиббса (Дж моль–1) сплавов (Ag2SnS3)1– x (AgSbS2)x от состава при температурах 300 (1), 400 (2), 550 (3), 600 (4) и 620 K (5): 1) [14 000 – 7000(1 – x)2](1 – x)x + + 8.314 × 300[x ln(x) + (1 – x)ln(1 – x)], 2) [15 500 – ‒ 6000(1 – x)2](1 – x)x + 8.314 × 400[x ln(x) + (1 – x)ln(1 – x)], 3) [18 000 – 6000(1 – x)2](1 – x)x + 8.314 × × 550[x ln(x) + + (1 – x)ln(1 – x)], 4) [18 000 – 6000(1 – x)2](1 – x)x + + 8.314 × 600[xln(x) + (1 – x)ln(1 – x)], 5) [18 000 – 6000(1 – x)2](1 – x)x + 8.314 × 620[x ln(x) + + (1 – x)ln(1 – x)].
Для выбора состава твердых растворов и определения условий выращивания монокристаллов использовали уравнение [32], связывающее координаты фазовой диаграммы и кинетические параметры кристаллизации:
(2)
$\chi = {{x_{i}^{s}} \mathord{\left/ {\vphantom {{x_{i}^{s}} {x_{i}^{l}}}} \right. \kern-0em} {x_{i}^{l}}} = {{k_{i}^{s}} \mathord{\left/ {\vphantom {{k_{i}^{s}} {k_{i}^{l}}}} \right. \kern-0em} {k_{i}^{l}}},$ЗАКЛЮЧЕНИЕ
Система Ag2SnS3–AgSbS2 эвтектическая, являющаяся квазибинарным разрезом квазитройной системы Ag2S–SnS2–Sb2S3. Координаты эвтектики равны 30 мол. % Ag2SnS3 и температуре 700 K. Выявлены узкие области гомогенности на основе исходных компонентов. Границы твердых растворов при 300 K соответствуют 12 мол. % AgSbS2 (со стороны Ag2SnS3) и 5 мол. % Ag2SnS3(со стороны AgSbS2). Для определения границ твердых растворов на основе Ag8SnS6 и Ag3SbS3, различающихся по составу и кристаллографическим данным, успешно апробирован асимметричный вариант модели регулярных растворов. Для выбора состава твердых растворов и определения условий выращивания монокристаллов использовано уравнение, связывающее координаты фазовой диаграммы и кинетические параметры кристаллизации.
Список литературы
Avellaneda D., Nair M.T., Nair P.K. // J. Thermochem. Soc. 2010. V. 158. № 6. P. 346.
Fiechter S., Martinez M., Schmidt G. et al. // J. Phys. Chem. Solid. 2003. V. 64. P. 1859. https://doi.org/10.1016/S0022-3697(03)00172-0
Gurieva G., Levchenko G., Levchenko S. et al. // Thin Solid Films. 2013. V. 535. № 2. P. 384. https://doi.org/10.1016/j.tsf.2012.11.104
Kim K.M., Tampo H., Shibata H. et al. // Thin Solid Films. 2013. V. 536. № 1. P. 111. https://doi.org/10.1016/j.tsf.2013.03.119
Delgado G.E., Mora A.Y., Marcano G. et al. // Mater. Res. Bull. 2003. V. 38. P. 1949. https://doi.org/10.1016/j.materresbull.2003.09.017
Parasyuk O.V., Gulay L.D., Piskach L.V. et al. // J. Alloys Compd. 2002. V. 339. P. 140. https://doi.org/10.1016/S0925-8388(01)01985-5
Parasyuk O.V., Chykhrij S.I., Bozhko V.V. et al. // J. Alloys Compd. 2005. V. 399. P. 32. https://doi.org/10.1016/j.jallcom.2005.03.008
Parasyuk O.V., Fedorchuk A.O., Kogut Yu.M. et al. // J. Alloys Compd. 2010. V. 500. P. 26. https://doi.org/10.1016/j.jallcom.2010.03.198
Parasyuk O.V., Olekseyuk I.D., Piskach L.V. et al. // J. Alloys Compd. 2005. V. 399. P. 173. https://doi.org/10.1016/j.jallcom.2005.03.023
Zmiy O.F., Gulay L.D., Ostapyuk T.A. et al. // Chem. Matuls Alloys. 2008. № 1. P. 115.
Babanly M.B., Yusibov Y.A., Abishev V.T. Ternary chalcogenides based on copper and silver. Baku, 1993. 342 p.
Belandria E., Fernandez B.J. // Jpn. Appl. Phys. 2000.V. 39. P. 293.
Aliev O.M., Asadov M.M., Azhdarova D.S. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 6. P. 833. https://doi.org/10.1134/S0036023618060037
Gurbanov G.R., Adygezalova M.B. // Russ. J. Inorg. Chem. 2018. V. 63. № 1. P. 111. https://doi.org/10.1134/S0036023618010096
Kokhan O.P. The Interactions in Ag2X–BIVX2 (BIV – Si, Ge, Sn; X – S, Se) Systems and the Properties of Compounds. Ph. D. thesis. Uzhgorod: Uzhgorod State Univ, 1996.
Wang N., Fan A.K. // Neues Jahrb. Mineral. Abh. 1989. V. 160. P. 33.
Kitazawa H., Kitakeze A., Sugaki A. // Collected abstract mineral. Soc. Japan. 19. 1985.
Ковалева И.С., Попова Л.Д., Гендлер Ф.М. и др. // Изв. АН СССР. Неорган. материалы. 1970. Т. 6. С. 1345.
Keighin C.W., Noneva R.M. // Mineralium Deposita. 1969. V. 4. P. 153.
Miargyrite AgSbS2 // Mineral Data Publishing. Version1. 2001–2005. handbookofmineralogy.org/pdfs/miargyrite.pdf
Bohac P., Orliukas A., Gäumann A. // Helv. Phys. Acta. 1977. V. 50. P. 853.
Koh J., Itagaki K. // Transactions of the Japan Institute of Metals. 1984. V. 25. № 5. P. 367.
Висков В.С., Ковалева И.С., Токбаева К. и др. // Изв. АН СССР. Неорган. материалы. 1975. Т. 11. № 10. С. 1879.
Hall H.T. The systems Ag–Sb–S, Ag–As–S, and Ag–Bi–S: Phase relations and mineralogical significance. Ph. D. thesis. Brown University, 1966. 172 p.
Knowles C.R. // Acta Crystallogr. 1964. V. 17. P. 847.
Ненашева С.Н., Пеньков И.Н., Сафин И.А. // Докл. АН СССР. 1968. Т. 183. С. 90.
Geller S., Wernick J.H. // Acta Crystallogr. 1959. V. 12. P. 46.
Рустамов П.Г., Курбанова Р.Д., Мовсумзаде А.А. // Докл. АН АзССР. 1987. № 1. С. 27.
Mamedov A.N., Tagiev E.R., Aliev Z.S. et al. // Inorg. Mater. 2016. V. 52. № 6. P. 543. https://doi.org/10.1134/S002016851606008X
Asadov S.M., Mamedov A.N., Kulieva S.A. // Inorg. Mater. 2016. V. 52. № 9. P. 876. https://doi.org/10.1134/S0020168516090016
Mamedov A.N., Akhmedova N.Ya., Asadov C.M. et al. // Chemical Problems 2019. V. 17. № 1. P. 16. https://doi.org/10.32737/2221-8688-2019-1-16-25
Gurbanov G.R., Mamedov S.G., Adygezalova M.B. et al. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1659. https://doi.org/10.1134/S0036023617120099
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии