Журнал неорганической химии, 2020, T. 65, № 12, стр. 1691-1696
Температурная трансформация фазовых диаграмм систем вода–оксиэтилированный нонилфенол–MgCl2
А. В. Станкова a, b, А. М. Елохов a, c, *, О. С. Кудряшова c, d, А. Е. Леснов b, d
a Пермский государственный национальный исследовательский университет
614990 Пермь, ул. Букирева, 15, Россия
b Институт технической химии УрO РАН
614013 Пермь, ул. Королева, 3, Россия
c Естественнонаучный институт Пермского государственного национального исследовательского университета
614990 Пермь, ул. Генкеля, 4, Россия
d Пермский государственный аграрно-технологический университет им. Д.Н. Прянишникова
614990 Пермь, ул. Петропавловская, 23, Россия
* E-mail: elhalex@yandex.ru
Поступила в редакцию 10.06.2020
После доработки 14.07.2020
Принята к публикации 27.07.2020
Аннотация
Экспериментально доказана схема топологической трансформации фазовых диаграмм систем вода–оксиэтилированный нонилфенол–MgCl2 с изменением температуры. Установлено, что область расслаивания возникает в гомогенной области, ограничена замкнутой бинодальной кривой и расширяется с ростом температуры. Область монотектического равновесия появляется при касании бинодальной кривой линии растворимости соли. Показано, что увеличение степени оксиэтилирования неонолов приводит к увеличению температуры образования области расслаивания и монотектического равновесия, что является следствием увеличения гидратации мицелл ПАВ. На основании установленных закономерностей и изученных фазовых диаграмм систем можно осуществлять целенаправленный подбор компонентов и оптимизацию параметров процессов экстракции с участием оксиэтилированных ПАВ.
ВВЕДЕНИЕ
Наиболее сложной задачей при разработке экстракционных систем на основе поверхностно-активных веществ (ПАВ) и водорастворимых полимеров является выбор высаливателя и оптимизация температурно-концентрационных параметров процесса экстракции.
Выбор высаливателя зависит от свойств используемого ПАВ и температуры, при которой осуществляется экстракция. Для высаливания оксиэтилированных ПАВ и полиэтиленгликолей из водных растворов используют соли многозарядных анионов и катионов металлов 1-й группы или аммония [1–3], а также галогениды и нитраты металлов 1-й группы [4, 5]. В качестве высаливателя катионных ПАВ применяют соли, содержащие анионы с низкой энергией гидратации – нитраты, иодиды, бромиды и тиоцианаты металлов 1 группы и аммония [6–9]. Экстракция анионными ПАВ осуществляется в присутствии галогенидов металлов 1-й группы [10, 11].
Оптимизацию температурно-концентрационных параметров процесса экстракции осуществляют на основе равновесной фазовой диаграммы с учетом особенностей ее трансформации с изменением температуры. Закономерности топологической трансформации фазовых диаграмм с изменением параметров состояния получают c использованием метода, предложенного В.М. Валяш-ко [12–14] и развиваемого Саратовской научной школой физико-химического анализа [15–17].
Ранее разработана обобщенная схема топологической трансформации фазовых диаграмм систем вода–оксиэтилированное ПАВ–неорганическая соль с изменением температуры [18] и экспериментально доказано существование ее фрагментов для случаев всаливающего-высаливающего [19], только высаливающего [20] или только всаливающего [21] действия соли. Настоящая работа посвящена исследованию фазовых равновесий и установлению особенностей топологической трансформации фазовых областей с изменением температуры в системах вода–оксиэтилированный нонилфенол–MgCl2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали оксиэтилированные нонилфенолы C9H19C6H4(OCH2CH2)nOH (n = 12 для неонола АФ-9-12, n = 25 для неонола АФ-9-25, ТУ 2483-077-05766801-98), гексагидрат хлорида магния квалификации “ч. д. а.”, дистиллированную воду ($n_{D}^{{{\text{25}}}}$ = 1.3325).
Границы области расслаивания определяли визуально-политермическим методом. Запаянные ампулы, содержащие смеси исходных компонентов известного состава, помещали в термостат и нагревали при периодическом перемешивании со скоростью 0.2 град/мин, вблизи температуры помутнения скорость нагрева снижали. Температуру помутнения определяли, отмечая появление устойчивой опалесценции. Итоговое значение температуры помутнения устанавливали, усредняя результаты 2–3 измерений. По результатам исследований строили зависимости температуры помутнения от содержания одного компонента или смеси двух компонентов в определенном соотношении. На основании политерм методом графической интерполяции строили изотермические разрезы температурной призмы трехкомпонентной системы.
Изотермы растворимости при температурах ниже 75°С изучены методом сечений. В качестве физического свойства измеряли показатель преломления жидкой фазы на рефрактометре ИРФ-454Б. Критерием установления равновесия служило равенство показателя преломления во времени. На основании полученных данных строили зависимости показателя преломления от концентрации одного из компонентов и по изломам на графике определяли составы, отвечающие фазовым переходам при заданной температуре.
Растворимость обоими методами определена с погрешностью ±0.5 мас. %, погрешность определения температуры помутнения ±1.0°С. Методика эксперимента подробно описана в работе [21].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Хлорид магния в исследуемом интервале температур (20–90°С) кристаллизуется в виде гексагидрата и имеет положительный температурный коэффициент растворимости. Экспериментально доказано, что новые соединения в твердой фазе не образуются. Система вода–неонол АФ-9-12 характеризуется нижней критической точкой растворимости (НКТР) – 84°С (3.0 мас. % неонола АФ-9-12). Область расслаивания существует в узком температурном интервале – от 84°С до температуры кипения. Двойная система вода–неонол АФ-9-25 гомогенна во всем интервале жидкого состояния.
Фазовые равновесия в системе вода–неонол АФ-9-12–MgCl2
В интервале температур 20–63°С фазовая диаграмма характеризуется двумя областями: ненасыщенных растворов (L) и кристаллизации гексагидрата хлорида магния (L + MgCl2 ∙ 6H2O). Положение линии насыщенных растворов установлено изотермическим методом сечений с помощью четырех сечений, исходящих из точки, отвечающей гексагидрату хлорида магния, в точки с соотношением вода : неонол АФ-9-12 (мас. %) = = 5.0 : 95.0; 15.0 : 85.0; 25.0 : 75.0 и 35.0 : 65.0. Установлено, что с ростом температуры область ненасыщенных растворов увеличивается (рис. 1а).
Рис. 1.
Диаграмма растворимости системы вода–неонол АФ-9-12–MgCl2 при 20 и 60 (а), 63 (б), 75 (в), 80 (г), 84 (д) и 85°С (e).
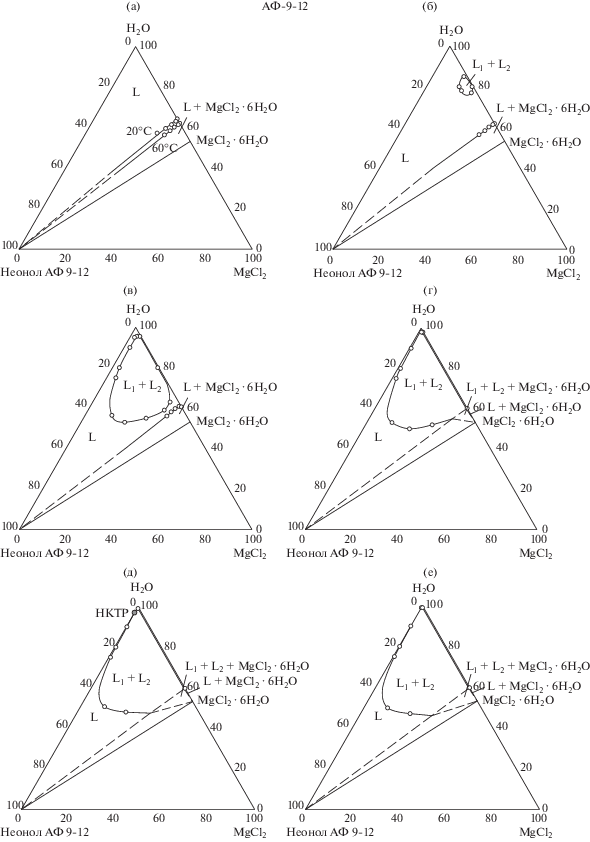
При температуре 63°С в гомогенной области возникает область расслаивания (L1 + L2), ограниченная замкнутой бинодальной кривой (рис. 1б). Дальнейший рост температуры приводит к расширению области расслаивания (рис. 1в).
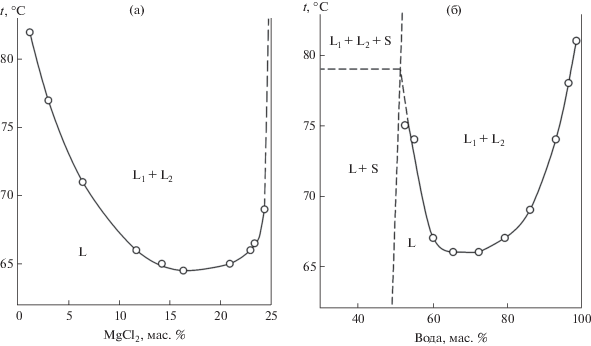
Положение бинодальной кривой области расслаивания определяли визуально-политермическим методом с помощью восьми сечений. Изучены три изогидрических сечения, содержащих 90.0, 80.0 и 75.0 мас. % воды. Политермы этих сечений имеют одну линию, отвечающую фазовому переходу L ↔ L1 + L2, которая начинается в точке, отвечающей температуре расслоения раствора ПАВ, проходит через минимум и асимптотически приближается к линии, отвечающей раствору хлорида магния (рис. 2а). Наличие минимума объясняется переходом от высаливающего действия, обусловленного в первую очередь влиянием хлорид-ионов, к всаливающему, обусловленному доминирующим влиянием катиона магния. Одно сечение исходило из вершины неонола АФ-9-12 в точку с соотношением MgCl2 : вода = 17.0 : 83.0. Вид политермы указанного сечения подобен политермам изогидрических сечений. Четыре сечения исходили из вершины воды в точки с соотношением MgCl2 : неонол АФ-9-12 = 90.0 :10.0; 80.0 : 20.0; 60.0 : 40.0 и 40.0 : 60.0. Политермы указанных сечений подобны (рис. 2б) и состоят из четырех ветвей, разделяющих области ненасыщенных растворов (L), расслаивания (L1 + L2), монотектического равновесия (L1 + L2 + S) и кристаллизации гексагидрата хлорида магния (L + S). Положение ветвей, отвечающих фазовым переходам с участием твердых фаз, установить не удалось в связи с высокой вязкостью смесей и медленным установлением равновесия.
Рис. 2.
Политерма изогидрического сечения 75 мас. % воды (а) и политерма сечения вода–40 мас. % MgCl2 + 60 мас. % неонол АФ-9-12 (б).
При некоторой температуре, точное значение которой установить не удалось в связи с трудностью фиксирования фазовых переходов с участием гексагидрата хлорида магния, происходит соприкосновение критической точки бинодальной кривой и линии растворимости гексагидрата хлорида магния, вследствие чего возникает область монотектического равновесия (L1 + L2 + S, рис. 1г). Дальнейший рост температуры сопровождается увеличением области расслаивания и монотектического равновесия.
При температуре 84°С бинодальная кривая касается своей критической точкой стороны вода–неонол АФ-9-12 в точке, отвечающей критическому составу двойной подсистемы вода–неонол АФ-9-12 (рис. 1д). Последующее увеличение температуры приводит к дальнейшему расширению области расслаивания, качественных изменений фазовой диаграммы при этом не наблюдается (рис. 1е).
Таким образом, схема топологической трансформации фазовой диаграммы вода–неонол АФ-9-12–MgCl2 соответствует обобщенной схеме топологической трансформации фазовых диаграмм систем вода–оксиэтилированное ПАВ–неорганическая соль для случая, когда двойная подсистема вода–ПАВ характеризуется НКТР, а соль обладает слабым высаливающим действием [18]. Указанная схема экспериментально подтверждена впервые.
Фазовые равновесия в системе вода–неонол АФ-9-25–MgCl2
Фазовые равновесия в системе вода–неонол АФ-9-25–MgCl2 изучены визуально-политермическим методом с помощью шести сечений: изогидрического, содержащего 80.0 мас. % воды, сечения, исходящего из вершины неонола АФ-9-25 в точку с соотношением MgCl2 : вода = 17.0 : 83.0, двух сечений, исходящих из вершины воды в точки с соотношением MgCl2 : неонол АФ-9-25 = = 90.0 : 10.0 и 80.0 : 20.0, и двух сечений, исходящих из точки, отвечающей гексагидрату хлорида магния, на сторону вода : неонол АФ-9-25 в точки с соотношением 35.0 : 65.0 и 50.0 : 50.0. Вид политерм всех сечений подобен описанным ранее для системы с неонолом АФ-9-12.
На основании полученных политерм установлено, что в интервале температур 25–75°С на фазовой диаграмме системы присутствуют две области: ненасыщенных растворов и кристаллизации гексагидрата хлорида магния. При дальнейшем увеличении температуры в гомогенной области возникает область расслаивания, ограниченная замкнутой бинодальной кривой, расширяющаяся с ростом температуры (рис. 3). Очевидно, при дальнейшем росте температуры возможно образование области монотектического равновесия аналогично системе вода–неонол АФ-9-12–MgCl2, однако экспериментально подтвердить это не удалось в связи с невозможностью проведения исследований при температурах выше 95°С.
Рис. 3.
Граница области расслаивания системы вода–неонол АФ-9-25–MgCl2 при 80.0 (1), 82.5 (2), 85.0 (3) и 90.0°С (4).
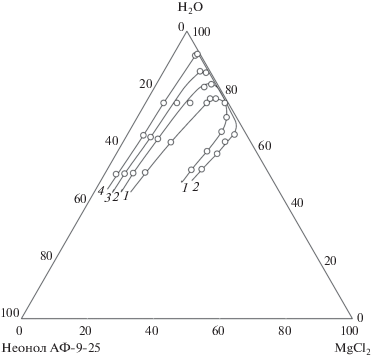
Таким образом, схема топологической трансформации фазовой диаграммы вода–неонол АФ-9-25–MgCl2 соответствует обобщенной схеме топологической трансформации фазовых диаграмм систем вода–оксиэтилированное ПАВ–неорганическая соль для случая, когда двойная подсистема вода–ПАВ является гомогенной во всем интервале жидкого состояния, а соль обладает слабым высаливающим действием [18].
Рассмотрим основные факторы, определяющие различия в фазовом поведении исследованных систем вода–оксиэтилированный нонилфенол–MgCl2.
Образование областей расслаивания с замкнутой бинодальной кривой связано с особенностями изменения высаливающей способности хлорида магния в зависимости от его концентрации. При низких концентрациях доминирует высаливающий эффект, обусловленный в первую очередь действием хлорид-ионов. С ростом концентрации хлорида магния высаливающее действие сменяется всаливающим, обусловленным доминирующим влиянием катиона магния и его возможным ион-дипольным взаимодействием с оксиэтиленовыми группами неонолов [22].
Влияние степени оксиэтилирования ПАВ обусловлено различной степенью гидратации мицелл ПАВ и различной скоростью их обезвоживания с ростом температуры. Температурная дегидратация мицелл ПАВ и последующая их агрегация зависят от степени гидрофильности молекул ПАВ, которую можно оценить по величине гидрофильно-липофильного баланса (ГЛБ) или НКТР системы ПАВ–вода. Вычисленные значения ГЛБ по Девису [23] и НКТР двойных систем неонол–вода представлены в табл. 1. Неонол АФ-9-25 во всем исследуемом интервале температур гидратирован в большей степени, чем неонол АФ-9-12, поэтому его способность к высаливанию значительно ниже, чем у неонола АФ-9-12. По этой причине образование области расслаивания в системе с неонолом АФ-9-25 происходит при более высокой температуре, чем с неонолом АФ-9-12.
ЗАКЛЮЧЕНИЕ
Полученные данные позволили экспериментально доказать возможность реализации двух схем обобщенной схемы топологической трансформации фазовых диаграмм систем вода–оксиэтилированный ПАВ–неорганическая соль для случаев, когда соль обладает слабым высаливающим действием, а двойная подсистема вода–ПАВ характеризуется НКТР (система вода–неонол АФ-9-12–MgCl2) или является гомогенной во всем интервале жидкого состояния (система вода–неонол АФ-9-25–MgCl2) [16].
Список литературы
Hamta A., Dehghani M.R. // J. Mol. Liq. 2017. V. 231. P. 20. https://doi.org/10.1016/j.molliq.2017.01.084
Javadi N., Dalali N. // J. Iran. Chem. Soc. 2011. V. 8. № 1. C. 231. https://doi.org/10.1007/BF03246220
Stankova A.V., Elokhov A.M., Lesnov A.E. // J. Sib. Fed. Univ. Chem. 2019. V. 12. № 3. P. 328. https://doi.org/10.17516/19982836-0130
Gürkan R., Altunay N., Yıldırım E. // Food Anal. Methods. 2016. V. 9. № 11. P. 3218. https://doi.org/10.1007/s12161-016-0505-7
Frizzarin R.M., Portugal L.A., Estela J.M. et al. // Talanta. 2016. V. 148. P. 694. https://doi.org/10.1016/j.talanta.2015.04.076
Akl Z.F. // J. Radioanal. Nucl. Chem. 2016. V. 308. № 2. P. 693. https://doi.org/10.1007/s10967-015-4432-7
Filik H., Giray D., Ceylan B. et al. // Talanta. 2011. V. 85. P. 1818. https://doi.org/10.1016/j.talanta.2011.07.052
Zarei A.R., Sovizi M.R. // J. Anal Chem. 2011. V. 66. № 3. P. 269. https://doi.org/10.1134/S1061934811030026
Lesnov A.E., Chukhlantseva E.Y., Kudryashova O.S. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 5. P. 835. https://doi.org/10.1134/S0036024419050194
Hryniewicka M., Starczewska B., Syperek I. // J. Mol. Liq. 2013. V. 187. P. 320. https://doi.org/10.1016/j.molliq.2013.08.012
Tagashira Sh., Ichimaru T., Nozaki K. et al. // Solvent Extr. Res. Dev., Jpn. 2013. V. 20. P. 39. https://doi.org/10.15261/serdj.20.39
Валяшко В.М. Фазовые равновесия и свойства гидротермальных систем. М.: Наука, 1990. 270 с.
Urusova M.A., Valyashko V.M. // Russ. J. Inorg. Chem. 2019. V. 64. № 3. P. 401. https://doi.org/10.1134/S0036023619030215
Urusova M.A., Valyashko V.M. // Russ. J. Inorg. Chem. 2018. V. 63. № 7. P. 983. https://doi.org/10.1134/S0036023618070239
Smotrov M.P., Cherkasov D.G., Il’in K.K. // Russ. J. Inorg. Chem. 2017. T. 62. № 3. C. 386. https://doi.org/10.1134/S0036023617030159
Il'In K.K., Cherkasov D.G. // Chem. Eng. Commun. 2016. V. 203. № 5. P. 642. https://doi.org/10.1080/00986445.2015.1076802
Cherkasov D.G., Chepurina Z.V., IlIn K.K. // Russ. J. Phys. Chem. 2015. V. 89. № 8. P. 1396. https://doi.org/10.1134/S0036024415080063
Elokhov A.M., Lesnov A.E., Kudryashova O.S. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1636. https://doi.org/10.1134/S0036023618120070
Elokhov A.M., Kudryashova O.S., Lesnov A.E. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 585. https://doi.org/10.1134/S0036023617050084
Elokhov A.M., Stankova A.V., Kudryashova O.S. et al. // Bull. Karaganda University. Chemistry. 2018. № 4 (92). P. 35.
Elokhov A.M., Kudryashova O.S., Lesnov A.E. // Russ. J. Phys. Chem. 2019. V. 93. № 9. P. 1822. https://doi.org/10.1134/S003602441909005X
Stankova A.V., Elokhov A.M., Kudryashova O.S. // Russ. J. Phys. Chem. 2018. V. 92. № 7. P. 1386. https://doi.org/10.1134/S0036024418070270
Davies J.T., Rideal R.K. Interfacial Phenomena. N.Y.: Academic Press, 1961. 461 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


