Журнал неорганической химии, 2020, T. 65, № 12, стр. 1676-1682
Фазовые равновесия в системах Ag2Se–Cu2SnSe3 и Ag8SnSe6–Cu2SnSe3
В. А. Рзагулиев a, А. Н. Мамедов a, b, О. Ш. Керимли a, Ш. Г. Мамедов a, *
a Институт катализа и неорганической химии им. академика М.Ф. Нагиева НАН Азербайджана
AZ1143 Баку, пр-т Г. Джавида, 113, Азербайджан
b Азербайджанский технический университет
AZ1073 Баку, пр-т Г. Джавида, 25, Азербайджан
* E-mail: azxim@mail.ru
Поступила в редакцию 26.05.2020
После доработки 13.06.2020
Принята к публикации 16.07.2020
Аннотация
Впервые методами дифференциального термического (с привлечением термодинамических расчетов), рентгенофазового и микроструктурного анализа, а также определением микротвердости и плотности изучено фазообразование в разрезах Ag2Se–Cu2SnSe3 и Ag8SnSe6–Cu2SnSe3 квазитройной системы Ag2Se–SnSe2–Cu2Sе. Существование новых четверных соединений не установлено. Выявлено, что оба разреза являются квазибинарными и относятся к простому эвтектическому типу с ограниченной растворимостью на основе исходных селенидов. Координаты эвтектических точек: 40 мол. % Ag2Se, T = 910 K и 50 мол. % Ag8SnSe6, T = 780 K. Растворимость на основе Cu2SnSe3 составляет 10 мол. % Ag2Se в системе Ag2Se–Cu2SnSe3 и 15 мол. % Ag8SnSe6 в системе Ag8SnSe6–Cu2SnSe3. Методом направленной кристаллизации Бриджмена–Стокбаргера выращены монокристаллы соединения Cu2SnSe3 и твердых растворов (Cu2SnSe3)1 –х(Ag8SnSe6)х (х = 0.02–0.15). Установлено, что эти растворы кристаллизуются в моноклинной сингонии и с увеличением содержания Ag8SnSe6 параметры элементарной ячейки увеличиваются (а = 6.968–6.985, b = 12.051–12.078, с = 6.945–6.968 Å, β = = 109.20°–109.30°, пр. гр. Сс , Z = 4, ρ = 5.75–5.86 г/см3).
ВВЕДЕНИЕ
Изучение взаимодействия между полупроводниковыми соединениями, в частности между халькогенидами серебра и меди, обладающей суперионной проводимостью, представляет большой научный и практический интерес. Согласно представлениям А.Ф. Иоффе [1], усложнение состава твердых растворов приводит к улучшению рядa физических свойств, например термоэлектрической эффективности. В связи c этим представляет интерес изучение характера фазового равновесия в системах Ag2Se–Cu2SnSe3 и Ag8SnSe6–Cu2SnSe3.
Селениды Ag2Se, Cu2SnSe3 и Ag8SnSe6 исследованы в работах [2–21]. Эти соединения конгруэнтно плавятся при 1170, 973 и 1017 K соответственно. По данным [5–7, 12, 16, 17], Ag2Sе и Ag8SnSe6 имеют по одному полиморфному превращению при 410 и 356 K соответственно. Литературные сведения о кристаллической структуре низкотемпературной модификации α-Ag2Se противоречивы [22, 23]. Согласно [24], низкотемпературная модификация Ag2Se имеет псевдокубическую структуру с параметром решетки а = 4.978 Å, а высокотемпературная модификация $~{\beta }$-Ag2Se кристаллизуется в орторомбической сингонии с параметрами решетки а = 7.067, b = 7.80, с = 4.34 Å [25, 26] или а = 4.333, b = 7.162, с = 7.764 Å [5, 12], пр. гр. Р212121.
Низкотемпературная модификация α-Ag8SnSe6 относится к кубической (а = 11.12 Å), а высокотемпературная модификация β-Ag8SnSe6 – к орторомбической сингонии (а = 7.9168, b = 7.8219, с = 11.045 Å, пр. гр. Рmn21, ρвыч = 7.072 г/см3 [15–19]. Это соединение изоструктурно Сu8GeS6 и β‑ Ag8GeSе6 [17]. Среднее межатомное расстояние Ag–Se в структуре Ag8SnSe6 составляет 2.59–2.82 Å.
Соединение Cu2SnSe3 имеет кубическую решетку, период которой изменяется (а = 5.688–5.696 Å) в пределах области гомогенности [15, 16, 27]. Согласно [28], это соединение имеет моноклинную структуру с параметрами решетки a = = 6.5936, b = 12.1593, с = 6.6084 Å, β = 108 056°, пр. гр. Сс.
Исходные соединения Ag2Se, Ag8SnSe6 и Cu2SnSe3 привлекают внимание исследователей как перспективные материалы для применения в нелинейных оптических приборах и фотоэлементах [29–34]. Учитывая перспективность исходных соединений, изучение взаимодействия между ними имеет как научное, так и практическое значение.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для решения поставленной задачи были приготовлены исходные соединения и серия сплавов. Материалами для синтеза Ag2Se, Ag8SnSe6 и Cu2SnSe3 служили селен мaрки “в. ч.”, электрическая медь марки “в. ч.” и серебро чистотой выше 99.999%. Соединения были получены сплавлением элементарных компонентов, которые взвешивали с точностью 0.0001 г. Сплавление проводили в запаянных и откачанных до 10–3 мм рт. ст. кварцевых ампулах. Подъем температуры производили медленно с часовыми выдержками при температурах плавления Ag2Se, Ag8SnSe6 и Cu2SnSe3 (1170, 1017 и 973 K соответственно). После окончания синтеза давали выдержку в течение 2–3 ч при 1060 K для Ag2Se, 920 K для Ag8SnSe6 и 900 K для Cu2SnSe3. Охлаждение проводили в режиме выключенной печи. Для изучения фазового равновесия в системах Ag2Se–Cu2SnSe3 и Ag8SnSe6–Cu2SnSe3 синтезировано по 11 сплавов различного состава через 5–10 мол. % из полученных исходных соединений сплавлением в запаянных и откачанных ампулах с выдержкой 40–45 мин при температуре на 50–60°С выше температуры плавления. Сплавы закаливали в воде, а затем проводили гомогенизирующий отжиг в течение 250–340 ч при 740 K в случае системы Ag8SnSe6–Cu2SnSe3 и 850 K в случае системы Ag2Se–Cu2SnSe3.
Сплавы исследовали методами дифференциального термического (ДТА) и рентгенофазового (РФА) анализа, металлографии. ДТА проводили на пирометре Курнакова с применением хромель-алюмелевой термопары. Записывали кривые нагревания и охлаждения для каждого образца. Скорость нагревания составляла 8–10 град/мин, охлаждение проводили в выключенной печи. Точки солидуса фиксировали по началу отклонения дифференциальной записи на кривой нагревания, точки ликвидуса – по началу отклонения дифференциальной записи на кривой охлаждения. По максимальному отклонению дифференциальной записи при нагревании контролировали температуру ликвидуса, найденную по кривым охлаждения, и соответственно по максимальному отклонению при охлаждении – температуру, полученную по кривой нагревания. Навеска образца составляла 2–3 г.
Рентгенфазовый анализ проводили на рентгеновском дифрактометре Д2 РILSENER фирмы Брюкер (СuKα-излучение, Ni-фильтр, диапазон съемки – 10° ≤ 2θ ≤ 90°). Микротвердость образцов измеряли на микротвердомере ПМТ-3 (оптимальная нагрузка составляла 0.02 кг), а микроструктуру образцов изучали на микроскопе МИМ-7, в качестве травителя использовали разбавленный раствор азотной кислоты. Погрешность измерения тепловых эффектов составляла ±2°, вычисления параметров решетки – ±0.001 Å, измерения микротвердости – ±0.005 МПа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
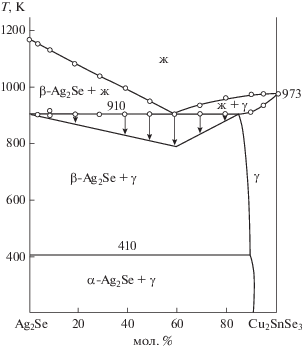
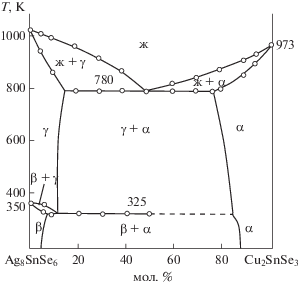
По данным ДТА построили Т–х-диаграммы систем Ag2Se–Cu2SnSe3 и Ag8SnSe6–Cu2SnSe3 (рис. 1, 2). Как видно на рис. 1, разрез Ag2Se–Cu2SnSe3 относится к эвтектическому типу. Координаты эвтектической точки составляют 40 мол. % Ag2Se и 910 K. Растворимость на основе Cu2SnSe3 при эвтектической температуре равна 15 мол. % Ag2Se, а при 300 K – 10 мол. % Ag2Se. Растворимость на основе селенида серебра практически не обнаружена. Разность ионных и атомных радиусов Cu+ и Ag+ равна 8.87%, что укладывается в рамки 15%-ного правила Юм-Розери [35]. Несмотря на близость геометрических параметров, взаимная растворимость узкая, что, по-видимому, связано c разностью кристаллических структур Ag2Se (кубическая) и Cu2SnSe3 (моноклинная). Ликвидус разреза состоит из ветвей первичной кристаллизации β-Ag2Se и γ-твердых растворов на основе Cu2SnSe3. Фазовый переход α-Ag2Se $ \rightleftarrows $ β-Ag2Se протекает при 410 K. Аналогичный характер фазообразования наблюдается и в разрезе Ag8SnSe6–Cu2SnSe3. Как видно из рис. 2, разрез является квазибинарным сечением квазитройный системы Ag2Se–SnSe2–Cu2Sе и относится к эвтектическому типу. Координаты эвтектической точки: 50 мол. % Cu2SnSe3 и T = 780 K. Взаимная растворимость между компонентами ограниченная: 15 мол. % Ag8SnSe6 на основе Cu2SnSe3 и 5 мол. % Cu2SnSe3 на основе кубического Ag8SnSe6. Температура фазового перехода α-Ag8SnSe6 $ \rightleftarrows $ β-Ag8SnSe6 при увеличении Cu2SnSe3 уменьшается, т.е. имеет эвтектоидный характер концентрации.
Для микроскопического исследования с синтезированных сплавов были срезаны плоские образцы, поверхность которых сначала шлифовали, а затем полировали с помощью алмазной пасты. Для выявления характеристики материала с поверхности удаляли полированный слой травлением составом 50% HNO3 + 50% H2O. Микрофотографии поверхностей каждого образца снимали с помощью металлографического микроскопа МИМ-7, работающего на отраженном свете. Микрофотографии поверхностей образцов (Cu2SnSe3)1– х(Ag8SnSe6)х (рис. 3) показывают, что все полученные сплавы однофазны и характеризуются крупноблочными структурами без каких-либо включений. Структура, размеры и расположение зерен у каждого образца отличаются. Монокристаллы из области твердых растворов (Cu2SnSe3)1 –х(Ag8SnSe6)х (х = 0.02 и 0.15) были получены направленной кристаллизацией расплава по методу Бриджмена–Стокбаргера. Для этого синтезированные поликристаллические образцы состава Cu1.98Ag0.02SnSe3 и Cu1.85Ag0.15SnSe3 помещали в ампулы длиной 12 см с внутренним диаметром 0.5 см. Эвакуированные до давления 10‒3 мм рт. ст. ампулы с соответствующими составами перемещали внутри вертикальной печи, имеющей две температурные зоны. В верхней зоне (Т1) температура поддерживается на 50–60 K выше, а во второй (Т2) – на 50–60 K ниже точки плавления соответствующего состава. В верхней (Т1) зоне печи образцы в ампуле находятся в расплавленном состоянии. Когда острый кончик ампулы переходит точку температуры плавления, в зоне с меньшей температурой (Т2) образуются зародыши кристаллов Cu1.98Ag0.02SnSe3 и Cu1.85Ag0.15SnSe3. Перемещение ампулы со скоростью 0.2–0.3 см/ч оказалось подходящим для выращивания образовавшихся зародышей указанных образцов. На рис. 4 показаны полученные таким способом монокристаллы Cu1.98Ag0.02SnSe3 и Cu1.85Ag0.15SnSe3, пригодные для рентгеноструктурных и физических исследований. Образование в системе Ag8SnSe6–Cu2SnSe3 ограниченной области растворимости подтверждено и данными РФА (рис. 5). Установлено, что дифракционные картины сплавов, содержащих ≤15 мол. % Ag8SnSe6, качественно идентичны дифрактограмме Cu2SnSe3, т.е. они являются твердыми растворами замещения на основе этого соединения (α-${\text{фаза}}$), а дифрактограммы сплавов с содержанием ≤5 мол. % Cu2SnSe3 аналогичны дифрактограммам чистого Ag8SnSe6 (β-фаза). Порошковые рентгенограммы сплавов состава 5–85 мол. % Cu2SnSe3 состоят из совокупности линий α- и β-фаз, что находится в соответствии с фазовой диаграммой (рис. 2). Рентгенограммы α-фазы индицированы в моноклинной сингонии (табл. 1). В пределах области гомогенности α-фаз концентрационные зависимости параметров их кристаллических решеток практически линейны.
Рис. 4.
Микроснимки монокристаллов Cu1.98Ag0.02SnSe3 (а) и Cu1.85Ag0.15SnSe3 (б), выращенных направленной кристаллизацией расплава.

Рис. 5.
Дифрактограммы сплавов системы Ag8SnSe6–Cu2SnSe3: 1 – Ag8SnSe6; 2 – 5 мол. % Cu2SnSe3; 3 – 85 мол. % Cu2SnSe3; 4 – 90% Cu2SnSe3; 5 – 95 мол. % Cu2SnSe3; 6 – Cu2SnSe3.
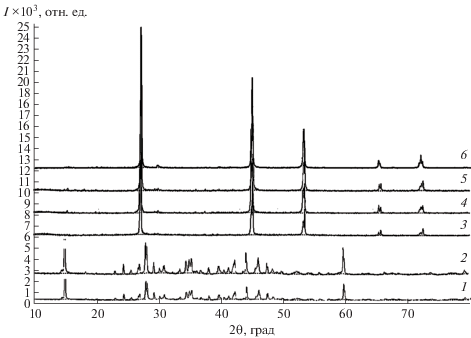
Таблица 1.
Кристаллографические данные твердых растворов (Cu2SnSe3)1 –х(Ag8SnSe6)х, сингония моноклинная, Z = 4, пр. гр. Сс
| Состав | Параметр решетки, Å | β, град | ||
|---|---|---|---|---|
| a | b | c | ||
| Cu2SnSe3 | 6.968 | 12.051 | 6.945 | 109.20 |
| Cu1.98 Ag0.02SnSe3 | 6.969 | 12.056 | 6.948 | 109.21 |
| Cu1.97 Ag0.03SnSe3 | 6.970 | 12.058 | 6.951 | 109.23 |
| Cu1.95 Ag0.05SnSe3 | 6.972 | 12.062 | 6.954 | 109.23 |
| Cu1.92 Ag0.08SnSe3 | 6.974 | 12.065 | 6.957 | 109.25 |
| Cu1.90 Ag0.10SnSe3 | 6.978 | 12.072 | 6.960 | 109.27 |
| Cu1.85 Ag0.15SnSe3 | 6.985 | 12.078 | 6.968 | 109.30 |
ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ
Границы твердых растворов, образующихся в квазибинарных разрезах Ag2Se–Cu2SnS3 и Ag8SnSe6–Cu2SnSe3, уточняли с помощью температурно-концентрационной зависимости свободной энергии Гиббса. Из литературного анализа следует, что соединения Ag2Se, Cu2SnS3 и Ag8SnSe6 существенно отличаются по составу, структуре и параметрам кристаллической решетки. Поэтому в уравнении Гиббса–Гельмгольца использовали асимметричный вариант модели регулярных твердых растворов немолекулярных соединений [36–39]. В частности, уравнения Гиббса–Гельмгольца для твердых растворов (1 – x)Ag8SnSe6 –xCu2SnSe3 и (1 – x)Ag2Se–xCu2SnSe3 имеют вид:
(1)
$\begin{gathered} \Delta G_{T}^{0}{\text{\;}} = {\text{\;}}\left( {1 - x} \right)\left[ {\Delta H_{{298}}^{0}\left( {{\text{A}}{{{\text{g}}}_{8}}{\text{SnS}}{{{\text{e}}}_{6}}} \right)} \right. - \\ - \,\,\left. {T\Delta S_{{298}}^{0}\left( {{\text{A}}{{{\text{g}}}_{8}}{\text{SnS}}{{{\text{e}}}_{6}}} \right)} \right] + \\ + \,\,x\left[ {\Delta H_{{298}}^{0}\left( {{\text{C}}{{{\text{u}}}_{2}}{\text{SnS}}{{{\text{e}}}_{3}}} \right) - T\Delta S_{{298}}^{0}\left( {{\text{C}}{{{\text{u}}}_{2}}{\text{SnS}}{{{\text{e}}}_{3}}} \right)} \right] + \\ + \,\,\left( {a + bT} \right){{x}^{m}}{{(1 - x)}^{n}} + \\ + \,\,RT\left[ {\left( {1 - x} \right)\ln {{f}_{1}}\left( x \right) + x\ln {{f}_{2}}\left( x \right)} \right], \\ \end{gathered} $(2)
$\begin{gathered} \Delta G_{T}^{0}{\text{\;}} = {\text{\;}}\left( {1 - x} \right)\left[ {\Delta H_{{298}}^{0}\left( {{\text{A}}{{{\text{g}}}_{2}}{\text{Se}}} \right) - T\Delta S_{{298}}^{0}\left( {{\text{A}}{{{\text{g}}}_{2}}{\text{Se}}} \right)} \right] + \\ + \,\,x\left[ {\Delta H_{{298}}^{0}\left( {{\text{C}}{{{\text{u}}}_{2}}{\text{SnS}}{{{\text{e}}}_{3}}} \right) - T\Delta S_{{298}}^{0}\left( {{\text{C}}{{{\text{u}}}_{2}}{\text{SnS}}{{{\text{e}}}_{3}}} \right)} \right] + \\ + \,\,\left( {a + bT} \right){{x}^{m}}{{(1 - x)}^{n}} + \\ + \,\,RT\left[ {\left( {1 - x} \right)\ln {{f}_{1}}\left( x \right) + x\ln {{f}_{2}}\left( x \right)} \right].{\text{\;}} \\ \end{gathered} $В уравнениях (1) и (2) х – мольная доля Cu2SnSe3 в твердых растворах (1 – x)Ag8SnSe6–xCu2SnSe3 и (1 – x)Ag2Se–xCu2SnSe3; R = 8.314 Дж моль–1 K–1; $\Delta H_{{298}}^{0}$ и $\Delta S_{{298}}^{0}$ – стандартные энтальпии и энтропии образования соединений. Их значения взяты из работ [40, 41]; $\Delta H_{{298}}^{0}$(Ag8SnSe6) = –207.6 кДж моль–1, $\Delta H_{{298}}^{0}$(Cu2SnSe3 = –320.4 кДж моль–1, $\Delta S_{{298}}^{0}$(Ag8SnSe6) = –31.33 Дж моль–1 K–1, $\Delta S_{{298}}^{0}$(Cu2SnSe3) = 100.35 Дж моль–1 K–1; axm(1 – x)n представляет энтальпии смешения твердых растворов в рамках асимметричного варианта модели регулярных растворов. Для нахождения постоянных значений в этой формуле применяли многоцелевой генетический алгоритм [42]. Для осуществления процесса итерации использовали следующие условия в совокупности с экспериментальными данными ДТА:
х = 0–1; a > 0; b > 0; m > n > 1; 325 K < T < 780 K и 410 K < T < 910 K.
Последние слагаемые в уравнениях (1) и (2) представляют конфигурационную энтропию смешения ($\left( 2 \right)$Т∆S) твердых растворов c учетом немолекулярной природы соединений Ag8SnSe6, Cu2SnSe3 и Ag2Se. Функции f1(x) включают в качестве постоянных стехиометрические коэффициенты разноименных атомов в молекулах соединений [43].
В частности, уравнение (1) после выставления термодинамических величин и параметров модели регулярных растворов имеет следующий вид:
(3)
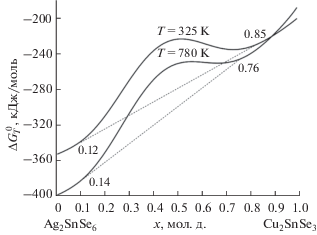
$\begin{gathered} \Delta G_{T}^{0}\left( {{\text{кДж/моль}}} \right) = x\left( { - 207.6 + 0.03133T} \right) + \\ + \,\,\left( {1 - x} \right)\left( { - 320.4 - 0.10035T} \right) + 8.314T/1000 \times \\ \times \,\,\left( {1 - x} \right)\left( {8\ln \left( {1 - x} \right) + 2x\ln \left( x \right)} \right) + 31{\kern 1pt} 000{{x}^{4}}{{\left( {1 - x} \right)}^{5}}. \\ \end{gathered} $Зависимости свободной энергии смешения твердых растворов от состава для температур 325 и 780 K для твердых растворов (1 – x)Ag8SnSe6–xCu2SnSe3 представлены на рис. 6, из которого следует, что в средних областях концентрации твердые растворы неустойчивы и распадаются на две фазы. Границы гомогенности определены по положению общей касательной на рис. 6 исходя из равенства химического потенциала компонента в гетерогенной смеси твердых растворов двух разных модификаций (рис. 1 и 2). Расчеты выполнены и визуалированы с помощью программы OriginLab2019 и www.matematikam.ru.
Рис. 6.
Зависимости свободной энергии образования твердых растворов от температуры и состава (уравнение (3)).
ЗАКЛЮЧЕНИЕ
Впервые построены Т–х-фазовые диаграммы квазибинарных разрезов Ag2Se–Cu2SnSe3 и Ag8SnSe6–Cu2SnSe3 квазитройной системы Ag2Se–SnSe2–Cu2Sе. Установлено, что диаграммы их состояния относятся к эвтектическому типу с ограниченной растворимостью на основе компонентов. Определены температурно-концентрационные зависимости свободной энергии Гиббса сплавов, что позволило уточнить границы твердых растворов (1 – x)Ag8SnSe6–xCu2SnSe3: 15 мол. % Ag8SnSe6 на основе Cu2SnSe3 и 12 мол. % Cu2SnSe3 на основе орторомбического Ag8SnSe6.
Построенные фазовые диаграммы использованы для выбора состава растворов-расплавов при выращивании монокристаллов α- (твердый раствор на основе Cu2SnSe3) и β-фаз (твердый раствор на основе Ag8SnSe6) заданного состава методом направленный кристаллизации.
Список литературы
Иоффе А.Ф. Физика полупроводников. М.–Л.: Изд-во АН СССР, 1957.
Абрикосов Н.Х., Банкина В.Ф., Порецкая Л.В. и др. Полупроводниковые халькогениды и сплавы на их основе. М.: Наука, 1975. 220 с.
Физико-химические свойства полупроводниковых веществ / Под ред. Новоселовой Л.В., Лазарева В.Б. М.: Наука, 1979. 339 с.
Балапаков М.Х., Якшибаев Р.А., Мухаммедьянов У.Х. // Физика твердого тела. 2003. Т. 45. № 4. С. 604.
Бабанлы М.Б., Юсибов Ю.А., Абишев В.Т. Трехкомпонентные халькогениды на основе меди и серебра. Баку: Изд-во БГУ, 1993. 342 с.
Shimato E., Okasaki N. // J. Phys. Condens. Mater. 1993. V. 5. № 21. P. 3405.
Баккулова Н.Н. Кристаллическая структура, динамика решетки и ионный перенос в суперионных проводниках халькогенидов меди и серебра Автореф. дис. докт. физ-мат. наук. Уфа, 2005. 46 с.
Tveryanovich Y.S., Razumtcev A.A., Fazletohinov T.R. et al. // Thin Solid Films. 2018. V. 666. P. 172. https://doi.org/10.1016/j.tsf./2018.09.036
Qi Cao, Yi-Feng Cheng, Han Bi et al. // J. Mater. Chem. A. 2015. V. 3(40). P. 20091. https://doi.org/10.1039/C5TA049780
Prathiba P.J., Mohanraj K.H., Siva Kumar G. // Trans. Nonferrous Met. Soc. 2015. V. 25. № 7. P. 2241.
Okereke N.A., Ekounobi A.I. // J. Optoelectron Biomed Mater. 2011. № 3. P. 51.
Yusibov Yu.A., Alverdiev I.Dzh., Mashadiyeva L.F. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 162. https://doi.org/10.1134/S0036023618120227
Kreutzbruck M., Mocwitz B., Gruhl F. // J. Appe. Phys. Lett. 2005. V. 86. № 4. P. 813.
Chougale U.M., Han S.H., Rath M.C. et al. // Mater. Phys. Mechanics. 2013. V. 17. № 1. P. 47.
Olekseyuk I.D., Ostapyuk T.A., Yuhimuk T.V. // Науковий вiслик Волинського национального унiверситету iмеni Леci Украiнки. Рoздil I. Неорганична хiмiя. 2009. Т. 29. № 1. С. 35.
Delgado G.E., Mora A.J., Marcano G. et al. // Mater. Res. Bull. 2003. V. 38. № 4. P. 1949. https://doi.org/10.1016/ j.materresbull.2003.09.017
Gulay L.D., Olekseyuk I.D., Parasyuk O.V. // J. Alloys. Compd. 2002. V. 339. № 1. P. 113. https://doi.org/10.1016/S0925-8388(01)01970-3
Rzaguliev V.A., Kerimli O.Sh., Mamedov Sh.G. // Proc. XXI Intern. Conf. St. Petersburg, 2019. P. 20.
Рзагулиев В.А., Керимли О.Ш., Аждарова Д.С. и др. // Конденсированные среды и межфазные границы. 2019. Т. 21. № 4. С. 544. https://doi.org/10/17308/komf.2019.21/2365
Pакитин В.В. Физико-химический механизм синтеза и элементарные реакции с участием фотогенерированных носителей тока в кестеритах Cu–Zn–Sn–S(Se). Дис. … канд. хим. наук. М., 2016. 133 с.
Zmiy O.F., Gulay L.D., Klimovich O.S. // Chem. Met. Alloys. 2008. № 1. P. 115. www.Chemical journal org.
Klymovch O.S. // Chem. Met. Alloys. 2008. № 1. P. 288.
Yu J., Yun H. // Acta Crystallogr. E. 2011. V. 67. № 1. P. 145.
Liu H. // Nature Materials. 2012. V. 11. № 2. P. 422.
Constantinesch L.W. // Tin Solid Films. 1983. V. 28. № 1. P. 73.
Асадов Ю.Г., Алиев Ю.И., Бабаев А.Г. // Физика элементарных частиц и атомного ядра. 2015. Т. 46. № 3. С. 812.
Sharma B.B., Ayyar R., Shing H. // Phys. Status Solidi A. 1977. V. 40. № 3. P. 691.
Marcano G., Chalbaud L.M., Rincon C. et al. // Mater. Lett. 2002. V. 53. № 1. P. 151.
Avellaneda D., Nair M.T., Nair P.K. // J. Thermochem. Soc. 2010. V. 158. № 6. P. 346.
Gurieva G., Levchenko S., Schorr S. et al. // Thin Solid Films. 2013. V. 535. № 2. P. 384.
Kim K.M., Tampo H., Shibata H. // Thin Solid Films. 2013. V. 536. № 1. P. 11.
Алферов Ж.И. // Успехи химии. 2013. Т. 82. № 7. С. 587.
Мейтин М. // Электроника: Наука, технология. Бизнес. 2000. № 6. С. 40.
Алферов Ж.И., Андреев М., Румянцев В.Д. // Физика и техника полупроводников . 2004. Т. 38. № 8. С. 937.
Юм Розери. Введение в физическое металловедение. М.: Металлургия, 1965. 275 с.
Gurbanov G.R., Mamedov Sh.G., Adygezalova M.B. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 12. P. 1638. https://doi.org/10.1134/S0036023617120099
Mammadov Sh.H., Mammadov A.N., Kurbanova R.C. // Russ. J. Inorg. Chem. 2020. V. 65. № 2. P. 217. https://doi.org/10.1134/S003602362001012X
Mamedov A.N., Tagiev E.R., Babanly M.B. // Inorg. Mater. 2016. V. 52. № 6. P. 543. https://doi.org/10.1134/S002016851606008X
Asadov S.M., Mustafaeva S.N., Mamedov A.N. // J. Therm. Anal. Calorim. 2018. V. 133. № 2. P. 1135. https://doi.org/10.1007/s10973-018-6967-7
Бабанлы М.Б., Юсибов Ю.А. Электрохимические методы в термодинамике неорганических систем. Баку: ЭЛМ, 2011. 306 с.
Moroz M.V., Prokhorenko M.V., Demchenko P.Yu. et al. // J. Chem. Thermodyn. 2017. V. 106. P. 228.
Mammadov A.N., Alverdiev I.D., Aliev Z.S. et al. //Adv. Intell. Syst. Comput. 2020. V. 1095. P. 8. https://doi.org/10.1007/978-3-030-35249-3_118
Мамедов A.H. Термодинамика систем с немолекулярными соединениями: расчет и аппроксимация термодинамических функций и фазовых диаграмм. LAMBERT. Academic Publ., 2015.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии