Журнал неорганической химии, 2020, T. 65, № 12, стр. 1651-1655
Термодинамические свойства M-EuTaO4
П. Г. Гагарин a, А. В. Гуськов a, В. Н. Гуськов a, *, Л. Х. Балдаев b, Е. Г. Сазонов b, А. В. Тюрин a, М. А. Рюмин a, К. С. Гавричев a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b ООО “Технологические системы защитных покрытий”
108851 Москва, ул. Южная, 9А, Россия
* E-mail: guskov@igic.ras.ru
Поступила в редакцию 22.07.2020
После доработки 27.07.2020
Принята к публикации 31.07.2020
Аннотация
Моноклинный М-ортотанталат европия синтезирован обратным осаждением с конечным отжигом при 1673 K. Образец исследован с использованием рентгенофазового и химического анализа, морфология – с помощью электронной микроскопии. Методом адиабатической калориметрии определена температурная зависимость молярной теплоемкости M-EuTaO4 в интервале 8–350 K и рассчитаны термодинамические функции: энтропия, приращение энтальпии и приведенная энергия Гиббса. Установлен общий вид вклада в теплоемкость аномалии Шоттки.
ВВЕДЕНИЕ
Танталаты редкоземельных элементов (РЗЭ, RE) известны как высокотемпературные оксиды высокой плотности [1, 2] и высокой химической и электрохимической стабильности [3, 4]. Эти вещества представляют интерес благодаря ионной проводимости [5, 6], люминесцентным и оптическим свойствам [7–10], а также как сцинтилляционные материалы [11–13]. Особое внимание уделяется этим веществам как перспективным материалам или компонентам для термобарьерных или защитных покрытий авиадвигателей и газотурбинных установок [14–18]. В системах RE2O3–Ta2O5 образуется несколько двойных оксидов [1, 2], наиболее изученными из которых являются ортотанталаты состава RETaO4 [19–21]. Ортотанталаты РЗЭ с большим атомным радиусом (лантана, церия и празеодима) кристаллизуются в орторомбической сингонии Pbca [22], а остальных РЗЭ, включая иттрий, – в моноклинной [1, 2]. Известны две моноклинные модификации ортотанталатов РЗЭ: M (I2/a, Z = 4) и M' (P2/a, Z = 2), различающиеся удвоением кристаллической решетки вдоль параметра b. При уменьшении атомного радиуса катиона за счет лантаноидного сжатия (и увеличении его атомной массы) устойчивость M-модификации понижается, а M '-формы увеличивается, и ортотанталаты иттербия и лютеция существуют только в M '-модификации [23, 24], тогда как для NdTaO4 известен лишь M-тип структуры [25, 26]. Особенностью этих двух моноклинных фаз состава RETaO4 в ряду Sm…Tm (а также иттрий [27, 28]) является необратимое превращение M ' → M при нагревании, и, таким образом, для перечисленных РЗЭ наиболее устойчивой модификацией следует считать M-фазу. Необходимо отметить, что существует температурный интервал, в котором обе моноклинные модификации могут существовать одновременно [28, 29]. При низкотемпературной кристаллизации (~1273 K) тонких пленок этих соединений на оксиде алюминия могут возникать и другие фазы [30], поэтому для получения чистого M-типа следует внимательно относиться к термической обработке синтезированных соединений. Это особенно касается керамического способа синтеза, когда недостаточно высокие температуры (<1500 K) приводят к неполному образованию М-формы и образованию метастабильных фаз типа T ' [31]. При нагревании ортотанталатов до температур 1600–1700 K происходит повышение симметрии кристаллической структуры с обратимым превращением в тетрагональную модификацию T (I41/a, Z = 4) [32]. Поскольку синтез, термическая обработка и практическое применение материалов на основе ортотанталатов как в виде объемных деталей, так и в виде покрытий или тонких пленок при высоких температурах неизбежно связаны с контактами с другими материалами, а также с активными средами, актуальной проблемой является анализ “живучести” этих материалов. Экспериментальное проведение таких оценок является сложной и дорогостоящей задачей, существенно упростить выполнение которой можно при помощи термодинамического моделирования, результатом которого является определение конечного равновесного состояния физико-химической системы с участием ортотанталатов, позволяющее избежать кинетических осложнений. Для проведения такого моделирования необходимы достоверные термодинамические функции участвующих в процессе веществ, определенные на экспериментальной основе, так как используемые оценки по имеющимся полуэмпирическим моделям для двойных оксидов часто дают недостаточно точный результат [33].
Целью настоящей работы является измерение низкотемпературной теплоемкости ортотанталата европия в диапазоне 8–350 K, расчет термодинамических функций: энтропии, приращения энтальпии, приведенной энергии Гиббса и оценка вида вклада аномалии Шоттки в теплоемкость M-EuTaO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ортотанталат европия получали методом обратного осаждения водным раствором аммиака (NH4OH, 25–28 мас. %, A.C.S., ООО “Химмед”) из водно-спиртового раствора хлорида тантала(V) (99.99%) и секвиоксида европия (99.99%) производства ООО “Ланхит”, предварительно растворенного в соляной кислоте (35–38 мас. %, “ос. ч. 20-4”, ООО “Химммед”), с последующим обезвоживанием и ступенчатым отжигом полученного осадка (максимальная температура отжига 1673 K, 4 ч). Подробное описание синтеза приведено в работах [25, 26]. Идентификацию образца проводили с помощью рентгеновской дифракции на порошке (дифрактометр Bruker D8 Advance, CuKα‑излучение, λ = 1.5418 Å, диапазон углов 2θ = = 10°–80°). Определение химического состава осуществляли с использованием оптического эмиссионного спектрометра Agilent 725 с индукционно-связанной плазмой. Морфологию полученного образца изучали посредством электронного микроскопа (Cross Beam Zeiss NVision 40 electron microscope (SEM)). Измерения теплоемкости проводили методом адиабатической калориметрии на автоматическом низкотемпературном калориметре БКТ-3 АОЗТ “Термис”, как и последующие расчеты, в соответствии с приведенными в [34] методиками. Молекулярную массу ортотанталата европия 396.90948 г/моль рассчитывали по рекомендованным в [35] значениям атомных масс.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для проведения калориметрических исследований был получен образец M-EuTaO4. По данным рентгенофазового анализа (рис. S1 ), образец посторонних фаз не содержал и характеризовался параметрами a = 5.430(5), b = 11.101(6), c = = 5.084(4) Å, β = 95.62(2)°, которые находились в пределах значений, приведенных в работах [1, 2, 7, 14, 15, 20]. Поскольку размерный фактор вещества может влиять на величины теплоемкости и других термодинамических свойств [например, 36], изучение морфологии образца является необходимым этапом предварительных исследований. По данным электронной микроскопии, образец ортотанталата европия (рис. S2 ) нормально закристаллизован и не является наноразмерным (размер частиц >100 нм), что также подтверждено расчетами по Шереру областей когерентного рассеяния. Определение химического состава ортотанталата европия показало, что атомное соотношение металлов Eu : Ta составляет 50.15 : 49.85 (±0.20), и образец в пределах погрешностей химического анализа является стехиометрическим. Приведенные отклонения в составе не могут внести значительных погрешностей в величины молярной теплоемкости (S3).
Измерения молярной теплоемкости проводили на образце массой 3.41087 ± 0.00005 г в 142 точках и диапазоне температур 8.78–346.40 K (табл. S1 , рис. 1а).
Рис. 1.
Экспериментальная зависимость молярной теплоемкости M-EuTaO4: а – область 8–350 K, б – интервал 8–40 K: 1 – экспериментальные точки, 2 – аппроксимация теплоемкости уравнением (1), 3 – решеточная теплоемкость M‑GdTaO4 [29].
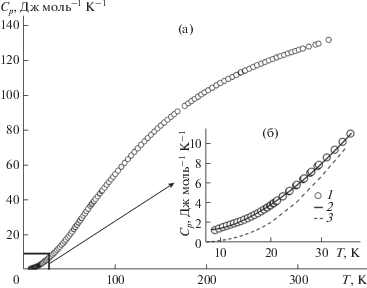
Как видно из рис. 1а, аномалии, связанные со структурными превращениями в изученной температурной области, отсутствуют. Результаты адиабатических измерений молярной теплоемкости удовлетворительно сглажены с помощью уравнения:
По сглаженным значениям теплоемкости рассчитаны энтропия, приращение энтальпии и приведенная энергия Гиббса без учета вкладов низкотемпературного участка 0–8 K (табл. 1). Коэффициенты аппроксимирующего уравнения приведены в табл. S2 .
Таблица 1.
Стандартные термодинамические функции M-EuTaO4: молярные теплоемкость, энтропия, приращение энтальпии и приведенная энергия Гиббса Φ°(T) = S°(T) – S°(8 K) – [H°(T) – H°(8 K)]/T, М.м. = 396.90948 г/моль, Р = = 101.3 кПа
| T, K | $C_{{p,m}}^{^\circ }$(T), Дж моль–1 K–1 |
S°(T) – S°(8 K), Дж моль–1 K–1 |
H°(T) – H°(8 K), Дж моль–1 |
Φ°(T), Дж моль–1 K–1 |
|---|---|---|---|---|
| 8 | 1.357 | 0 | 0 | 0 |
| 9 | 1.413 | 0.163 | 1.385 | 0.211 |
| 10 | 1.508 | 0.317 | 2.846 | 0.396 |
| 12 | 1.797 | 0.616 | 6.136 | 0.710 |
| 14 | 2.197 | 0.922 | 10.12 | 0.978 |
| 16 | 2.688 | 1.247 | 14.99 | 1.218 |
| 18 | 3.258 | 1.596 | 20.93 | 1.442 |
| 20 | 3.896 | 1.972 | 28.07 | 1.657 |
| 25 | 5.755 | 3.034 | 52.06 | 2.186 |
| 30 | 7.958 | 4.273 | 86.20 | 2.731 |
| 35 | 10.49 | 5.685 | 132.2 | 3.309 |
| 40 | 13.32 | 7.267 | 191.6 | 3.930 |
| 45 | 16.42 | 9.013 | 265.8 | 4.598 |
| 50 | 19.75 | 10.91 | 356.2 | 5.315 |
| 55 | 23.25 | 12.96 | 463.7 | 6.080 |
| 60 | 26.86 | 15.14 | 588.9 | 6.895 |
| 65 | 30.52 | 17.43 | 732.4 | 7.756 |
| 70 | 34.19 | 19.83 | 894.2 | 8.661 |
| 75 | 37.81 | 22.31 | 1074 | 9.610 |
| 80 | 41.37 | 24.86 | 1272 | 10.60 |
| 85 | 44.84 | 27.48 | 1488 | 11.62 |
| 90 | 48.23 | 30.14 | 1720 | 12.67 |
| 95 | 51.52 | 32.83 | 1967 | 13.76 |
| 100 | 54.72 | 35.56 | 2235 | 14.87 |
| 110 | 60.89 | 41.06 | 2814 | 17.17 |
| 120 | 66.78 | 46.62 | 3452 | 19.54 |
| 130 | 72.41 | 52.18 | 4148 | 21.98 |
| 140 | 77.75 | 57.75 | 4899 | 24.46 |
| 150 | 82.75 | 63.28 | 5702 | 26.99 |
| 160 | 87.37 | 68.77 | 6553 | 29.54 |
| 170 | 91.61 | 74.20 | 7448 | 32.12 |
| 180 | 95.49 | 79.55 | 8384 | 34.70 |
| 190 | 99.08 | 84.81 | 9357 | 37.30 |
| 200 | 102.4 | 89.98 | 10 360 | 39.90 |
| 210 | 105.6 | 95.05 | 11 400 | 42.49 |
| 220 | 108.5 | 100.0 | 12 480 | 45.08 |
| 230 | 111.2 | 104.9 | 13 570 | 47.65 |
| 240 | 113.8 | 109.7 | 14 700 | 50.21 |
| 250 | 116.1 | 114.4 | 15 850 | 52.75 |
| 260 | 118.3 | 119.0 | 17 020 | 55.29 |
| 270 | 120.4 | 123.5 | 18 220 | 57.80 |
| 280 | 122.4 | 127.9 | 19 430 | 60.28 |
| 290 | 124.4 | 132.2 | 20 660 | 62.75 |
| 298.15 | 125.8 ± 0.6 | 135.8 ± 0.8 | 21 680 ± 100 | 64.85 ± 0.65 |
| 300 | 126.1 | 136.5 | 21 920 | 65.21 |
| 310 | 127.7 | 140.7 | 23 190 | 67.63 |
| 320 | 129.8 | 144.7 | 24 470 | 70.03 |
| 330 | 131.2 | 148.7 | 25 770 | 72.41 |
| 340 | 133.3 | 152.7 | 27 090 | 74.77 |
| 350 | 133.6 | 156.6 | 28 430 | 77.10 |
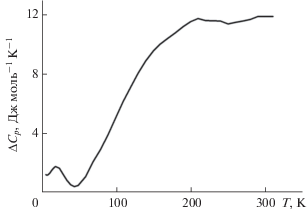
Низкотемпературный участок 0–8 K характеризуется наличием аномалий, в том числе магнитных превращений, наблюдаемых обычно у соединений лантаноидов в диапазоне 0–5 K [37]. Магнитные переходы могут дать заметный вклад в абсолютную энтропию, которая для перехода антиферромагнетик–парамагнетик составляет Rln2 = 5.76 Дж моль–1 K–1, однако реальная величина этого вклада требует экспериментального подтверждения, возможностями которого мы не располагаем. Помимо магнитных переходов особенностью соединений лантаноидов является взаимодействие электронов незаполненной 4f-оболочки с электрическим полем кристаллической решетки, приводящее к существенному повышению теплоемкости. Это явление принято называть аномалией Шоттки [38–40]. Таким образом, наблюдаемая теплоемкость соединений лантаноидов складывается из решеточной Clat и электронной составляющей Cel, которая, в свою очередь, распадается на вклады магнитных переходов Cmag и вклад аномалии Шоттки СSch:
(2)
${{C}_{p}} = {{C}_{{{\text{lat}}}}} + {{C}_{{{\text{el}}}}} = {{C}_{{{\text{lat}}}}} + {{C}_{{{\text{mag}}}}} + {{С}_{{{\text{Sch}}}}}$при отсутствии других вкладов, например, за счет структурных превращений. К сожалению, выделить решеточную составляющую из экспериментальной теплоемкости M-EuTaO4 затруднительно, поэтому в настоящей работе выполнено сравнение с решеточной теплоемкостью ортотанталата гадолиния, оцененной в [29]. Температурные зависимости экспериментальной M-EuTaO4 и решеточной теплоемкости M-GdTaO4 приведены на рис. 1б. Как видно из рисунка, кривая теплоемкости M-EuTaO4 (кривая 1) располагается заметно выше кривой решеточной теплоемкости ортотанталата гадолиния (кривая 3). Так как эти два соединения изоструктурны, величины решеточных теплоемкостей могут различаться только лишь за счет изменения атомной массы лантаноида, которое, впрочем, компенсируется изменением ионного радиуса. Таким образом, оценить избыточную теплоемкость можно с использованием разности:
(3)
$\Delta {{C}_{p}} = {{C}_{p}}\left( {M{\text{ - EuTa}}{{{\text{O}}}_{4}}} \right) - {{C}_{p}}\left( {M{\text{ - GdTa}}{{{\text{O}}}_{4}}} \right).$Полученная разность приведена на рис. 2 и характеризует общий вид вклада аномалии Шоттки в молярную теплоемкость ортотанталата европия.
ЗАКЛЮЧЕНИЕ
Молярная теплоемкость моноклинного M-ортотанталата европия измерена методом адиабатической калориметрии в интервале 8–350 K и рассчитаны термодинамические функции: энтропия, приращение энтальпии и приведенная энергия Гиббса без учета температурного участка 0–8 K. Полученные значения функций при 298.15 K составили: Сp(298.15 K) = 125.8 ± 0.6 Дж моль–1 K–1, S°(298.15 K) – S°(8 K) = 136.0 ± 0.8 Дж моль–1 K–1, H°(298.15 K) – H°(8 K) = 21690 ± 100 Дж моль–1 и Φ°(T) = S°(298.15 K) – S°(8K) – [H°(298.15 K) – H°(8 K)]/T = 65.10 ± 0.65 Дж моль–1 K–1. Определен вид температурной зависимости вклада аномалии Шоттки. Полученные результаты могут быть использованы для термодинамического моделирования фазовых равновесий в сложных системах с участием ортотанталата европия.
Список литературы
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редкоземельных элементов. Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Рождественский Ф.А., Зуев М.Г., Фатеев А.А. Танталаты трехвалентных металлов. М.: Наука, 1986. 168 с.
Osterloh F.E. // Chem. Mater. 2008. V. 20. P. 35. https://doi.org/10.1021/cm7024203
Arakawa S., Shiotsu T., Hayashi S. // J. Ceram. Soc. Jpn. 2005. V. 113. P. 317. https://doi.org/10.2109/jcersj.113.317
Haugsrud R., Norby T. // Nat. Mater. 2006. V. 5. P. 193. https://doi.org/10.1038/nmat1591
Nyman M., Rodriguez M.A., Rohwer L.E.S. et al. // Chem. Mater. 2009. V. 21. P. 4731. https://doi.org/10.1021/cm9020645
Brixner L.H., Chen H. // J. Electrochem. Soc. 1983. V. 130. P. 2435. https://doi.org/10.1149/1.2119609
Rozhdestvenskii F.A., Zuev M.G. // J. Lumin. 1983. V. 28. P. 465. https://doi.org/10.1016/0022-2313(83)90013-3
Siqueira K.P.F., Carmo A.P., Bell M.J.V. et al. // J. Lumin. 2016. V. 179. P. 140. https://doi.org/10.1016/j.jlomin.2016.06.054
Wang S., Jiang M., Gao L. et al. // Materials. 2016. V. 9. P. 55. https://doi.org/10.3390/ma9010055
Dou R., Zhang Q., Gao J. et al. // Crystals. 2018. V. 8. P. 55. https://doi.org/10.3390/cryst8020055
Voloshyna O., Gerasimov J., Siletskiy O. et al. // Optical Mater. 2017. V. 66. P. 332. https://doi.org/10.1016/j.optmat.2017.02.037
Nakauchi D., Koshimizu M., Okada G. et al. // Radiat. Meas. 2017. V. 106. P. 129. https://doi.org/10.1016/j.radmeas.2017.03.033
Wang J., Chong X.Y., Zhiu R. et al. // Scr. Mater. 2017. V. 126. P. 24. https://doi.org/10.1016/j.scriptamat.2016.08.019
Chen L., Hu M., Wu P. et al. // J. Am. Ceram. Soc. 2019. V. 102. P. 4809. https://doi.org/10.1111/jace.16328
Zhou Y., Gan G., Ge Z. et al. // Mater. Res. Express. 2020. V. 7. P. 015204. https://doi.org/10.1088/2053-1591/ab669f
Shian S., Sarin P., Gurak M. et al. // Acta Mater. 2014. V. 69. P. 196. https://doi.org/10.1016/j.actamat.2014.01.054
Chen L., Song P., Feng J. // Scr. Mater. 2018. V. 152. P. 117. https://doi.org/10.1016/j.scriptamat.2018.03.042
Портной К.И., Тимофеева Н.И., Салибеков С.Е. // Изв. АН СССР. Неорган. материалы. 1970. Т. 6. С. 289.
Ma Z., Zheng J.Y., Wang S. et al. // Opt. Eng. 2018. V. 5. P. 017 107. https://doi.org/10.1117/1.OE.57.1.017107
Siqueira K.P.F., Carvalho G.B., Dias A. // Dalton Trans. 2011. V. 40. P. 9454. https://doi.org/10.1039/c1dt10783f
Forbes T.Z., Numan M., Rodriguez M.A. et al. // J. Solid State Chem. 2010. V. 183. P. 2516. https://doi.org/10.1016/j.jssc.2010.08.024
Guskov V.N., Khoroshilov A.V., Ryumin M.A. et al. // Ceram. Int. 2020. V. 46. P. 5402. https://doi.org/10.1016/j.ceramint.2019.10.296
Nikiforova G.E., Kondrat’eva O.N., Tyurin A.V. et al. // J. Alloys Compd. 2019. V. 803. P. 1016. https://doi.org/10.1016/j.jallcom.2019.06.354
Гуськов В.Н., Сазонов Е.Г., Тюрин А.В. и др. // Журн. неорган. химии. 2019. Т. 64. С. 874. https://doi.org/10.1134/S0044457X19080051
Гуськов В.Н., Сазонов Е.Г., Хорошилов А.В. и др. // Неорган. материалы. 2019. Т. 55. С. 959. https://doi.org/10.1134/S0020168519090048
Рюмин М.А., Сазонов Е.Г., Гуськов В.Н. и др. // Неорган. материалы. 2016. Т. 52. С. 1223. https://doi.org/10.7868/S0002337X16110142
Хорошилов А.В., Ашмарин А.А., Гуськов В.Н. и др. // Докл. РАН. 2019. Т. 484. С. 181. https://doi.org/10.31857/S0869-56524842181-183
Рюмин М.А., Сазонов Е.Г., Гуськов В. Н. и др. // Неорган. материалы. 2017. Т. 53. С. 737. https://doi.org/10.7868/S0002337X17070120
Brunckova E., Kolev H., Kanuchova M. // Surf. Interface Anal. 2018. https://doi.org/10.1002/sia.6583
Siqueira K.P.F., Dias A. // Mater. Res. 2014. V. 17. P. 167. https://doi.org/10.1590/S1516-14392013005000189
Stubičan. V.S. // J. Am. Ceram. Soc. 1964. V. 47. P. 55. https://doi.org/10.1111/j.1151-2916.1964.tb15654.x
Leitner J., Voňka P., Sedmidubsky D. et al. // Thermochim. Acta. 2010. V. 497. P. 7. https://doi.org/10.1016/j.tca.2009.08.002
Рюмин М.А., Никифорова Г.Е., Тюрин А.В. и др. // Неорган. материалы. 2020. V. 56. P. 102. https://doi.org/10.1134/S00201685200101148
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. P. 2051. https://doi.org/10.1351/pac200678112051
Ho J.C., Hamdeh H.H., Chen Y.Y. et al. // Phys. Re. V. B. 1995. V. 52. P. 10122. https://doi.org/10.1103/physrevb.52.10122
Besara T., Lundberg M.S., Sun J. et al. // Prog. Solid State Ch. 2014. V. 42. P. 23. https://doi.org/10.1016/j.progsolidstchem.2014.05.001
Westrum E.F. // J. Therm. Anal. Calorim. 1985. V. 30. P. 1209. https://doi.org/10.1007/bf01914288
Chirico R.D., Westrum E.F. // J. Chem. Thermodyn. 1980. V. 12. P. 71. https://doi.org/10.1016/0021-9614(80)90118-4
Chirico R.D., Westrum E.F. // J. Chem. Thermodyn. 1980. V. 12. P. 311. https://doi.org/10.1016/0021-9614(80)90143-3
Дополнительные материалы
- скачать ESM.docx
- Дополнительные материалы
Инструменты
Журнал неорганической химии