Журнал неорганической химии, 2020, T. 65, № 11, стр. 1469-1496
Краун-порфиринаты металлов: получение, оптические свойства и применение (обзор)
А. Ю. Цивадзе a, *, А. Ю. Чернядьев a, **
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский пр-т, 31, корп. 4, Россия
* E-mail: tsiv@phyche.ac.ru
** E-mail: chernyadyev@mail.ru
Поступила в редакцию 27.05.2020
После доработки 07.07.2020
Принята к публикации 10.07.2020
Аннотация
Рассмотрены способы получения краун-замещенных порфиринатов металлов, особенности строения данных соединений и особенности влияния катионов металлов на люминесцентные и другие фотофизические свойства краун-замещенных порфиринатов металлов. Проведен анализ термохромных, флуоресцентных, фосфоресцентных свойств краун-порфиринатов металлов, рассмотрены возможности применения данных соединений в качестве люминесцентных сенсоров температуры, сенсоров на катионы щелочных металлов, термохромных материалов, активных компонентов фотовольтаических преобразователей световой энергии.
ВВЕДЕНИЕ
РАЗДЕЛ I. Синтез и люминесцентные свойства краун-порфиринатов металлов
РАЗДЕЛ II. Надмолекулярные структуры на основе краун-порфирината алюминия и их оптические свойства
РАЗДЕЛ III. Люминесцентные сенсоры температуры на основе краун-порфиринатов переходных металлов
РАЗДЕЛ IV. Композиционные фотовольтаические преобразователи с применением краун-порфиринатов платиновых металлов в активном слое
ЗАКЛЮЧЕНИЕ
ВВЕДЕНИЕ
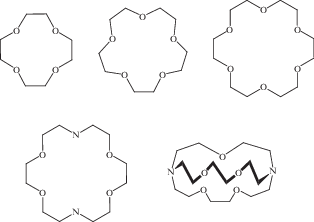
Краун-эфиры, как известно, являются одним из классов органических соединений, которые эффективно связывают катионы щелочных, щелочноземельных металлов [1–3] и лантанидов [4]. Краун-эфирные фрагменты также представляют интерес как структурные блоки сложных органических молекул, которые могут быть связаны в супрамолекулярные ансамбли различного строения при взаимодействии с катионами щелочных и щелочноземельных металлов [5–8]. К настоящему времени краун-эфиры (рис. 1) нашли широкое применение как агенты межфазного переноса нерастворимых в органических средах солей, например перманганата калия, который благодаря краун-эфирам можно использовать как окислитель и в органических неполярных растворителях [9]. Активно развиваются и такие области применения краун-эфиров, как селективная экстракция лантанидов из сложных по химическому составу водных растворов [4], а также разделение изотопов металлов, что достигается за счет варьирования заместителей при атомах углерода краун-эфирных колец, обеспечивающих устойчивость определенной конформации краун-эфира, которая способствует селективному связыванию определенного изотопа металла вопреки принципу Педерсена – простого размерного соответствия ионного радиуса катиона металла и размера полости краун-эфира [7, 10–12]. Определенный интерес представляет и замещение атомов кислорода в краун-эфирах на атомы азота и серы, что может обеспечивать связывание катионов переходных металлов молекулами краун-эфиров [13–16], благодаря этому такие краун-эфиры нашли широкое применение, и наука о данных соединениях развивается и в настоящее время. Примечателен тот факт, что в металлоорганической химии получило развитие такое направление, как синтез антикраунов – металлоорганических циклических соединений ртути, которые, в отличие от класcических краунов, связывают не катионы металлов, а галогенид-ионы и другие анионы [17–19].
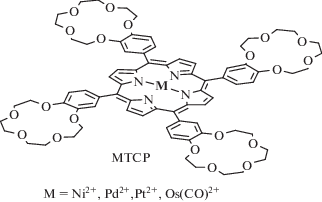
В то же время в супрамолекулярной химии активно развивается направление, связанное с модификацией краун-эфирными фрагментами циклических тетрапиррольных молекул – порфиринов и фталоцианинов [7, 8, 20]. Такая модификация дает возможность конструирования сложных ансамблей краун-порфиринов (рис. 2–4) и краун-фталоцианинов (рис. 5), которые образуются при взаимодействии этих тетрапиррольных соединений с катионами щелочных и других металлов, на основе которых можно создавать катализаторы четырехэлектронного восстановления кислорода [21, 22], новые электронно-оптические устройства (фотовольтаические преобразователи, электролюминесцентные излучатели), а также материалы, обладающие фоторефрактивными [23] и нелинейно-оптическими свойствами [24].
Рис. 2.
Краун-порфиринаты металлов с полиэфирными циклами при пиррольных циклах порфиринового кольца.
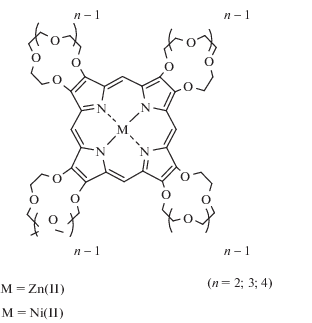
Рис. 4.
Аза-краун-порфиринат цинка с кофациальным расположением краун-эфирного и порфиринового фрагментов.
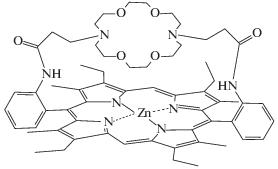
Рис. 5.
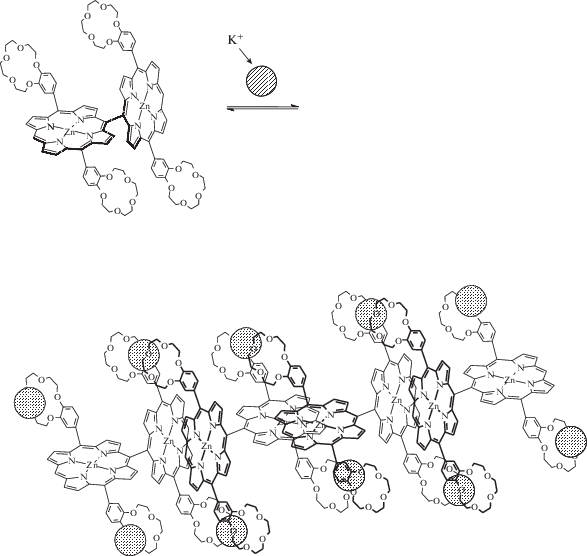
Супрамолекулярный димер, образующийся при взаимодействии тетра(15-краун-5)фталоцианината меди(II) с катионами K+ .
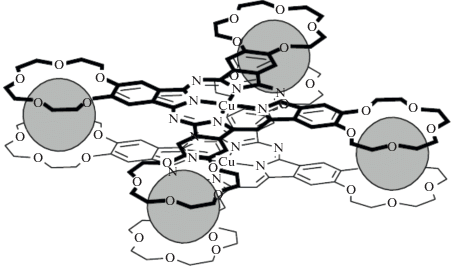
Другое важное свойство краун-замещенных порфиринов и фталоцианинов заключается в возможности создания оптических сенсоров на определенные катионы металлов, что достигается, например, при связывании катионов калия с тетра(15-краун-5)фталоцианинами с образованием супрамолекулярных кофациальных димеров (рис. 5), в которых тетрапиррольные циклы при сближении друг с другом на расстояние ~4 Å изменяют свои оптические свойства – наблюдается смещение полос поголощения в ЭСП для краун-фталоцианинатов металлов [7]. Краун-порфирины также обладают сенсорными свойствами на катионы щелочных металлов по изменению светопоглощающих и люминесцентных свойств молекул-рецепторов, однако синтез таких соединений более сложный и осуществляется в несколько стадий [25–32], за исключением тетра-бензо-краун-порфиринов, которые можно получить сравнительно легко – в одну стадию органического синтеза с довольно простой очисткой искомого соединения в некоторых случаях [33].
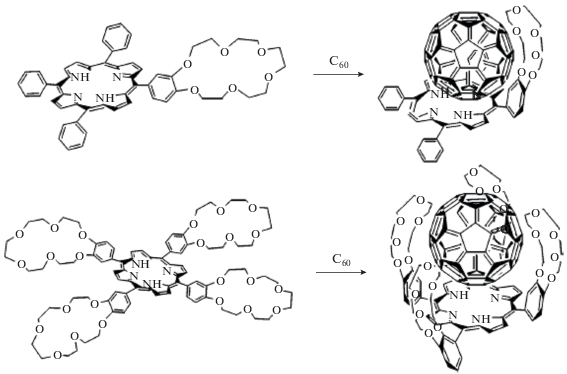
Оказалось, что краун-замещенные порфирины могут связывать не только катионы металлов, но и нейтральные молекулы, такие как фуллерены (рис. 6) [20]. Добавление катионов калия в раствор таких супрамолекулярных диад (рис. 7) может приводить к изменению сильного поляризующего влияния фуллерена на молекулу краун-порфирина (а) на слабое (б), что подтверждается кинетическими кривыми затухания флуоресценции [20]. Время жизни флуоресценции краун-порфирина 1 значительно уменьшается при сильном поляризующем влиянии фуллерена на порфириновый цикл (кривая ii), возрастает при связывании катиона калия краун-эфирным фрагментом (кривая iii). При добавлении 18-краун-6 в раствор время жизни снова уменьшается, что свидетельствует об увеличении поляризующего влияния фуллерена на порфириновый цикл соединения 1 (рис. 8). Данный пример демонстрирует возможность управления работой выхода электрона молекулы-донора при управляемом поляризующем влиянии молекулы-акцептора методами супрамолекулярной химии, это может быть важно для настройки фотофизических характеристик супрамолекулярной диады и последующего использования в активных слоях современных солнечных батарей. Однако управлять оптическими и фотофизическими свойствами краун-порфиринов можно не только методами супрамолекулярной химии, но и варьированием металла-комплексообразователя, связанного с порфириновым циклом. Связывание катиона металла с порфириновым циклом, как известно, приводит к повышению симметрии молекулы порфирина, а значит, и к изменению оптических свойств макроцикла [34].
Рис. 7.
Управление супрамолекулярной дриадой за счет связывания катионов калия или их удаления при добавлении в раствор 18-краун-6.
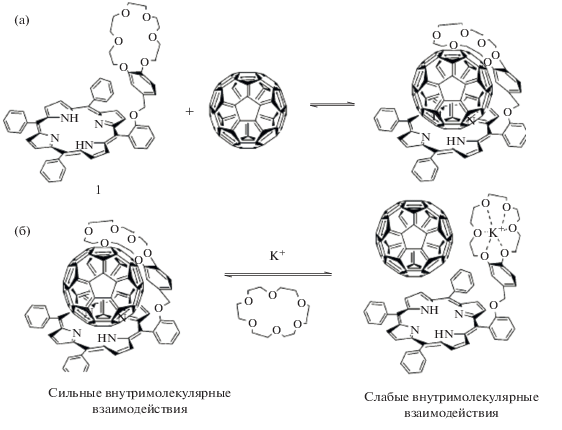
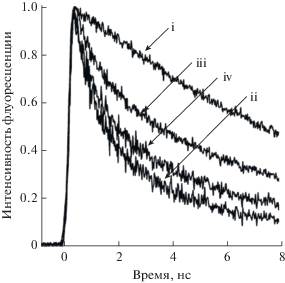
Рис. 8.
Кинетика затухания флуоресценции краун-порфирина (i) 1, (ii) 1 (0.1 мM) + C60 (0.1 мM), (iii) 1 (0.1 мM) + C60 (0.1 мM) + K+ (1.0 мM), (iv) 1 (0.1 мM) + C60 (0.1 мM) + K+ (1.0 мM) + 18-краун-6 (>10.0 мM).
В данном обзоре мы сосредоточили внимание на том, как меняются оптические свойства (люминесцентные, светопоглощающие) наиболее синтетически доступных тетра-краун-замещенных порфиринов при связывании катионов металлов различной химической природы (s-, p- и d-элементов) с тетрапиррольным циклом, поскольку варьирование катионов металлов в полости краун-порфиринов приводит к появлению новых интересных свойств краун-порфиринатов металлов, на основе которых могут быть созданы новые термохромные материалы, люминесцентные сенсоры на катионы щелочных металлов, люминесцентные сенсоры температуры, а также фотовольтаические преобразователи послойной структуры или более современные преобразователи, сконструированные по принципу обьемного гетероперехода [35].
РАЗДЕЛ I. СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА КРАУН-ПОРФИРИНАТОВ МЕТАЛЛОВ
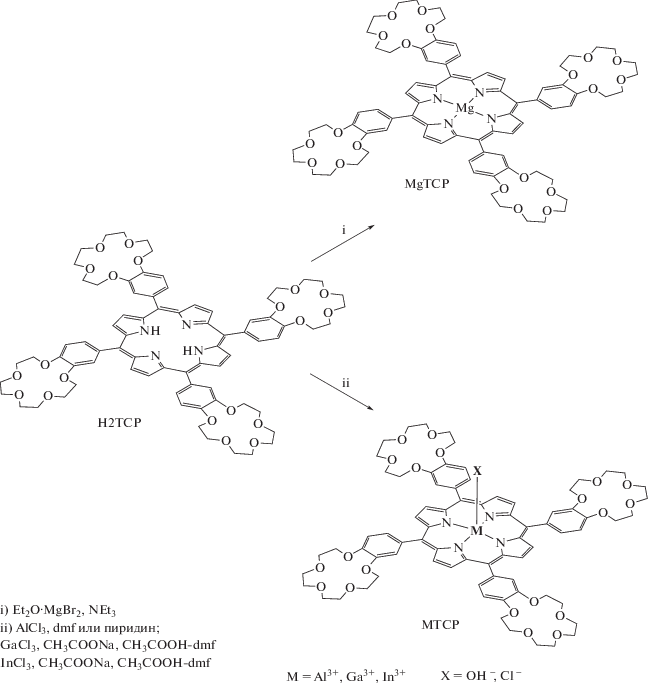
Как было отмечено выше, природа катиона металла, связанного с тетрапиррольным циклом молекулы краун-замещенных порфиринов, может оказывать значительное влияние на характер светопоглощающих и особенно люминесцентных свойств данных соединений, на которых основано широкое применение порфиринатов металлов. В связи с этим важное значение имеет разработка методов синтеза, позволяющих получать краун-порфиринаты различных по химической природе металлов с высоким выходом и при использовании относительно простых методов очистки продукта синтеза. Сравнительно легко доступны по сравнению с другими краун-порфиринами мезо-тетра(бензо-15-краун-5)порфиринаты металлов, так как исходное свободное основание порфирина можно получить известными и хорошо себя зарекомендовавшими методами синтеза мезо-тетраарил-замещенных порфиринов из пиррола и ароматического альдегида того или иного строения в кипящих карбоновых кислотах [36] или более сложным методом в присутствии кислоты Льюиса с получением сначала порфириногена и последующим его окислением в порфирин [37]. Это позволяет увеличить выход порфирина в два и более раз по сравнению с первым методом. Для синтеза мезо-тетра(бензо-15-краун-5)порфина нами была предложена методика, позволяющая выделить данное соединение из реакционной смеси без использования трудоемкой колоночной хроматографии, применявшейся ранее [21]. Вместо нее удалось применить метод селективного осаждения этанолом мезо-тетра(бензо-15-краун-5)порфина из многокомпонентной реакционной смеси [33]. Однако данным методом не удалось селективно осадить аналогичный мезо-тетра(бензо-12-краун-4)порфин из реакционной смеси, по-видимому, в силу сравнительно высокой растворимости данного соединения в этаноле и его гомолoгах – метаноле и пропаноле. Мезо-тетра(бензо-12-краун-4)порфин можно получить методом Адлера [36] или методом Линдсея [37] c “классическим” хроматографическим выделением краун-порфирина [38, 39].
Краун-порфиринаты металлов непереходного ряда можно получить при взаимодействии свободного основания порфирина с галогенидами соответствующих металлов [40–47] (схема 1 ). При этом краун-порфиринаты галлия(III) и индия(III) можно получить даже из хлоридных комплексов данных металлов, имеющих гидратную оболочку [40]. В данном случае гидратная оболочка не препятствует прохождению реакции комплексообразования с порфириновым циклом в силу относительно слабого связывания молекул воды катионом металла. Однако при применении хлоридов магния(II) и алюминия(III) гидратная оболочка препятствует прохождению реакции комплексообразования с порфириновым циклом ввиду прочного связывания молекул воды катионом металла [41, 42]. Для получения краун-порфиринатов алюминия(III) могут использоваться такие соединения, как триметилалюминий [43, 44] и безводный хлорид алюминия, однако последний реагирует с порфириновым циклом лишь в стеклующейся смеси с диметилформамидом (ДМФА) или пиридином при высокой температуре (схема 1 ), достаточной для разрыва связей алюминий–хлор [45–47]. Триметилалюминий легко реагирует со свободным основанием порфирина уже при комнатной температуре ввиду легкого разрыва связей алюминий–углерод при координации порфиринового цикла катионом алюминия(III) и быстрого удаления метана в виде газа из координационной сферы катиона Al3+ [43, 44]. Для получения краун-порфирината магния(II) из множества комплексов данного металла наиболее подходящим исходным соединением оказался бромид магния, который получают окислением металлического магния бромом в диэтиловом эфире [41, 42]. Такой комплекс легко реагирует со свободным основанием порфирина, поскольку содержит слабосвязанную молекулу диэтилового эфира с катионом металла, легко уходящую из координационной сферы катиона Mg2+ при взаимодействии с атомами азота порфиринового цикла (схема 1 ). Данный метод, разработанный Линдсеем и Вудфордом [42], позволяет получать порфиринаты магния с количественным выходом при комнатной температуре или незначительном нагревании (до 40°С).
Схема 1 . Синтез краун-порфиринатов металлов непереходного ряда.
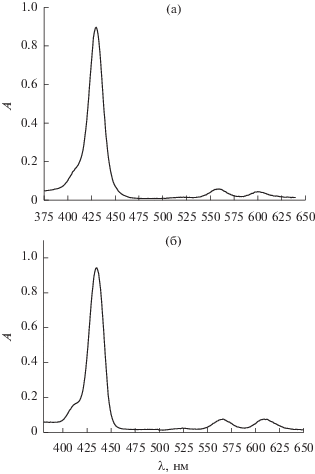
Свободный мезо-тетра(бензо-15-краун-5)порфин, мезо-тетра(бензо-12-краун-4)порфин и соответствующие порфиринаты магния(II) и алюминия(III) обладают довольно высоким квантовым выходом флуоресценции (табл. 1, 2) в растворе ДМФА, которая наблюдается в красной области спектра с основным максимумом эмиссии при ~652 нм для свободных оснований краун-порфиринов (рис. 9) и смещена в синюю область для порфиринатов магния(II) и алюминия(III) [48, 40 ]. Можно отметить, что квантовый выход флуоресценции мезо-тетра(бензо-15-краун-5)порфина и соответствующих порфиринатов алюминия(III) и галлия(III) в растворе ДМФА характеризуется более высоким значением (табл. 1) по сравнению с аналогичной серией соединений мезо-тетра(бензо-12-краун-4)порфина [40, 48] (табл. 2). Это, вероятно, связано с тем, что утяжеление краун-эфирного фрагмента при фенильном цикле замедляет торсионные колебания бензо-краун-фрагментов при порфириновом цикле, способствуя тем самым излучательной релаксации возбужденного синглетного состояния порфириновой молекулы. Свободный мезо-тетра(бензо-15-краун-5)порфин и соответствующие порфиринаты алюминия(III), галлия(III) и индия(III) не проявляют при комнатной температуре (298 K) фосфоресцентных свойств даже в условиях защиты молекул порфиринов от контакта с триплетным молекулярным кислородом [40]. Спектры поглощения краун-порфиринатов металлов непереходного ряда включают характерную для порфиринов полосу Соре в синей области спектра и две Q-полосы поглощения в зеленой и красной областях [34] (рис. 10).
Таблица 1.
Фотофизические характеристики 15-краун-5-замещенных порфиринов в растворе ДМФА при температуре 298 K [40]
| Соединение | ЭСП, λmax, нм | Спектр флуоресценции, λmax, нм | Квантовый выход флуоресценции, % |
|---|---|---|---|
| H2TCP | 427, 519, 556, 595, 645 | 657, 724 | 14.8 |
| Al(OH)TCP | 431, 560, 603 | 608, 661 | 13.1 |
| Ga(OH)TCP | 430, 558, 601 | 611, 664 | 8.2 |
| InClTCP | 435, 565, 609 | 616, 670 | 3.4 |
Таблица 2.
Фотофизические характеристики 12-краун-4-замещенных порфиринов в растворе ДМФА при температуре 298 K [48]
| Соединение | ЭСП, λmax, нм | Спектр флуоресценции, λmax, нм | Квантовый выход флуоресценции, % |
|---|---|---|---|
| MgP | 431, 566, 608 | 624, 672 | 15.8 |
| H2P | 424, 517, 554, 593, 643 | 657, 723 | 12.2 |
| Al(OH)P | 427, 561, 599 | 601, 656 | 10.2 |
| Ga(OH)P | 428, 557, 597 | 608, 661 | 6.1 |
Рис. 9.
Спектры флуоресценции растворов свободного мезо-тетра(бензо-15-краун-5)порфина и соответствующих порфиринатов магния(II) и алюминия(III) в ДМФА при возбуждении светом с длиной волны 430 нм.
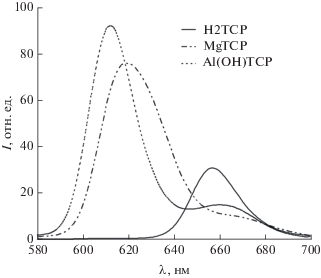
Рис. 10.
Спектры поглощения 15-краун-5-замещенных порфиринатов галлия(III) (а) и индия(III) (б) в ДМФА.
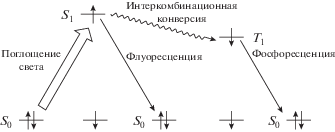
Эффект “тяжелого атома” для данного ряда соединений проявляется уменьшением квантового выхода флуоресценции с увеличением заряда ядра катиона-комплексообразователя, приводящим к деградации возбужденного синглетного состояния за счет интеркомбинационной конверсии, снижающей вероятность конкурирующего процесса флуоресцентного излучения (схема 2 ). Квантовый выход флуоресценции соответственно снижается в ряду соединений Al-TCP–Ga-TCP–In-TCP [40]. Краун-порфиринаты легких металлов непереходного ряда могут представлять интерес как люминесцентные сенсоры на катионы металлов, термохромные материалы (подробнее см. в разделе II) и в качестве люминесцирующих агентов межфазного переноса катионов металлов [48].
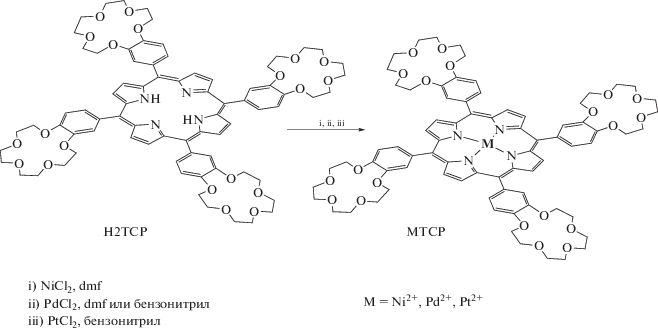
Схема 2 . Синтез краун-порфиринатов платиновых металлов.
Хлоридные комплексы платиновых металлов VIII группы (Ni2+, Pd2+, Pt2+) реагируют со свободными основаниями краун-порфиринов, однако при наличии легко уходящих лигандов в координационной сфере катиона металла, таких как бензонитрил, диметилформамид [33, 49]. Краун-порфиринаты никеля(II) и палладия(II) можно получить в относительно мягких условиях – при нагревании в ДМФА [39], в то время как порфиринат платины(II) – лишь в высококипящем бензонитриле (188°С) исходя из хлорида платины(II) и свободного основания краун-порфирина (схема 2 ), что, по-видимому, связано с более высоким значением энергии активации реакции комплексообразования краун-порфирина с хлоридом двухвалентной платины по сравнению с энергией активации аналогичных реакций для хлоридов палладия(II) и никеля(II) [33, 39, 49].
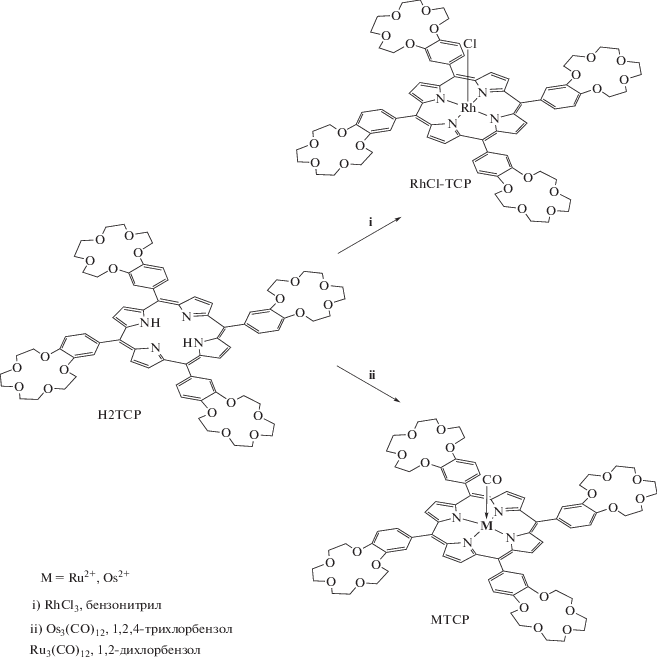
Краун-порфиринат родия(III) можно получить исходя из хлорида соответствующего металла (RhCl3) и свободного основания порфирина в бензонитриле или диметилформамиде (схема 3 ). Однако в ДМФА реакция осложняется образованием биядерного SAT (sitting at top) комплекса родия(I) с координированными молекулами порфирина [50] наряду с образованием основного продукта – краун-порфирината родия(III). В кипящем бензонитриле SAT-комплекс родия(I) c порфирином не образуется, так как бензонитрил не содержит в составе молекулы группы, обладающие сильными восстановительными свойствами, в отличие от ДМФА, содержащего альдегидную группу CH=O. В реакции RhCl3 с краун-порфирином образуется только порфиринат родия(III), содержащий в качестве ацидолиганда хлорид-ион [51]. Краун-порфиринаты других металлов VII группы – кобальта и иридия, вероятно, можно получить методами, аналогичными тем, что ранее применялись для синтеза других тетра-арил-замещенных порфиринатов данных металлов [52, 53]. Можно отметить, что порфиринаты кобальта(II) довольно легко можно получить из хлорида кобальта(II) и свободного основания порфирина в метаноле или смеси растворителей хлороформ-метанол, которая применялась, например, для синтеза краун-порфирината цинка(II) [39]. Методы синтеза порфиринатов иридия, позволяющие получать целевой продукт с высоким выходом, к настоящему времени не разработаны. Интересный подход для синтеза данных соединений был предложен в работе [52], где в качестве исходного комплекса иридия была выбрана гекахлориридиевая кислота, а в качестве растворителя – фенол, который в процессе восстановления иридия(IV) генерирует комплекс иридия(III), способный вступать в реакцию со свободным основанием порфирина. Однако происходит и более глубокое восстановление до иридия(I), что приводит к образованию SAT-комплекса с молекулами порфирина, аналогичного по строению уже упомянутому SAT-комплексу родия(I) с молекулами порфирина в качестве нейтральных лигандов [50].
Схема 3 . Синтез краун-порфиринатов родия(III), рутения(II) и осмия(II).
Краун-порфиринаты платиновых металлов VI группы (рутений, осмий) можно получать из оксидов данных металлов [54], гексахлоросматов и гексахлоррутенатов щелочных металов [55]. Однако получить с высоким выходом порфиринаты рутения(II) и осмия(II) удается только исходя из карбонильных комплексов данных металлов [56, 57]. Удобно применять карбонильные комплексы ноль-валентных рутения (Ru3(CO)12) и осмия (Os3(CO)12) в силу их широкой доступности по сравнению с другими карбонильными кластерами этих металлов. Реакции свободного основания порфирина с данными трехъядерными комплексами позволяют получить с высоким выходом порфиринаты двухвалентных рутения и осмия (схема 3 ). Краун-порфиринаты железа, вероятно, тоже могут быть получены с высоким выходом при использовании карбонильных соединений железа по аналогии с синтезом других тетра-арил-замещенных порфиринатов железа [50].
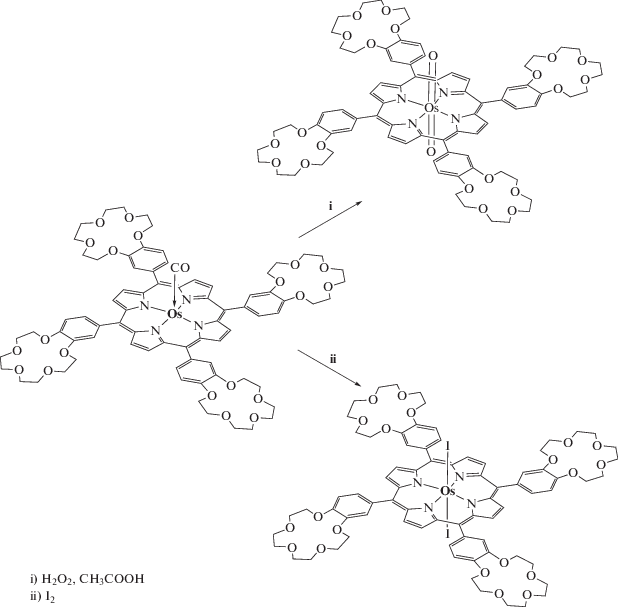
Краун-порфиринаты осмия(II), платины(II) и палладия(II) можно окислить в устойчивые порфиринаты осмия(IV), осмия(VI), платины(IV) и палладия(IV) соответственно. Краун-порфиринат осмия(IV) образуется при окислении порфирината осмия(II) молекулярным иодом c количественным выходом [58], краун-порфиринат осмия(VI) можно получить с высоким выходом в реакции порфирината осмия(II) с пероксидом водорода (схема 4 ) в уксусной кислоте [57].
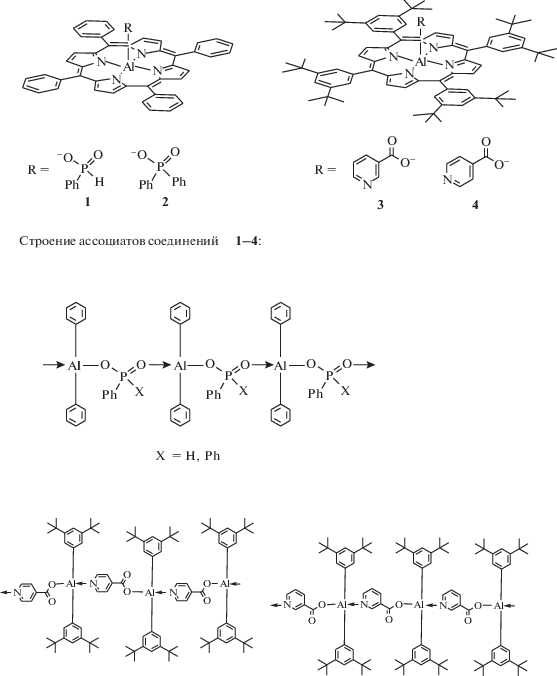
Схема 4 . Реакции окисления краун-порфирината осмия(II).
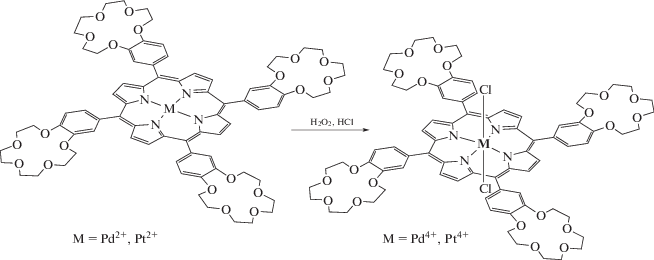
Окисление краун-порфиринатов палладия(II) и платины(II) по катиону металла происходит в более жестких условиях при взаимодействии с сильным окислителем – перекисью водорода в соляной кислоте [59]. Такие реакции (схема 5 ) позволяют получить порфиринаты палладия(IV) и платины(IV) с приемлемым, но далеким от количественного выходом по причине побочного образования катион-радикалов порфиринатов палладия и платины, осмоления части исходного продукта через реакции катион-радикалов порфиринового кольца, а также по причине возможного частичного разрушения краун-эфирных фрагментов [59]. Представленные выше краун-порфиринаты платиновых металлов, в отличие от порфиринатов легких металлов непереходного ряда (Mg2+, Al3+, Ga3+), обладают слабым флуоресцентным свечением и довольно сильной фосфоресценцией (схема 6 , рис. 11, 12) при комнатной температуре в дегазированных растворах и даже в растворах, контактирующих с кислородом воздуха, однако интенсивность фосфоресценции в последнем случае значительно снижается за счет тушения молекулами кислорода [60].
Схема 5 . Реакции окисления краун-порфиринатов палладия(II) и платины(II).
Схема 6 . Электронные переходы поглощения, интеркомбинационной конверсии, флуоресценции и фосфоресценции в молекулах краун-порфиринатов металлов.
Рис. 11.
Скорректированный на чувствительность прибора спектр фосфоресценции Pt(II)TCP в полистироле при 77 K (штриховая линия) и при 298 K (сплошная линия), длина волны возбуждающего света – 530 нм.
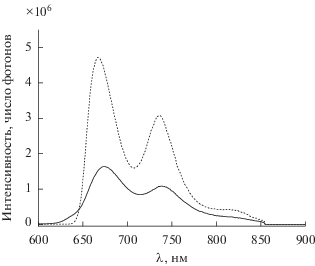
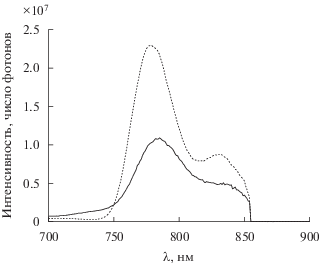
Рис. 12.
Скорректированный на чувствительность прибора спектр фосфоресценции Os(CO)TCP в полистироле при 77 K (штриховая линия) и 298 K (сплошная линия), длина волны возбуждающего света 584 нм.
Интенсивность и времена жизни фосфоресценции краун-порфиринатов платиновых металлов в пленке полистирола как при комнатной температуре (298 K), так и при температуре жидкого азота (77 K) зависят от величины эффекта “тяжелого атома” катиона металла, а также от наличия неспаренных электронов у катиона металла, связанного с порфириновым циклом, и, кроме того, от энергетического положения d–d-переходов поглощения катиона металла [39]. Эффект “тяжелого атома” [61] нивелирует флуоресценцию и обеспечивает фосфоресцентное свечение (рис. 11, 12) за счет активации каналов синглет-триплетной интеркомбинационной конверсии и триплет-синглетных излучательных переходов (схема 6 ) у краун-порфиринатов платины(II) и осмия(II), осмия(IV), осмия(VI). При этом кинетика затухания фосфоресценции данных соединений характеризуется довольно короткими временами жизни опять же в силу проявления значительного эффекта “тяжелого атома” (подробнее см. в разделе III).
Меньший по величине эффект “тяжелого атома” катионов Pd2+, Pd4+, Rh3+ у соответствующих краун-порфиринатов металлов проявляется в том, что интенсивность флуоресценции и фосфоресценции у данных соединений имеет сопоставимые значения и различается не более чем в 20 раз даже в условиях глубокой заморозки жидким азотом (77 K), что позволяет рассматривать краун-порфиринаты палладия(II), палладия(IV) и родия(III) как перспективные люминесцентные сенсоры температуры (раздел III). Времена жизни фосфоресценции у краун-порфиринатов палладия(II), палладия(IV) и родия(III) [39] характеризуются значительно более высокими значениями по сравнению с краун-порфиринатами платины и осмия (табл. 1 в разделе III), что также связано с более слабым эффектом “тяжелого атома” у катионов Pd2+, Pd4+, Rh3+ по сравнению с тяжелыми катионами Pt2+, Pt4+, Os2+, Os4+, Os6+, которые характеризуются сильным электричеcким полем ядра, которое значительно увеличивает вероятность запрещенных по спину электронных переходов порфиринового кольца [61, 62] (раздел III). Помимо эффекта “тяжелого атома”, производимого катионом металла, на проявление люминесцентных свойств порфиринатами металлов могут влиять и другие свойства катионов металлов. Например, парамагнетизм катиона Os4+ способствует большему изменению времени жизни фосфоресценции краун-порфирината Os(I2)TCP при изменении температуры, чем это наблюдается у диамагнитных краун-порфиринатов осмия(II) и осмия(VI) [58]. У краун-порфирината никеля(II) происходит наложение d–d-переходов поглощения на Q-полосу поглощения порфиринового цикла, благодаря чему данный комплекс не проявляет люминесцентных свойств (отсутствует флуоресцентное и фосфоресцентное свечение [39]). Данное свойство, однако, имеет свои плюсы для практического применения. Краун-порфиринат никеля(II) обладает высокой активностью в процессах фотогенерированного разделения зарядов в активных слоях фотовольтаических преобразователей послойного строения, выполненных по принципу обьемного гетероперехода (раздел IV), поскольку энергия фото- и электровозбуждения в солнечных батареях не расходуется на побочные процессы фото- и электролюминесценции [62] порфирината металла.
РАЗДЕЛ II. НАДМОЛЕКУЛЯРНЫЕ СТРУКТУРЫ НА ОСНОВЕ КРАУН-ПОРФИРИНАТА АЛЮМИНИЯ И ИХ ОПТИЧЕСКИЕ СВОЙСТВА
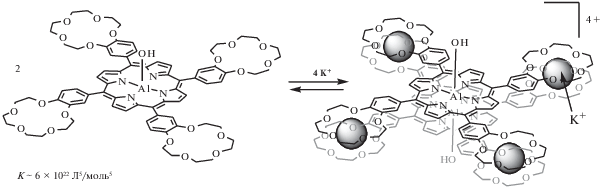
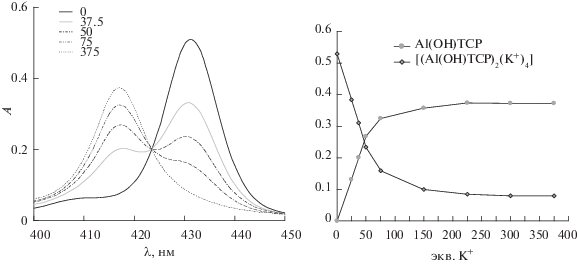
Как было отмечено в предыдущем разделе, краун-порфиринаты алюминия(III) и магния(II) обладают довольно высоким квантовым выходом флуоресценции в силу того, что катионы таких легких металлов не проявляют выраженного эффекта “тяжелого атома” [61, 63], а также ограничивают колебания порфиринового цикла за счет комплексообразования с его атомами азота [64, 34 ]. 15-Краун-5-замещенные порфиринаты магния(II) и алюминия(III), которые удается растворить в воде в присутствии небольшой добавки ДМФА, проявляют сенсорные свойства на катионы калия в воде по изменению ЭСП и люминесцентных свойств молекулы-рецептора [41]. Особенно интересным для данного применения оказался 15-краун-5-замещенный порфиринат алюминия(III) (схема 7 ), обладающий высокой устойчивостью во всем диапазоне pH (от сильно кислой среды до сильно щелочной), в то время как 15-краун-5-замещенный порфиринат магния(II) устойчив в щелочной среде и теряет катион магния при pH < 7 [41]. Концентрация катионов калия в растворе может быть определена с помощью 15-краун-5-порфиринатов алюминия(III) и магния(II) по соотношению интенсивностей полос поглощения молекулы-рецептора и супрамолекулярного ассоциата в ЭСП (рис. 13).
Cхема 7. Реакция образования супрамолекулярного димера на основе Al(OH)TCP и катионов калия.
Рис. 13.
Изменения ЭСП при взаимодействии Al(OH)TCP (С = 1.4 × 10–6 моль/л) c KClO4 в растворе H2O/ДМФА (100 : : 1 по объему). Вверху указано количество мольных эквивалентов K+ по отношению к Al(OH)TCP.
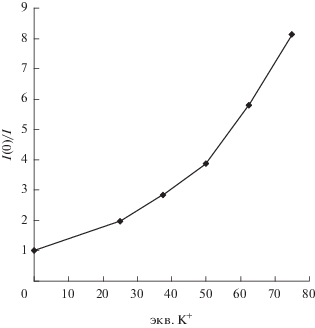
Возможно также определение концентрации катионов калия по тушению флуоресценции (рис. 14) 15-краун-5-порфирината алюминия(III) [41], которое состоит из вклада как динамического тушения флуоресценции катионами калия в растворе, так и статического тушения, обусловленного образованием супрамолекулярного димера с катионами калия согласно нелинейной зависимости I0/I в координатах Штерна–Фольмера [60, 65] (рис. 15). Возможна оценка концентрации катионов калия и по росту полосы эмиссии супрамолекулярного ассоциата, однако его полоса эмиссии (рис. 14) накладывается на плечо в спектре люминесценции исходного краун-порфирината алюминия(III) [41].
Рис. 14.
Изменения спектров флуоресценции при добавлении KClO4 к Al(OH)TCP (С = 0.7 × 10–7 моль/л) в растворе вода/ДМФА (100 : 1 по объему) при возбуждении светом с длиной волны 430 нм. Вверху указано количество мольных эквивалентов K+ по отношению к Al(OH)TCP.
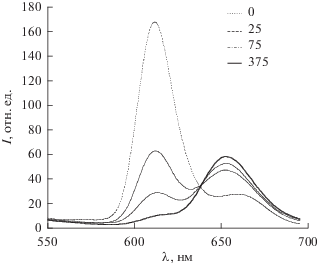
Рис. 15.
Зависимость тушения флуоресценции (переход эмиссии с максимумом при 612 нм) Al(OH)TCP (С = 0.7 × 10–7 моль/л) в растворе вода/ДМФА (100 : : 1 по объему) от концентрации катионов калия в координатах Штерна–Фольмера при длине волны возбуждающего света 430 нм.
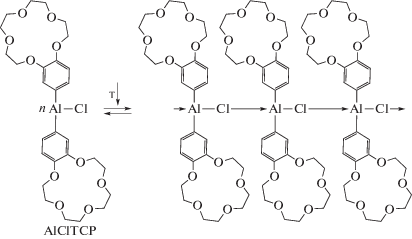
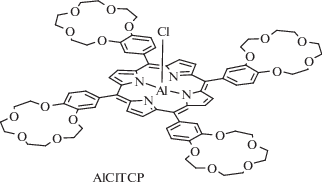
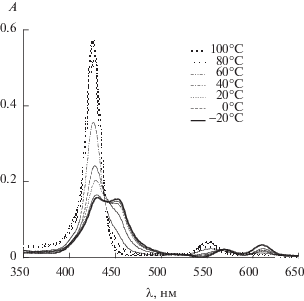
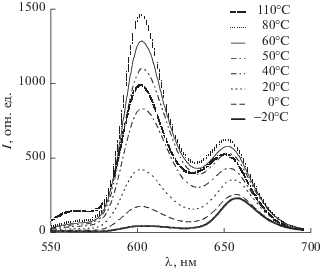
Интересное свойство 15-краун-5-порфирината алюминия(III), содержащего хлорид-ион в качестве ацидолиганда (рис. 16), было обнаружено в растворе толуола. При температуре 20°С раствор был зеленым, а при нагревании до 70°С и выше становился фиолетовым [47]. После охлаждения до 20°С зеленая окраска раствора возращалась и менялась на фиолетовую при повторном нагревании и т.д. Анализ обнаруженного обратимого термохромного поведения 15-краун-5-порфирината алюминия(III) в толуоле методами ЭСП, люминесцентной спектроскопии и динамического рассеяния света показал, что молекулы данного соединения собираются в ассоциаты (схема 8 ) при комнатной температуре, а при нагревании ассоциаты распадаются на отдельные молекулы 15-краун-5-порфирината алюминия(III) [47]. Изменения цвета, согласно спектрам люминесценции (рис. 17) и ЭСП (рис. 6), обусловлены образованием координационного полимера при образовании координационной связи между хлорид-ионом и катионом Al3+ разных молекул краун-порфирината алюминия (схема 8 , рис. 18). При этом в ЭСП наблюдается характерное для ассоциатов порфиринов расщепление полосы Соре и красный сдвиг Q-полос (рис. 18), спектр люминесценции также сильно изменяется – исчезает полоса эмиссии индивидуальных молекул порфирината алюминия и появляется смещенная в красную область полоса эмиссии ассоциатов низкой интенсивности [47] (рис. 5). Образование крупных ассоциатов было подтверждено также и методом динамического рассеяния света. Данные измерений этим методом в приближении сферической формы движущихся частиц позволили оценить их диаметр, который составил ~1000 нм при 20°С, т.е. коллоидная частица в растворе включает в себя большое число молекул тетра-бензо-15-краун-5-порфирината алюминия, для которых диаметр молекулы составляет ~2.5 нм в конформации плоского диска [47].
Схема 8 . Механизм ассоциации молекул AlCl-TCP в растворе толуола.
Рис. 17.
Температурная зависимость изменения спектров флуоресценции раствора AlClTCP в толуоле (СAlClTCP ~ 1 × 10–6 моль/л).
Аналогичный характер изменения цвета, спектров люминесценции и ЭСП наблюдался у фосфорилзамещенных порфиринатов алюминия [66] и у порфиринатов алюминия, содержащих анион никотиновой или изоникотиновой кислоты [67] в качестве ацидолиганда (рис. 19), однако изменение цвета авторы данных работ наблюдали не при изменении температуры раствора, а при варьировании природы растворителя [66, 67]. Данные работ [66, 67] дополнительно подтверждают предложенный нами механизм ассоциации 15-краун-5-порфирината алюминия(III) в толуоле (схема 8 ), которым обьясняются термохромные свойства этого комплекса алюминия [47]. Интересно отметить, что 15-краун-5-порфиринаты галлия(III) и индия(III) [40] (схема 1 , раздел I) не проявляют термохромных свойств в растворе толуола, что может быть связано с малой прочностью межмолекулярных координационных связей для этих соединений. 15-Краун-5-порфиринат алюминия(III), содержащий гидроксид-анион в качестве ацидолиганда, проявляет лишь слабый термохромный эффект в растворе толуола из-за сравнительно малой растворимости в нем.
РАЗДЕЛ III. ЛЮМИНЕСЦЕНТНЫЕ СЕНСОРЫ ТЕМПЕРАТУРЫ НА ОСНОВЕ КРАУН-ПОРФИРИНАТОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ
Люминесцентные сенсоры температуры представляют интерес как датчики дистанционного бесконтактного анализа температуры [68]. Их принцип действия основан на возбуждении УФ- или видимым светом люминофора, в качестве которого могут применяться соли лантанидов, селениды кадмия и свинца, комплексы переходных металлов с органическими лигандами [68]. Данные люминесцирующие соединения могут изменять интенсивность фосфоресцентного свечения при изменении температуры за счет конкуренции излучательных переходов фосфоресценции и безызлучательных переходов дезактивации возбужденных состояний молекулярных систем электронов [69], а также изменения заселенности электронных уровней катионов лантанидов [70]. Однако для измерения температуры с помощью известных фосфоресцирующих комплексов переходных металлов интенсивность их фосфоресцентного свечения необходимо непрерывно соотносить с интенсивностью возбуждающего света, которая может колебаться в широких пределах как при возбуждении естественным солнечным светом, так и при возбуждении лампами и светодиодами [69].
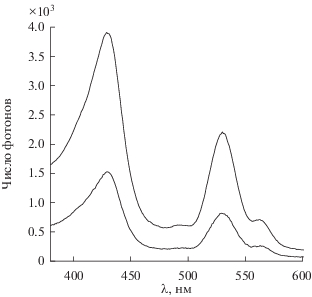
Нами было установлено, что краун-порфиринаты платиновых металлов (палладия(IV) [71] и родия(III) [51]) обладают высокой чувствительностью интенсивности фосфоресцентного свечения к температуре в диапазоне температур 77–358 K, но одновременно обладают и флуоресцентными переходами эмиссии, интенсивность которых мало чувствительна к температуре и лишь незначительно уменьшается при нагревании от 77 до 358 K (схема 6 , рис. 20a, 20б). При использовании данных соединений в качестве фосфоресцентных сенсоров температуры не нужно соотносить интенсивность фосфоресцентного свечения с интенсивностью возбуждающего света для правильного определения температуры, достаточно оценить соотношение интенсивности переходов флуоресценции и фосфоресценции, которое остается постоянным при изменяющейся интенсивности возбуждающего света (рис. 20a, 20б). Помимо широкого диапазона измеряемых температур с помощью краун-порфиринатов палладия(IV) и родия(III) можно отметить значительную полуширину линий эмиссии и пологий характер изменения спектров флуоресценции и фосфоресценции в области максимума [71], что может позволить использовать упрощенные конструкции детекторов для анализа интенсивности в максимумах эмиссии по сравнению с конструкциями детекторов для люминесцентных сенсоров на основе лантанидов, имеющих довольно острые пики переходов эмиссии и требующих более точной настройки детектора на определенную длину волны регистрируемого сигнала [70]. Также преимуществом перед соединениями лантанидов является и возможность возбуждения порфиринатов палладия(IV) и родия(III) светом УФ и почти всего видимого диапазона [71, 51 ]. При этом соотношение интенсивности переходов флуоресценции и фосфоресценции остается неизменным при возбуждении во всем УФ- и видимом диапазоне длин волн, о чем свидетельствует совпадение спектров возбуждения флуоресценции и фосфоресценции краун-порфиринатов палладия (IV) и родия(III) (рис. 21).
Рис. 20.
Изменение спектров флуоресценции (550–650 нм) и фосфоресценции (650–850 нм) через определенные промежутки времени при нагревании образца PdCl2TCP в полистироле от 77 до 297 K при возбуждении люминесценции светом с длиной волны 440 нм (а) и при температуре образца PdCl2TCP в полистироле (298 K – график вверху, 323 K – в середине, 358 K – внизу) при возбуждении люминесценции светом с длиной волны 440 нм (б).
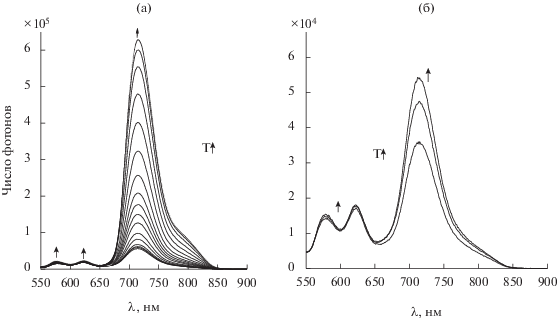
Рис. 21.
Спектры возбуждения PdCl2TCP: флуоресценции (λmax = 623 нм) – график внизу, фосфоресценции ( λmax = = 714 нм) – график вверху.
Указанными свойствами люминесцентных сенсоров по соотношению интенсивности флуоресцентных и фосфоресцентных переходов эмиссии, как оказалось, обладают не все порфиринаты металов, а лишь содержащие диамагнитный катион металла со средним эффектом “тяжелого атома” [61]. Например, у краун-порфиринатов платины(II) [33] и осмия(II) [57] ввиду выраженного эффекта “тяжелого атома” переходы флуоресценции становятся едва заметными на фоне переходов фосфоресценции, что исключает возможность использования переходов флуоресценции в качестве надежного рэпера, относительно которого изменяется интенсивность переходов фосфоресценции при изменении температуры. Краун-порфиринаты металлов первого переходного периода (медь, никель, кобальт) также не могут рассматриваться как люминесцентные сенсоры температуры данного типа ввиду наличия у этих комплексов только одного типа люминесценции – флуоресценции (порфиринаты кобальта), фосфоресценции (порфиринаты меди), а порфиринаты никеля, как известно, вовсе не обладают люминесцентными свойствами [39].
Любопытным фактом оказалось проявление как флуоресцентных, так и фосфоресцентных свойств краун-порфиринатами индия(III) [40] и олова(IV) [71] в полимерной основе (полистирол) при температуре 77 K, но при температуре выше ~203 K наблюдалось полное исчезновение фосфоресцентного свечения у данных соединений, в то время как флуоресценция сохраняется и при комнатной температуре [40]. Катионы In3+ и Sn4+ характеризуются эффектом “тяжелого атома”, сравнимым с катионами Pd2+, Pd4+, Rh3+ [61], однако фосфоресценция у краун-порфиринатов индия(III) и олова(IV) тушится значительно быстрее с ростом температуры по сравнению с краун-порфиринатами палладия(II), палладия(IV) и родия(III) [71, 51 ]. Возможным обьяснением такого различия может быть относительно слабое связывание катионов In3+ и Sn4+ с порфириновым циклом по сравнению с катионами переходных металлов, у которых связи с порфириновым циклом могут усиливаться за счет делокализации d-электронов катионов металлов с участием молекулярных орбиталей порфиринового цикла. Относительно слабое связывание катионов In3+ и Sn4+ с порфириновым циклом может приводить к усилению безызлучательной деградации возбужденных триплетных уровней при повышении температуры, чем и может обьясняться полное исчезновение переходов фосфоресценции при температуре выше 203 K у краун-порфиринатов индия(III) и олова(IV). Данные соединения могут представлять интерес как люминесцентные сенсоры температуры лишь при очень низких температурах.
Другой метод измерения температуры – по изменению кинетических кривых затухания фосфоресценции краун-порфиринатов металлов, защищенных от контакта с кислородом воздуха, также может представлять интерес. Как оказалось, краун-порфиринаты платины(II) [33] и осмия(II) [57] в полистироле обладают малым ходом времени жизни фосфоресценции при изменении температуры от 77 до 298 K по причине значительного проявления эффекта “тяжелого атома”, ускоряющего как при низких, так и при высоких температурах переходы между синглетными и триплетными электронными уровнями порфириновой молекулы, в том числе и переходы фосфоресценции (рис. 22a, 22б). Оказалось, что времена жизни фосфоресценции сильнее изменяются с температурой у краун-порфирината родия(III) [71] в полистироле, чем у краун-порфиринатов платины(II) [33] и осмия(II) [57]. Для порфирината родия RhClTCP время жизни изменяется в 13.8 раз при нагревании от 77 до 298 K (41 и 565 мкс при 77 и 298 K соответственно), а у краун-порфиринатов платины(II) и осмия(II) лишь в 5.7 и 4 раза также при нагревании от 77 до 298 K (табл. 3). Такое различие, возможно, связано с активацией колебаний связи родий–хлор при повышении температуры, которые могут возмущать электронно-возбужденное состояние молекулы RhClTCP и ускорять тем самым излучательные переходы фосфоресценции с переходом в основное синглетное состояние S0 (схема 1 ).
Рис. 22.
Кривые затухания фосфоресценции Pt(II)TCP в полистироле при 298 K (сплошная линия, 33 мкс) и при 77 K (штриховая линия, 188 мкс). Длина волны возбуждающего света 530 нм, длина волны в канале регистрации фосфоресценции 674 нм (a); кривые затухания фосфоресценции Os(CO)TCP в полистироле при 298 K ( сплошная линия, 45 мкс) и при 77 K (штриховая линия, 182 мкс). Длина волны возбуждающего света 584 нм, длина волны в канале регистрации фосфоресценции 785 нм (б); кривые затухания фосфоресценции Сu(II)TCP в полистироле при 298 K (сплошная линия, 11 мкс) и при 77 K (штриховая линия, 453 мкс). Длина волны возбуждающего света 535 нм, длина волны в канале регистрации фосфоресценции 797 нм (в).
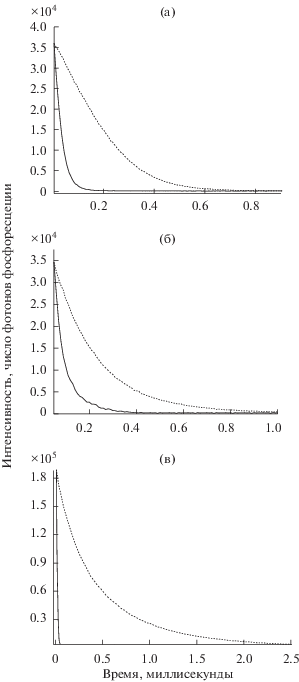
Таблица 3.
Сравнение характеристик фосфоресценции краун-порфиринатов металлов в пленке полистирола
| Соединение | Максимум поглощения в ЭСП (раствор в хлороформе), нм | Максимум в спектре фосфоресценции при 298 K, нм | Время жизни фосфоресценции, мкс | |
|---|---|---|---|---|
| 298 K | 77 K | |||
| Os(CO)TCP | 417, 525 | 785, 838 | 45 мкс | 182 мкс |
| Pt(II)TCP | 408, 512, 539 | 674, 742 | 33 мкс | 188 мкс |
| Cu(II)TCP | 421, 541 | 797 | 11 мкс | 453 мкс |
| RhClTCP | 434, 540, 578 | 731 | 41 мкс | 565 мкс |
| Os(O2)TCP | 403, 592 | 787, 842 | 44 мкс | 179 мкс |
| Os(I2)TCP | 410, 518 | 780, 819 | 25 мкс | 142 мкс |
Значительный ход времени жизни фосфоресценции (рис. 22в, рис. 23) с температурой был обнаружен у краун-порфирината меди(II) [72] – соединения, в котором катион металла не обладает значительным эффектом “тяжелого атома”, однако катион меди(II) характеризуется наличием неспаренного электрона в своей электронной оболочке, магнитное поле которого может влиять на вероятность электронных синглет-триплетных и триплет-синглетных переходов в молекуле порфирината меди(II) (схема 6 ). Время жизни фосфоресценции краун-порфирината меди(II) в полистироле увеличивается в 41 раз! (табл. 3) при изменении температуры от 298 до 77 K [72]. Обладая высоким квантовым выходом фосфоресценции [72, 39 ], краун-порфиринат меди(II) является весьма перспективным соединением для измерения температуры по изменению кинетики затухания фосфоресценции, для регистрации которой требуется сравнительно высокий квантовый выход фосфоресценции, поскольку измерение кривой затухания проводится в режиме включения-выключения лампы-вспышки, в отличие от метода сравнения интенсивности флуоресцентного и фосфоресцентного свечения, в котором сигнал люминесценции измеряется при непрерывном возбуждении образца тем или иным источником света.
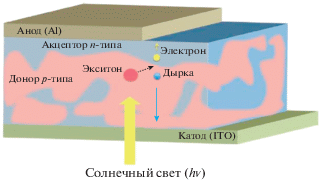
РАЗДЕЛ IV. КОМПОЗИЦИОННЫЕ ФОТОВОЛЬТАИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ С ПРИМЕНЕНИЕМ КРАУН-ПОРФИРИНАТОВ ПЛАТИНОВЫХ МЕТАЛЛОВ В АКТИВНОМ СЛОЕ
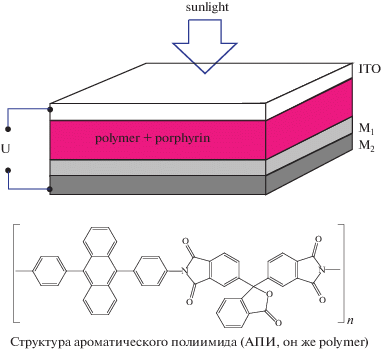
Как известно, электроды с нанесенной на них пленкой порфирина, проявляют эффект Беккереля – увеличение ЭДС при освещении видимым светом [73]. Являясь органическими полупроводниками с очень интенсивным поглощением света в синей области спектра, порфирины могут генерировать фотозаряды при нанесении на электрод в индивидуальном виде [73, 74], однако могут быть использованы и в составе композиций с улучшенными характеристиками транспорта зарядов во внешнюю цепь, чему обычно препятствуют процессы рекомбинации фоторазделенных зарядов [73]. Все сказанное относится и к мезо-тетра-бензо-15-краун-5)порфиринатам металлов, которые являются представителями синтетических, относительно легко доступных порфиринов [7, 8]. Краун-порфиринаты металлов могут быть применены в качестве активных компонентов твердотельных композиционных фотовольтаических (ФВ) преобразователей с показанной на схеме 9 последовательностью слоев. Добавка краун-порфиринатов платины(II), палладия(II) и никеля(II) (рис. 24) в слой ароматического полиимида (АПИ, схема 9 ) [74] в количестве 10, 20 и 30 мас. % дает следующий максимальный КПД устройств: ФВ-преобразователи, содержащие краун-порфиринат платины(II) – 0.01%, краун-порфиринат палладия(II) – 0.15%, краун-порфиринат никеля(II) – на уровне 1%. Такая разница в эффективности однотипных устройств может обьясняться как сильно различающейся энергией d–d-переходов катионов металлов, связанных с порфириновым циклом, так и релаксацией энергии возбуждения в полосе Сорэ через d–d-переходы катионов палладия(II) и платины(II) [75]. У краун-порфирината никеля(II) d–d-переходы лежат в красной области и перекрываются лишь с дальней Q-полосой поглощения системы электронов порфиринового кольца, за счет чего поглощенная энергия в области полосы Соре может передаваться через электронные уровни катиона никеля(II) на экситонные уровни АПИ, которые могут в процессе миграции экситонов распадаться на дефектах структуры полимера на разделенные заряды, обеспечивающие фототок устройства. Кроме того, при использовании краун-порфиринатов платины(II) и палладия(II) в активном слое ФВ-преобразователя поглощенная энергия может расходоваться на фосфоресцентное излучение, характерное для порфиринатов данных металов, как это уже было отмечено в разделах I и III. Краун-порфиринат никеля(II), как и другие порфиринаты никеля(II) [39], фактически не проявляет флуоресцентных и фосфоресцентных свойств, что способствует повышению эффективности процессов образования экситонов АПИ.
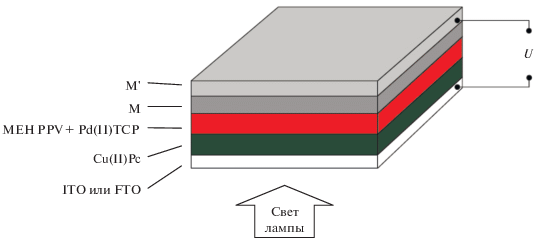
Cхема 9. Структура послойного ФВ-преобразователя с активным слоем на основе АПИ с добавкой краун-порфирината платины(II), палладия(II) или никеля(II).
Рис. 24.
Краун-порфиринаты платиновых металлов – допирующие добавки ФВ-преобразователей с послойной структурой и обьемным гетеропереходом.
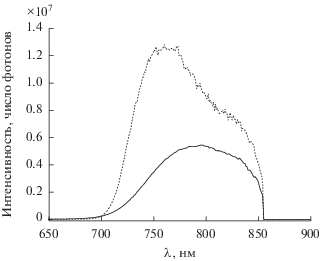
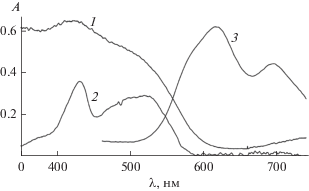
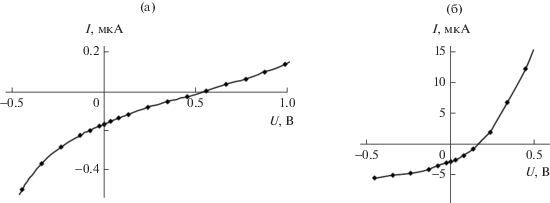
На основе другого полимера в активном слое – MEH PPV c добавкой краун-порфирината палладия(II) были сконструированы твердотельные ФВ-преобразователи, содержащие два активных слоя: первый слой (донорный) – это упомянутый выше полимер с добавкой краун-порфирината палладия(II), в качестве второго слоя (акцепторного) был использован фталоцианинат меди(II), нанесенный испарением из раствора (схема 10 ). Такая конструкция представляет интерес как с точки усиления поглощения света во всем видимом диапазоне за счет взаимодополнения спектров (рис. 25) краун-порфирината палладия(II) и фталоцианината меди(II), так и с точки зрения возможности получить более близкую к выпрямляющей вольт-амперную характеристику (ВАХ) преобразователя [35] (схема 11 ) за счет создания контакта акцепторного и донорного слоев, что отражается в более высоком значении фактора заполнения и, соответственно, КПД устройства по сравнению с устройствами с сильно отклоняющейся от выпрямляющей ВАХ [35, 74] (рис. 26). Близкую к выпрямляющей характеристику действительно удалось получить на устройствах предложенного типа (схема 10, 12), максимальный КПД устройства составил 0.02 электрона на фотон [74]. Также для двуслойных ФВ-преобразователей данного типа были установлены закономерности влияния адсорбированных газов на границе раздела слоев и возможности улучшения работы устройств при варьировании металлического электрода [74].
Схема 10 . Многослойная структура ФВ-преобразователя, содержащего полимерный слой, допированный краун-порфиринатом палладия(II) Pd(II)TCP.
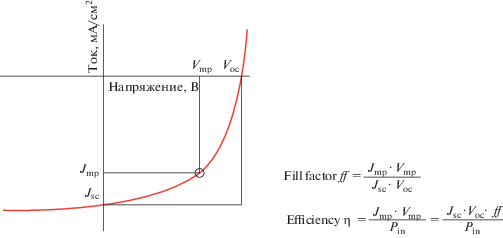
Схема 11 . Определение фактора заполнения (ff) и КПД преобразования (η) по вольт-амперной характеристике фотовольтаического преобразователя при облучении его солнечным светом. Jsc – ток короткого замыкания, отнесенный к площади ФВ-преобразователя, Voc – напряжение открытой цепи. Jmp – ток, отнесенный к единице площади ФВ-преобразователя при заданном напряжении Vmp, приложенном к ФВ-перобразователю. Pin – мощность падающего света, отнесенная к площади поверхности ФВ-преобразователя.
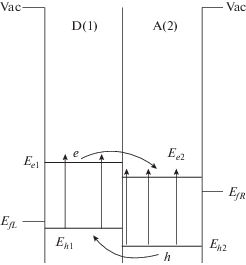
Схема 12 . Упрощенная энергетическая схема ФВ-преобразователя с двумя слоями органических полупроводников: D(1) – электроноакцепторный слой (MEH PPV + Pd(II)TCP), A(1) – электроноакцепторный слой (CuPc); EfL, EfR – уровни Ферми, Ee, Eh – транспортные уровни электронов и дырок соответственно. Vac – энергия свободного электрона в вакууме.
Рис. 26.
Вольт-амперная характеристика образца ITO-CuPc-MEH PPV + Pd(II)TCP-Ca-Al (а) FTO-CuPc-MEH PPV + + Pd(II)TCP-Se-In-Al (б) и при облучении светом с плотностью мощности 10 мВт/см2, имеющим спектр, близкий к солнечному; площадь образцов 0.1 см2.
В представленных выше одно- и двуслойных ВФ-преобразователях добавка значительного количества краун-порфирината металла обеспечивала приемлемые характеристики работы устройств послойного строения [74] по току короткого замыкания, фото-ЭДС и КПД. Однако оказалось, что краун-порфиринаты металлов могут существенно увеличивать фактор заполнения и КПД ФВ-устройств, изготовленных не послойно, а на основе принципа обьемного гетероперехода с такими активными компонентами, как светопоглощающие полимеры-полупроводники в качестве донорного компонента и различных производных фуллерена в качестве электроноакцептора [35, 76].
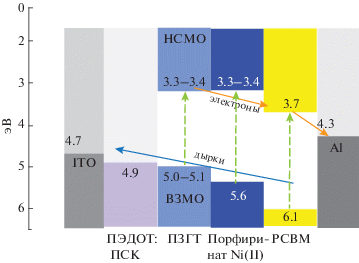
Оказалось, что добавка очень небольшого количества (0.1 мас. %) краун-порфирината никеля(II) в активный слой известного и широко применяемого преобразователя с обьемным гетеропереходом (рис. 27) на основе поли-3-гексилтиофена и производного фуллерена C60 – МЭ-С61-МК [76, 77] (PCBM – на английском) приводит к увеличению максимального КПД устройства от 3.6 до 4% согласно сравнению максимальных факторов заполнения по ВАХ устройств с допирующей добавкой и без нее [78]. Механизм действия допирующей добавки – краун-порфирината никеля(II) – основан на том, что НСМО (низшая свободная молекулярная орбиталь) и ВЗМО (высшая занятая молекулярная орбиталь) краун-порфирината никеля(II) хорошо соответствуют каскаду уровней энергии компонентов устройства, которые обеспечивают электронную и дырочную проводимость при фотовозбуждении (схема 13 ). Важную роль может играть сильное поглощение порфирината никеля(II) в красной и особенно синей областях спектра, а также формирование при внедрении молекул краун-порфирината никеля(II) с обьемными краун-эфирными фрагментами “дефектов структуры” полимера, на которых может происходить распад экситонов полимера на разделенные заряды, что, в свою очередь, должно способствовать улучшению тока фотогенерированных зарядов во внешнюю цепь, обеспечивая увеличение КПД устройства [35, 76]. Можно отметить и возможность образования супрамолекулярных диад краун-порфирината никеля(II) c C60 – МЭ-С61-МК (PCBM) при приготовлении обьемной смеси фотоактивных компонентов преобразователя обьемного гетероперехода. В таких супрамолекулярных диадах, аналогичных рассмотренным в работе [20] (раздел введение), может происходить прямой перенос электрона с молекулы порфирината металла на молекулу замещенного фуллерена при фотовозбуждении, что, очевидно, может обеспечивать дополнительный вклад в общий ток от разных процессов, происходящих одновременно в ФВ-преобразователе с обьемным гетеропереходом.
Схема 13 . Расположение уровней молекулярных орбиталей компонент фотоактивного слоя и работа выхода электрона для ITO и Al-электродов. Полимерный электрод ПЭДОТ-ПСК – комплекс поли(этилендиокситиофена) и поли(сульфокислоты).
Рис. 27.
Структура ФВ-преобразователя с активным слоем, выполненным по принципу обьемного гетероперехода (с многократным увеличением площади контакта донорного и акцепторного слоев по сравнению с послойными ФВ-преобразователями).
Аналогичный эффект увеличения КПД ФВ-преобразователя с обьемным был достигнут при введении небольшой допирующей добавки краун-порфирината осмия(II) в активный слой другого известного устройства с обьемным гетеропереходом на основе поли-2-метокси-5-(2-этилгексилокси)-1,4-фениленвинилена (MEH-PPV) и PCBM [79]. Добавление в этот активный слой 0.1 мас. % и более мезо-тетра(бензо-15-краун-5)порфината осмия(II) приводило к увеличению КПД устройства от 0.9 до 1.0% [78]. Механизмы увеличения эффективности устройства, вероятно, имеют ту же природу, что и рассмотренные выше для краун-порфирината никеля(II).
В заключение можно отметить, что характеристики ФВ-преобразователя на основе поли-3-гексилтиофена (П3ГТ) и производного фуллерена C60 – МЭ-С61-МК с допирующей добавкой краун-порфирината никеля(II) приближаются к максимально возможным для данного типа ФВ-устройств (КПД ~ 4%) с объемным гетеропереходом (рис. 27) при использовании полимера-полупроводника и производных фуллерена С60 [76]. Можно также отметить и эффективный способ повышения КПД ФВ-устройств с обьемным гетеропереходом на основе политиофена и фуллерена, который заключается в создании буферного слоя TiOx на границе алюминий–обьемная композиция из политиофена и фуллерена. При оптимальной толщине 10 нм введение такого слоя обеспечивает увеличение КПД устройства от 3.39 до 4.36% [80]. Кроме того, слой TiOx замедляет деградацию устройства при эксплуатации в воздушной атмосфере, тем самым обеспечивая увеличение срока службы ФВ-преобразователя такого типа [80]. Вероятно, применение одновременно допирующих добавок на основе краун-порфиринатов никеля(II) и осмия(II) [78] и буферного слоя TiOx оптимальной толщины [80] в устройствах с объемным гетеропереходом позволит еще более значительно увеличить фактор заполнения (схема 11 ) и КПД устройств такого типа [76, 78, 80].
ЗАКЛЮЧЕНИЕ
Варьирование катионов металлов, связанных с тетрапиррольным циклом краун-порфиринов, позволяет управлять оптическими свойствами данного класса соединений, особенно это относится к люминесцентным свойствам, поскольку именно от природы катиона металла зависит интенсивность флуоресценции и фосфоресценции краун-порфирината металла, кинетические характеристики люминесценции обоих этих типов. Зная закономерности влияния катионов металлов на люминесцентные свойства порфиринового цикла у краун-порфиринов, продемонстрированные в данном обзоре, можно направленно применять краун-порфиринаты металлов в качестве люминесцентных сенсоров на катионы щелочных металлов в растворе, люминесцентных сенсоров температуры по изменению интенсивности переходов фосфоресценции относительно переходов флуоресценции, а также по изменению кинетических характеристик фосфоресценции при изменении температуры. Актуальной задачей остается создание водорастворимых краун-порфиринатов металлов, которые могут представлять интерес как люминесцентные сенсоры на катионы щелочных металлов. Эта задача может быть решена путем введения гидрофильных заместителей при краун-эфирном или тетрапиррольном фрагменте молекул краун-замещенных порфиринов. Интерес представляет и дальнейшее развитие направления создания новых люминесцентных сенсоров на основе краун-порфиринатов металлов, особенно с парамагнитными катионами металлов. Краун-порфиринаты металлов и супрамолекулярные диады на их основе также могут представлять интерес как активные компоненты ФВ-преобразователей на основе соединений со структурой перовскита [81–85], в которых они могут найти применение как для улучшения светопоглощающих характеристик активного слоя, так и для улучшения транспорта электронов на границах раздела активный слой–электрод, где могут возникать потенциальные ямы для электронов.
Список литературы
Pedersen C.J. // J. Am. Chem. Soc. 1967. V. 89. P. 7017.
Pedersen C.J. // J. Am. Chem. 1970. V. 92. P. 391.
Хираока М. Краун-соединения. М.: Мир, 1974. 363 с.
Babailov S.P. // Macroheterocycles. 2012. V. 5. P. 249.
Стид Д.В., Этвуд Д. Супрамолекулярная химия. М.: Академкнига, 2007. 480 с.
Лен Ж.М. Супрамолекулярная химия. Новосибирск: Наука СO РАН, 1998. 333 с.
Цивадзе А.Ю. // Успехи химии. 2004. Т. 71. № 1. С. 6.
Tsivadze A.Yu. // Russ. J. Inorg. Chem. 2003. V. 48. № 13–14. Suppl. P. 1.
Яновская Л.А. Органический синтез в двухфазных системах. М.: Химия, 1982. 184 с.
Demina L.I., Kostikova G.V. // Russ. J. Inorg. Chem. 2019. V. 64. P. 323. https://doi.org/10.1134/S0036023619030082
Kostikova G.V., Krasnova O.G.// Russ. J. Inorg. Chem. 2018. V. 63. P. 1663. https://doi.org/10.1134/S0036023618120124
Demin S.V., Shokurova N.A. // Russ. J. Inorg. Chem. 2018. V. 63. P. 121. https://doi.org/10.1134/S0036023618010059
Громов C.П., Дмитриева С.Н. // Успехи химии. 2005. Т. 74. С. 503.
Topal G., Demirel N. // J. Heterocyclic Chem. 2001. V. 38. P. 281.
Ziyadanogullari B., Topal G. // Talanta. 2001. V. 53. P. 1083.
Pedersen C.J. // J. Org. Chem. 1971. V. 36. P. 254.
Tugashov K.I., Gribaniov D.A.// Organometallics. 2016. V. 35. № 13. P. 2197. https://doi.org/10.1021/acs.organomet.6b00231
Tugashov K.I., Gribaniov D.A. // Organometallics. 2017. V. 36. № 13. P. 2437. https://doi.org/10.1021/acs.organomet.7b00315
Tugashov K.I., Yunusov S.M. // Russ. Chem. Bull. 2018. V. 67. № 1. P. 45. https://doi.org/10.1007/s11172-018-2035-5
D’Souza F., Chitta R., Gadde S. // J. Phys. Chem. A. 2006. V. 110. № 13. P. 4338.
Thanabal V., Krishnan V. // J. Am. Chem. Soc. 1982. V. 104. P. 3643.
Thanabal V., Krishnan V. // Inorg. Chem. 1982. V. 21. P. 3606.
Vannikov A.V., Grishina A.D. // Dokl. Phys. Chem. 2005. V. 403. P. 137. https://doi.org/10.1007/s10634-005-0044-1
Vannikov A.V., Grishina A.D. // Russ. J. Phys. Chem. 2006. V. 80. P. 453. https://doi.org/10.1134/S0036024406030253
Murashima T., Uchihara Y. // Tetrahedron Lett. 1996. V. 37. P. 3133.
Hamilton A., Lehn J.-M. // J. Am. Chem. Soc. 1986. V. 108. P. 5158.
Ruzie C., Michaudet L. // Tetrahedron Lett. 2002. V. 43. P.7423.
Sessler J.L., Brucker E.A. // Tetrahedron Lett. 1995. V. 36. P. 1175.
Comte C., Gros C.P. // New J. Chem. 1998. P. 621.
Shinmori H., Furuta H. // Tetrahedron Lett. 2002. V. 43. P. 4881.
Shinmori H., Yasuda Y., Osuka A. // Eur. J. Org. Chem. 2002. P. 1197.
Shinmori H., Osuka A. // Tetrahedron Lett. 2000. V. 41. P. 8527.
Chernyadyev A.Y., Logacheva N.M., Tsivadze A.Y. // Russ. J. Inorg. Chem. 2005. V. 50. P. 552.
Аскаров К.А., Березин Б.Д. Порфирины: структура, свойства, синтез. М.: Мир, 1985. 333 с.
Walter M.G. // J. Porphyrins Phthalocyanines. 2010. V. 14. P. 759. https://doi.org/10.1142/S1088424610002689
Adler A.D., Longo F.R. // J. Org. Chem.1967. V. 32. P. 476.
Lindsey J.S., Seher L.C. // J. Org. Chem. 1987. V. 52. P. 827.
Jahan M., Safari N. // Polyhedron. 2005. V. 24. P. 1682.
Chernyadyev A.Y., Tsivadze A.Y. // Prot. Met. 2015. V. 51. № 4. P. 533. https://doi.org/10.1134/S2070205115040073
Chernyadyev A.Y., Tsivadze A.Y. // Prot. Met. 2020. V. 56. № 5. in press.
Tsivadze A.Y., Chernyadyev A.Y. // Russ. Chem. Bull. 2011. V. 60. P. 2251.
Lindsey J.S., Woodford J.N. // Inorg. Chem. V. 34. P. 1063.
Richeter S., Thion J. // Inorg. Chem. 2006. V. 45. P. 10 049.
Davidson G., Lane L. // Inorg. Chem. 2008. V. 46. P. 8721.
Стужина О.В., Ломова Т.Н. // Журн. физ. химии. 2008. Т. 82. № 2. С. 216.
Ломова Т.Н., Зайцева С.В. // Коорд. химия. 1999. Т. 25. № 6. С. 424.
Chernyadyev A.Y., Tsivadze A.Y. // Prot. Met. 2011. V. 47. № 4. P. 435. https://doi.org/10.1134/S207020511104006X
Chernyadyev A.Y., Tsivadze A.Y. // Prot. Met. 2018. V. 54. № 6. P. 1086. https://doi.org/10.1134/S2070205118060084
Chernyadyev A.Y., Logacheva N.M., Tsivadze A.Y. // Russ. J. Inorg. Chem. 2006. V. 51. № 5. P. 720.
Ломова Т.Н. Аксиально координированные металлопорфирины в науке и практике. М.: КРАСАНД, 2019. 704 с.
Chernyadyev A.Y., Kotenev V. A., Tsivadze A.Y. // Prot. Met. 2019. V. 55. № 6. P. 635. https://doi.org/10.1134/S2070205119060066
Adler A.D., Longo F.R. // J. Inorg. Nucl. Chem. 1970. V. 32. P. 2443.
Тюляева Е.Ю., Можжухина Е.Г. // Журн. неорган. химии. 2015. Т. 60. С. 194.
Buchler J.W., Rohbock K. // J. Organomet. Chem. 1974. V. 65. P. 223.
Buchler J.W., Herget G. // Liebigs Ann. Chem. 1983. P. 2164.
Che C.M., Poon C.K. // Inorg. Chem. 1985. V. 24. P. 1277.
Plachev Yu.A., Chernyadyev A.Y., Tsivadze A.Y. // Russ. J. Inorg. Chem. 2009. V. 54. № 5. P. 558. https://doi.org/10.1134/S0036023609040111
Chernyadyev A.Y., Kotenev V.A., Tsivadze A.Y. // Prot. Met. 2020. V. 56. № 3. P. 505. https://doi.org/10.1134/S2070205120030090
Chernyadyev A.Y., Logacheva N.M., Tsivadze A.Y. // Russ. J. Inorg. Chem. 2005. V. 50. № 12. P. 1921.
Паркер С. Фотолюминесценция растворов. М.: Мир, 1972. 510 с.
Соловьев К.Н., Борисевич Е.А. // Успехи физ. наук. 2005. Т. 175. С. 247.
Мальцев Е.И., Брусенцева М.А. // Высокомолекулярные соединения. Сер. А. 2006. Т. 48. С. 254.
Ermolaev V.L., Sveshnikova E.B. // Acta Phys. Pol. 1968. V. 34. P. 771.
Градюшко Т., Цвирко М.П. // Оптика и спектроскопия. 1971. Т. 21. С. 548.
Лакович Д. Основы флуоресцентной спектроскопии. М.: Мир, 1986. 496 с.
Richeter S., Thion J. // Inorg. Chem. 2006. V. 45. P. 10 049.
Davidson G., Lane L. // Inorg. Chem. 2008. V. 46. P. 8721.
Сидоров А.И. Сенсорная фотоника. СПб.: Ун-т ИТМО, 2019. 99 с.
Tsvirko M., Tkaczyk S. // Functional Materials. 2013. V. 20. P. 127.
Клинков В.А. // Научно-технические ведомости СПбГПУ. 2018. Т. 11. С. 44.
Chernyadyev A.Y., Kotenev V.A., Tsivadze A.Y. // Prot. Met. 2015. V. 51. № 6. P. 964. https://doi.org/10.1134/S2070205115060040
Chernyadyev A.Y., Kotenev V.A., Tsivadze A.Y. // Prot. Met. 2017. V. 53. № 4. P. 670. https://doi.org/10.1134/S2070205117040037
Комиссаров Г.Г. Фотосинтез: физико-химический подход. М.: Едиториал УРСС, 2006. 224 с.
Kolesnikov V.A., Tedoradze M.G., Chernyad’ev A.Yu. // High Energy Chemistry. 2007. V. 41. № 2. P. 103. https://doi.org/10.1134/S0018143907020099
Ливер Э. Электронная спектроскопия неорганических соединений. М.: Мир, 1987. 493 с.
Трошин П.А. // Российские нанотехнологии. 2008. Т. 3. С. 56.
Ma W., Yang C., Gong X. // Adv. Funct. Mater. 2005. V. 15. P. 1617.
Цивадзе А.Ю., Чернядьев А.Ю. Пат. РФ № RU 2469440 C2. Дата публикации 10.12.2012.
Reyes-Reyes M., Kim K. // Org. Lett. 2005. V. 7. P. 5749.
Stepanenko S.N. // Prot. Met. 2016. V. 52. № 2. P. 232. https://doi.org/10.1134/S2070205116010226
Kojima A. // J. Am. Chem. Soc. 2009. V. 131. P. 6050. https://doi.org/10.1021/ja809598r
Park N.-G. // J. Phys. Chem. Lett. 2013. V. 4. P. 2423. https://doi.org/10.1021/jz400892a
Snaith H. // J. Phys. Chem. Lett. 2013. V. 4. P. 3623. https://doi.org/10.1021/jz4020162
Kamat P. // J. Am. Chem. Soc. 2014. V. 136. P. 3713. https://doi.org/10.1021/ja501108n
Lindblad R. // J. Phys. Chem. Lett. 2014. V. 5. P. 648. https://doi.org/10.1021/jz402749f
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии