Журнал неорганической химии, 2020, T. 65, № 11, стр. 1565-1569
Диэлектрические и радиояркостные свойства водных растворов тетрахлоропалладата аммония по СВЧ- и КВЧ-данным
А. К. Лященко a, *, А. Ю. Ефимов a, В. С. Дуняшев a, И. А. Ефименко a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: aklyas@mail.ru
Поступила в редакцию 21.05.2020
После доработки 18.06.2020
Принята к публикации 22.06.2020
Аннотация
Рассмотрена связь диэлектрических и радиояркостных характеристик водных растворов (NH4)2[PdCl4] в начальной области концентраций при 298.15 K. По экспериментальным данным комплексной диэлектрической проницаемости в области максимума дисперсии воды и растворов рассчитаны параметры диэлектрической релаксации, отражающие нарушение сетки Н-связей при переходе от воды к раствору. С использованием этих данных по формулам Френеля определены квазиоптические коэффициенты и радиояркостные характеристики водных растворов на частотах см- и мм-областей. С помощью высокочувствительного радиометра на частоте 61.2 ГГц найдены радиояркостные параметры модельных растворов. В них наблюдается уменьшение радиояркостной температуры при переходе от воды к раствору как по экспериментальным, так и по расчетным данным. Показано, что собственное излучение растворов отражает вклады как дипольных, так и ионных потерь, которые все еще остаются значимыми в мм-области. Они могут даже определять наличие разнознаковых эффектов радиояркости. Разработаны основы нового подхода к исследованию растворов с комплексными ионами на основе их собственного излучения в мм-области спектра.
ВВЕДЕНИЕ
Процессы гидратации в растворах комплексных соединений остаются все еще недостаточно изученными [1]. Их изучение методом диэлектрической СВЧ-спектроскопии было начато в работе [2] на примере растворов K2[PdCl4] и K2[PtCl4]. Было определено изменение статических диэлектрических констант и релаксационной динамики при переходе от воды к растворам солей. В то же время такие изменения связаны с действием как катиона, так и аниона. Выбор растворов тетрахлоропалладата аммония объясняется тем, что они позволяют увидеть изменения воды под действием комплексного аниона в наиболее чистом виде, так как ион ${\text{NH}}_{{\text{4}}}^{ + }$ практически не нарушает исходную сетку H-связей воды [3]. Ион аммония – единственный из катионов, для которого характерно образование твердых растворов замещения во льду [4]. Всестороннее изучение водных растворов комплексных соединений (в данном случае (NH4)2[PdCl4]) в см- (диэлектрическая спектроскопия) и мм- (радиометрия) областях спектра важно для понимания изменения структуры воды в растворах с комплексообразованием и гидролизом. Кроме того, водные растворы тетрахлоропалладата аммония представляют практический интерес. (NH4)2[PdCl4] является представителем класса биологически активных комплексов палладия (АH)n[PdCl4], где АН – протонированный азотсодержащий катион, проявляющий высокую противоопухолевую, радиопротекторную и иммуномодулирующую активность [5], которая отсутствует, например, у K2[PdCl4] [5–7].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Комплексная диэлектрическая проницаемость на частоте ν определяется как ε*(ν) = ε'(ν) – iε"(ν), где ε' – диэлектрическая проницаемость, ε" – диэлектрические потери, i – мнимая единица. Для описания ее частотной зависимости в случае неэлектролитов обычно используют модель Дебая или Коула–Коула с дополнительным параметром распределения времени релаксации:
В растворах электролитов появляется дополнительная составляющая в ε"(ν), связанная с перемещениями зарядов (ионов) под действием электромагнитного излучения. Эта составляющая задается формулой:
ε"(ν) = σ/2πε0ν,
где σ – удельная электропроводность раствора, См/м.
В [8] такая модель была использована для описания частотных зависимостей диэлектрических свойств растворов калиевых солей с ионами [PdCl4]2– и [PtCl4]2– и растворов солей аммония с другими анионами в сантиметровой области.
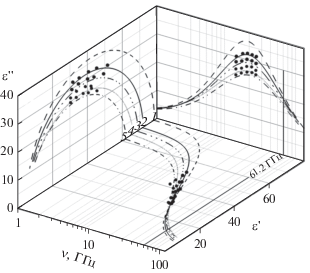
На рис. 1 показана аппроксимация данных диэлектрического эксперимента, полученных на частотах 7–25 ГГц в рамках выбранной релаксационной модели. Там же показана частота (61.2 ГГц), на которой были проведены радиометрические измерения.
Рис. 1.
Частотные зависимости диэлектрической проницаемости (ε') и диэлектрических потерь (ε") при 298.15 K: 1 – вода, 2 – раствор 0.3 моль/кг (NH4)2[PdCl4], 3 – раствор 0.5 моль/кг (NH4)2[PdCl4], 4 – раствор 0.75 моль/кг (NH4)2[PdCl4], 5 – раствор 0.86 моль/кг (NH4)2[PdCl4].
Зная комплексную диэлектрическую проницаемость водных растворов, можно найти их квазиоптические параметры, в частности, R(ν) – коэффициент отражения на частоте ν. Он рассчитывается из ε*(ν) помощью формулы Френеля:
Таким образом, экстраполяцией диэлектрического эксперимента можно получить коэффициент отражения, который в условиях термодинамического равновесия связан с измеряемым в радиометрическом эксперименте коэффициентом излучения χ(ν) простым соотношением: χ(ν) = 1 – R(ν). Далее основной радиометрический показатель – радиояркостная температура Тя(ν) на частоте ν – находится из выражения Тя(ν) = χ(ν)*T, где Т – термодинамическая температура. Так как радиояркостная температура воды Тя(воды) в работе постоянна, то иногда, особенно на рисунках, более наглядным является представление данных в виде ∆Тя= Тя(раствора) – Тя(воды).
Ионный вклад в ε"(ν) быстро уменьшается с ростом частоты, поэтому им часто пренебрегают в миллиметровой области частот. В связи с этим представляет интерес сопоставить оба варианта расчета радиояркостных характеристик растворов: в одном случае учитываются как ионные, так и дипольные диэлектрические потери (χ, Тя), а в другом – только дипольный вклад в ε" (χ(d), Тя(d)).
Ранее в работе [9] для растворов сульфатов щелочных металлов из диэлектрических характеристик в мм-области были рассчитаны R(ν) и показано хорошее согласие с радиометрическим экспериментом. С использованием высокочувствительного радиометра на примере (NH4)2[PdCl4] этот подход применен для получения радиояркостной температуры Тя водных растворов с комплексообразованием.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для всестороннего изучения процессов гидратации в растворах комплексных соединений (оно может быть осложнено из-за протекающего гидролиза) были использованы два экспериментальных метода – СВЧ-диэлектрическая спектроскопия в интервале частот 16–25 ГГц при 298.15 K и радиометрия на частоте 61.2 ГГц при 298.15 K. В качестве объекта исследования был выбран тетрахлоропалладат аммония. Синтезированный тетрахлоропалладат аммония представляет собой темно-зеленые кристаллы, растворимые в воде. Растворы для исследований готовили весовым способом на бидистиллированной воде. Максимальная концентрация раствора (NH4)2[PdCl4], приготовленного для измерений, равна 0.86 моль/кг. Это довольно низкое значение объясняется пределом растворимости соли. Насыщенные и пересыщенные растворы для данных исследований непригодны.
Методом диэлектрической СВЧ-спектроскопии исследована высокочувствительная диэлектрическая проницаемость ε' и полные потери ε" водных растворов тетрахлоропалладата аммония (m = 0.3, 0.5, 0.75, 0.86 моль/кг) на частотах ν = 16, 19, 22, 25 ГГц при температуре 298.15 K. Для измерения комплексной диэлектрической проницаемости водных растворов в сантиметровом диапазоне длин волн использован так называемый метод “цилиндрического стерженька” в волноводе [10]. Аппаратура и методика измерений подробно описаны в [11–14]. Относительные погрешности определения ε' и ε" находятся в пределах ±1.5–2 и ±2–2.5% соответственно.
Диэлектрические релаксационные параметры и статические диэлектрические константы, полученные данным методом, представлены в табл. 1. Эти данные были использованы для получения квазиоптических параметров растворов (экстраполяция на частоту 61.2 ГГц). Результаты представлены в табл. 2.
Таблица 1.
Диэлектрические характеристики водных растворов (NH4)2[PdCl4] для релаксационной модели Коула–Коула при 298.15 K
| Концентрация (NH4)2[PdCl4], моль/кг H2O | σ, См/м | εs | ∆ε | τ, пс | α |
|---|---|---|---|---|---|
| 0 | 0 | 78.4 | 73.4 | 8.25 | 0 |
| 0.3 | 6.84 | 72.0 | 67.0 | 7.9 | 0.03 |
| 0.5 | 10.3 | 69.1 | 64.1 | 7.8 | 0.06 |
| 0.75 | 13.9 | 66.3 | 61.3 | 7.7 | 0.1 |
| 0.86 | 17.4 | 62.3 | 57.3 | 7.4 | 0.09 |
Таблица 2.
Рассчитанные и измеренные коэффициенты излучения и радиояркостные температуры водных растворов (NH4)2[PdCl4] на частоте 61.2 ГГц
| Концентрация (NH4)2[PdCl4], моль/кг H2O | Расчет | Радиометрия | ||||
|---|---|---|---|---|---|---|
| χ(d)* | χ | Тя(d)*, K | Тя, K | χ | Тя, K | |
| 0 | 0.506 | 0.506 | 150.9 | 150.9 | 0.506 | 150.9 |
| 0.3 | 0.515 | 0.498 | 153.5 | 148.5 | 0.499 | 148.8 |
| 0.5 | 0.521 | 0.496 | 155.3 | 147.9 | 0.493 | 146.9 |
| 0.75 | 0.528 | 0.495 | 157.4 | 147.6 | 0.485 | 144.6 |
| 0.86 | 0.535 | 0.492 | 159.5 | 146.7 | 0.485 | 144.6 |
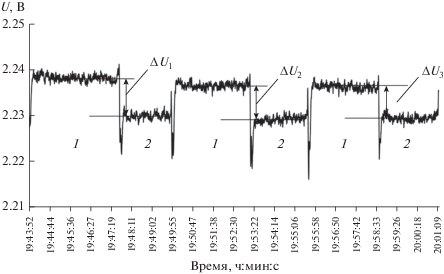
Для экспериментального изучения радиояркостных характеристик растворов был использован высокочувствительный модуляционный радиометр с фиксированной рабочей частотой 61.2 ГГц (λ = 4.9 мм) производства НПО “Исток” (ИРЭ РАН, Фрязино) [15]. Его устройство и методика измерений описаны ранее [16]. Однако градуировка сигнала для расчета радиояркостных параметров растворов в этих работах не проводилась. Показания прибора оцифровываются и сохраняются в виде зависимостей радиофизического отклика U (напряжение на выходе радиометра, В) от времени. Участок подобной зависимости приведен на рис. 2 для случая совместных измерений образцов чистой воды и 0.5 моль/кг раствора (NH4)2[PdCl4]. Постоянный участок длительностью не менее 3–5 мин с дрейфом напряжения не более 0.1 мВ/мин использовали для определения статистически усредненного значения сигнала U. Проведя последовательные измерения для воды и раствора комплексного соединения, нашли величину ΔU = Uраствора – Uводы. Для повышения точности и достоверности результатов, а также для сведения к минимуму влияния возможного изменения состояния прибора и раствора в течение эксперимента подобные парные измерения проводили несколько раз. Измерения относятся к определенному временному отрезку. Изменения, связанные с гидролизом в концентрированных растворах, не рассматривались. Далее из полученных наборов инкрементов ΔU1, ΔU2, …, Un находили средние значения ΔU. Градуировка шкалы прибора описана в работе [17]. Для пересчета величин ΔU в коэффициенты излучения χ растворов использовали данные воды, раствора хлорида калия и медной пластины. Найденные из экспериментальных данных величин ΔU значения χ и Тя для данных растворов представлены в табл. 2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как видно из рис. 1 и табл. 1, изменения комплексной диэлектрической проницаемости воды в растворах тетрахлоропалладата аммония в начальной области концентраций описываются релаксационной моделью Коула–Коула с небольшим параметром распределения времен релаксации (α < 0.1). При этом значения статической диэлектрической проницаемости εs и времена диэлектрической проницаемости τ уменьшаются при переходе от воды к раствору. Это соответствует типичной гидрофильной гидратации. Как и в случае растворов KCl и других солей аммония, изменение параметров говорит о слабой гидратации иона тетрахлоропалладата.
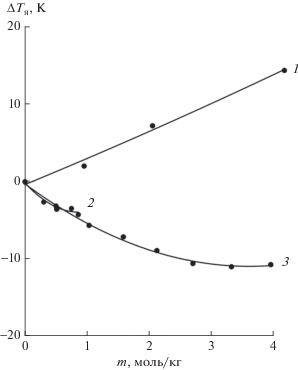
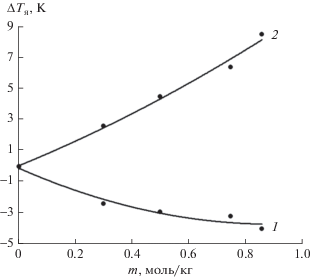
На рис. 3 показано сравнение расчетных значений ∆Тя для растворов KCl [18], LiCl [12, 19] и (NH4)2[PdCl4]. При переходе от воды к раствору показано уменьшение ∆Тя для растворов хлорида калия и тетрахлоропалладата аммония, в отличие от растворов хлорида лития. Это следует не только из расчетных данных, но и из результатов измерений. В то же время согласие рассчитанных и измеренных параметров радиояркости для растворов тетрахлоропалладата аммония реализуется только в самом первом приближении. Возможно, отклонения связаны с гидролизом, наблюдающимся в растворах тетрахлоропалладата аммония [20, 21]. Расчет для случая суммарных и дипольных диэлектрических потерь показывает, что ионные вклады все еще остаются значимыми в мм-области. Это видно на рис. 4, где приведены как суммарные, так и дипольные составляющие радиояркостной температуры по сравнению с водой. Сравнение полученных характеристик с данными для других растворов солей показывает, что рассмотренный случай соответствует слабой гидратации иона, как в случае растворов хлорида калия или сульфата цезия и в отличие от растворов хлорида лития.
ЗАКЛЮЧЕНИЕ
Как следует из проведенного анализа, в этой и других работах наблюдается отличие изменений радиояркостных характеристик растворов разного состава и концентраций. Присутствует значимое и дифференцированное изменение сигнала по сравнению с водой. Здесь это следует для растворов с комплексными анионами. Соответственно, может быть рассмотрен вопрос о разработке дополнительного метода экспериментального исследования комплексных соединений в растворах. Во многих случаях дистанционный метод измерений имеет несомненные преимущества, например, агрессивные среды, радиоактивные воды и т.д. Становится реальным также непрерывный мониторинг во времени. Наличие радиояркостных контрастов растворов в сложных многокомпонентных системах и микрогетерогенных средах, по-видимому, может иметь значение в биологических жидкостях и использоваться в химико-технологических процессах. Эти вопросы требуют дальнейших исследований.
Список литературы
Barthel J.M.G., Krienke H., Kunz W. Physical chemistry of electrolyte solutions: modern aspects. N.Y.: Springer, 1998. 395 p.
Лященко А.К., Логинова Д.В., Лилеев А.С. и др. // Журн. коорд. химии. 2009. Т. 35. № 9. С. 643. [Lyashchenko A.K., Loginova D.V., Lileev A.S. et al. // Russ. J. Coord. Chem. 2009. V. 35. № 9. P. 633. https://doi.org/10.1134/S1070328409090012]
Lileev A., Lyashchenko A. // J. Mol. Liq. 2009. V. 150. P. 4. https://doi.org/10.1016/j.molliq.2009.08.008
Labowitz L., Westrum E. // J. Phys. Chem. 1961. V. 65. № 3. P. 403. https://doi.org/10.1021/j100821a004
Буслаева Т.М., Умрейко Д.С., Новицкий Г.Г. и др. Химия и спектроскопия платиновых металлов. Минск: Университетское, 1990. С. 279.
Ефименко И.А., Чураков А.В., Иванова Н.А. и др. // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1476. [Efimenko I.A., Churakov A.V., Ivanova N.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 11. P. 1469. https://doi.org/10.1134/S003602361711]
Барчуков В.Г., Ефименко И.А., Ерофеева О.С. и др. Пат. № 269809 от 11.09.2019 г.
Логинова Д.В. Гидрофобная и гидрофильная гидратация в водных растворах электролитов по данным СВЧ-диэлектрической спектроскопии. Дис. … канд. хим. наук. М.: ИОНХ РАН, 2007. 161 с.
Лященко А.К., Дуняшев В.С. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1635. [Lyashchenko A.K., Dunyashev V.S. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1656. https://doi.org/10.1134/S0036023618120136]
Lyashenko A.K., Lileev A.S. // J. Chem. Eng. Data. 2010. V. 55. № 5. P. 2008. https://doi.org/10.1021/je900961m
Broadband Dielectric Spectroscopy / Eds. Kremer F., Schönhals A., Berlin: Springer-Verlag, 2003. 729 p.
Засецкий А.Ю., Лященко А.К. Квазиоптический метод измерения комплексной диэлектрической проницаемости водных растворов электролитов в миллиметровом диапазоне длин волн и релаксационные характеристики растворов. Деп. ВИНИТИ 06.07.99. № 2181-В99. 62 с.
Le Bot J. // Compt. Rend. Acad. Sci. 1953. V. 236. № 5. P. 469.
Лященко А.К., Лилеев А.С., Каратаева И.М. Современные проблемы общей и неорганической химии // Cб. тр. II Междунар. конф. М., 19–21 мая 2009. С. 316.
Криворучко В.И. // Изв. вузов. Радиофизика. 2003. Т. 46. № 8-9. С. 782.
Лященко А.К., Каратаева И.М., Козьмин А.С., Бецкий О.В. // Докл. АН. 2015. Т. 462. № 5. С. 561. [Lyashchenko A.K., Karataeva I.M., Kozmin A.S., Betskii O.V. // Dokl. Phys. Chem. 2015. V. 462. № 2. P. 127. https://doi.org/10.1134/S0012501615060032]
Лященко А.К., Каратаева И.М., Дуняшев В.С. // Журн. физ. химии. 2019. Т. 93. № 4. С. 552. [Lyashchenko A.K., Karataeva I.M., Dunyashev V.S. // Russ. J. Phys. Chem. A. 2019. V. 93. № 4. P. 682. https://doi.org/10.1134/S0036024419040204]
Лященко А.К, Ефимов А.Ю., Дуняшев В.С., Каратаева И.М. // Журн. неорган. химии. 2020. Т. 65. № 2. С. 237. [Lyashchenko A.K., Efimov A.Yu., Dunyashev V.S., Karataeva I.M. // Russ. J. Inorg. Chem. 2020. V. 65. № 2. P. 241. https://doi.org/10.1134/S0036023620020096]
Wachter W., Fernandez S., Buchner R., Hefter G. // J. Phys. Chem. B. 2007. V. 111. № 30. P. 9010. https://doi.org/10.1021/jp072425e
Бельская О.Б., Гуляева Т.И., Арбузов А.Б. и др. // Кинетика и катализ. 2010 Т. 51. № 1. С.114. [Bel’skaya O.B., Gulyaeva T.I., Arbuzov A.B. et al. // Kinet. Catal. 2010. V. 51. № 1. P. 105. https://doi.org/10.1134/S0023158410010179]
Золотов Ю.А., Варшал Г.М., Иванов В.М. // Аналитическая химия металлов платиновой группы: Сб. обзорных статей. М.: КомКнига, 2005. 592 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии