Журнал неорганической химии, 2020, T. 65, № 11, стр. 1570-1578
Химическое осаждение из газовой фазы иридия на карбиды гафния и тантала
В. В. Лозанов a, *, И. Ю. Ильин b, Н. Б. Морозова b, С. В. Трубин b, Н. И. Бакланова a
a Институт химии твердого тела и механохимии СО РАН
630128 Новосибирск, ул. Кутателадзе, 18, Россия
b Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: lozanov.25@gmail.com
Поступила в редакцию 28.05.2020
После доработки 10.06.2020
Принята к публикации 26.06.2020
Аннотация
Методом химического осаждения из газовой фазы получены нанокристаллические иридиевые покрытия на подложках из карбидов гафния и тантала при температуре 600°С. Последующая высокотемпературная обработка при 1100°С приводит к химическому взаимодействию иридия с карбидами гафния и тантала с образованием наноразмерных интерметаллических твердых растворов замещения MIr3 –x и выделением свободного углерода. Наличие интерметаллического взаимодействия подтверждается данными рентгеновской фотоэлектронной спектроскопии.
ВВЕДЕНИЕ
Карбиды и бориды гафния и тантала широко применяются в современном материаловедении для создания высокотемпературных материалов и покрытий, работающих в экстремальных условиях [1–3]. Однако их потенциал не ограничивается высокотемпературными приложениями. Недавние исследования показали, что карбиды и бориды тантала и гафния могут успешно применяться для создания преобразователей солнечной энергии в качестве материалов, поглощающих солнечное излучение в большом спектральном диапазоне [4, 5]. Термоэмиссионные свойства и металлическая тепло- и электропроводность позволяют применять тугоплавкие карбиды в качестве полевых эмиссионных катодов, а также для разработки высокотемпературных MOSFET устройств в микроэлектронике [6, 7]. В некоторых технологических задачах требуется снижение работы выхода электронов карбида [7]. Так, в работе [8] было установлено, что в карбидах переходных металлов после нанесения иридиевой пленки и термической активации наблюдалось увеличение тока эмиссии, обусловленное уменьшением работы выхода поверхности. Ввиду того, что активация термоэмиссионных свойств проводится при температуре от 1000°С и выше, для оценки работоспособности таких устройств необходимо учитывать процессы, которые могут происходить на границе иридиевая пленка–карбидная подложка. Ранее нами было изучено взаимодействие между порошками иридия и порошками карбидов гафния и тантала [9, 10]. Было показано, что взаимодействие становится заметным уже при температурах 1000–1100°С и происходит с образованием интерметаллических твердых растворов MIr3 ±x и выделением свободного углерода.
Цель настоящей работы – детальное изучение взаимодействия иридия с карбидами тантала и гафния при температуре 1100°С на основе данных по морфологии, фазовому и элементному составу, а также данных о химическом состоянии элементов. В качестве модельного объекта нами использована диффузионная пара тонкое иридиевое покрытие (получено методом MOCVD)–таблетка TaC или HfC.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение подложек HfC и TaC
Получение карбидных подложек проводили методом горячего прессования. В качестве исходных веществ использовали порошки HfC (чистота 99%, ТУ 6-09-03-361-78) и TaC (чистота 99%, ТУ 6-09-03-443-77). Порошки засыпали в графитовую пресс-форму, которую затем заполняли аргоном (чистота 99.998%) до давления 120 кПа. Далее прикладывали нагрузку до давления 20 МПа и нагревали карбид до температуры 1700°С со скоростью 100 град/мин. Термическую обработку под давлением проводили в течение 1 ч. Затем пресс-форму охлаждали до комнатной температуры и снимали нагрузку. Полученные таблетки запаковывали в эпоксидную смолу и полировали на шлифовально-полировальном станке (Полилаб, Россия) последовательно алмазными суспензиями с размерами частиц 9, 6, 3 и 1 мкм.
Получение иридиевого покрытия
Иридиевое покрытие на карбидных подложках получали методом химического осаждения из газовой фазы металлоорганического соединения-предшественника (MOCVD). В качестве соединения-предшественника (прекурсора) использовали (ацетилацетонато)(1,5-циклооктадиен) иридия(I) [Ir(acac)(cod)], где acac – ацетилацетонат-ион (C5H7O2)–, cod – циклооктадиен C8H8. Синтез прекурсора проводили следующим образом: навеску 5.64 г [Ir(cod)Cl]2 (8.4 ммоль, синтезирован по методу [11]) переносили в раствор 90 мл диэтилового эфира и 1.68 г (16.8 ммоль) H(acac). Затем в реакционную смесь добавляли 1 М KOH (25.0 ммоль), через 10 мин – предварительно дегазированную воду до эквивалента с эфиром 1 : 1. Реакционную смесь перемешивали в течение 20 ч при комнатной температуре. Эфирный слой упаривали в вакууме, водный отфильтровывали в токе аргона. Образовавшийся осадок высушивали и промывали водой. Продукт экстрагировали в экстракторе Сокслета гексаном, затем сублимировали в вакууме при p = 6.7 Па и t = 120°C. Выход продукта составил 80%. Преимущества данного прекурсора состоят в том, что иридий осаждается в наноразмерном состоянии при достаточно низких температурах (500–600°С), а количество кислорода в прекурсоре составляет всего 5.7 ат. %. Механизм разложения соединения схематически может быть представлен следующим образом:
(1)
${\text{[Ir(acac)}}{\kern 1pt} {\text{(cod)]}}\, + \,{{{\text{H}}}_{{\text{2}}}} = {\text{I}}{{{\text{r}}}_{{{\text{тв}}}}} + {{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{{\text{2г}}}}}{\kern 1pt} \uparrow {\text{ + }}\,{{{\text{C}}}_{{\text{8}}}}{{{\text{H}}}_{{{\text{8г}}}}}{\kern 1pt} \uparrow {\kern 1pt} {\text{.}}$Эксперименты по осаждению проводили в вертикальном реакторе. В качестве газа-носителя был использован аргон, который подавался со скоростью 1 л/ч, а в качестве газа-реагента – водород (v = 2 л/ч). Давление в камере поддерживали 1.3 кПа, температура подложки составляла 600°С для всех экспериментов, время эксперимента для таблеток TaC – 120 мин, для таблеток HfC – 180 мин.
Термическая обработка карбидных подложек с иридиевым покрытием
Высокотемпературную термическую обработку карбидных подложек с иридиевым покрытием проводили в установке горячего прессования при температуре 1100°С без нагрузки. Для этого образец помещали в графитовый тигель, камеру пресса вакуумировали, а затем заполняли аргоном (чистота 99.998%) до давления 120 кПа. Образец нагревали со скоростью 100 град/мин, выдерживали при максимальной температуре в течение 30 мин, а затем охлаждали.
Методы исследования
Дифракционные данные получали с использованием дифрактометра D8 Advance (Bruker, Германия) в CuKα-излучении в диапазоне углов 2θ = = 10°–90°. Рентгенофазовый анализ, уточнение параметров решетки фаз и размера областей когерентного рассеяния (ОКР) проводили методом Ритвельда с использованием программного обеспечения Topas 4.2 и базы данных ICSD (FIZ Karlsruhe, Германия). Погрешность в определении параметра решетки составила ±0.001 Å. Изучение морфологии поверхности проводили на сканирующем электронном микроскопе TM-1000 (Hitachi, Япония). Рентгеновские фотоэлектронные спектры (РФЭС) регистрировали на фотоэлектронном спектрометре SPECS (Германия) с использованием полусферического анализатора PHOIBOS-150-MCD-9 и монохроматора FOCUS-500 (излучение AlKα, hν = 1486.74 эВ, 200 Вт). Шкала энергии связи (BE) была предварительно откалибрована с использованием положений пиков энергетических уровней атомов Au 4f7/2 (BE = = 84.0 эВ) и Cu 2p3/2 (BE = 932.67 эВ). Энергию связи измеряли с точностью ±0.1 эВ. Для удаления верхнего поверхностного слоя образцы подвергали бомбардировке ионами Ar+ с энергией 2.5 кэВ в течение 5 мин. Сравнение РФЭС элементов до и после обработки в течение 5 мин показывает, что травление не приводит к изменению электронных состояний атомов. РФЭ-спектры обрабатывали в специализированной программе CASA (Япония), используя функцию Фойгта. Фон учитывали по методу Ширли.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфология и фазовый состав системы MOCVD Ir–MC до термообработки
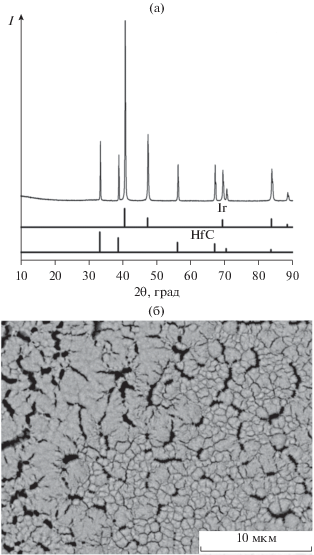
Рентгенофазовый анализ (РФА) пары MOCVD Ir–HfC до термообработки показал, что в составе продуктов присутствуют только металлический иридий и карбид гафния (рис. 1а). Параметры решетки иридия близки к таковым для чистого иридия (3.841 Å по сравнению с 3.840 Å). Размер ОКР, согласно данным РФА, составляет ∼75 нм. При этом параметр решетки карбида гафния после MOCVD-эксперимента увеличился по сравнению с таковым для горячепрессованного образца HfC (4.637 Å по сравнению с 4.633 Å, погрешность определения составляет ±0.001 Å). Методом сканирующей электронной микроскопии (СЭМ) показано, что иридиевое покрытие состоит из зерен субмикронного (<200 нм) размера (рис. 1б). В покрытии присутствуют трещины, однако отслаивания не наблюдается. Исходя из литературных данных о термическом расширении карбидов и иридия, можно оценить степень деформаций сжатия, возникающих после охлаждения от температуры 600°C до комнатной в иридиевом покрытии [12, 13]. Полученные значения невелики и составляют ~0.4%.
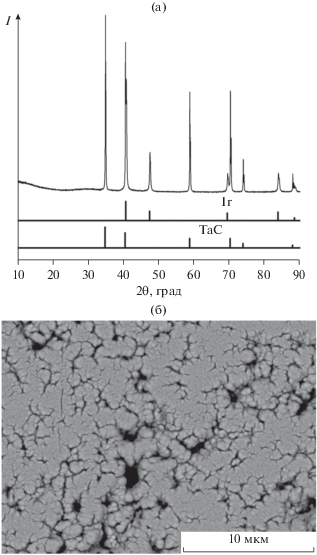
Для пары MOCVD Ir–TaC были получены аналогичные результаты. С помощью РФА показано, что при осаждении иридия на подложку из карбида тантала никакие новые фазы не образуются. В составе покрытия присутствует только металлический иридий с параметрами решетки 3.840 Å и карбид тантала (рис. 2а). Параметр решетки карбида тантала составляет 4.458 Å, что совпадает в пределах погрешности со значением параметра решетки для горячепрессованного TaC (4.457 Å). Размер ОКР иридия, согласно данным РФА, составляет ∼50 нм. Это значение меньше того, которое было определено для иридия, осажденного на подложку HfC. Вероятной причиной является меньшее время осаждения для системы Ir–TaC. В покрытии присутствуют поры (рис. 2б). Покрытие достаточно прочно сцеплено с карбидной подложкой.
Влияние высокотемпературной обработки на систему MOCVD Ir–MC
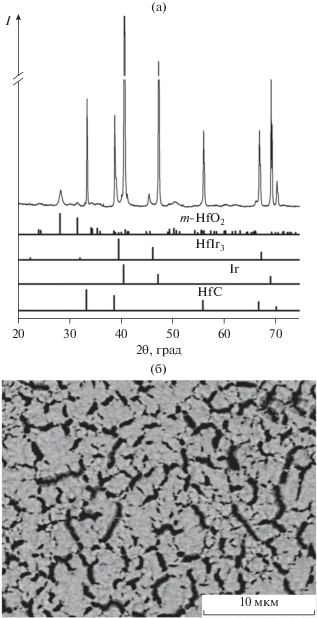
Термообработка пары иридиевое покрытие–карбид гафния при 1100°С приводит к появлению новых рефлексов на дифрактограмме (рис. 3). Эти рефлексы можно отнести к кубическому твердому раствору замещения на основе HfIr3, параметры решетки которого существенно больше, чем для стехиометрического интерметаллида (3.990 Å по сравнению с 3.935 Å). Это свидетельствует о смещении состава интерметаллида в сторону обогащения гафнием [6]. Согласно данным РФА, размер ОКР HfIr3 –x составляет ~40 нм. Можно отметить, что размер ОКР иридия после термообработки существенно увеличился по сравнению с таковым для исходной пары Ir–HfC и составил ∼194 нм. Анализ СЭМ-снимков также свидетельствует о некотором увеличении размера островков иридия на поверхности карбида и об уширении трещин (рис. 3б). Быстрый рост размера частиц иридия, по-видимому, обусловлен тем, что температура термообработки соответствует температуре Таммана (1100°С), при которой подвижность атомов иридия становится существенной [14]. По данным РФА, в продуктах взаимодействия присутствует диоксид гафния моноклинной модификации, содержание которого составляет ~15 мол. %. Размер ОКР оксидной фазы, определенный по уширению рефлексов, составляет ~30 нм. Появление фазы HfO2, по-видимому, связано либо с загрязнением системы кислородом воздуха в ходе осаждения иридия, либо с присутствием кислородных атомов в составе прекурсора. Действительно, параметр решетки карбида гафния после MOCVD-эксперимента при 600°С и термообработки при 1100°С увеличился (4.638 Å), это может быть связано с внедрением в кристаллическую решетку HfC атомов кислорода.
Рис. 3.
Рентгенофазовый анализ (а) и СЭМ-снимок (б) иридиевого покрытия на карбиде гафния после термической обработки при 1100°С.
Ранее сообщалось об использовании РФЭС-метода для исследования окисления интерметаллида HfIr3, однако величины энергии связи Hf 4f и Ir 4f не приведены [15]. Методом РФЭС изучены образцы систем Ir–HfC и Ir–TaC, определены элементы и получена информация о химическом состоянии атомов. Данные РФЭС для системы MOCVD Ir–HfC представлены на рис. 4а–4в, а соотнесение компонентов с типами связей – в табл. 1. В спектре Hf 4f присутствуют два дублета – 4f7/2 и 4f5/2. Первый дублет с меньшей энергией соответствует состоянию Hf0, которое может быть связано с образованием интерметаллида HfIr3 – x при термообработке (рис. 4а), что подтверждается и данными РФА. Второй дублет указывает на состояние Hf4+ и присутствие связей Hf–O. Этот результат также находится в согласии с результатами РФА. Действительно, на рентгенограмме обнаружены пики, принадлежащие моноклинному диоксиду гафния. В спектре Ir 4f присутствуют два дублета: 4f7/2 и 4f5/2. Первый дублет (энергия наиболее интенсивного пика E = = 60.7 эВ) можно приписать состоянию Ir0. Учитывая данные РФА, можно предположить, что иридий присутствует в виде непрореагировавшего иридия и в виде интерметаллида (HfIr3 – x). Присутствие второго дублета (энергия наиболее интенсивного пика E = 61.9 эВ), возможно, связано с состоянием Ir3+. Следует отметить, что интенсивность второго дублета в разы меньше, чем первого дублета. Можно предположить, что появление этого малоинтенсивного дублета связано с присутствием следового количества примеси, содержащей связи Ir–O. Сравнение результатов этой работы и литературных данных (табл. 1) показывает, что линия Hf 4f, соответствующая нейтральному состоянию гафния, смещена в сторону бóльших энергий на 0.3 эВ.
Рис. 4.
Рентгеновские фотоэлектронные спектры Hf 4f (а), Ir 4f (б), C 1s (в) и O 1s (г) иридиевого покрытия на карбиде гафния после термической обработки при 1100°С.
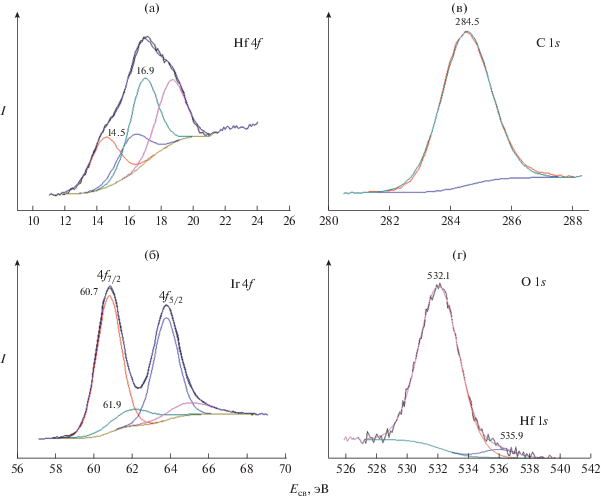
Таблица 1.
Сопоставление энергии связи (эВ) линии Hf 4f7/2, Ta 4f7/2, Ir 4f7/2 и C 1s с литературными данными для элементов в различном состоянии
| Элемент | Настоящая работа | Литературные данные | Соединение и ссылка |
|---|---|---|---|
| Hf0 | 14.5 | 14.23 | Hf [17] |
| Hf4+ | 16.9 | 16.7 | HfO2 [17] |
| Ta0 | 23.0 | 21.9–22.0 | Ta [17] |
| Taδ+ в карбиде | 23.7 | 23.55 23.08 |
TaC0.98 [18] Ta2C [18] |
| Ta5+ | 26.1 | 25.9 26.5 |
KTaO3 [17] Ta2O5 [17] |
| Ir0 | 60.7 | 60.75 60.8 |
Ir [17] Ir [11] |
| Ir3+ | 61.9 | 61.8 61.37–61.79 |
K3IrBr6 [17] [20] |
| C0 | 284.5 | 284.5 | Графит [17] |
| Cδ– в карбиде | 282.3 | 280.80 281.9 282.7–283.5 |
HfC [18] TaC [18] WC [18] |
Энергия связи для Ir0 также смещена на 0.1 эВ по сравнению с литературными данными. На наш взгляд, такое смещение можно объяснить тем, что гафний и иридий присутствуют после термообработки в виде интерметаллида HfIr3 –x. Согласно теории Энгеля–Брюэра, в таком интерметаллиде между иридием и гафнием возможен электронный обмен [16]. В спектре углерода C 1s присутствует только одна линия, соответствующая свободному углероду в виде фазы графита. Этот результат хорошо согласуется с ранее полученными нами данными о том, что при взаимодействии иридия с карбидом гафния при таких температурах никаких тройных соединений не образуется, а углерод выделяется в свободном виде по реакции [9]:
(2)
${\text{HfC}} + \left( {3 - x} \right){\text{Ir}} = {\text{HfI}}{{{\text{r}}}_{{3{\text{ }}--x}}} + {\text{C}}.$В спектре кислорода уровня O 1s присутствует только один пик, имеющий энергию связи 532.1 эВ (рис. 4г), что указывает на присутствие кислорода в составе образца. Это значение несколько выше, чем для кислорода в составе HfO2 (530.0–530.4 эВ) и более характерно для кислорода в состоянии O–, присутствующего в виде дефектов [17–19]. Следует отметить, что данные РФА свидетельствуют о присутствии кислородсодержащей фазы (HfO2, рис. 3а).
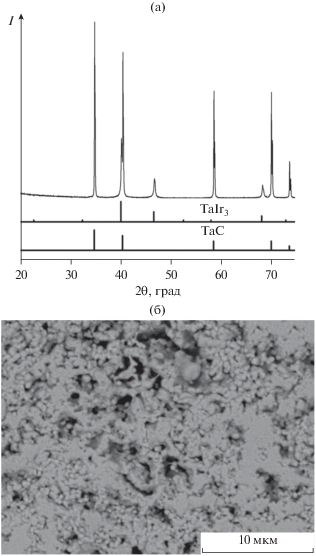
Результаты РФА и СЭМ системы Ir–TaC после воздействия высокой температуры (1100°С) приведены на рис. 5а, 5б. Согласно РФА, весь иридий в покрытии прореагировал с карбидом тантала с образованием интерметаллического твердого раствора замещения на основе TaIr3. Параметры решетки TaIr3 незначительно смещены в бóльшую сторону (3.888 Å по сравнению с 3.886 Å), что может свидетельствовать о некотором смещении состава [10]. Размер ОКР интерметаллического твердого раствора, оцененный по данным РФА, составляет 43 нм. Морфология поверхности представлена зернами субмикронного размера (рис. 5б). Параметры решетки карбида тантала остались без изменений в пределах погрешности ±0.001 (4.457 Å) и соответствуют практически стехиометрическому составу TaC.
Рис. 5.
Рентгенофазовый анализ (а) и СЭМ-снимок (б) иридиевого покрытия на карбиде тантала после термической обработки при 1100°С.
Данные РФЭС представлены на рис. 6а–6в и в табл. 1. В спектре Ta 4f присутствуют дублеты 4f7/2 и 4f5/2. Дублет (E = 23.0 эВ) можно отнести к состоянию Ta0. Значение энергии несколько отличается от литературных данных (табл. 1). Присутствие этого дублета может быть связано с образованием интерметаллида TaIr3 – x, а наблюдаемое смещение обусловлено, по-видимому, взаимодействием тантала с иридием. Интересно отметить, что энергия уровня Та 4f7/2 в субкарбиде Ta2C тоже близка к этому значению и составляет 23.08 эВ. Однако образование этого карбида после воздействия температуры 1100°С на систему Ir–TaC представляется маловероятным. Второй дублет (E = 23.7 эВ) близок к состоянию тантала в карбиде TaC. Наконец, третий дублет соответствует танталу в окисленном состоянии Ta5+, что свидетельствует о возможном наличии оксидной рентгеноаморфной фазы Ta2O5. Атомное соотношение Ta0 и Ta5+ составляет 3.6 : 1, что соответствует ~11 мол. % Ta2O5. Присутствие компоненты О 1s также обнаружено в обзорном РФЭ-спектре этой системы.
Рис. 6.
Рентгеновские фотоэлектронные спектры Ta 4f (а), Ir 4f (б), C 1s (в) и O 1s (г) иридиевого покрытия на карбиде тантала после термической обработки при 1100°С.
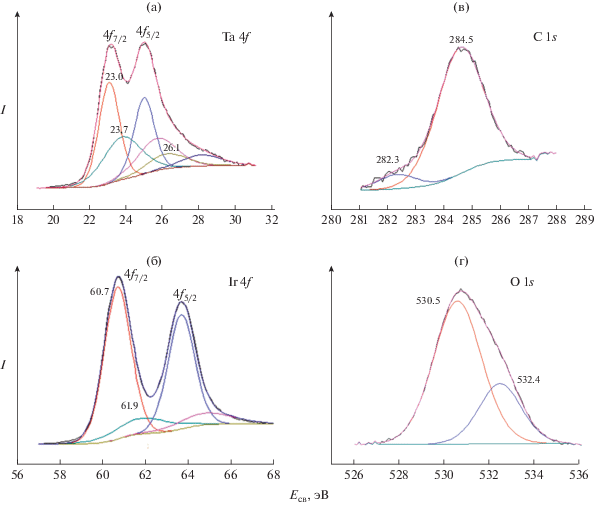
РФЭ-спектр иридия на ТаС аналогичен спектру иридиевого покрытия на HfC (рис. 6б, 4б). Наблюдаемые компоненты спектра 4f7/2 (Е = 60.7 эВ) можно отнести к состоянию иридия в составе интерметаллического твердого раствора TaIr3 –x. Поскольку на рентгенограмме продукта, полученного при прогреве Ir–TaC отсутствует металлический иридий, спектр уровня 4f7/2 относится лишь к иридию в TaIr3 –x. В спектре углерода уровня C 1s присутствуют две компоненты (рис. 6в). Меньшая по энергии компонента соответствует углероду в составе карбидной фазы TaC. Интенсивная полоса с энергией 284.5 эВ соответствует свободному углероду. Следует отметить, что данные РФЭС для системы Ir–TaC получены впервые. Однако необходимо провести дополнительные исследования для более точной интерпретации этих данных.
В спектре кислорода O 1s присутствуют две линии, имеющие энергию связи 530.5 и 532.4 эВ (рис. 6г), что указывает на наличие кислорода в составе образца и согласуется с данными спектра Ta 4f. Первая компонента с энергией 530.5 эВ относится к кислороду в составе Ta2O5, вторая компонента характерна для кислорода в состоянии O– [17–19].
В целом взаимодействие в двух различных системах (иридиевое покрытие на карбиде гафния и на карбиде тантала) при нагреве до 1100°С схоже. В обоих случаях наблюдается формирование интерметаллического соединения, в котором энергия связи для нейтрального состояния Hf0 и Ta0 выше на 0.3–1 эВ по сравнению с чистыми металлами. В спектре иридия смещение компоненты спектра Ir 4f7/2 по сравнению с чистым металлом невелико и составляет всего 0.1 эВ, что входит в погрешность измерения энергии связи. Похожий результат ранее был получен для интерметаллического соединения Al3Ni, в котором смещение энергии для полосы Ni 2p3/2 составило +0.5 эВ по сравнению с чистым металлом, а смещение энергии для полосы Al 2p по сравнению с чистым металлом было незначительно (в пределах ±0.1 эВ) [21]. Следует также отметить, что литературные данные о состоянии металлов в интерметаллических соединениях крайне ограничены, поэтому сделать однозначное отнесение компонентов РФЭ-спектра Ir 4f7/2 к интерметаллиду или к чистому металлу затруднительно. РФЭ-спектры Ir 4f7/2 систем на основе HfC–Ir и TaC–Ir оказались недостаточно чувствительны к состоянию атомов иридия. Внести ясность в трактовку результатов позволили данные РФА. Действительно, на рентгенограмме системы HfC–Ir, прошедшей термообработку, присутствуют пики как иридия металлического, так и интерметаллида HfIr3 –x.
Второй аспект схожести систем заключается в присутствии кислородсодержащих фаз в составе покрытия. Более отчетливо этот результат проявился для системы HfC–Ir, после термообработки на рентгенограмме образца были обнаружены пики, принадлежащие моноклинному диоксиду гафния. На карбиде тантала оксидная фаза методом РФА не фиксируется, однако детектируется с помощью РФЭС. Появление оксидных фаз, как отмечалось выше, может быть обусловлено взаимодействием кислородсодержащих продуктов распада прекурсора с карбидной подложкой в процессе MOCVD-осаждения либо присутствием следовых количеств кислорода в потоках газов-носителей.
ЗАКЛЮЧЕНИЕ
Методом MOCVD получены нанокристаллические иридиевые покрытия на подложках из карбидов гафния и тантала при температуре 600°С. Последующая высокотемпературная обработка при 1100°С приводит к химическому взаимодействию иридия с карбидами гафния и тантала с образованием наноразмерных (40–43 нм) интерметаллических твердых растворов замещения MIr3 – x и выделением свободного углерода. Наличие интерметаллического взаимодействия подтверждается данными РФЭ-спектров по смещению полос Hf 4f7/2 и Ta 4f7/2 в область бóльших энергий на 0.3–1 эВ.
Осаждение иридиевого покрытия из металлоорганических прекурсоров сопровождается, по-видимому, взаимодействием кислородсодержащих газообразных продуктов разложения прекурсора с карбидной подложкой. Последующая высокотемпературная обработка приводит к образованию и кристаллизации оксидных фаз.
Список литературы
Симоненко Е.П., Симоненко Н.П., Лысенко А.С. и др. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 420. https://doi.org/10.31857/S0044457X20030149
Симоненко Е.П., Симоненко Н.П., Петричко М.И. и др. // Журн. неорган. химии. 2019. Т. 64. № 11. С. 1127. https://doi.org/10.1134/S0044457X19110199
Симоненко Е.П., Гордеев А.Н., Симоненко Н.П. и др. // Журн. неорган. химии. 2016. Т. 61. № 10. С. 1259. [Simonenko E.P., Simonenko N.P., Sevastyanov V.G. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 10. P. 1203. https://doi.org/10.1134/S003602361610017X]https://doi.org/10.7868/S0044457X16100172
Musa C., Licheri R., Orrù R. et al. // Sol. Energy. 2018. V. 169. P. 111. https://doi.org/10.1016/j.solener.2018.04.036
Sani E., Mercatelli L., Fontani D. et al. // J. Renewable Sustainable Energy. 2011. V. 3. P. 063107. https://doi.org/10.1063/1.3662099
Mackie W.A., Lovell J.M., Magera G.G. // IVESC 2012. Monterey. CA. USA: IEEE. 2012. P. 129. https://doi.org/10.1109/IVESC.P.2012.6264168
Hwang W.S., Chan D., Cho B.J. // IEEE Trans. Electron Devices. 2008. V. 55. № 9. P. 2469. https://doi.org/10.1109/TED.2008.927946
Кан Х.С., Кульварская Б.С. // ЖТФ. 1973. Т. 43. № 6. С. 1269.
Lozanov V.V., Baklanova N.I., Bulina N.V. et al. // ACS Appl. Mater. Interfaces. 2018. V. 10. № 15. P. 13 062. https://doi.org/10.1021/acsami.8b01418
Baklanova N.I., Lozanov V.V., Titov A.T. // Corros. Sci. 2018. V. 143. P. 337. https://doi.org/10.1016/j.corsci.2018.08.044
Vasilyev V.Yu., Morozova N.B., Basova T.V. et al. // RSC Adv. 2015. V. 5. P. 32034. https://doi.org/10.1039/C5RA03566J
Jun C.K., Shaffer P.T.B. // J. Less-Common Met. 1971. V. 24. № 3. P. 323. https://doi.org/10.1016/0022-5088(71)90113-5
Halvorson J.J., Wimber R.T. // J. Appl. Phys. 1972. V. 43. P. 2519. https://doi.org/10.1063/1.1661553
Baker R.T.K., Sherwood R.D. // J. Catal. 1980. V. 61. № 2. P. 378. https://doi.org/10.1016/0021-9517(80)90385-1
Fisher R.F., Alvey M.D., George P.M. // J. Vac. Sci. Technol. A. 1992. V. 10. № 4. P. 2253. https://doi.org/10.1116/1.577927
Wang H., Carter E.A. // J. Am. Chem. Soc. 1993. V. 115. № 6. P. 2357. https://doi.org/10.1021/ja00059a034
Wagner C.D. The NIST X-Ray Photoelectron Spectroscopy (XPS) Database. Oakland, CA, USA: Natl. Inst. Stand. Technol. 1991. https://nvlpubs.nist.gov/ nistpubs/Legacy/TN/nbstechnicalnote1289.pdf
Naumkin A.V., Kraut-Vass A., Gaarenstroom S.W., Powell C.J. NIST Standard Reference Database 20. Version 4.1. 2012. https://doi.org/10.18434/T4T88K
Dupin J.-Ch., Gonbeau D., Vinatier P. et al. // Phys. Chem. Chem. Phys. 2000. V. 2. P. 1319. https://doi.org/10.1039/A908800H
Huang F., Wan Z., Jin Y. et al. // J. Electrochem. Soc. 2017. V. 164. № 13. B632. https://doi.org/10.1149/2.0641713jes
Bertóti I., Mohai M., Csanády A. et al. // Surf. Interface Anal. 1992. V. 19. P. 457. https://doi.org/10.1002/sia.740190186
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии