Журнал неорганической химии, 2020, T. 65, № 11, стр. 1443-1448
C-борилированные сложные эфиры и амиды на основе клозо-додекаборатного аниона: синтез и физико-химические свойства
И. Н. Клюкин a, *, Н. А. Селиванов b, А. Ю. Быков b, А. П. Жданов b, К. Ю. Жижин b, Н. Т. Кузнецов b
a Санкт-Петербургский государственный технологический институт (Технический университет)
190013 Санкт-Петербург, Московский пр-т, 26, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: klukinil@gmail.com
Поступила в редакцию 30.04.2020
После доработки 15.05.2020
Принята к публикации 27.05.2020
Аннотация
Изучен процесс нуклеофильного присоединения монокарбонильного производного клозо-додекаборатного аниона [B12H11CO]– с N- и O-нуклеофилами. Показано, что данный процесс протекает в мягких условиях и с высоким выходoм. При этом обнаружено, что возможно присоединение не только первичных и вторичных, но и третичных аминов. Полученные борилированные производные термически неустойчивы, и при нагревании происходит процесс расщепления связей C–O, C–N с образованием исходного аниона [B12H11CO]–. В кислой среде в водных растворах происходит гидролиз борилированных производных с образованием карбоксилатного производного общего вида [B12H11COOH]2–.
ВВЕДЕНИЕ
Химия кластерных соединений бора берет свое начало в середине XX в., когда были заложены теоретические и экспериментальные основы этой области знаний [1, 2]. За это время были синтезированы и изучены свойства разнообразных классов борсодержащих соединений: клозо-, нидо- и арахно-боранов, карборанов, металлоборанов [3–6]. Было обнаружено, что подобные соединения обладают разнообразными свойствами: оптическими, термическими, магнитными [7–9].
Особое место в химии кластерных соединений бора занимают клозо-бороводородные анионы с общей формулой [BnHn]2– (n = 5–12) [10–12]. Данный класс соединений способен вступать в реакции экзо-полиэдрического замещения атомов водорода на различные функциональные группы, что позволяет создавать сложные молекулярные ансамбли заданного строения. Для проведения процессов замещения часто требуются довольно жесткие условия синтеза: проведение реакций в сильнокислой среде при высоких температурах, добавление избытка окислителя [13, 14]. Все это приводит к тому, что зачастую с образованием целевых веществ наблюдается большое количество продуктов деструкции кластера [15]. Анионы [B10H10]2– и [B12H12]2– практически не подвергаются деструкции в описанных выше условиях, что обусловливает такой высокий интерес к химии данных кластерных соединений [16, 17].
Основное внимание исследователей в химии кластерных анионов бора направлено на синтез и изучение физико-химических свойств производных клозо-боратных анионов с экзо-полиэдрическими кратными связями. Нитрилевые производные кластерных анионов бора [BnHn– 1NCR]– (n = 10, 12, R = алкил, арил) являются наиболее изученным классом подобных соединений [18, 19]. Другим интересным классом соединений являются карбонильные производные общего вида [BnHn – x(СO)x]2– x (n = 10, 12, x = 1, 2) [20–22]. Ранее в нескольких работах было изучено взаимодействие монокарбонильных производных [BnHn– 1СO]– (n = 10, 12) с N- и O-нуклеофилами [23–26]. Ранее в работе [27] нами были изучены подходы к синтезу борилированных амидов на основе процессов взаимодействия производного [B10H9CO]– с аминами. Было показано, что в процессе нуклеофильного присоединения могут участвовать не только первичные и вторичные, но и третичные амины.
Цель настоящей работы – синтез борилированных сложных эфиров и амидов клозо-додекаборатного аниона на основе взаимодействия монокарбонильного производного общего вида [B12H11CO]– с одноатомными спиртами и аминами. Для целевых производных была изучена гидролитическая и термическая стабильность.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Элементный анализ на углерод, водород и азот осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba).
Определение бора методом ICP MS выполняли на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo в ЦКП “Научно-аналитического центра ФГУП “ИРЕА” Национального исследовательского центра Курчатовский институт”.
ИК-спектры соединений записывали на ИК-Фурье-спектрофотометре Инфралюм ФТ-08 (НПФ АП “Люмекс”) в области 4000–600 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензии исследуемого вещества в вазелиновом масле (Aldrich).
Спектры ЯМР (1H, 11B, 13C) растворов исследуемых веществ в CD3CN записывали на спектрометре Bruker Avance II-300 на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан или эфират трехфтористого бора. Исследования выполнены с использованием оборудования ЦКП ФМИ ИОНХ РАН, функционирующего при поддержке государственного задания ИОНХ РАН в области фундаментальных научных исследований.
Синтез и очистка исходных веществ и реагентов
((C6H5)4P)[B12H11CO] получали по известной методике [23]. Ацетонитрил CH3CN (Aldrich, 99%) и гидрид натрия NaH (Aldrich, 98%) использовали без предварительной очистки. Метанол CH3OH, изо-пропанол C3H7OH и трет-бутанол (CH3)3СOH абсолютизировали по методике [28].
Синтез борилированных сложных эфиров
((C6H5)4P)2[B12H11COOCH3]. ((С6H5)4P)[B12H11CO] (0.20 г, 0.4 мкмоль) растворяли в ацетонитриле (CH3CN, 3.0 мл), добавляли метанол (CH3OH, 1.0 мл) и гидрид натрия (NaH, 0.02–0.03 г), нагревали в течение 4 ч при температуре 70°C. После окончания процесса раствор охлаждали до комнатной температуры, добавляли ((С6H5)4P)Cl (0.15 г, 0.4 мкмоль) и концентрировали на роторном испарителе. Целевой продукт перекристаллизовывали из метанола и промывали двумя порциями диэтилового эфира. Получено 0.31 г (90%). ИК-спектр (KBr): ν(BH) 2480 см–1 , ν(CO) 1735 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): 2.1 (с, 1B, B(1)), –16.3 (д, 5B, B(2–6)), –17.5 (д, 5B, B(7–11)), –25.6 (д, 1B, B(12)); ЯМР 1H (CD3CN, м.д.): –1.00–1.50 (м, 11H, B12H11), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 3.75 (м, 3H, CH3); ЯМР 13С (CD3CN, м.д.): 177.2 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135. 8 (Ph4P+), 122.7 (Ph4P+), 50.7 (СН3).
((С6H5)4P)2[B12H11СOOCH(CH3)2] получали по методике, аналогичной для ((С6H5)4P)2[B12H11СOOCH3], в качестве нуклеофильного субстрата использовали изо-пропанол (CH3)2CHOH, нагревание проводили в течение 6 ч. Получено 0.31 г (85%). ИК-спектр (KBr): ν(BH) 2480 см–1, ν(CO) 1737 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): 1.7 (с, 1B, B(1)), –16.1 (д, 5B, B(2–6)), –17.2 (д, 5B, B(7–11)), –25.3 (д, 1B, B(12)); ЯМР 1H (CD3CN, м.д.): –1.00–1.50 (м, 11H, B12H11), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 4.61 (м, H, CH ), 1.28 (м, 6H, CH3); ЯМР 13С (CD3CN, м.д.): 171.9 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 66.8 (СН), 20.4 (СН3).
((С6H5)4P)2[B12H11СOOC(CH3)3] получали по методике, аналогичной для ((С6H5)4P)2[2-B10H9СOOCH3], в качестве нуклеофильного субстрата использовали трет-бутанол (CH3)3COH, нагревание проводили в течение 6 ч. Получено 0.29 г (81%). ИК-спектр (KBr): ν(BH) 2480 см–1, ν(CO) 1738 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): 2.3 (с, 1B, B(1)), –15.9 (д, 5B, B(2–6)), –17.0 (д, 5B, B(7–11)), –25.3 (д, 1B, B(12)); ЯМР 1H (CD3CN, м.д.): –1.00–1.50 (м, 11H, B12H11), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 1.52 (т, 9H, CH3(α)); ЯМР 13С (CD3CN, м.д.): 172.1 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 77.8 (C(СН3)3), 28.1 (C(СН3)3).
Синтез борилированных амидов
((С6H5)4P)2[B12H11СONHC4H9]. ((С6H5)4P)[B12H11CO] (0.20 г, 0.4 мкмоль) растворяли в ацетонитриле (CH3CN) (5 мл), добавляли BuNH2 (0.3 мл) и нагревали в течение 5 ч при температуре 70°C. После окончания процесса раствор охлаждали до комнатной температуры, добавляли ((С6H5)4P)Cl и концентрировали на роторном испарителе. Целевой продукт перекристаллизовывали из ацетона ((CH3)2CO) и промывали двумя порциями диэтилового эфира. Получено 0.31 г (84%). ИК-спектр (суспензия в вазелиновом масле): ν(BH) 2480 см–1 , ν(NH): 3430 см–1, ν(CO) 1643 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): –0.6 (с, 1B, B(1)), –14.6 (д, 5B, B(2–6)), –15.7 (д, 6B, B(7–12); ЯМР 1H (CD3CN, м.д.): –1.00–1.50 (м, 11H, B12H11), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 6.71 (шир. сигнал, 1H, NH), 2.99 (м, 2H, CH2CH2CH2CH3), 1.65 (м, 2H, CH2CH2CH2CH3), 1.45 (м, 2H, CH2CH2CH2CH3), 0.95 (т, 3H, CH2CH2CH2CH3); ЯМР 13С (CD3CN, м.д.): 190.1 (BCON), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 39.7 (CH2CH2CH2CH3), 32.1 (CH2CH2CH2CH3), 19.6 (CH2CH2CH2CH3), 13.4 (CH2CH2CH2CH3).
((С6H5)4P)2[B12H11СON(C4H9)2] получали по методике, аналогичной для ((С6H5)4P)2[B12H11СONHC4H9], в качестве нуклеофильного субстрата использовали дибутиламин (C4H9)2NH. Получено 0.32 г (83%). ИК-спектр (KBr): ν(BH) 2480 см–1, ν(CO) 1640 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): –1.0 (с, 1B, B(1)), –14.9 (д, 5B, B(2–6)), –15.8 (д, 6B, B(7–12); ЯМР 1H (CD3CN, м.д.): –1.00–1.50 (м, 11H, B12H11), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 3.09 (т, 4H, CH2CH2CH2CH3), 1.51 (м, 4H, CH2CH2CH2CH3), 1.25 (м, 4H, CH2CH2CH2CH3), 1.01 (т, 6H, CH2CH2CH2CH3); ЯМР 13С (CD3CN, м.д.): 191.5 (BCON), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 52.9 (CH2CH2CH2CH3), 33.6 (CH2CH2CH2CH3), 22.3 (CH2CH2CH2CH3), 14.6 (CH2CH2CH2CH3).
((С6H5)4P)[B12H11СON(C2H5)3] получали по методике, аналогичной для ((С6H5)4P)2[B12H11СONHC4H9], в качестве нуклеофильного субстрата использовали триэтиламин (C2H5)3N. Получено 0.19 г (81%). ИК-спектр (KBr): ν(BH) 2480 см–1, ν(CO) 1645 см–1; ЯМР 11B-{1H} (CD3CN, м.д): –0.8 (с, 1B, B(1)), –14.5 (д, 5B, B(2–6)), –15.5 (д, 6B, B(7–12); ЯМР 1H (CD3CN, м.д.): –1.00–1.50 (м, 11H, B12H11), 8.07 (м, 4H, Ph4P+), 7.90 (м, 8H, Ph4P+), 7.80 (м, 8H, Ph4P+), 3.09 (кв., 6H, CH2CH3), 1.31 (м, 9H, CH2CH3); ЯМР 13С (CD3CN, м.д.): 187.1 (BCON), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 51.5 (СН2CH3), 13.9 (СН2CH3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
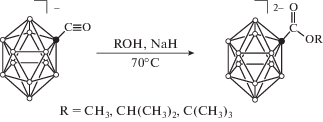
Первоначально нами было изучено взаимодействие монокарбонильного производного общего вида [B12H11CO]– с молекулами спиртов (рис. 1). Процесс нуклеофильного присоединения одноатомных спиртов к производному [B12H11CO]– проходил в среде ацетонитрила при температуре 70°С и приводил к образованию борилированных сложных эфиров общего вида [B12H11COOR]2–. В качестве нуклеофильных органических субстратов использовали молекулы метилового CH3OH, изо-пропилового CH(CH3)2OH и трет-бутилового C(CH3)3OH спиртов. Во всех случаях в качестве основания добавляли гидрид натрия NaH, что позволило сократить время процесса и повысить выход целевых производных. Процесс присоединения вторичных и третичных спиртов протекает за более длительное время по сравнению со взаимодействием с первичными спиртами. Контроль за ходом реакции и определение структуры получившихся производных осуществляли методами мультиядерной ЯМР- и ИК-спектроскопии. Так, спектр ЯМР 11B соединения ((C6H5)4P)2[B12H11COOCH3] имеет следующий вид: сигнал от замещенного атома бора при 2.1 м.д., который не расщепляется в дублет в отсутствие широкополосного подавления спин-спинового взаимодействия, два сигнала в сильном поле при –16.3 и –17.5 м.д. с общей интегральной интенсивностью, равной 10, а также сигнал в сильном поле при –25.6 м.д. Данный вид спектра соответствует монозамещенному производному клозо-додекаборатного аниона. В спектре ЯМР 1H ((C6H5)4P)2[B12H11COOCH3] помимо сигналов от катионов присутствует сигнал от атомов экзо-полиэдрического заместителя: сигнал при 3.75 м.д. от метильных протонов. В спектре ЯМР 13С этого соединения помимо сигналов от тетрафенилфосфониевых катионов наблюдаются сигналы от углеродных атомов экзо-полиэдрического заместителя: при 177.2 м.д. от карбоксилатного атома углерода и при 50.7 м.д. от атома углерода метильной группы.
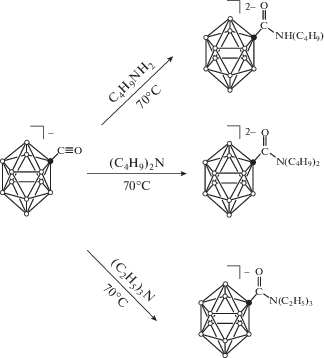
Взаимодействие [B10H9CO]– с аминами протекает так же, как и со спиртами, в мягких условиях в ацетонитриле при температуре 70°С (рис. 2). При этом стоит отметить, что в данный процесс способны вступать не только первичные и вторичные, но и третичные амины. Контроль за ходом реакции и определение структуры образующихся производных осуществляли методами мультиядерной ЯМР- и ИК-спектроскопии. ЯМР 11B спектр амидного производного отличается от спектра сложноэфирного производного. Так, спектр соединения (С6H5)4P)2[B12H11CONHC4H9] имеет следующий вид: сигнал от замещенного атома бора при –0.6 м.д., который не расщепляется в дублет в отсутствие широкополосного подавления спин-спинового взаимодействия, два сигнала в сильном поле при –14.6 и –15.7 м.д. с общей интегральной интенсивностью, равной одиннадцати.
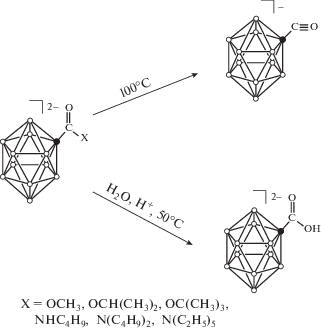
Как и в случае клозо-декаборатного аниона, обнаружено, что, в отличие от органических аналогов, в полученных борилированных производных связи C–N и C–O являются очень лабильными и способными расщепляться при нагревании (рис. 3). Так, при нагревании полученных производных до 100°C наблюдается расщепление связей C–O и С–N с образованием исходного аниона [B12H11CO]–. Образование исходного производного подтверждается методом 11B ЯМР-спектроскопии. Так, в 11B ЯМР-спектре полностью исчезают сигналы целевых соединений и наблюдаются сигналы, характерные для монозамещенного общего вида [B12H11CO]–: сигнал при 5.4 м.д. с интегральной интенсивностью, равной 1, группа сигналов в сильном поле при –14.2, –15.3, ‒17.2 м.д. и сигнал от атома бора в замещенной позиции при –33.6 м.д.
При нагревании водных растворов продуктов при 50°С и pH < 3 в течение 3 ч происходит полный гидролиз борилированных производных с образованием карбоксилатного производного общего вида [B12H11COOH]2–. Процесс гидролиза целевых производных наблюдается с помощью 1H и 13С ЯМР-спектроскопии. В спектрах борсодержащих веществ, полученных после выделения и очистки из реакционной смеси, исчезают сигналы от экзо-полиэдрических алкильных заместителей. В 1H ЯМР-спектре появляется сигнал при 4.35 м.д., соответствующий протону экзо-полиэдрической карбоксильной группы COOH. В 13С ЯМР-спектре наблюдается сильное смещение сигнала карбоксилатного атома углерода в слабое поле, и соответствующий пик проявляется при 192 м.д.
ЗАКЛЮЧЕНИЕ
Изучен процесс нуклеофильного присоединения при взаимодействии монокарбонильного производного клозо-додекаборатного аниона [B12H11CO]– с N- и O-нуклеофилами. Показано, что данный процесс протекает в мягких условиях и с высоким выходом. При этом обнаружено, что возможно присоединение не только первичных и вторичных, но и третичных аминов. Полученные борилированные производные термически неустойчивы, и при нагревании происходит процесс расщепления связей C–O, C–N с образованием исходного аниона [B2H11CO]–. В кислой среде в водных растворах происходит гидролиз борилированных производных с образованием карбоксилатного производного общего вида [B12H11COOH]2–.
Список литературы
Hoffmann R., Lipscomb W.N. // J. Chem. Phys. 1962. V. 36. № 8. P. 2179. https://doi.org/10.1063/1.1732849
Eberhardt W.H., Crawford B., Lipscomb W.N. // J. Chem. Phys. 1954. V. 22. № 6. P. 989. https://doi.org/10.1063/1.1740320
Shmal’ko A.V., Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1726. https://doi.org/10.1134/S0036023619140067
Nandi C., Kar S., Zafar M. et al. // Inorg. Chem. 2020. V. 59. № 6. P. 3537. https://doi.org/10.1021/acs.inorgchem.0c00122
Hansen B.R.S., Paskevicius M., Li H.W. et al. // Coord. Chem. Rev. 2016. V. 323. P. 60. https://doi.org/10.1016/j.ccr.2015.12.003
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czechoslov. Chem. Commun. 2002. V. 67. № 6. P. 679. https://doi.org/10.1135/cccc20020679
Stockmann P., Gozzi M., Kuhnert R. et al. // Chem. Soc. Rev. 2019. V. 48. № 13. P. 3497. https://doi.org/10.1039/c9cs00197b
Mukherjee S., Thilagar P. // Chem. Commun. 2016. V. 52. № 6. P. 1070. https://doi.org/10.1039/c5cc08213g
Viñas I Teixidor C. // Future Med. Chem. 2013. V. 5. № 6. P. 617. https://doi.org/10.4155/fmc.13.41
Zhizhin K.Y., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Polyhedron 2016. V. 105. № February. P. 205. https://doi.org/10.1016/j.poly.2015.11.049
Sivaev I.B., Bregadze V.V. // Eur. J. Inorg. Chem. 2009. № 11. P. 1433. https://doi.org/10.1002/ejic.200900003
Hawthorne M.F., Mavunkal I.J., Knobler C.B. // J. Am. Chem. Soc. 1992. V. 9. № 2. P. 4427.
Bayer M.J., Hawthorne M.F. // Inorg. Chem. 2004. V. 43. № 6. P. 2018. https://doi.org/10.1021/ic030289w
Knoth W.H., Sauer J.C., Balthis J.H. et al. // J. Am. Chem. Soc. 1967. V. 3973. № 11. P. 4842.
Kubasov A.S., Matveev E.Y., Turyshev E.S. et al. // Inorg. Chim. Acta. 2018. V. 477. P. 277. https://doi.org/10.1016/j.ica.2018.03.013
Kubasov A.S., Turishev E.S., Polyakova I.N. et al. // J. Organomet. Chem. 2017. V. 828. P. 106. https://doi.org/10.1016/j.jorganchem.2016.11.035
Laila Z., Yazbeck O., Ghaida F.A. et al. // J. Organomet. Chem. 2020. V. 910. P. 121132. https://doi.org/10.1016/j.jorganchem.2020.121132
Zhdanov A.P., Voinova V.V., Klyukin I.N. et al. // J. Clust. Sci. 2019. V. 2. https://doi.org/10.1007/s10876-019-01628-2
Shelly K., Knobler C.B., Hawthorne M.F. // Inorg. Chem. 1992. V. 31. № 13. P. 2889. https://doi.org/10.1021/ic00039a041
Klyukin I.N., Novikov A.S., Zhdanov A.P. et al. // Mendeleev Commun. 2020. V. 30. № 1. P. 88. https://doi.org/10.1016/j.mencom.2020.01.029
Qin X.F., Wu H.S., Jiao H. // J. Mol. Struct. THEOCHEM. 2007. V. 822. № 1–3. P. 111. https://doi.org/10.1016/j.theochem.2007.08.001
Lisovskii M.V., Plyavnik N.V., Serebrennikova G.A. et al. // Russ. J. Inorg. Chem. 2005. V. 50. № 1. P. 20. [Лисовский М.В., Плавник Н.В., Серебренникова Г.А. и др. // Журн. неорган. химии. 2005. Т. 50. № 1. С. 24.]
Wilbur D.S., Thakar M.S., Hamlin D.K. et al. // Bioconjug. Chem. 2009. V. 20. № 10. P. 1983. https://doi.org/10.1021/bc9000799
Wilbur D.S., Chyan M., Nakamae H. et al. // Bioconjug. Chem. 2012. V. 23. P. 409.
Wilbur D.S., Chyan M.K., Hamlin D.K. et al. // Nucl. Med. Biol. 2010. V. 37. № 2. P. 167. https://doi.org/10.1016/j.nucmedbio.2009.10.004
Klyukin I.N., Selivanov N.A., Bykov A.Y. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 11. P. 1405. [Клюкин И.Н., Селиванов Н.А., Быков А.Ю. и др. // Журн. неорган. химии. 2019. Т. 64. № 11. С. 1179.] https://doi.org/10.1134/S0036023619110081
Leonard J., Lygo B., Procter G. // Advanced Practical Organic Chemistry, Boca Raton, 2013.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии