Журнал неорганической химии, 2020, T. 65, № 11, стр. 1558-1564
Сорбция фторид-ионов композитами на основе целлюлозы и оксида алюминия
А. В. Долганов a, А. В. Баландина a, *, Д. Б. Чугунов a, А. С. Тимонина a, А. В. Князев b
a Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева
430005 Саранск, ул. Большевистская, 68, Россия
b Университет Лобачевского
603950 Нижний Новгород, пр-т Гагарина, 23, Россия
* E-mail: iman081@gmail.com
Поступила в редакцию 03.03.2020
После доработки 10.06.2020
Принята к публикации 27.06.2020
Аннотация
Исследованы сорбционные свойства композита на основе микрокристаллической целлюлозы и химически иммобилизованной на ее поверхность наноразмерной пленки из оксида алюминия для удаления фторид-ионов из воды. Показано, что оптимальная толщина слоя, при которой происходит максимальная сорбция ионов фтора, составляет 50 нм. Изучено влияние на сорбцию различных параметров, таких как рН раствора и время сорбции. Определены кинетические параметры процесса сорбции и лимитирующая стадия процесса. Данные о протекании ионообменного механизма сорбции фторид-ионов полученным сорбентом подтверждены с помощью ИК-спектроскопического анализа.
ВВЕДЕНИЕ
Фтор является одним из жизненно важных элементов в организме человека, проявляя терапевтическое действие только в микроскопических дозах. Однако в больших количествах фтор несет опасность для здоровья. Основное количество фторид-ионов поступает в организм с водой. Во многих регионах Российской Федерации и в мире [1] остро стоит проблема избытка фтора в питьевых и подземных водах, что является одной из серьезных проблем. По данным Всемирной организации здравоохранения, концентрация фтора в питьевой воде не должна превышать 1.5 мг/л. Фторидные и фторсодержащие минералы в горных породах и почвах служат источником повышенного содержания фтора в подземных водах, которые являются основным источником питьевой воды. Большое количество фторидов выделяется также при производстве стекла, в химической и металлургической промышленности, поэтому важно удалить излишки фтора из питьевой воды.
Для удаления избытка фтора из воды используются различные методы, такие как адсорбция [2–10 ], ионный обмен [11], обратный осмос [12], осаждение в виде малорастворимых соединений [13, 14], электродиализ, электрокоагуляция [15] и т.д.
Среди всех методов, упомянутых выше, адсорбция признана наиболее эффективным методом удаления фтора из-за низкой стоимости, высокой эффективности и экологичности.
В ряде работ показано, что эффективность удаления фтора сильно зависит от рН раствора [16, 17], наиболее эффективно фторид-ионы адсорбируются при значениях рН 5–7.
В работе [18] исследован механизм адсорбции на α-Al2O3, а авторами [19] изучено влияние температуры на этот процесс.
Широко изучали активированный Al2O3 с поверхностью, модифицированной соединениями La(III) и Y(III) [20], оксидом марганца [21] и путем пропитки квасцами [22], нанесения оксида меди [23], магнезиальной активации [24].
В литературе описаны способы очистки воды от фтора с использованием адсорбентов на основе TiO2 [25], титаната висмута и алюминия [26], оксидов марганца и церия [27].
Композитные материалы неорганического происхождения, содержащие природные полимеры, привлекают внимание исследователей в качестве адсорбентов, так как имеют ряд преимуществ. Целлюлоза является наиболее распространенным возобновляемым биополимером на Земле [28, 29]. Она также доступна по цене, безопасна и обладает развитой поверхностью.
В настоящей работе исследованы адсорбционные свойства микрокристаллической целлюлозы, на которую с помощью технологии атомно-слоевого осаждения (АСО) нанесен нанослой оксида алюминия. С использованием полученного композиционного материала изучен процесс сорбции фторид-ионов из воды, исследована зависимость сорбционной емкости от толщины слоя оксида алюминия, времени контакта раствора с сорбентом, рН раствора, а также определены кинетические параметры данного процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все использованные химические реактивы имели квалификацию “х. ч.” и “ч. д. а.”: ализаринкомплексон (ТУ 6-09-4547), лантан азотнокислый 6-водный (ТУ 6-09-4676), натрий уксуснокислый 3-водный (ГОСТ 199), гидроксид натрия (ГОСТ 4328), кислота уксусная (ГОСТ 61), фиксаналы соляной и азотной кислот. В экспериментах использовали деионизированную воду. Все эксперименты проводили при комнатной температуре и нормальном атмосферном давлении.
В качестве исходной матрицы использовали пленки на основе микрокристаллической целлюлозы. Перед этапом нанесения пленки из микрокристаллической целлюлозы ее помещали в реактор и проводили процесс.
Модельный раствор фторид-ионов определенной концентрации был приготовлен путем разбавления стандартного образца ГСО 7261-96.
Сорбент представляет собой целлюлозу, на которую с помощью технологии АСО наносили пленку Al2O3 различной толщины. Принцип нанесения тонких пленок методом АСО заключается в следующем. Подложку, находящуюся в вакуумной камере, при рабочей температуре подвергали поочередно воздействию двух реагентов (прекурсоров), находившихся в паровом состоянии. Прекурсоры, реагируя только на поверхности подложки, образуют монослой тонкопленочного соединения. Толщину нанесенных слоев определяли по ранее полученным калибровочным прямым [30]. На рис. 1 представлена типичная картина, получаемая при использовании метода растровой электронной спектроскопии для изучения среза полученных пленок. Как видно из рис. 1, формируется плотная пленка из оксида алюминия, имеющая практически одинаковую толщину по всему контуру.
Рис. 1.
Структура среза пленки микрокристаллическая целлюлоза/Al2O3, полученного методом растровой электронной микроскопии.

При нанесении пленки оксида алюминия (Al2O3) в качестве прекурсоров использовали триметилалюминий (Al(CH3)3–ТМА) и воду (H2O), температура реактора составляла 100°С. Этот процесс хорошо изучен: рост пленки происходит за счет самоограниченных реакций, и алюминий, содержащий прекурсор, обладает высокой реакционной способностью [31]. Его можно условно разделить на четыре стадии:
1) ввод в камеру паров триметилалюминия; на поверхности подложки триметилалюминий связывается с поверхностью, теряя одну из метильных групп, активными поверхностными группами становятся две метильные группы, связанные с атомом алюминия;
2) продувка камеры газом-носителем для удаления из нее остатков прекурсора и продуктов реакции; после продувки на поверхности подложки остается связанный с поверхностью прекурсор;
3) ввод в камеру паров воды; молекулы воды мгновенно вступают в реакцию с поверхностным монослоем, образуя оксидную пленку и высвобождая метан в качестве летучего продукта реакции, после этой стадии активными поверхностными группами становятся гидроксильные группы;
4) продувка камеры газом-носителем для удаления из нее остатков паров воды и продуктов реакции; при последующем вводе первого прекурсора (в нашем случае триметилалюминия) он снова реагирует с поверхностными гидроксил-группами, начиная новый цикл ALD-процесса, в результате получается тонкая пленка с активными поверхностными группами, участвующими в следующем полуцикле.
В упрощенном виде ALD-процесс можно записать следующим образом:
Эксперименты по адсорбции проводили в стационарном режиме. Образцы пленки из микрокристаллической целлюлозы, модифицированной оксидом алюминия массой от 0.01 до 0.02 г, вводили в раствор фторид-ионов с концентрацией 5 мг/л и перемешивали в течение 1 ч при скорости 200 об/мин. По достижении равновесия массовую концентрацию фторид-ионов измеряли фотометрическим методом (ГОСТ 4386-89) на УФ-видимом спектрофотометре UV-1800 Shimadzu.
С помощью метода атомно-абсорбционной спектроскопии (ААС) определили содержание (мас. %) оксида алюминия, нанесенного на целлюлозу. Содержание составило от 41.40 до 66.94% в зависимости от слоя сорбента. Каждый эксперимент проводили трижды при одних и тех же условиях, стандартное отклонение измерений пределах ±2%. С использованием метода ААС были также исследованы растворы после сорбции с целью изучения процесса выщелачивания ионов из сорбента в раствор.
Далее расчет адсорбционной емкости вели в пересчете на общую массу сорбента и отдельно на оксид алюминия по формуле (1):
где А – адсорбционная емкость сорбента, мг/г; С0 – начальная концентрация фторид-ионов в растворе, мг/л; С – равновесная концентрация фторид-ионов в растворе после сорбции, мг/л; m – общая масса сорбента и масса сорбента в пересчете на Al2O3 , г; V – объем раствора, из которого ведется сорбция, л.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исходный образец пленки из микрокристаллической целлюлозы без нанесения пленки оксида алюминия не обладает адсорбционной способностью. Об этом свидетельствуют нулевые значения емкости на протяжении всего времени эксперимента.
Влияние толщины слоя пленки Al2O3 на сорбцию фторид-ионов
Для определения оптимальных условий адсорбции фторид-ионов была найдена толщина слоя оксида алюминия (варьировалась от 50 до 200 нм с шагом 50 нм) (рис. 2). Результаты эксперимента показывают, что максимальное значение адсорбционной емкости (40.3 мг/г) достигается при толщине слоя оксида алюминия 50 нм, что превосходит значения, представленные в работе [21], где заявленная емкость адсорбента Al(OH)3 составляет 0.19 мг/г, в работе [24] (адсорбент активированный алюминий, емкость 1.45 мг/г), в исследовании [25] (адсорбент Al2O3, пропитанный Mg(OH)2, емкость 10.12 мг/г), у авторов [27] (адсорбент гранулированный гидроксид железа, емкость 7.0 мг/г).
Рис. 2.
Зависимость значений адсорбционной емкости от толщины слоя оксида алюминия на кристаллической микроцеллюлозе (1 – емкость, отнесенная к оксиду алюминия; 2 – к общей массе сорбента).
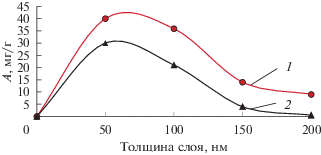
Уменьшение сорбционной емкости с увеличением толщины слоя пленки, вероятно, связано с возникновением частичной кристаллической фазы, что затрудняет связывание фторид-ионов.
Влияние рН раствора на адсорбцию фтора
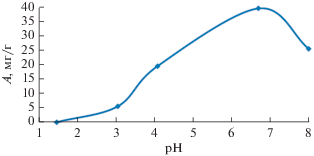
Влияние рН раствора на адсорбцию фторид-ионов было исследовано при проведении эксперимента при различных значениях рН (1.5–8). На рис. 3 представлена адсорбция фторид-ионов на биополимере как функция рН раствора. С увеличением рН возрастает адсорбционная емкость. Адсорбция фтора на сорбенте максимальна при рН 6.8. Дальнейшее увеличение рН способствует уменьшению емкости.
Как показано в [32], эффект рН можно также объяснить рассмотрением точки нулевого заряда адсорбента (рНт. н. з.). Поверхность изучаемого адсорбента положительно заряжена при рН < 2.3 и становится отрицательно заряженной при рН > 2.3. Поэтому при рН < 2.3 адсорбция неблагоприятна из-за отталкивающих электростатических взаимодействий между ионами и положительно заряженными функциональными группами. Максимальная адсорбция фтора происходит при значениях pH выше pHт. н. з., когда поверхность адсорбента имеет сильный отрицательный заряд.
Стабильность сорбента в процессе сорбции исследовали методом ААС, была изучена стабильность полученного материала. После процесса сорбции при различных ее режимах в растворах измеряли концентрацию алюминия. Результаты представлены в табл. 1. Видно, что в изучаемых растворах полностью отсутствуют ионы алюминия, в результате чего можно сделать вывод о том, что полученный материал в условиях сорбции является достаточно устойчивым и стабильным во времени.
Кинетика процесса сорбции
Исследование кинетики сорбции позволяет установить скорость достижения равновесия, максимальную рабочую емкость сорбента для раствора определенного состава, а также механизм взаимодействия ионов фтора с сорбентом при сорбции. Полученные результаты показывают, что сорбция ионов фтора образцом с толщиной слоя оксида алюминия 50 нм протекает интенсивнее, чем образцом с толщиной сорбционного слоя 100 нм (рис. 4).
Рис. 4.
Сорбция фторид-ионов из водного раствора во времени (1 – толщина слоя сорбента 50 нм; 2 – толщина слоя сорбента 100 нм).
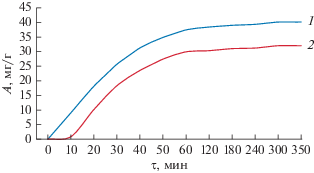
Как показано на рис. 4, адсорбционная емкость значительно увеличивается в течение 1 ч, а после 60 мин происходит ее незначительное изменение и наступает состояние равновесия.
Из литературы известно, что механизм сорбции различных ионов имеет сложный многостадийный характер, и трудно рассмотреть все стадии процесса [33], поэтому на основании кинетического процесса была определена лимитирующая стадия сорбции и вклад диффузионных процессов, критерием определения которых является соблюдение линейной зависимости. Для внешних диффузионных процессов зависимость выглядит следующим образом: –ln(1 – F) = f(τ), и кинетическая кривая данного процесса описывается уравнением (2):
где y – некоторая постоянная величина для данных условий; F – степень достижения равновесия.
С целью подтверждения влияния внешней диффузии на скорость сорбции была получена зависимость –ln(1 – F) = f(τ) (рис. 5).
Рис. 5.
Зависимость –ln(1 – F) от времени сорбции фторид-ионов (1 – толщина слоя сорбента 50 нм; 2 – толщина слоя сорбента 100 нм).
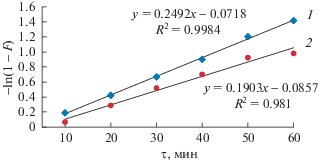
В случае образца, имеющего слой Al2O3 толщиной 100 нм (рис. 5, кривая 2), не на всем участке зависимости –ln(1 – F) от τ наблюдается прямолинейный характер функции –ln(1–F) = f(τ). Полученная закономерность показывает смешанный диффузионный механизм сорбции, т.е. это диффузия сорбата из раствора к поверхности сорбента и диффузия сорбата в зерне сорбента.
Иная картина наблюдается у образца, имеющего слой Al2O3 толщиной 50 нм (рис. 5, кривая 1). Здесь на всем участке наблюдается прямолинейный характер функции –ln(1 – F) = f(τ). Это указывает на то, что сорбционный процесс на сорбенте протекает по внешнему диффузионному механизму.
Для процесса, в котором лимитирующей стадией является внутренняя диффузия, соблюдается следующая прямолинейная зависимость: Гτ = = f(τ1/2) и кинетическая кривая описывается уравнением (3):
где Гτ – количество фторид-ионов на единицу массы сорбента, ммоль/г; Kd – константа скорости внутренней диффузии, ммоль г–1 мин–0.5; А – величина, пропорциональная толщине пленки, окружающей зерно сорбента (отрезок, отсекаемый продолжением прямой зависимости Гτ= f(τ) на оси ординат).Доказательством того, что стадией, лимитирующей сорбционный процесс, является внутренняя диффузия, служит соблюдение линейной зависимости Гτ= f(τ), представленной на рис. 6.
Рис. 6.
Зависимость Г от τ1/2 сорбции фторид-ионов (1 – толщина слоя сорбента 50 нм; 2 – толщина слоя сорбента 100 нм).

На основании полученных зависимостей определены кинетические параметры (константы скорости внутренней диффузии Kd), характеризующие внутреннюю диффузию фторид-ионов сорбентом с толщиной слоя оксида алюминия 50 и 100 нм: Kd (50 нм) = 0.317 л моль–1 с–1; Kd (100 нм) = = 0.179 л моль–1 с–1.
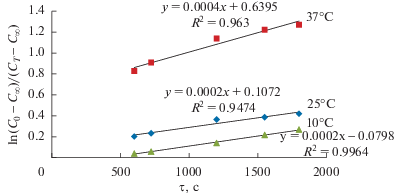
Проведена адсорбция в интервале температур от 10 до 37°С. Как видно из представленных кривых (рис. 7), скорость реакции адсорбции максимальна в первые 20 мин, ближе к 60 мин система приближается к равновесию.
Обработка полученных данных в координатах из уравнения (4)
(4)
$\begin{gathered} k\tau = \left( {{{k}_{1}} + {{k}_{2}}} \right)\tau = \ln \left( {{{C}_{0}}--\frac{{{{C}_{\infty }}}}{{\left( {{{C}_{0}}--{{C}_{\infty }}} \right)--({{C}_{0}}--C)}}} \right) = \\ = \frac{{\ln \left( {{{C}_{0}}--{{C}_{\infty }}} \right)}}{{C--{{C}_{\infty }}}} \\ \end{gathered} $Поскольку кинетика химических реакций хорошо описывает реакции до неполного их завершения, для анализа и построения логарифмической зависимости использовали именно тот участок, когда реакция протекала на 70–80%.
Как видно из рис. 7, логарифмические зависимости имеют линейный характер, что доказывает протекание адсорбции ионов в виде реакции первого порядка [34].
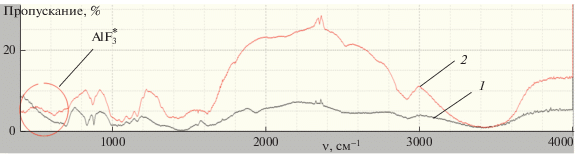
О протекании ионообменного механизма сорбции фторид-ионов полученным сорбентом подтверждают данные ИК-спектроскопии. В ИК-спектрах образцов после сорбции наблюдаются полосы поглощения при 735 и 740 см–1, относящиеся к асимметричным валентным колебаниям связи Al–F (рис. 8).
ЗАКЛЮЧЕНИЕ
Исследована сорбция фторид-ионов материалом на основе целлюлозы, на которую с помощью технологии атомно-слоевого осаждения нанесен нанослой оксида алюминия. Показано, что при минимальной толщине слоя сорбента 50 нм происходит максимальная адсорбция фтора. Для оценки адсорбционной способности сорбента по отношению к фтору была исследована зависимость сорбции от рН раствора. Максимальная сорбционная емкость наблюдается при значении pH 7. Получены изотермы адсорбции фторид-иона, на основе расчета кинетических параметров процесса определена лимитирующая стадия сорбции.
Список литературы
Inaniyan M., Raychoudhury T. // Int. J. Environ. Sci. Technol. 2019. V. 16. P. 7545. https://doi.org/10.1007/s13762-018-2097-9
Ren C., Yu Z., Phillips B.L. et al. // J. Colloid Interface Sci. 2019. V. 557. P. 357. https://doi.org/10.1016/j.jcis.2019.09.039
Mondal P., Purkait M.K. // Chemosph. 2019. V. 235. P. 391. https://doi.org/http:1016/j.chemosphere.2019.06.189
Liu J., Zhao P., Yue Xu, Ji X. // Bioinorg. Chem. Appl. 2019. V. 2019. P. 1. https://doi.org/10.1155/2019/5840205
Wei L., Zietzschmann F., Rietveld L.C., Halem D. // Chemosphere. 2020. V. 243. P. 125307. https://doi.org/10.1016/j.chemosphere.2019.125307
Raghav S., Nair M., Kumar D. // Appl. Surf. Sci. 2019. V. 498. P. 143785. https://doi.org/10.1016/j.apsusc.2019.143785
Kumar R., Mondal S. // Lecture Notes in Civil Engineering. 2020. V. 57. P. 417. https://doi.org/10.1007/978-981-15-0990-2_34
Yang C., Guan L., Wang J. et al. // Environ. Technol. 2019. V. 40. P. 3668. https://doi.org/10.1080/09593330.2018.1484523
Singh N.B., Srivastava Y.K., Shukla S.P., Markandeya J.B. // J. The Instit. Engineers (India): Series A. 2019. V. 100. P. 667. https://doi.org/10.1007/s40030-019-00387-7
Miretzky P., Cirelli A.F.// J. Fluorine Chem. 2011. V. 132 Р. 231. https://doi.org/10.1016/j.jfluchem.2011.02.001
Meenakshi S., Viswanathan N. // J. Colloid Interface Sci. 2007. V. 308. P. 438. https://doi.org/10.1016/j.jcis.2006.12.032
Richards L.A., Richards B.S., Schäfer A.I. // J. Membrane Sci. 2011. V. 369. P. 188. https://doi.org/10.1016/j.memsci.2010.11.069
Labastida I., Armienta M.A., Beltrán M. et al. // J. Geochem. Explor. 2017. V. 183. P. 206. https://doi.org/10.1016/j.gexplo.2016.12.001
Lahnid S., Tahaikt M., Elaroui K. et al. // Desalination. 2008. V. 230. P. 213. https://doi.org/10.1016/j.desal.2007.11.027
Nagaraj A., Sadasivuni K.K., Rajan M. // Carbohydr. Polym. 2017. V. 176. P. 402. https://doi.org/10.1016/j.carbpol.2017.08.089
Farrah H., Slavek J., Pickering W.F. // J. Soil Res. 1987. V. 25. P. 55. https://doi.org/10.1071/SR9870055
Ku Y., Chiou H.-M. // Water Air Soil Pollut. 2002. V. 133. P. 349. https://doi.org/10.1023/A:1012929900113
Bahena J.L.R., Cabrera A.R., Valdivieso A.L., Urbina R.H. // Sep. Sci. Technol. 2002. V. 37. P. 1973. https://doi.org/10.1081/SS-120003055
Valdivieso A.L., Reyes Bahena J.L., Song S., Herrera Urbina R. // J. Colloid Interface Sci. 2006. V. 298. P. 1. https://doi.org/10.1016/j.jcis.2005.11.060
Wasay S.A., Tokunaga S., Park S.W. // Sep. Sci. Technol. 1996. V. 31. P. 1501. https://doi.org/10.1080/01496399608001409
Maliyekkal S.M., Sharma A.K., Philip L. // Water Res. 2006. V. 40. P. 3497. https://doi.org/10.1016/j.watres.2006.08.007
Tripathy S.S., Bersillon J.-L., Gopal K. // Sep. Purif. Technol. 2006. V. 50. P. 310. https://doi.org/10.1016/j.seppur.2005.11.036
Bansiwal A., Pillewan P., Biniwale R.B., Rayalu S.S. // Microporous Mesoporous Mater. 2010. V. 129. P. 54. https://doi.org/10.1016/j.micromeso.2009.08.032
Maliyekkal S.M., Shukla S., Philip L., Nambi I.M. // Chem. Eng. J. 2008. V. 140. P. 183. https://doi.org/10.1016/j.cej.2007.09.049
Wajima T., Umeta Y., Narita S., Sugawara K. // Desalination. 2009. V. 249. P. 323. https://doi.org/10.1016/j.desal.2009.06.038
Karthikeyan M., Elango K.P. // J. Environ. Sci. (China). 2009. V. 21. P. 1513. https://doi.org/10.1016/S1001-0742(08)62448-1
Deng S., Liu H., Zhou W. et al. // J. Hazard. Mater. 2011. V. 186. P. 1360. https://doi.org/10.1016/j.jhazmat.2010.12.024
Ku Y., Chiou H.-M. // Water Air Soil Pollut. 2002. V. 133. P. 349. https://doi.org/10.1023/A:1012929900113
Sairam Sundaram C., Viswanathan N., Meenakshi S. // J. Hazard. Mater. 2009. V. 163. P. 618. https://doi.org/10.1016/j.jhazmat.2008.07.009
Nishchev K.N., Novopoltsev M.I., Ruzavina N.A. et al. // 14th International Baltic Conference on Atomic Layer Deposition, BALD 2016 – Proceedings 24 March 2017. P. 13. https://doi.org/10.1109/BALD.2016.7886524
Miikkulainen V., Leskelä M., Ritala M., Puurunen R.L. // J. Appl. Phys. 2013. P. 021301. https://doi.org/10.1063/1.4757907
Toyoda A., Taira T. // IEEE Trans. Semicond. Manuf. 2000. V. 13. № 3. P. 305. https://doi.org/10.1109/66.857940
Алосманов Р.М. // Сорбционные и хроматографические процессы. 2010. Т. 10. С. 427.
Tran H.N., You S.-J., Hosseini-Bandegharaei A. et al. // Chemosphere. 2017. P. 10. https://doi.org/10.1016/j.watres.2017.04.014
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии