Журнал неорганической химии, 2020, T. 65, № 10, стр. 1299-1307
Синтез и кристаллическое строение 9-азаметаллокраунов-3 меди(II) с 4-иодпиразолом
А. С. Виноградов a, *, В. А. Павленко a, И. О. Фрицкий a, И. А. Гуральский a, С. Шова b
a Киевский национальный университет им. Тараса Шевченко
01601 Киев, ул. Владимирская, 64, Украина
b “П. Пони” Институт макромолекулярной химии Румынской академии наук
700487 Яссы, Алея Гр. Гика Водэ, 41А, Румыния
* E-mail: linke33967@gmail.com
Поступила в редакцию 25.04.2020
После доработки 12.05.2020
Принята к публикации 27.05.2020
Аннотация
Синтезированы и выделены в кристаллическом состоянии два полиядерных комплекса меди с депротонированным 4-иодпиразолом (Ipz) состава [Cu3(µ3-OH)(µ-Ipz)3Cl2 · 2CH3CN]2 (1) и [Cu3(µ3-OH)(µ-Ipz)3Br2]n (2). Методом рентгеноструктурного анализа монокристаллов исследовано кристаллическое и молекулярное строение этих соединений. Структура комплекса 1 состоит из димеризованных 9-азаметаллокрауновых-3 фрагментов Cu3(µ3-OH)(µ-Ipz)3Cl2 · 2CH3CN, соединенных между собой мостиковыми атомами хлора. Димерные молекулы связаны в полимерную цепь водородными связями между атомами водорода μ3-OH-группы и атомом хлора соседнего фрагмента. Комплекс 2 кристаллизуется в виде полимерной структуры, состоящей из трехъядерных фрагментов Cu3(µ3-OH)(µ-Ipz)3Br2, объединенных мостиковыми атомами брома. Установлено, что в случае комплекса 1 координационное число Cu(II) дополняется до 5 за счет молекулы ацетонитрила, а в комплексе 2 пятикоординированное геометрическое окружение атома меди создается двумя мостиковыми атомами брома от соседних структурных субъединиц.
ВВЕДЕНИЕ
Пиразолсодержащие лиганды проявляют выраженную склонность к разносторонней координации при образовании полиядерных соединений. Они могут формировать структуры различной ядерности – от моноядерных комплексов до полиядерных кластеров и металлоциклов. В результате введения в пиразольное кольцо дополнительных потенциально координирующихся групп увеличивается количество донорных центров, что может способствовать формированию различных типов координационных соединений [1–3]. В последнее время внимание исследователей привлекают трехъядерные пиразолсодержащие комплексы меди азаметаллокраунового типа, которые проявляют нетривиальные магнитные свойства [4–6] и могут быть катализаторами для пероксидного окисления алканов [7]. В указанных трехъядерных структурах с азаметаллокрауновым мотивом возможно замещение терминальных монодентатных лигандов, причем при их замещении на бидентатные лиганды последние могут выступать в качестве мостиков между двумя трехъядерными структурными единицами [8]. Известно, что редокс-активные трехъядерные кластеры меди могут входить в состав активных центров некоторых белков, таких как аскорбатоксидаза, лакказа и церулоплазмин [9]. Именно поэтому представляет интерес получение смешановалентных комплексов ${\text{Cu}}_{{\text{3}}}^{{{\text{7}} + }}\left( {{\text{Cu}}_{{\text{2}}}^{{{\text{II}}}}{\text{C}}{{{\text{u}}}^{{{\text{III}}}}}} \right),$ ${\text{Cu}}_{{\text{3}}}^{{{\text{4}} + }}\left( {{\text{Cu}}_{{\text{2}}}^{{\text{I}}}{\text{C}}{{{\text{u}}}^{{{\text{II}}}}}} \right)$ и ${\text{Cu}}_{{\text{3}}}^{{{\text{5}} + }}\left( {{\text{C}}{{{\text{u}}}^{{\text{I}}}}{\text{Cu}}_{{\text{2}}}^{{{\text{II}}}}} \right)$ [10, 11]. Подобные комплексы образуются при взаимодействии пиразола (pz) с некоторыми карбоксилатами меди(II) в водной среде и характеризуются наличием треугольного ядра [Cu3(µ3-OH)(µ-pz)3(RCOO)2] (R = H, C2H5, C3H7) [12–23] и координированных к атомам меди молекул растворителя. Известны структуры состава [Cu3(µ3-OH)(µ-pz)3(HCOO)2(Hpz)2], [Cu3(µ3-OH)(µ-pz)3(CH3CH2COO)2(EtOH)] и [Cu3(µ3-OH)(µ-pz)3(CH3(CH2)2COO)2(MeOH)(H2O)] [24]. В водной среде при действии раствора HCl на трехъядерные пиразолатные комплексы меди(II) типа 9-азаметаллокраунов-3 были получены шестиядерные полимерные треугольные структуры [{Cu3(µ3-OH)(µ-pz)3(Hpz)2}2(µ-MeCOO)2](Cl)2 · · 2H2O [25]. Ряд подобных структур был получен в результате взаимодействия карбоксилатов меди(II) с пиразолом в протонных растворителях [26]. Описан механизм образования подобных трехъядерных структур в реакции Cu(NO3)2, пиразола, NaOH и Na2CO3 в тетрагидрофуране [27].
Цель настоящей работы – установление влияния объемных заместителей в 4-положении пиразольного цикла на характер комплексообразования с солями меди(II), а также получение координационных соединений более высокой ядерности с использованием трехъядерных 9-азаметаллокрауновых-3 субъединиц в качестве конструкционных блоков с последующим изучением особенностей их молекулярного и кристаллического строения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза комплексов в качестве исходных веществ использовали 4-иодпиразол (IpzH) и порошок металлической меди фирмы “Aldrich”, безводные CuCl2, CuBr2 и ацетонитрил фирмы “Enamine Ltd”.
Элементный анализ на содержание углерода, азота и водорода проводили с использованием анализатора Perkin-Elmer 2400 CHN путем сжигания навески образца в струе чистого кислорода при температуре 1080°С с последующим хроматографированием полученных газообразных CO2, H2O и N2 в струе гелия. Результаты анализа не отличались от теоретически рассчитанных величин более чем на 0.4%. Для теоретического расчета процентного содержания элементов использовали компьютерную программу MWcalc.
ИК-спектры регистрировали на спектрометре Spectrum BXII FT-IR Perkin-Elmer в диапазоне 400–4000 см–1 в таблетках KBr.
Рентгеноструктурный анализ (РСА) проводили при комнатной температуре на дифрактометре Xcalibur Е с детектором CCD (МоKα-излучение, графитовый монохроматор). Определение параметров элементарной ячейки, а также интегрирование данных выполняли с помощью программного пакета CrysAlisPro от Oxford Diffraction. Для учета поправок на абсорбцию применяли метод multi scan. Структуры расшифровывали методом Intrinsic Phasing с помощью программы ShelXT [28] с использованием графического интерфейса Olex2 [29] и уточняли в анизотропном полноматричном варианте для неводородных атомов с помощью программы ShelXL [30]. Позиции атомов водорода OH-групп определяли из разностных синтезов Фурье. Остальные атомы водорода рассчитывали геометрически и уточняли изотропно в модели “жесткого тела”. Кристаллографические данные и характеристики структурного эксперимента приведены в табл. 1, некоторые межатомные расстояния и валентные углы – в табл. 2 и 3, структуры депонированы в Кембриджском банке структурных данных (№ 1990920, 1990921).
Таблица 1.
Кристаллографические данные и характеристики эксперимента для структур 1 и 2
| Параметр | 1 | 2 |
|---|---|---|
| Брутто-формула | C13H13Cl2Cu3I3N8O | C9H7Br2Cu3I3N6O |
| М | 939.53 | 946.35 |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | I2/m | C2/c |
| а, Å | 9.4772(8) | 11.426(2) |
| b, Å | 23.8366(14) | 17.231(2) |
| с, Å | 10.9412(12) | 9.6721(16) |
| β, град | 91.288(9) | 94.886(18) |
| V, Å3 | 2471.0(4) | 1897.2(5) |
| Z | 4 | 4 |
| ρвыч, г/см3 | 2.525 | 3.313 |
| μ, мм–1 | 6.545 | 12.437 |
| Размеры кристалла, мм | 0.30 × 0.25 × 0.15 | 0.25 × 0.15 × 0.10 |
| Область θ, град | 3.418–50.05 | 4.288–50.038 |
| Число измер./незав. рефлексов (Rint) | 8308/2243 (0.0783) | 3241/1676 (0.0719) |
| Число уточняемых параметров | 135 | 86 |
| GOOF | 1.068 | 1.091 |
| R-фактор (I > 2σ(I)) | R1 = 0.1135, wR2 = 0.3098 | R1 = 0.0825, wR2 = 0.2092 |
| R-фактор (по всему массиву) | R1 = 0.1542, wR2 = 0.3298 | R1 = 0.1183, wR2 = 0.2311 |
| Δρmax, Δρmin, e Å–3 | 1.61, –1.31 | 2.26, –1.33 |
Таблица 2.
Избранные длины связей и углы в комплексе 1
| Связь | d, Å | Связь | d, Å | Угол | ω, град | Угол | ω, град |
|---|---|---|---|---|---|---|---|
| Cu1–N2 | 1.92(2) | Cu2–O1A | 2.06(8) | N2Cu1N3 | 176.7(10) | O1BCu1N1 | 119.0(19) |
| Cu1–N3 | 1.94(2) | Cu1···Cu1i | 3.389(7) | N2Cu1O1B | 86(2) | O1ACu1N1 | 140(2) |
| Cu1–O1B | 1.94(4) | Cu2···Cu1 | 3.389(7) | N3Cu1O1B | 91(2) | N2Cu1Cl1 | 90.3(8) |
| Cu1–O1A | 1.98(4) | Угол | ω, град | N2Cu1O1A | 89(2) | N3Cu1Cl1 | 92.8(8) |
| Cu1–N1 | 2.25(3) | N4iCu2N4 | 172(15) | N3Cu1O1A | 89(2) | O1BCu1Cl1 | 149.3(18) |
| Cu1–Cl1 | 2.485(7) | N4iCu2O1B | 88.2(7) | N2Cu1N1 | 89.2(10) | O1ACu1Cl1 | 128.6(18) |
| Cu2–Cl2 | 2.284(12) | N4Cu2O1B | 88.2(7) | N3Cu1N1 | 91.8(11) | N1Cu1Cl1 | 91.2(8) |
| Cu2–N4i | 1.97(2) | N4Cu2Cl2 | 92.8(7) | N4iCu2O1A | 87(7) | ||
| Cu2–N4 | 1.97(2) | O1BCu2Cl2 | 162.2(18) | N4Cu2O1A | 87(7) | ||
| Cu2–O1B | 2.05(8) | O1ACu2Cl2 | 177.7(17) | N4iCu2Cl2 | 92.8(7) |
Таблица 3.
Избранные длины связей и углы в комплексе 2
| Связь | d, Å | Связь | d, Å | Угол | ω, град | Угол | ω, град |
|---|---|---|---|---|---|---|---|
| Cu1–N2 | 1.924(15) | Cu2–O1 | 1.99(2) | O1Cu2O1i | 18.8(11) | O1Cu1Br1iii | 142.0(6) |
| Cu1–N2i | 1.924(15) | Cu2–O1i | 2.00(2) | N3Cu2Br1 | 92.8(5) | Br1iCu1Br1iii | 94.72(15) |
| Cu1–O1i | 1.97(2) | Cu2···Cu2i | 3.397(5) | N1Cu2Br1 | 92.6(5) | N2Cu1N2ii | 174.1(10) |
| Cu1–O1 | 1.97(2) | Cu2···Cu1 | 3.402(4) | O1Cu2Br1 | 149.5(6) | N2Cu1O1ii | 86.1(9) |
| Cu2–Br1 | 2.432(3) | Угол | ω, град | O1iCu2Br1 | 168.0(6) | N2iiCu1O1ii | 88.1(9) |
| Cu2i–Br1i | 2.432(3) | N3Cu2N1 | 170.2(8) | O1iCu1Br1ii | 142.0(6) | N2Cu1O1 | 88.1(9) |
| Cu1–Br1ii | 2.658(3) | N3Cu2O1 | 89.8(8) | O1Cu1Br1ii | 123.2(6) | N2iiCu1O1 | 86.1(9) |
| Cu1–Br1iii | 2.658(3) | N1Cu2O1 | 89.7(8) | N2Cu1Br1iii | 91.7(6) | O1iiCu1O1 | 18.9(12) |
| Cu2–N3 | 1.890(16) | N3Cu2O1i | 89.6(8) | N2iCu1Br1iii | 92.3(5) | N2Cu1Br1i | 92.3(5) |
| Cu2–N1 | 1.956(16) | N1Cu2O1i | 86.8(8) | O1iCu1Br1iii | 123.2(6) | N2iiCu1Br1i | 91.7(6) |
Синтез комплексов
[Cu3(µ3-OH)(µ-Ipz)3Cl2 · 2CH3CN]2 (1) получали добавлением к смеси 0.25 г (3.9 ммоль) металлической меди и 0.52 г (3.85 ммоль) CuCl2 ацетонитрильного раствора 1.5 г 4-иодпиразола (7.73 ммоль). Реакционную смесь перемешивали на магнитной мешалке без нагревания в течение 1 ч при свободном доступе воздуха до практически полного растворения металлической меди и выпадения осадка продукта. Осадок светло-зеленой окраски отфильтровывали и растворяли в ацетонитриле. Полученный раствор фильтровали от микроостатков меди. Медленным испарением растворителя были получены кристаллы, пригодные для РСА. Цвет кристаллического соединения соответствовал цвету осадка – темно-зеленый для комплекса [Cu3(µ3-OH)(µ-Ipz)3Cl2 · 2CH3CN]2 (1). Выход составил 50%.
| С | H | N | |
| Найдено, %: | 16.30; | 1.23; | 11.68. |
| Для [Cu3(µ3-OH)(µ-Ipz)3Cl2 · 2CH3CN]2 | |||
| вычислено, %: | 16.61; | 1.39; | 11.92. |
ИК-спектр (ν, см–1): 3422, 3338, 3117, 1376, 1288, 1167, 1059, 999, 941, 844, 610.
[Cu3(µ3-OH)(µ-Ipz)3Br2]n (2) получали добавлением к смеси 0.25 г (3.9 ммоль) металлической меди и 0.86 г (3.83 ммоль) CuBr2 ацетонитрильного раствора 1.5 г 4-иодпиразола (7.73 ммоль). Реакционную смесь перемешивали на магнитной мешалке без нагревания в течение 1 ч при свободном доступе воздуха до практически полного растворения металлической меди и выпадения осадка продукта. Осадок коричневой окраски отфильтровывали и растворяли в ацетонитриле. Полученный раствор фильтровали от микроостатков меди. Медленным испарением растворителя были получены кристаллы, пригодные для РСА. Цвет кристаллического соединения соответствовал цвету осадка – темно-коричневый для [Cu3(µ3-OH)(µ-Ipz)3Br2]n (2). Выход составил 55%.
ИК-спектр (ν, см–1): 3336, 3117, 1376, 1285, 1169, 1057, 940, 850, 612, 424.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
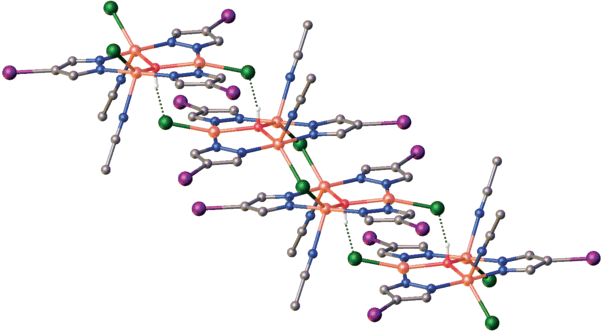
По результатам РСА, полученные комплексы кристаллизуются в моноклинной сингонии (пр. гр. I2/m для 1 и C2/c для 2). Структура 1 состоит из димерных центросимметричных шестиядерных молекул, состоящих из двух одинаковых девятичленных трехъядерных фрагментов с топологией 9-азаметаллокрауна-3, связанных между собой двумя µ2-мостиковыми атомами хлора (рис. 1). Трехъядерные фрагменты характеризуются собственной симметрий Cs (плоскость симметрии проходит через атомы Cu2, Cl2, C2, I1 и разупорядоченные мостиковые гидроксилы O1A и O1B) и содержат по три атома меди двух типов с КЧ = 4 и 5, которые объединены в девятичленный цикл тремя депротонированными остатками 4-иодпиразола, выполняющими мостиковые функции. Азаметаллокраун дополнительно центрирован тридентатной мостиковой гидроксигруппой (Cu1–O1A = Cu1i–O1A = 1.98(4) Å, Cu2–O1A = 2.06(8) Å, код симметрии: (i) +x, 1 – y, +z). Геометрия пятикоординированного атома Cu1 реализуется за счет двух атомов азота депротонированных молекул пиразола (Cu1–N2 = 1.92 (2) Å, Cu1–N3 = 1.94 (2) Å), мостикового атома хлора (Cu1–Cl1 = Cu1i–Cl1i = = 2.485 (7) Å), атома кислорода μ3-OH-группы и дополняется за счет атома азота координированной молекулы CH3CN (Cu1–N1 = 2.25 (3) Å). Геометрия атома Cu2 с КЧ = 4 практически плоскоквадратная с небольшим выходом атома меди из плоскости квадрата и реализуется за счет двух атомов азота депротонированных молекул пиразола (Cu2–N4 = 1.97 (2) Å), атома хлора (Cu2–Cl2 = = 2.284 (12) Å) и атома кислорода μ3-OH-группы. Атом кислорода μ3-OH-группы разупорядочен по двум позициям с равной вероятностью. Для подобных комплексов такое разупорядоченное (50/50) положение μ3-OH-группы является характерной особенностью. Мостиковые атомы кислорода связывают три атома меди и выходят из плоскости металлоцикла соответственно на 0.44 (О1А) и 0.27 (О1В) Å.
Рис. 1.
Молекулярная структура [Cu3(µ3-OH)(µ-Ipz)3Cl2 · 2CH3CN]2(1). Код симметрии: (i) +x, 1 – y, +z.
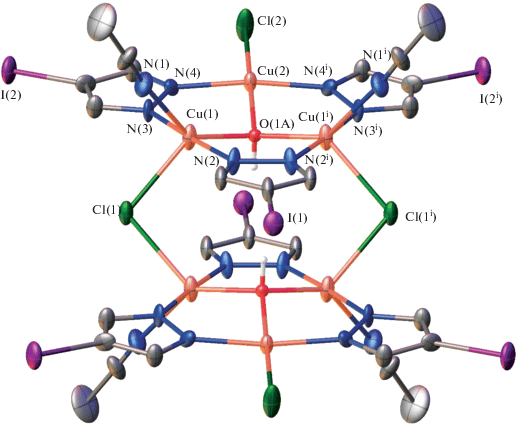
В кристаллической структуре гексаядерные комплексные молекулы объединяются в ступенчатые колонны, расположенные параллельно оси z, за счет водородных связей между трансляционными димерными субъединицами. В формировании водородных связей (табл. 4) принимают участие μ3-OH-гидроксильные группы и атомы Cl2 (O…Cl = 2.69(7) Å, H…Cl = 1.83(2) Å, угол 167(4)°) (рис. 2). Соседние колонны связаны между собой ван-дер-ваальсовыми взаимодействиями.
Таблица 4.
Параметры водородных связей (Å, град) в комплексе 1
| D–H···A | D–H | H···A | D···A | D–H···A |
|---|---|---|---|---|
| O1B–H1B···Cl2iii | 0.87 | 1.83 | 2.68 (6) | 168 |
| O1A–H1A···N2iv | 0.86 | 2.58 | 3.29 (7) | 141 |
| O1A–H1A···N2ii | 0.86 | 2.58 | 3.29 (7) | 141 |
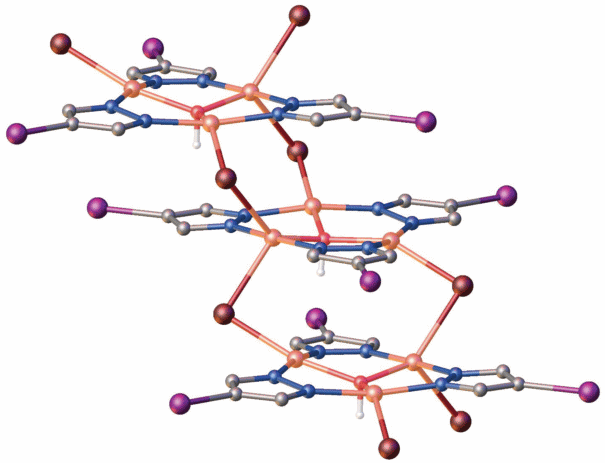
В отличие от соединения 1, кристаллическая структура комплекса 2 состоит из полимерных цепей, формирующихся из трехъядерных фрагментов Cu3(µ3-OH)(µ-Ipz)3Br2, объединенных µ2-мостиковыми атомами брома (рис. 3). Полимерные цепи упакованы параллельно направлению z кристалла, взаимодействие между трансляционными цепочками носит ван-дер-ваальсовый характер. Геометрические параметры водородных связей в структуре 2 представлены в табл. 5.
Рис. 3.
Кристаллографически независимая часть структуры комплекса 2, демонстрирующая координационное окружение ионов меди(ІІ). Коды симметрии: (i) 1 – x, +y, 3/2 – z; (ii) 1 – x, 1 – y, 1 – z; (iii) +x, 1 – y, 1/2 + z.
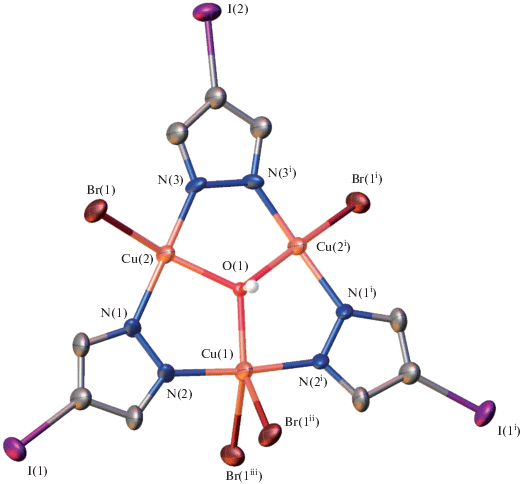
Таблица 5.
Параметры водородных связей (Å, град) в комплексе 2
| D–H···A | D–H | H···A | D···A | D–H···A |
|---|---|---|---|---|
| C3–H3···I1iv | 0.93 | 3.24 | 4.17 (2) | 177 |
| C1–H1···I2v | 0.93 | 3.22 | 4.030 (19) | 147 |
| C4–H4···Br1v | 0.93 | 3.10 | 3.83 (2) | 136 |
| O1A–H1A···N2i | 0.96 | 2.66 | 3.40 (3) | 134 |
| O1A–H1A···N1i | 0.96 | 2.43 | 3.25 (3) | 144 |
Трехъядерные комплексные субъединицы в структуре 2 характеризуются собственной симметрией C2, причем ось второго порядка проходит через атомы Cu1, C5 и I2. 9-Азаметаллокрауновые-3 фрагменты содержат по три атома меди двух типов с КЧ = 4 (Cu2) и 5 (Cu1), которые объединены в девятичленный металлоцикл тремя депротонированными остатками 4-иодпиразола. Расстояния Cu1…Cu2 = Cu1…Cu2i = 3.402(4) Å, Cu2…Cu2i = 3.397(5) Å (код симметрии: (i) 1 – x, + y, 3/2 – z). Азаметаллокрауновый цикл дополнительно центрирован µ3-мостовым гидроксидом (Cu1–O1 = 1.97(2) Å, Cu2–O1 = 1.99(2) Å, Cu2i–O1 = = 2.00(2) Å). Координационное окружение пятикоординированного атома меди(II) формируется за счет двух атомов азота депротонированных молекул 4-иодпиразола (Cu1–N2 = Cu1–N2i = = 1.924(15) Å), двух мостиковых атомов брома (Cu1–Br1ii = Cu1–Br1iii = 2.658(3) Å, угол Br1iiCu1Br1iii = 94.7(2)°, коды симметрии: (ii) 1 – x, 1 – y, 1 – z; (iii) +x, 1 – y, 1/2 + z) и атома кислорода μ3-OH-группы. Геометрия атома Cu2 с КЧ = 4 практически плоскоквадратная с небольшим выходом атома меди из плоскости координационного полиэдра и реализуется за счет координации двух атомов азота депротонированных молекул 4-иодпиразола (Cu2–N1 = 1.956(16) Å, Cu2–N3 = 1.890(16) Å), мостикового атома брома (Cu2–Br1 = 2.432(3) Å) и атома кислорода μ3-OH-группы. Атом кислорода μ3-OH-группы разупорядочен по двум позициям (50/50) и выходит из плоскости металлоцикла на 0.32(2) Å.
В кристаллической структуре комплекса трехъядерные субъединицы, связанные центром инверсии, объединяются в полимерные цепочки мостиковыми атомами брома, которые дополняют КЧ атома меди Cu1 до 5. За счет связывания мостиковым атомом брома двух разных ионов меди (Cu1 и Cu2) мостиковые связи между мономерами имеют разную длину (2.658(3) и 2.432(3) Å соответственно, рис. 4).
Геометрия координационных полиэдров пятикоординированных атомов Cu1 в обеих структурах является промежуточной между тригонально-бипирамидальной и квадратно-пирамидальной. Анализ геометрии полиэдров с помощью программы SHAPE 2.1 (табл. 6) показал, что в комплексе 1 координационный полиэдр атома Cu1 представляет собой сильно искаженную тригональную бипирамиду в случае координации разупорядоченной мостиковой гидроксильной группы (О1A), в то время как при рассмотрении координации его второй разупорядоченной позиции (О1В) полиэдр представляет собой искаженную квадратную пирамиду (табл. 3). Эти выводы, а также высокие степени искажения полиэдров подтверждаются величинами геометрических индексов τ5 (0.602 для О1A и 0.456 для О1В [32]). В комплексе 2 обе позиции разупорядоченного гидроксида являются симметрически связанными, поэтому в обоих случаях координационные полиэдры идентичны (искаженная тригональная бипирамида). Следует отметить, что для атома Cu1 в комплексе 2 факторы SQ(P) для обоих типов полиэдров очень близки (3.697 и 3.836 для тригональной бипирамиды и квадратной пирамиды соответственно), что свидетельствует о промежуточной геометрии полиэдров. Это также подтверждается величинами геометрических индексов τ5 (0.536).
Таблица 6.
Анализ геометрии пятикоординированных атомов меди(II) в комплексах 1 и 2 с помощью программы SHAPE 2.1 [31] (величины SQ(P))*
| Центральный ион | Пятиугольник (D5h) | Вакантный октаэдр (C4v) | Тригональная бипирамида (D3h) | Квадратная пирамида (C4v) | Тригональная бипирамида Джонсона J12 (D3h) |
|---|---|---|---|---|---|
| Комплекс 1 | |||||
| Cu1–O1A | 29.774 | 5.627 | 2.793 | 3.601 | 7.632 |
| Cu1–O1B | 30.068 | 3.434 | 3.525 | 2.819 | 8.130 |
| Комплекс 2 | |||||
| Cu1–O1 | 31.553 | 5.985 | 3.697 | 3.836 | 9.834 |
* SQ(P) является мерой искажения координационного полиэдра центрального атома от идеальной геометрии [31]. SQ(P) = 0 в случае идеальной геометрии полиэдра, с увеличением отклонения от идеальной геометрии SQ(P) возрастает.
ЗАКЛЮЧЕНИЕ
Методом прямого синтеза получены два комплекса меди(II) с 4-иодпиразолом. Иодзамещенный пиразол был использован для проверки влияния объемного заместителя на комплексообразование. Установлено, что структура кристаллической ячейки комплексов зависит от природы аниона использованной исходной соли меди, но при этом образуются два структурно-однотипных соединения. С помощью РСА установлено молекулярное строение полученных веществ. Показано, что атомы меди в комплексах образуют плоскую девятичленную трехъядерную структуру Cu3(µ-Ipz)3, центрированную гидроксогруппой, в которой атом кислорода заметно выходит из плоскости 9-членного металлоцикла. При использовании CuCl2 наблюдается образование полимера, состоящего из димерных фрагментов, в которых координационное число одного из атомов меди дополняется до 5 за счет координации молекулы растворителя. В системе Cu–CuBr2–IpzH образуется полимерная структура, где геометрическое окружение одного из атомов меди достраивается за счет связывания структурных фрагментов мостиковыми атомами брома. Формирование именно такой структуры полимерных комплексов частично можно связать с меньшим радиусом атома хлора по сравнению с бромом. Разработанная методика может найти применение для синтеза подобных трехъядерных пиразолзамещенных структур.
Список литературы
Trofimenko S. // Chem. Rev. 1993. V. 93. P. 943. https://doi.org/10.1021/cr00019a006
Mukherjee R. // Coord. Chem. Rev. 2000. V. 203. P. 151. https://doi.org/10.1016/S0010-8545(99)00144-7
LaMonica G., Ardizzoia G.A. // Prog. Inorg. Chem. 1997. V. 46. P. 151. https://doi.org/10.1002/9780470166475.ch3
Zhou J.-H., Liu Z., Li Y.-Z. et al. // J. Coord. Chem. 2006. V. 59. P. 147. https://doi.org/10.1080/00958970500266206
Angaridis P.A., Baran P., Boca R. et al. // Inorg. Chem. 2002. V. 41. P. 2219. https://doi.org/10.1021/ic010670l
Su S., Zhang Y., Zhu M. et al. // Chem. Commun. (Cambridge, U. K.). 2012. V. 48. P. 11118. https://doi.org/10.1039/C2CC35606F
Di Nicola D., Karabach Y.Yu., Kirillov A.M. et al. // Inorg. Chem. 2007. V. 46. P. 221. https://doi.org/10.1021/ic061595n
Mezei G., Rivera-Carrillo M., Raptis R.G. // Inorg. Chim. Acta. 2004. V. 357. P. 3721. https://doi.org/10.1016/j.ica.2004.05.022
Solomon E.I., Sundaram U.M., Machonkin T.E. // Chem. Rev. 1996. V. 96. P. 2563. https://doi.org/10.1021/cr950046o
Mezei G., McGrady J.E., Raptis R.G. // Inorg. Chem. 2005. V. 44. P. 7271. https://doi.org/10.1021/ic050729e
Rivera-Carrillo M., Chakraborty I., Mezei G. et al. // Inorg. Chem. 2008. V. 47. P. 7644. https://doi.org/10.1021/ic800531y
Kaim W., Rall J. // Angew. Chem. Int. Ed. Engl. 1996. V. 35. P. 43. https://doi.org/10.1002/anie.199600431
Holm R.H., Kennepohl P., Solomon E.I. // Chem. Rev. 1996. V. 96. P. 2239. https://doi.org/10.1021/cr9500390
Kahn O. // Chem. Phys. Lett. 1997. V. 265. P. 109. https://doi.org/10.1016/S0009-2614(96)01424-8
Ferrer S., Haasnoot J.G., Reedijk J. et al. // Inorg. Chem. 2000. V. 39. P. 1859. https://doi.org/10.1021/ic981393u
Gutierrez L., Alzuet G., Real J.A. et al. // Inorg. Chem. 2000. V. 39. P. 3608. https://doi.org/10.1021/ic000218m
Ferrer S., Lloret F., Bertomeu I. et al. // Inorg. Chem. 2002. V. 41. P. 5821. https://doi.org/10.1021/ic020179+
Yaghi O.M., Li H., Davis C. et al. // Acc. Chem. Res. 1998. V. 31. P. 474. https://doi.org/10.1021/ar970151f
Eddaudi M., Moler D.B., Li H. et al. // Acc. Chem. Res. 2001. V. 34. P. 319. https://doi.org/10.1021/ar000034b
Moulton B., Zaworotko M.J. // Chem. Rev. 2001. V. 101. P. 1629. https://doi.org/10.1021/cr9900432
James S.L. // Chem. Soc. Rev. 2003. V. 32. P. 276. https://doi.org/10.1039/B200393G
Chen B., Fronczek F.R., Maverick A.W. // Inorg. Chem. 2004. V. 43. P. 8209. https://doi.org/10.1021/ic048992n
Murugavel R., Walawalkar M.G., Dan M. et al. // Acc. Chem. Res. 2004. V. 37. P. 763. https://doi.org/10.1021/ar040083e
Casarin M., Corvaja C., Di Nicola C. et al. // Inorg. Chem. 2005. V. 44. P. 6265. https://doi.org/10.1021/ic050678l
Casarin M., Cingolani A., Di Nicola C. et al. // Cryst. Growth Des. 2007. V. 7. P. 676. https://doi.org/10.1021/cg060501h
Massignani S., Scatena R., Lanza A. et al. // Inorg. Chim. Acta. 2017. V. 455. P. 618. https://doi.org/10.1016/j.ica.2016.05.009
Ahmed B.M., Mezei G. // Inorg. Chem. 2016. V. 55. P. 7717. https://doi.org/10.1021/acs.inorgchem.6b01172
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Adv. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Sheldrick G.M. // Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Llunell M., Casanova D., Cirera J. et al. // SHAPE, version 2.1, Universitat de Barcelona, Barcelona, Spain, 2013.
Addison A.W., Rao T.N., Reedijk J. et al. // J. Chem. Soc., Dalton Trans. 1984. V. 7. P. 1349. https://doi.org/10.1039/dt9840001349
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии