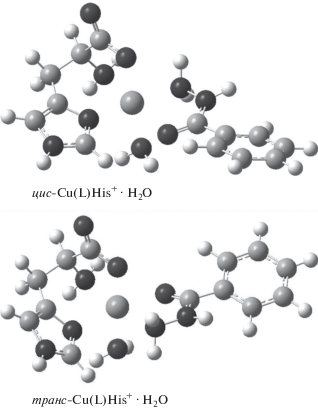Журнал неорганической химии, 2020, T. 65, № 1, стр. 56-64
Гомо- и гетеролигандные комплексные соединения меди(II) с гидразидами некоторых ароматических кислот и L-гистидином
Н. В. Трошанин a, *, Т. И. Бычкова a, В. В. Неклюдов a, А. Е. Климовицкий a
a Казанский (Приволжский) федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 29/1, Россия
* E-mail: nikita-vt@mail.ru
Поступила в редакцию 10.04.2019
После доработки 08.05.2019
Принята к публикации 17.08.2019
Аннотация
Методом спектрофотометрии с привлечением математического моделирования определены составы и константы устойчивости гомо- и гетеролигандных комплексов меди(II) с гидразидом бензойной (п-метоксибензойной, о-оксибензойной) кислоты и L-гистидином в водном растворе на фоне 0.1 М KNO3 при 25.0°С. Методом ИК-спектроскопии и с помощью квантово-химических расчетов установлены особенности строения некоторых комплексов, образующихся в бинарных и тройных системах.
ВВЕДЕНИЕ
Комплексообразование ионов переходных металлов с N,O-донорными органическими лигандами, такими как гидразиды карбоновых кислот и аминокислоты, на протяжении многих десятилетий является предметом изучения координационной, бионеорганической, биокоординационной химии.
Большинство исследований, посвященных гомолигандным комплексам 3d-металлов, в частности меди(II), с гидразидами кислот, касается препаративного выделения комплексов из растворов и выяснения их структуры. Обзор части из них сделан в статьях [1–3], комплексы меди(II) исследованы в работах [4–12], вышедших в свет за последние пятнадцать лет; в работах [8–12] имеется биологическая часть. Результаты структурных исследований комплексов меди(II) с гидразидом бензойной кислоты (бензгидразидом) и гидразидом п-метоксибензойной (анисовой) кислоты свидетельствуют о том, что эти моногидразиды координируются к центральному двухзарядному иону металла посредством атома азота группы –NH2 и атома кислорода группы >С=О, при этом в зависимости от рН среды образуются пятичленные металлоциклы с амидной (в слабокислой и нейтральной среде) или имидной (в щелочной) формой гидразидов. В то же время литературные данные [7, 13–16], полученные главным образом на основании анализа ИК-спектров, формируют весьма неоднозначные представления о способе координации к 3d-металлам гидразида о-оксибензойной (салициловой) кислоты. Согласно [13, 14], лиганд в амидной форме связывается с центральным ионом бидентатно через гидразидный фрагмент, по данным [15, 16], – тридентатно с участием фенолятного кислорода. Для имидной формы гидразида также предложены два варианта координации: через аминогруппу и енолятный кислород [14] и через азот азометиновой группировки и фенолятный кислород [7].
Состояние комплексов меди(II) с гидразидами карбоновых кислот в растворах (водных и водно-органических) изучено в меньшей степени, чем структура кристаллов этих соединений. Термодинамические и кинетические параметры процессов комплексообразования меди(II) с рядом гидразидов и дигидразидов в водной среде определены в спектрофотометрических и рН-метрических исследованиях [17–22]. Следует отметить, что константы образования комплексов с гидразидом салициловой кислоты (L''H2) состава CuL''H+, Cu(L''H)2, CuL'', CuL''(L''H)– (lg β равны соответственно 11.06, 21.11, 19.49, 29.75), найденные в [19] без детального уточнения техники эксперимента и принципов расчета, аномально велики и поэтому вызывают сомнения и требуют проверки.
Комплексы Cu(II) c гистидином исследованы довольно хорошо и в твердой фазе, и в растворе. На основании анализа кристаллов комплексов меди(II) с гистидином установлено, что медь(II) в них проявляет КЧ от 4 до 6 [23–27]. Термодинамические и кинетические характеристики реакций комплексообразования Cu(II) с L-гистидином в водных растворах определены при разных температурах и на разном солевом фоне; константы образования комплексов Cu(II) с L-гистидином, а также их спектральные параметры при 25.0°С на фоне 1.0 М нитрата калия были уточнены авторами [28].
Примеры гетеролигандных комплексов, содержащих одновременно молекулы гидразида и аминокислоты, встречаются в литературе редко. Выделенные из различных растворителей такие комплексы обычно имеют состав 1 : 1 : 1; для них определены растворимость, молекулярная электропроводность, температуры плавления или разложения [29–32]. Не проведен, однако, рентгеноструктурный анализ гетерокомплексов с гидразидами кислот и аминокислотами, который позволил бы с уверенностью говорить об их строении. Более доступный метод ИК-спектроскопии мало полезен для выяснения структуры, поскольку в спектрах перекрываются полосы колебаний почти одинаковых функциональных групп гидразидов и аминокислот. Литературные данные о гетеролигандных комплексных соединениях в водных растворах ионов металлов с гидразидами кислот и аминокислотами немногочисленны [21, 29, 30, 33]. Вместе с тем эти и другие гетеролигандные комплексы с полидентатными органическими лигандами представляют интерес как с точки зрения фундаментальной науки (важно понимание способа координации лигандов и их взаимного влияния в координационной сфере ионов металлов), так и с позиции ее прикладных аспектов (главным образом благодаря потенциальной биологической и каталитической активности).
В настоящей статье изложены результаты исследования комплексов, образующихся в бинарных системах медь(II)–гидразид бензойной (L) (п-метоксибензойной (L'), о-оксибензойной (L"H2)) кислоты и медь(II)–L-гистидин (HisH), а также в тройных системах медь(II)–гидразид бензойной (п-метоксибензойной, о-оксибензойной) кислоты–L-гистидин в водной среде на фоне 0.1 М нитрата калия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
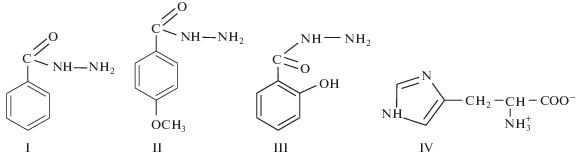
В работе использовали нитрат меди(II) марки “х. ч.”, L-гистидин марки “хроматографически чистый” фирмы Reanal, гидразид о-оксибензойной кислоты марки “ч.”. Гидразиды бензойной и п-метоксибензойной кислот получали действием гидразингидрата на этиловый эфир соответствующей карбоновой кислоты [34]. Чистота продуктов проверена по температурам плавления и данным элементного анализа (структурные формулы лигандов показаны на рис. 1).
Рис. 1.
Структурные формулы лигандов: I – гидразид бензойной кислоты (L), II – гидразид п-метоксибензойной (анисовой) кислоты (L'), III – гидразид о-оксибензойной (салициловой) кислоты (L"H2), IV – гистидин (HisH).
Кроме того, использовали хлороводородную кислоту, гидроксид натрия и нитрат калия марки “х. ч.”. Концентрацию меди(II) определяли иодометрически, концентрации лигандов и фоновой соли KNO3 задавали по их точным навескам. Титруемые растворы продували потоком аргона в течение всей процедуры титрования. При исследовании систем спектрофотометрическим методом необходимые значения рН создавали при помощи титрованных растворов хлороводородной кислоты и гидроксида натрия.
Определение значений рН среды и титрование выполняли с помощью рН-метра Unipractic. Точность измерений pH составляла в среднем ±0.05 лог. ед. Спектры поглощения растворов регистрировали на спектрофотометре Perkin–Elmer Lambda-35 в кварцевой кювете толщиной 1.0 см. Оптическую плотность растворов измеряли с точностью 0.001 ед. по отношению к раствору сравнения, содержащему все те же компоненты, что и исследуемый раствор, за исключением комплексообразователя. Все измерения проводили при температуре 25.0оС (термостатирование).
Моделирование параметров равновесий комплексообразования и расчет спектральных характеристик зафиксированных в растворах комплексов осуществляли по программе CPESSP [35]. Адекватность результатов расчета оценивали по величине двух критериев: Фишера (уравнение (1), всегда был F ≤ 1) и Гамильтона (уравнение (2), R ≤ 3%).
(1)
$F = \frac{{\sum\limits_i^N {{{{\left( {{{X}_{{i{\text{,эксп}}}}} - {{X}_{{i,{\text{расч}}}}}} \right)}}^{2}}} X_{{i,{\text{эксп}}}}^{2}}}{{{{\sigma }^{2}}}},$(2)
$R = \sqrt {\frac{{\sum\limits_i^N {{{\omega }_{{ii}}}} {{{\left( {{{X}_{{i,{\text{эксп}}}}} - {{X}_{{i,{\text{расч}}}}}} \right)}}^{2}}}}{{\mathop \sum \nolimits_i^N {{\omega }_{{ii}}}{{{\left( {{{X}_{{i,{\text{эксп}}}}}} \right)}}^{2}}}}} ,$Квантово-химическая оптимизация структур комплексов проведена в программе GAUSSIAN 09 [36] методом теории функционала плотности (DFT) на уровне PBE0 с использованием валентно-расщепленного базисного набора 6-311G. Эффект смещения центра заряда в комплексах учтен включением в базисный набор поляризационных функций d- и p-типа (обозначается 6-311G(d,p)). В отдельных случаях базисный набор 6-311G(d,p) усложнен добавлением диффузных функций s- и р-типа (базис 6-311++G(d,p)). Эффект растворителя был учтен в соответствии с моделью поляризуемого континуума Томаси в интегральной форме (IEFPCM) [37]. Во всех расчетах критерий толерантности при оптимизации энергии составлял 10–8 хартри.
Для установления структуры препаративно синтезированных комплексов привлечена инфракрасная спектроскопия. ИК-спектры регистрировали с разрешением 2 см–1 на ИК-Фурье-спектрометре Bruker Vertex 70 с приставкой нарушенного полного внутреннего отражения (НПВО) с кристаллом ZnSe (MIRacle, PIKE Technologies).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Константы протолитических равновесий лигандов, использованные при расчете констант устойчивости комплексных соединений, указаны в табл. 1. Константы диссоциации гидразидов бензойной и анисовой кислот, а также L-гистидина на фоне 0.1 М KNO3 были определены в работе [33]. Константы диссоциации гидразида о-оксибензойной кислоты на том же солевом фоне получены в этой работе методом рН-метрического титрования, они близки к сообщенным ранее (pK1 = 3.30, рK2 = 7.86, рK3 = 12.71 [19]).
Таблица 1.
Константы диссоциации гидразидов бензойной (L), п-метоксибензойной (L'), о-оксибензойной (L"H2) кислот и L-гистидина (HisH) в водной среде на фоне 0.1 М KNO3 при 25.0°C (в круглых скобках даны стандартные отклонения в последней значащей цифре)
| Равновесие | pK1 | рK2 | рK3 |
|---|---|---|---|
| LH+ ⇄ H+ + L | 3.115(1) | ||
| L'H+ ⇄ H+ + L' | 3.318(1) | ||
| L"${\text{H}}_{3}^{ + }$ ⇄ H+ + L"H2 | 3.140(8) | ||
| L"H2 ⇄ H+ + L"H– | 7.838(7) | ||
| L"H– ⇄ H+ + L2– | 11.78(3) | ||
| His${\text{H}}_{3}^{{2 + }}$ ⇄ H+ + His${\text{H}}_{2}^{ + }$ | 1.725(1) | ||
| His${\text{H}}_{2}^{ + }$ ⇄ H+ + HisH | 6.126(1) | ||
| HisH ⇄ H+ + His– | 9.207(3) |
Для всех гидразидов константа pK1 характеризует отщепление иона водорода от группы ‒С(О)NHNH3+. Константа рK2 для гидразида салициловой кислоты соответствует диссоциации фенольного гидроксила, а рK3 – амидно-имидному таутомерному переходу гидразида. Константы pK1, рK2 и рK3 для гистидина отвечают диссоциации карбоксигруппы, протонированного атома азота имидазольного кольца и аминогруппы соответственно.
Гомолигандные (бинарные) системы меди(II) с гидразидами кислот и L-гистидином исследованы при соотношениях металл : лиганд = 1 : 1, 1 : 2, 1 : 3 (с бензгидразидом), 1 : 1, 1 : 2, 1 : 3 (с гидразидом анисовой кислоты), 1 : 2 и 1 : 3 (с гидразидом салициловой кислоты), 1 : 2 (с L-гистидином). На рис. 2, 3 изображены зависимости молярного коэффициента экстинкции растворов (ε), рассчитанного по уравнению (3), от рН для систем с гидразидом бензойной кислоты (ход зависимостей для систем с двумя другими гидразидами аналогичный), а также с L-гистидином.
(3)
${\varepsilon } = \frac{A}{{{{c}_{{\text{M}}}}l}} = \sum\limits_n^N {{{{\alpha }}_{n}}{{{\varepsilon }}_{n}}} ,$Рис. 2.
Зависимости коэффициента экстинкции от рН в системе Cu(II)–гидразид бензойной кислоты (L)–0.1 М KNO3–Н2О: 1 – cCu(II) = 1.0 × 10–2 моль/л, cL = 1.2 × 10–2 моль/л, λ = 736 нм; 2 – cCu(II) = 1.0 × × 10–2 моль/л, cL = 2.2 × 10–2 моль/л, λ = 697 нм; 3 – cCu(II) = 1.0 × 10–2 моль/л, cL = 3.2 × 10–2 моль/л, λ = = 686 нм, t = 25.0oC.
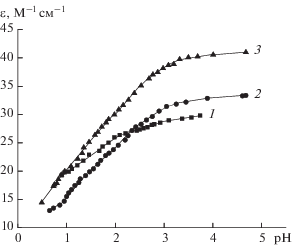
Рис. 3.
Зависимость коэффициента экстинкции от рН в системе Cu(II)–L-гистидин (HisH)–0.1 М KNO3–Н2О; cCu(II) = 4.0 × 10–3 моль/л, cHisH = 8.2 × × 10–3 моль/л; λ = 700 нм, t = 25.0°C.
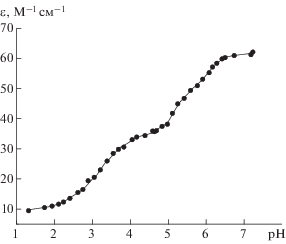
С целью выявления полиядерных комплексных форм система медь(II)–гидразид салициловой кислоты изучена методом сдвига равновесий при постоянной концентрации гидразида и меняющейся вплоть до четырехкратного избытка концентрации меди(II) (без солевого фона, зависимость молярного коэффициента экстинкции от отрицательного десятичного логарифма концентрации меди(II) см. на рис. 4). Константы устойчивости комплексов, образующихся в этих простых системах, и максимальные доли их накопления представлены в табл. 2.
Рис. 4.
Зависимость молярного коэффициента экстинкции растворов от отрицательного десятичного
логарифма концентрации комплексообразователя в системе медь(II)–гидразид о-оксибензойной кислоты (L"H2)–H2O; 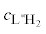 = 2.5 × 10–3 моль/л, сCu(II) = 2.5 × × 10–3–1.2 × 10–2 моль/л; рН 2.6–3.1; λ = 775 нм, t = = 25.0°C.
= 2.5 × 10–3 моль/л, сCu(II) = 2.5 × × 10–3–1.2 × 10–2 моль/л; рН 2.6–3.1; λ = 775 нм, t = = 25.0°C.
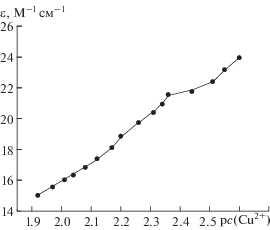
Таблица 2.
Константы устойчивости гомолигандных комплексных соединений меди(II) с гидразидами бензойной (L), п-метоксибензойной (L') и о-оксибензойной (L"H2) кислот, а также с L-гистидином на фоне 0.1 М KNO3 при 25.0°С
| Равновесие | lg β | αmax (pHmax)** | $\lg \left( {\frac{{{{K}_{1}}}}{{{{K}_{2}}}}} \right)$ | $\lg \left( {\frac{{{{K}_{2}}}}{{{{K}_{3}}}}} \right)$ | Δlg K |
|---|---|---|---|---|---|
| Cu2+ + L ⇄ CuL2+ | 3.68 ± 0.02 | 0.67 (1.72) | |||
| Cu2+ + 2L ⇄ CuL22+ | 6.11 ± 0.04 | 0.44 (3.20) | 1.25 | ||
| Cu2+ + 3L ⇄ CuL32+ | 8.14 ± 0.07 | 0.41 (4.68) | 0.40 | ||
| Cu2+ + L' ⇄ CuL'2+ | 3.97 ± 0.02 | 0.70 (1.73) | |||
| Cu2+ + 2L' ⇄ Cu${\text{L}}_{2}^{{'{\text{2 + }}}}$ | 6.55 ± 0.04 | 0.47 (3.21) | 1.39 | ||
| Cu2+ + 3L' ⇄ Cu${\text{L}}_{3}^{{'{\text{2 + }}}}$ | 8.64 ± 0.11 | 0.45 (4.79) | 0.48 | ||
| Cu2+ + L"H2 ⇄ CuL"${\text{H}}_{2}^{{2 + }}$ | 3.75 ± 0.01 | 0.58 (1.46) | |||
| Cu2+ + 2L"H2 ⇄ Cu(L"H2${\text{)}}_{2}^{{2 + }}$ | 6.43 ± 0.04 | 0.28 (2.28) | 1.07 | ||
| Cu2+ + 3L"H2 ⇄ Cu(L"H2${\text{)}}_{3}^{{2 + }}$ | 8.72 ± 0.08 | 0.18 (3.06) | 0.41 | ||
| Cu2+ + L"H– ⇄ CuL"H+ | 9.02 ± 0.05 | 0.18 (2.80) | |||
| Cu2+ + L"H2 + L"H– ⇄ Cu(L"H2)L"H+ | 11.70 ± 0.03 | 0.43 (3.06) | –1.07 | ||
| Cu2+ + 2L"H– ⇄ Cu(L"H)2 | 17.21 ± 0.14* | 0.05 (2.60) | 0.83 | ||
| 2Cu2+ + 2L"2– ⇄ Cu2${\text{L}}_{2}^{{''}}$ | 37.50 ± 0.05* | 0.10 (2.26) | |||
| Cu2+ + НisH ⇄ CuНisH2+ | 5.13 ± 0.03 | 0.51 (3.55) | |||
| Cu2+ + Нis‾ ⇄ CuНis+ | 10.12 ± 0.13 | 0.30 (4.40) | |||
| Cu2+ + 2НisH ⇄ Cu(НisH${\text{)}}_{2}^{{2 + }}$ | 9.02 ± 0.14 | 0.08 (4.05) | 1.24 | ||
| Cu2+ + HisH + Нis‾ ⇄ Cu(HisH)Нis+ | 14.56 ± 0.08 | 0.59 (5.11) | –0.69 | ||
| Cu2+ + 2Нis‾ ⇄ Cu(Нis)2 | 18.11 ± 0.06 | 0.97 (7.23) | 2.13 |
Логарифм отношения ступенчатых констант устойчивости моно- и бис-комплексов меди(II) с цвиттер-ионной формой L-гистидина соответствует значению, ожидаемому на основании статистических соображений для комплексов с бидентатно-координированными лигандами (lg(K1/K2)стат = = 1.2 [38]). В случае комплекса с анионной формой L-гистидина – Cu(His)2 – lg(K1/K2) = 2.28 выше статистического значения для бидентатной координации, а значит, один из лигандов, скорее всего, связан с ионом меди(II) тридентатно, что создает препятствие присоединению второго.
Из табл. 2 следует, что устойчивость комплексов одинакового состава с гидразидом п-метоксибензойной кислоты выше, чем с гидразидами о-оксибензойной и бензойной кислот, что коррелирует с величинами констант диссоциации гидразидов по группе –C(O)NHN${\text{H}}_{3}^{ + }$. Из этой закономерности, однако, выбивается трис-комплекс с салицилгидразидом, который оказался стабильнее аналогичной формы с гидразидом анисовой кислоты.
Анализируя значения ступенчатых констант устойчивости комплексов, приходим к выводу,
что в бис-комплексах гидразиды в амидной форме координированы к иону меди(II) бидентатно и,
по всей видимости, однотипно, т.е. через гидразидный фрагмент. Заниженное значение
lg(K1/K2) для незаряженного комплекса Cu(L"H)2 указывает на эффект его стабилизации, обусловленный, возможно, наличием ионных связей
лигандов с комплексообразователем. Отношения ступенчатых констант lg(K2/K3) для трис-комплексов очень малы (обычно для 3d-металлов lg(K2/K3) > lg(K1/K2)), что свидетельствует о легкости вхождения третьей молекулы гидразида во внутреннюю
координационную сферу комплексов. Учитывая ян-теллеровское искажение октаэдра меди(II),
допустимо полагать, что третий лиганд координируется монодентатно в аксиальном положении
при наличии двух других хелатно связанных лигандов в экваториальной плоскости. Причем,
как показали квантово-химические расчеты в вакууме, третьей молекуле гидразида в аксиальной
позиции выгоднее образовать связь с центральным ионом через атом азота NH2-группы, нежели через атом кислорода карбонильной группы. Определенный вклад в стабилизацию
комплекса 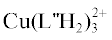 может вносить образование внутри- или межмолекулярных водородных связей с участием
ОН-групп молекул салицилгидразида. В то же время π-стэкинг ароматических колец, который
часто обеспечивает упрочнение комплексных соединений с гидразидами ароматических кислот,
в случае трис-комплексов с рассматриваемыми лигандами маловероятен. По крайней мере, попытки смоделировать
π-стэкинг-взаимодействие при оптимизации комплекса ${\text{CuL}}_{3}^{{2 + }}$ ⋅ H2O влекли за собой увеличение общей энергии структуры.
может вносить образование внутри- или межмолекулярных водородных связей с участием
ОН-групп молекул салицилгидразида. В то же время π-стэкинг ароматических колец, который
часто обеспечивает упрочнение комплексных соединений с гидразидами ароматических кислот,
в случае трис-комплексов с рассматриваемыми лигандами маловероятен. По крайней мере, попытки смоделировать
π-стэкинг-взаимодействие при оптимизации комплекса ${\text{CuL}}_{3}^{{2 + }}$ ⋅ H2O влекли за собой увеличение общей энергии структуры.
Комплекс Cu(L"H2)L"H+ характеризуется статистической устойчивостью, показателем этого служит величина Δlg K (Δlg Kстат ≈ –0.9 [38]).
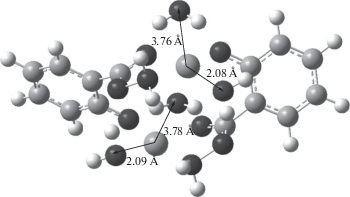
Биядерный комплекс с гидразидом салициловой кислоты обладает высокой стабильностью
(lgβ = 37.50). Результаты квантово-химической оптимизации структуры комплекса 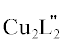 · 4H2O (рис. 5) дают основание полагать, что лиганды в его составе выполняют тридентатную функцию,
а ионы Сu2+ имеют КЧ = 4 (две из четырех заданных в явном виде молекул воды удалены на расстояние,
превышающее длину донорно-акцепторной связи).
· 4H2O (рис. 5) дают основание полагать, что лиганды в его составе выполняют тридентатную функцию,
а ионы Сu2+ имеют КЧ = 4 (две из четырех заданных в явном виде молекул воды удалены на расстояние,
превышающее длину донорно-акцепторной связи).
Рис. 5.
Структура комплекса Cu2L"2 · 4H2O, оптимизированная по программе GAUSSIAN 09 в рамках теории функционала плотности (DFT) с использованием функционала PBE0 и базисного набора 6-311++G(d,p) с учетом гидратного эффекта в модели IEFPCM.
При естественном испарении воды из раствора, содержащего медь(II) и салицилгидразид в соотношении металл : лиганд = 1 : 1, образовались кристаллические агрегаты; было интересно установить их структуру (образец 1). Кроме того, механохимически были синтезированы бис-комплексы: образец 2 – растиранием тригидрата нитрата меди(II) с двукратным избытком салицилгидразида, образец 3 – растиранием тех же веществ с гидроксидом калия (соотношение реагентов 1 : 2 : 4). Все образцы, а также чистый гидразид салициловой кислоты для сравнения были изучены методом ИК-спектроскопии; расшифровка ИК-спектров гидразида и комплексных соединений приведена в табл. 3.
Таблица 3.
Отнесение некоторых колебательных частот гидразида салициловой кислоты (ГСК) и салицилгидразидных комплексов меди(II), синтезированных при соотношениях металл : лиганд = 1 : 1 и 1 : 2 различными способами (условия синтеза см. в тексте)
| Формы колебаний | Характеристические частоты, см–1 | |||||
|---|---|---|---|---|---|---|
| ГСК | образец 1 | образец 2 | образец 3 | |||
| ν(OH), ν(H2О) | 3250–3260 | пик 3256 | пик 3257 | 3100–3300 | ||
| ν(NH2), ν(NH) | $\left\{ \begin{gathered} \hfill \\ \hfill \\ \end{gathered} \right.$ | 3100–3150, | 3160–3220, пик 3293 |
3160–3220, пик 3293 |
пик 3270 | |
| пик 3320 | ||||||
| ν(С=O) и др. (амид-I) | 1645 | 1631 | 1631 | – | ||
| ν(С=N) |
– | – | – | 1603 |
||
| δ(NH2), δ(NNH) |
1583 | 1600–1610 | 1600–1610 | 1583? | ||
| ν(С–N), ν(С=O), δ(NH2), | $\left. \begin{gathered} \hfill \\ \hfill \\ \end{gathered} \right\}$ | 1510–1530 | 1525–1545 | 1525–1545 | – | |
| δ(NH), δ(NCO) и др. (амид-II) | ||||||
| ν(С–O) | – | – | – | 1320–1330 | ||
По данным ИК-спектроскопии, в комплексах 1 (состава 1 : 1) и 2 (состава 1 : 2) молекулы гидразида салициловой кислоты координированы к иону меди(II) хелатно посредством кислорода карбонильной группы и азота аминогруппы, причем тип связывания не меняется при переходе от моно-комплекса к бис-комплексу, в противном случае спектры образцов различались бы существенно. В комплексе 3, очевидно, реализуется координация имидной формы гидразида – молекулы лиганда связаны с медью(II) через атом азота аминогруппы и атом кислорода фрагмента NH2N=С–О–. Важный в практическом отношении вывод касается применимости “сухого” метода синтеза комплексов меди(II) с амидной и имидной формами гидразида, особенно удобного в условиях, когда растворенные в воде реагенты способны вступать в окислительно-восстановительные реакции или гидролизоваться.
Тройные системы меди(II) c гидразидом бензойной (п-метоксибензойной, о-оксибензойной) кислоты и L-гистидином исследованы при соотношениях компонентов 1 : 1 : 1 и 1 : 2 : 2 (с гидразидом о-оксибензойной кислоты). Из зависимостей молярного коэффициента экстинкции от рН, подобных той, которая изображена на рис. 6 для системы с салицилгидразидом, были рассчитаны составы, доли накопления и константы равновесий образования комплексов (табл. 4).
Рис. 6.
Зависимости коэффициента экстинкции от рН в системе Cu(II)–гидразид о-оксибензойной кислоты (L"Н2)–L-гистидин (HisH)–0.1 М KNO3–Н2О: 1 – cCu(II) = 1.0 × 10–2 моль/л, 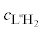 = 8.5 × 10–3 моль/л, cHisH = 8.5 × 10–3 моль/л, λ = 745 нм; 2 – cCu(II) = 1.0 × × 10–2 моль/л,
= 8.5 × 10–3 моль/л, cHisH = 8.5 × 10–3 моль/л, λ = 745 нм; 2 – cCu(II) = 1.0 × × 10–2 моль/л, 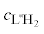 = 2.2 × 10–2 моль/л, cHisH = 2.2 × × 10–2 моль/л, λ = 714 нм, t = 25.0°C.
= 2.2 × 10–2 моль/л, cHisH = 2.2 × × 10–2 моль/л, λ = 714 нм, t = 25.0°C.
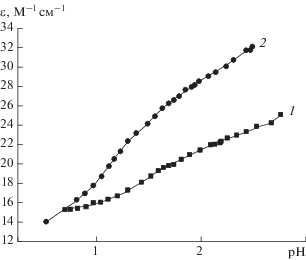
Таблица 4.
Константы устойчивости гетеролигандных комплексных соединений меди(II) с гидразидом бензойной (L) (п-метоксибензойной (L'), о-оксибензойной (L"H2)) кислоты и L-гистидином (HisH) на фоне 0.1 М KNO3 при 25.0°С
| Равновесие | lg β | lg βстат | Δlg K | lg Ks | lg Kadd* |
|---|---|---|---|---|---|
| Cu2+ + L + HisH ⇄ Cu(L)HisH2+ | 8.19 ± 0.03 | 7.9 | –0.52 | 0.59 | 3.16 |
| Cu2+ + L + His– ⇄ Cu(L)His+ | 13.25 ± 0.12 | 12.3 | –0.56 | 1.21 | 3.12 |
| Cu2+ + L' + HisH ⇄ Cu(L')HisH2+ | 8.53 ± 0.03 | 8.1 | –0.47 | 0.71 | 3.50 |
| Cu2+ + L' + His– ⇄ Cu(L')His+ | 13.68 ± 0.17 | 12.6 | –0.42 | 1.41 | 3.55 |
| Cu2+ + L"H2 + HisH ⇄ Cu(L"H2)HisH2+ | 8.40 ± 0.20 | 8.0 | –0.38 | 0.64 | 3.37 |
| Cu2+ + L"H2 + 2HisH ⇄ CuL"H2(HisH)22+ | 14.29 ± 0.07 | 5.20 |
Максимальные доли накопления комплексов Cu(L)HisH2+ и Cu(L')HisH2+ соответственно равны 0.21 (рН 4.09) и 0.23 (рН 4.05), а комплексов Cu(L)His+ и Cu(L')His+ – 0.18 (рН 4.09) и 0.22 (рН 4.05). В растворах, содержащих медь(II), гидразид о-оксибензойной кислоты и L-гистидин в молярном отношении 1 : 1 : 1, зафиксирован один гетеролигандный комплекс состава Cu(L"H2)HisH2+, которого удалось накопить лишь 4%. При двукратном избытке лигандов по отношению к меди(II) обнаружен комплекс CuL"H2(HisH$)_{2}^{{2 + }}$; его максимальная доля составляет 0.13 (рН 2.49). Большее накопление гетеролигандных форм при заданных концентрациях реагентов оказалось неосуществимо из-за высаливания гидразидов под действием нитрата калия.
Значения констант устойчивости однотипных гетеролигандных комплексов меди(II) с гидразидами кислот и L-гистидином состава 1 : 1 : 1 (табл. 4) увеличиваются, как и для простых комплексов, при переходе от гидразида бензойной кислоты к гидразиду о-оксибензойной кислоты и далее к гидразиду п-метоксибензойной кислоты. Близкое сходство констант присоединения lgKadd гидразидных лигандов к CuHisH2+ (для соединений 1, 3, 5) или к CuHis+ (для соединений 2, 4) и констант устойчивости соответствующих простых моно-гидразидокомплексов говорит об отсутствии заметных затруднений при вхождении молекул гидразидов во внутреннюю координационную сферу комплексов меди(II) с L-гистидином. Сравнение lg β с lg βстат (уравнение (4)), а также ΔlgK (уравнение (5)) и lg Ks (уравнение (6)) со статистически ожидаемыми Δlg Kстат ≈ –0.9 и lgKs(стат) = 0.3 [38] вскрывает наличие эффекта экстрастабилизации гетеролигандных комплексов.
(4)
$\lg {\beta }_{{{\text{MAB}}}}^{{{\text{стат}}}} = \frac{1}{2}\left( {\lg {{{\beta }}_{{{\text{M}}{{{\text{A}}}_{{\text{2}}}}}}} + \lg {{{\beta }}_{{{\text{M}}{{{\text{B}}}_{{\text{2}}}}}}}} \right) + \lg 2,$(5)
$\Delta \lg K = \lg {{{\beta }}_{{{\text{MAB}}}}} - \lg {{{\beta }}_{{{\text{MA}}}}} - \lg {{{\beta }}_{{{\text{MB}}}}},$(6)
$\lg {{K}_{s}} = \lg {{{\beta }}_{{{\text{MAB}}}}} - \frac{1}{2}\lg {{{\beta }}_{{{\text{M}}{{{\text{B}}}_{{\text{2}}}}}}} - \frac{1}{2}\lg {{{\beta }}_{{{\text{M}}{{{\text{A}}}_{{\text{2}}}}}}},$(7)
$\lg K_{{\text{A}}}^{{add}} = \lg {{{\beta }}_{{{\text{MAB}}}}} - \lg {{{\beta }}_{{{\text{MB}}}}},$(8)
$\lg K_{{\text{B}}}^{{add}} = \lg {{{\beta }}_{{{\text{M}}{{{\text{A}}}_{{\text{2}}}}{\text{B}}}}} - \lg {{{\beta }}_{{{\text{M}}{{{\text{A}}}_{{\text{2}}}}}}}.$Оценить с точки зрения статистики прочность CuL"H2(HisH$)_{2}^{{2 + }}$ проблематично, ведь гетеролигандные комплексы меди(II) состава 1 : 1 : 2 с гидразидами
кислот и аминокислотами не описаны в литературе. Рассчитать lg βстат и lgKs нельзя, так как неизвестна устойчивость комплекса Cu(HisH$)_{3}^{{2 + }}$, но для расчета константы присоединения (lgKadd, уравнения (7), (8)) молекулы гидразида к бис-комплексу Cu(HisH$)_{2}^{{2 + }}$ данных достаточно. Величина lgKadd для комплекса 6 на 1.45 логарифмических единиц больше константы устойчивости формы
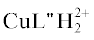 (lg β = 3.75), значит, имеются факторы, благоприятствующие присоединению молекулы
гидразида к комплексу Cu(HisH$)_{2}^{{2 + }}$. Повышенную устойчивость гетеролигандного соединения CuL"H2(HisH$)_{2}^{{2 + }}$ можно объяснить дополнительной поляризацией иона металла в неоднородном электростатическом
поле лигандов [39].
(lg β = 3.75), значит, имеются факторы, благоприятствующие присоединению молекулы
гидразида к комплексу Cu(HisH$)_{2}^{{2 + }}$. Повышенную устойчивость гетеролигандного соединения CuL"H2(HisH$)_{2}^{{2 + }}$ можно объяснить дополнительной поляризацией иона металла в неоднородном электростатическом
поле лигандов [39].
Возвращаясь к причинам экстрастабилизации комплексов состава 1 : 1 : 1 с цвиттер-ионной и анионной формами L-гистидина, предположим, что этот эффект сводится к так называемому d-π-взаимодействию с переносом электронной плотности с р-орбитали атома кислорода карбонильной группы гидразида через d-орбиталь иона металла на π-акцепторную систему имидазольного фрагмента гистидина. Особо значимой роль такого d-π-взаимодействия становится, если перенос электронной плотности происходит по транс-координате [39]. Действительно, как показала квантово-химическая оптимизация двух изомерных форм комплекса Cu(L)His+ · H2O (рис. 7), существование транс-изомера наряду с цис-изомером возможно и даже немного более предпочтительно (разница в энергиях изомеров составляет 1.33 ккал/моль).
Список литературы
Швелашвили А.Е., Мачхошвили Р.И. // Журн. неорган. химии. 1996. Т. 41. № 4. С. 570.
Миминошвили Э.Б. // Журн. структур. химии. 2009. Т. 50. С. 174. https://doi.org/10.1007/s10947-009-0205-x
Кокшарова Т.В., Мандзий Т.В., Скакун Т.С., Анисимов Ю.А. // Вісник ОНУ. Хімія. 2017. Т. 22. Вып. 1 (61). С. 79. https://doi.org/10.18524/2304-0947.2017.1(61).94714
Soares Fontes A.P., Guerra W., Machado F.C. et al. // Trans. Met. Chem. 2004. V. 29. № 4. P. 382. https://doi.org/10.1023/B:TMCH.0000027451.42739.b5
Emmanuel S.A., Thomas S.A., Idris S.O., Iyun J.F. // Der Pharma Chemica. 2012. V. 4. № 1. P. 370.
Adekunle F.A.O., Semire B., Odunola O.A. // Asian J. Chem. V. 25. № 13. 2013. P. 7371. https://doi.org/10.14233/ajchem.2013.14669
Characterisation of salicylic acid hydrazide and its metal complexes. http://shodhganga.inflibnet.ac.in/bitstream/10603/63297/8/08_chapter%202.pdf.
Patel R.N., Singh A., Shukla K.K. et al. // J. Coord. Chem. 2010. V. 63. № 19. P. 3483. https://doi.org/10.1080/00958971003628850
Nwabueze J.N., Salawu O.W. // Adv. Pure Appl. Chem. 2012. V. 1. № 2. P. 40.
Ojo A.S., Nwabueze J.N. // J. Pharm. Chem. Biol. Sci. 2016. V. 4. № 2. P. 281.
Paixão D.A., Marzano I.M., Jaimes E.H.L. et al. // J. Inorg. Biochem. 2017. V. 172. P. 138. https://doi.org/10.1016/j.jinorgbio.2017.04.024
Adeoye I.O., Adelowo O.O., Oladipo M.A., Odunola O.A. // Res. J. Appl. Scien. 2007. V. 2. № 5. P. 590.
Salami H.A., Haruna A.U., Ezeala F.T., Salawu O.W. // J. Der Pharma Chemica. 2015. V. 7. 4. P. 261.
Харитонов Ю.Я., Мачхошвили Р.И., Генералова Н.Б. // Журн. неорган. химии. 1974. Т. 19. № 7. С. 1856.
Mach J. // Acta Univ. Palack. Olomuc. Facult. Rerum Naturalium. 1974. T. 45. S. 15.
Kachhawaha M.S., Bhattacharya A.K. // J. Inorg. Nucl. Chem. 1963. V. 25. P. 361.
Попель А.А., Щукин В.А. // Журн. неорган. химии. 1975. Т. 20. № 7. С. 1917.
Fallab S., Erlenmeyer H. // Helv. Chim. Acta. 1953. V. 36. Fasc. I. № 3. S. 6.
Буев П.Н., Печурова Н.И. // Журн. неорган. химии. 1981. Т. 26. № 1. С. 133.
Буев П.Н., Печурова Н.И., Никитенко С.И. // Журн. неорган. химии. 1981. Т. 26. № 7. С. 1953.
Бычкова Т.И., Штырлин В.Г., Захаров А.В. // Журн. неорган. химии. 1989. Т. 34. № 11. С. 2820.
Бычкова Т.И., Афанасьева Г.В., Ижболдина Э.В. // Учен. зап. КГУ. Естеств. науки. 2009. Т. 151. Кн. 4. С. 39.
Deschamps P., Kulkarni P.P., Gautam-Basak M., Sarkar B. // Coord. Chem. Rev. 2005. V. 249. P. 895. https://doi.org/10.1016/j.ccr.2004.09.013
Hakimi M., Aliabadi T.S. // World Appl. Programming. 2012. V. 2. P. 431.
Stanila A., Marcu A., Rusu D. et al. // J. Mol. Struct. 2007. V. 834. P. 364. https://doi.org/10.1016/j.molstruc.2006.11.048
Alabdali A.J., Ibrahim F.M. // J. Appl. Chem. 2014. V. 6. P. 60. https://doi.org/10.9790/5736-0666063
Tripathi I.P., Kamal A. // Am. J. Adv. Drug Delivery. 2015. V. 3. № 1. P. 95.
Shtyrlin V.G., Zyavkina Yu.I., Gilyazetdinov E.M. et al. // Dalton Trans. 2012. V. 41. № 4. P. 1216. https://doi.org/10.1039/c1dt11309g
Фридман Я.Д., Сванидзе О.П., Долгашова Н.В. и др. // Изв. АН Киргиз. ССР. 1973. № 6. С. 54.
Фридман Я.Д., Сванидзе О.П., Долгашова Н.В. и др. // Журн. неорган. химии. 1974. Т. 19. № 12. С. 3304.
Каркарашвили М.В., Бешкенадзе И.А. // Сб. иссл. в обл. химии компл. и простых соед. некоторых перех. и редких металлов. Тбилиси, 1978. Вып. 3. С. 32.
Каркарашвили М.В., Бешкенадзе И.А. // Сб. иссл. в обл. химии компл. и простых соед. некоторых перех. и редких металлов. Тбилиси, 1978. Вып. 3. С. 44.
Трошанин Н.В., Разрывина А.А., Гилязетдинов Э.М. и др. // Учен. зап. Казан. ун-та. Сер. естеств. науки. 2017. Т. 159. Кн. 1. С. 40.
Смит П.А.С. Органические реакции. Ч. 3. М.: Изд-во иностр. литер., 1951. С. 322–347.
Сальников Ю.И., Глебов А.Н., Девятов Ф.В. Полиядерные комплексы в растворах. Казань: Изд-во Казан. ун-та, 1989. 288 с.
Gaussian 09, Revision B.01. Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian, Inc., Wallingford CT, 2010.
Tomasi J., Mennucci B., Cances E. // J. Mol. Struct. 1999. V. 464. P. 211. https://doi.org/10.1016/S0166-1280(98)00553-3
Бек М., Надьпал И. Исследование комплексообразования новейшими методами. М.: Мир, 1989. 413 с.
Пилипенко А.Т., Тананайко М.М. Разнолигандные и разнометальные комплексы и их применение в аналитической химии. М.: Химия, 1983. 224 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии