Журнал неорганической химии, 2020, T. 65, № 1, стр. 16-24
Соединения хрома(III) с некоторыми органическими лигандами
Н. А. Скорик a, *, Р. Р. Алимова b
a Томский государственный университет
634050 Томск, пр-т Ленина, 36, Россия
b АО “Сибиар”
630096 Новосибирск, Россия
* E-mail: Skorikninaa@mail.ru
Поступила в редакцию 26.06.2019
После доработки 19.08.2019
Принята к публикации 27.08.2019
Аннотация
При различных условиях установлено время достижения равновесия в системе хром(III)‒органический лиганд. Выделены соединения хрома(III) с пиколиновой Cr(C6H4NO2)3 ⋅ H2O, никотиновой CrOH(C6H4NO2)2 ∙ 2H2O и лимонной CrC6H5O7 ⋅ 3H2O кислотами, проведен их гравиметрический и термогравиметрический анализ, получены ИК-спектры. В растворе методом изомолярных серий установлен состав (1 : 1) доминирующих комплексов хрома(III) с анионами указанных кислот, методом pH-потенциометрии определены их константы устойчивости. Проведен анализ электронных спектров поглощения изученных систем. Для пиколината хрома разработана фотометрическая методика определения соли в растворе, определено значение константы растворимости KS (lg KS = –21.52 ± 0.29), проведен квантово-химический расчет для газообразной молекулы, рассчитаны энергетические и геометрические параметры.
ВВЕДЕНИЕ
Изучение систем, содержащих соли хрома(III) и биологически активные органические соединения, представляет не только научный, но и практический интерес. Ион этого металла играет роль в ряде биологических процессов, и многие соединения хрома(III) с органическими кислотами (алифатические и ароматические кислоты, оксикислоты, аминокислоты) находят широкое применение в медицине и пищевой промышленности. Хром занимает центральное место в метаболизме сахара и незаменим при лечении инсулиннезависимого диабета типа II. Биологическая роль пиколината хрома(III) состоит в том, что он участвует в утилизации глюкозы инсулином, предупреждает депрессию. В отличие от хрома(VI), большинство комплексов хрома(III) не являются цитотоксическими и мутагенными, по-видимому, из-за низкой клеточной проницаемости, связанной с их октаэдрической геометрией и кинетической инертностью.
Важным является исследование систем хром(III)‒органическая кислота, где протекание процесса комплексообразования иона Cr3+ осложнено реакциями гидролиза, полимеризации, замещения лигандов во внутренней сфере.
Основным свойством комплексов хрома(III) является их кинетическая устойчивость к реакциям замещения в водных растворах, именно поэтому так много комплексов хрома(III) удалось выделить. Многие реакции иона хрома(III) протекают в водных растворах при комнатной температуре медленно. Практически доказана инертность комплексов хрома(III) и выявлен механизм обмена лигандами. Авторы работы [1] указывают, что экспериментально определяемая скорость реакции замещения лигандов во внутренней сфере кинетически инертного аквакомплекса [Сг(Н2O)6]3+ (период полуобмена молекулами воды для него составляет 1‒3 сут [2]) является скоростью превращения внешнесферного комплекса [Cr(H2O)6]Hn – iL (заряды опущены), который быстро образуется в виде ионной пары (Hn–iL ‒ любая форма лиганда), во внутрисферный:
Раствор при этом подкисляется, отрыв протона может происходить как от лиганда, так и от молекулы воды аквакомплекса хрома(III).
В литературе имеются данные по синтезу солей хрома(III) с органическими лигандами. Описано получение соли Na3[Cr(C6H5O7)2] ∙ 8.5H2O, содержащей комплексный анион, из нитрата хрома(III), моногидрата лимонной кислоты (H3Cit ∙ H2O) в мольном соотношении 1 : 3 и раствора NaOH при рН 5.5 [3]. Отмечается, что полученное вещество имеет фиолетовую окраску. Патент [4] содержит описание способа получения пиколината хрома(III) из водного раствора CrCl3 ∙ 6H2O и пиколиновой кислоты C6H5NO2 (HPic): смесь реагентов кипятили в течение 15 мин, охлаждали, проводили кристаллизацию, фильтрацию, перекристаллизацию и получали темно-розовые кристаллы. Подобный состав MPic3 ∙ H2O имеют желтые кристаллы пиколинатов родия(III) и иридия(III), полученные из растворов хлоридов металлов и пиколиновой кислоты при нагревании смеси в течение 4 ч [5]. Кристаллические структуры обоих комплексов определены методом рентгеновской дифракции. В комплексах пиколинатные лиганды координированы с центром в виде бидентатных N,O-доноров, образующих пятичленные циклы. Молекула воды связана с карбоксилатными фрагментами двух соседних молекул MPic3 и действует как мост между отдельными сложными молекулами. В [6] описан синтез димерного пиколината Cr2(μ-OH)2(Pic)4 ∙ 5H2O и его ЯМР-спектр в диметилсульфоксиде.
Анализ литературных данных по получению никотината хрома(III) указывает на большую зависимость состава соли от условий синтеза. При взаимодействии никотиновой кислоты (HNic), гексагидрата перхлората хрома и перхлората натрия в водном растворе получен трехъядерный комплекс хрома(III) Na[Cr3O(HNic)6(H2O)3](ClO4)8 ∙ HNic ∙ 6H2O, состав которого был установлен на основании аналитических данных и результатов монокристаллического рентгеноструктурного анализа [7]. Никотиновая кислота связывается с хромом только через карбоксильный атом кислорода. Авторы [8] синтезировали оранжевые кристаллы транс[Cr(1,3-pn)2(Nic)2]Cl ∙ 4H2O (1,3-pn ‒ 1,3-пропандиамин). Дейтерий ЯМР-спектроскопия указала, что два транс-Nic−-аниона координированы через карбоксильные группы. В работе [9] описаны полученные никотинаты состава Cr2Nic3(ОН)3 ∙ 4H2O и Cr2(HNic)3Cl6 ∙ 6H2O, а также новые тройные комплексы хром(III)‒никотиновая кислота‒аминокислота с гистидином Cr(L-his)(HNic)Cl3 ∙ 5H2O и анионом цистеина Cr(L-cis−)(HNic)Cl2 ∙ 4H2O (конечный рН 3.0). С помощью физических измерений найдены их характеристики, во всех случаях никотиновая кислота связана с атомом хрома(III) через карбоксильную группу.
Авторы [10] синтезировали желтое кристаллическое вещество CrNic2 ∙ 4H2O и синее твердое вещество CrNic2OH ∙ 3H2O. Сообщается, что никотиновая кислота в комплексе хрома(II) связана только через пиридиновый азот, в комплексе хрома(III) ‒ через карбоксилат. Соединение со связью Cr−N имеет желтый, красный цвет, а со связью Cr−O – зеленый, синий. Хром(III) прочно связывается с ОН-группами и молекулами Н2О в водном растворе, в результате чего образуются полимерные комплексы, комплексы хрома(III) с никотинат-ионом в целом могут быть олатами.
Авторы работы [11] исследовали структуры CrPic3 и трех препаратов с никотинат-ионом (CrPic2Nic, CrPicNic2, CrNic3) при помощи жидкофазного ЯМР и твердофазного метода Фурье. Ни один препарат с никотинат-ионом не является кристаллическим, каждый исследуемый продукт имеет свой цвет. Олатная структура согласуется с наблюдением, что CrPicNic2 и CrNic3 относительно мало растворимы в H2O и ДМСО, и может объяснить наблюдаемый синий и зеленый цвет. Проведен расчет абсолютной энергии различных молекулярных конформаций синтезированных соединений (вычисления сделаны для комнатной температуры, газовой фазы). Сравнение относительной стабильности четырех конформаций указывает на бóльшую стабильность молекулярной конформации CrPic3. Данных по изучению комплексообразования хрома(III) с органическими лигандами в растворах в литературе не так много, имеются также сведения о смешанном комплексообразовании. В [12] приведена константа устойчивости комплекса хрома(III) с пиколиновой кислотой состава [CrPic2]+ (lgβ2 = 10.22, I = 0.5). В [13] изучено гетеролигандное комплексообразование хрома(III) в системе Cr3+‒HnL‒H2Sal, где HnL ‒ моноаминные карбоксиметильные комплексоны (метилиминодиуксусная, β-гидроксиэтилиминодиуксусная, нитрилотриуксусная кислоты), H2Sal ‒ салициловая кислота, определены константы устойчивости комплексов состава 1 : 1 : 1. С использованием спектрофотометрических данных и методов математического моделирования установлен состав и определены константы устойчивости моно- и билигандных комплексов хрома(III) с комплексонами ряда карбоксиметиленаминов и гидроксикарбоновыми кислотами алифатического (лимонная, винная) и ароматического рядов [1].
В настоящее время продолжается изучение физико-химических и биологических свойств пиколината хрома(III). Все больше споров вызывает использование пиколината хрома(III) в качестве пищевой добавки. Для сравнения с пиколинатом хрома(III) были синтезированы и охарактеризованы семь новых производных состава Cr(R–Pic)3 (R = H, Br, CF3, Cl, COOH, CH3, 5-OH, 3-OH) [14]. Эти комплексы хрома(III) не оказывают значительного влияния на глюкозу крови, сывороточный инсулин, общий холестерин и др. у мышей с диабетом. Указанные группы заместителей не способны явно улучшить биологическую активность CrPic3, поэтому обоснованность применения пиколината хрома(III) в качестве пищевой добавки вызывает сомнения.
В работах [15, 16] изучено электрохимическое восстановление CrPic3 в присутствии доноров протонов, таких как аскорбиновая, бензойная и уксусная кислоты, исследуется процесс обмена внутрисферных молекул воды комплексного иона [CrPic(H2O)4]2+ с внешнесферными молекулами H2O.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры растворов изучаемых систем снимали на спектрофотометре Leki SS2107UV, оптическую плотность измеряли на фотоколориметре КФК-2-УХЛ 4.2 при толщине поглощающего слоя l = 10 мм; pH растворов определяли на pH-метре 673 со стеклянным электродом, откалиброванным по растворам соляной кислоты с известным значением рН и определенной ионной силой. Термограммы синтезированных солей снимали на приборе Netzsch STA 449 F1 при следующих условиях: материал тигля − Al2O3, скорость нагрева – 10 град/мин, атмосфера − воздух (80 мл/мин); ИК-спектры регистрировали на спектрометре Agilent Cary 630 FTIR в частотном диапазоне 400–4000 см–1.
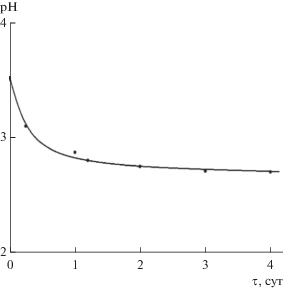
Учитывая высокую инертность хрома(III), при проведении синтеза его соединений с органическими лигандами, изучении комплексообразования в растворах необходимо знать время, требуемое для достижения равновесия в системе. Влияние времени на скорость образования хелатов хрома(III) изучено на примере системы Cr(NO3)3‒H3Cit (CCr = CCit = 0.0125 моль/л; pH0 3.5; Vобщ = 15 мл) по изменению во времени значения pH раствора (рис. 1).
Как видно из рис. 1, равновесие в системе Cr(NO3)3–H3Cit при комнатной температуре достигается через 2–3 сут. При нагревании раствора на водяной бане (Vобщ ≈ const) равновесие в данной системе устанавливается через 3–3.5 ч (pH изменяется от 3.5 до 2.5 за счет увеличивающегося гидролиза иона Cr3+ при нагревании). На основании электронных спектров поглощения (ЭСП) указанной системы, снятых при различном времени кипячения раствора (объем раствора поддерживали постоянным), сделан вывод о том, что равновесия комплексообразования, гидролиза (сравнение с ЭСП системы Cr(NO3)3–H2O в тех же условиях) устанавливаются через 20 мин (pH изменяется от 3.5 до 2.1). Во всех случаях отмечено изменение окраски растворов от сине-фиолетовой, принадлежащей гексаакваионам [Cr(H2O)6]3+, до темно-синей, что доказывает протекание процесса комплексообразования с органическим лигандом. С учетом литературных и установленных нами условий достижения равновесия в системах, содержащих хром(III) и органический лиганд, выбраны методики получения солей и условия изучения комплексообразования хрома(III) с лимонной, пиколиновой и никотиновой кислотами.
Cинтез цитрата хрома(III) проводили по реакции взаимодействия девятиводного нитрата хрома(III) и лимонной кислоты (мольное соотношение компонентов 1 : 1):
Для этого к 5 мл раствора, содержащего 3.32 г Cr(NO3)3 ∙ 9H2O, приливали 5 мл раствора лимонной кислоты (1.74 г Н3Cit ∙ H2O). В полученном прозрачном растворе сине-фиолетового цвета (pHсмеси 1.36) создавали рН ~3.7‒4.0 концентрированным раствором NaOH. Смесь нагревали на водяной бане в течение 3 ч, охлаждали и выдерживали сутки (рН 2.3), высаливали цитрат хрома(III) ацетоном. Образовавшуюся массу промывали ацетоном, затем сушили на воздухе.
Cинтез пиколината хрома(III) осуществляли по реакции взаимодействия девятиводного нитрата хрома(III) с пиколиновой кислотой в мольном соотношении 1 : 3 (Vсмеси ~30 мл):
В полученном прозрачном растворе 2.5 М раствором NaOH создавали рН 3.40. При стоянии раствора (2 сут) выпадал темно-розовый осадок, который промывали водой и сушили на воздухе. Пиколинат хрома также получали нагреванием смеси исходных компонентов на бане (2 ч) при pH 1.9‒3.5. Состав солей, полученных в этом интервале pH, был идентичным.
При синтезе никотината хрома(III) (соотношение исходных компонентов 1 : 3) к 15 мл раствора, содержащего 2.86 г Cr(NO3)3 ∙ 9H2O, приливали 15 мл слегка нагретого раствора 2.77 г никотиновой кислоты и 4.30 мл 2.5 М раствора NaOH. Полученный прозрачный раствор серо-зеленого цвета выдерживали на водяной бане в течение 3 ч, охлаждали и оставляли на сутки. Раствор с осадком приобретал серую окраску, его еще раз выдерживали на водяной бане, после охлаждения раствора (рН 3.20) выпавший осадок отфильтровывали, промывали холодной водой и высушивали на воздухе.
Синтезированные соли хрома(III) проанализированы на содержание воды и оксида хрома гравиметрическим методом. Для этого соли выдерживали при температуре 130°С (2 ч) для удаления воды, затем при 900°С в течение 2–3 ч до образования оксида Cr2O3. Содержание воды, органического лиганда и оксида хрома в солях было определено также с помощью термогравиметрии. Удовлетворительное совпадение результатов определения кристаллизационной воды в цитрате и пиколинате хрома(III) методами термогравиметрии (tmax = 110 и 118°С соответственно) и гравиметрии при 130°С позволило провести их усреднение. Наблюдалась хорошая сходимость гравиметрических и термогравиметрических данных при определении содержания оксида хрома(III) во всех солях. Усредненные результаты гравиметрического и термогравиметрического анализа солей приведены в табл. 1. Наблюдается удовлетворительная сходимость рассчитанных и экспериментально полученных значений содержания в солях воды, лиганда и оксида хрома. Термический распад цитрата хрома(III) CrCit ∙ 3H2O на воздухе, по данным термограммы, протекает в несколько стадий, на что указывает изменение массы соли: эндотермический процесс дегидратации происходит в интервале температур 70−240°С (tmax = 110°C); экзотермический эффект при 240−440°С (tmax = 410°C) соответствует полной термической деструкции цитрат-иона с дальнейшим образованием оксида Cr2O3:
Таблица 1.
Данные термического и термогравиметрического методов анализа синтезированных солей хрома(III)
| Состав соли (pH водного раствора) |
Н2О, % | Lm−, % | Cr2O3, % | |||
|---|---|---|---|---|---|---|
| найдено | вычислено | найдено | вычислено | найдено | вычислено | |
| CrOH(C6H4NO2)2 ∙ 2H2O, CrOHNic2 ∙ 2H2O (3.2) | 12.0 | 10.31 | 67.7 | 69.93 | 21.4 | 21.76 |
| Cr(C6H4NO2)3 ∙ H2O, CrPic3 ∙ H2O (3.4; 1.9) | 4.2 | 4.13 | 78.3 | 83.95 | 17.8 | 17.42 |
| CrC6H5O7 ∙ 3H2O, CrCit ∙ 3H2O (2.3) | 16.7 | 18.30 | 60.2 | 64.08 | 26.0 | 25.75 |
На термограмме гидроксоникотината хрома(III) CrOHNic2 ∙ 2H2O группа эндотермических эффектов при 70−340°С (tmax = 225°C) соответствует дегидратации и частичной сублимации никотиновой кислоты. С экзотермическим эффектом в интервале температур 340−520°С (tmax = = 446°C) происходит полное выгорание никотинат-иона на воздухе и образование оксида хрома(III). Потеря воды пиколинатом хрома(III) CrPic3 ∙ H2O протекает с эндотермическим эффектом в интервале 70−210°С (tmax = 118°C). В интервале температур 320−570°С (tmax = 370, 518°C) наблюдается деструкция аниона и начало образования оксида хрома(III).
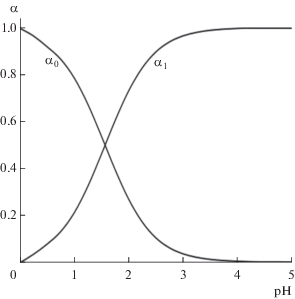
Для синтезированного пиколината хрома CrPic3 ∙ H2O была определена константа растворимости KS = [Cr3+] ∙ [Pic−]3. Поскольку соль плохо растворима, для определения ее растворимости взяты исходные растворы с достаточно высокой концентрацией соляной кислоты (0.3−1 моль/л), pH 0.52‒0 и ионной силой I = 1. Как видно из рис. 2, выход комплекса CrPic2+ в растворах в указанном интервале pH составляет всего ~(8–2)%. Поэтому, пренебрегая комплексообразованием в кислых растворах, для насыщенного раствора пиколината хрома учитывали следующие равновесия и соответствующие им константы:
(1)
$\begin{gathered} {\text{CrPi}}{{{\text{c}}}_{{{\text{3(т)}}}}} \leftrightarrow {\text{CrPi}}{{{\text{c}}}_{{3({\text{p}})}}} \leftrightarrow {\text{Cr}}_{{({\text{p}})}}^{{3 + }} + 3{\text{Pic}}_{{({\text{p}})}}^{ - }, \\ {{K}_{S}} = \left[ {{\text{C}}{{{\text{r}}}^{{3 + }}}} \right] \cdot {{\left[ {{\text{Pi}}{{{\text{c}}}^{ - }}} \right]}^{3}}, \\ \end{gathered} $(2)
${{{\text{H}}}^{ + }} + {\text{Pi}}{{{\text{c}}}^{ - }} \leftrightarrow {\text{HPic}},\,\,\,\,{{В}_{1}} = {{\left[ {{\text{HPic}}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{HPic}}} \right]} {\left[ {{{{\text{H}}}^{ + }}} \right]}}} \right. \kern-0em} {\left[ {{{{\text{H}}}^{ + }}} \right]}} \cdot \left[ {{\text{Pi}}{{{\text{c}}}^{ - }}} \right],$(3)
$\begin{gathered} {\text{C}}{{{\text{r}}}^{{3 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {{\left[ {{\text{CrOH}}} \right]}^{{2 + }}} + {{{\text{H}}}^{ + }}, \\ {{K}_{h}}_{1} = {{\left( {{{{\left[ {{\text{CrOH}}} \right]}}^{{2 + }}} \cdot \left[ {{{{\text{H}}}^{ + }}} \right]} \right)} \mathord{\left/ {\vphantom {{\left( {{{{\left[ {{\text{CrOH}}} \right]}}^{{2 + }}} \cdot \left[ {{{{\text{H}}}^{ + }}} \right]} \right)} {\left[ {{\text{С}}{{{\text{r}}}^{{{\text{3 + }}}}}} \right]}}} \right. \kern-0em} {\left[ {{\text{С}}{{{\text{r}}}^{{{\text{3 + }}}}}} \right]}}. \\ \end{gathered} $Рис. 2.
Диаграмма выхода частиц Cr3+ (α0) и СrPic2+ (α1) в зависимости от pH (CL = 0.01моль/л, lgB1 = 5.15, lgβ1 = 5.58; программа “Выход комплекса” [17]).
Из равновесия (1) видно, что в насыщенном растворе CCr = Ссоли (Ссоли ‒ растворимость соли, моль/л), тогда уравнение материального баланса по иону металла имеет вид:
(4)
$\begin{gathered} {{C}_{{{\text{Cr}}}}} = {{С}_{{{\text{соли}}}}} = \left[ {{\text{C}}{{{\text{r}}}^{{3 + }}}} \right] + {{\left[ {{\text{CrOH}}} \right]}^{{2 + }}} = \\ = \left[ {{\text{C}}{{{\text{r}}}^{{3 + }}}} \right]\left( {1{\text{ }} + {{K}_{h}}_{1}/h} \right) = \left[ {{\text{C}}{{{\text{r}}}^{{3 + }}}} \right] \cdot \omega . \\ \end{gathered} $Из выражения (3) для Кh1 найдена величина [CrOH]2+ = Kh1 [Cr3+]/h (h – равновесная концентрация ионов водорода [H+]); функция гидролиза ω = 1 + Kh1/h, Kh1 ‒ константа гидролиза иона Cr3+, взятая равной 7.1 × 10−5 [1]. Из уравнения (4) получаем: [Cr3+] = Cсоли/ω. Из уравнения (5) материального баланса по лиганду с учетом равновесия (1)
(5)
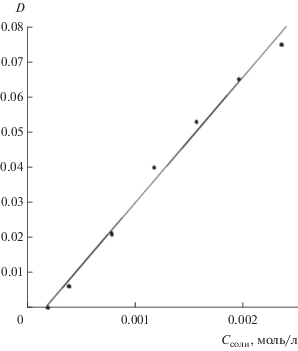
$\begin{gathered} {{С}_{{{\text{Pic}}}}} = \left[ {{\text{HPic}}} \right] + \left[ {{\text{Pi}}{{{\text{c}}}^{ - }}} \right] = \\ = {{В}_{1}}h\left[ {{\text{Pi}}{{{\text{c}}}^{ - }}} \right] + \left[ {{\text{Pi}}{{{\text{c}}}^{ - }}} \right] = \left[ {{\text{Pi}}{{{\text{c}}}^{ - }}} \right]f = 3{{С}_{{{\text{соли}}}}}, \\ \end{gathered} $Определение содержания соли в насыщенных растворах пиколината хрома(III) ($C_{{{\text{HCl}}}}^{0}$ = = 0.3‒1 моль/л) проводили фотометрически при λэф = 440 или 540 нм, используя для приготовления калибровочных растворов (СHCl = 0.5 моль/л, pH 0.30; I = 1) стандартный раствор соли CrPic3 ∙ H2O с концентрацией 2.36 × 10−3 моль/л. Градуировочные характеристики для растворов CrPic3 при 440 (рис. 3) и 540 нм имеют хорошие коэффициенты корреляции (0.996 и 0.995 соответственно). Для определения растворимости соли к аликвоте ее насыщенного раствора прибавляли необходимые объемы 1 М раствора HCl, 2 М раствора NaCl (Vобщ = 6 мл), чтобы СHCl = 0.5 моль/л, I = 1, как и в калибровочных растворах. В соответствии с выходом частиц Cr3+ и CrPic2+ (рис. 2) в 0.5 М растворах HCl (pH 0.30) присутствует ~95% акваионов хрома(III), которые и обусловливают поглощение раствора.
Рис. 3.
Градуировочная характеристика для растворов CrPic3 (СHCl = 0.5 моль/л, I = 1; λ = 440 нм; l = 10 мм; R2 = 0.996).
В табл. 2 приведены данные по определению растворимости пиколината хрома(III) в растворах с $C_{{{\text{HCl}}}}^{0}$ = 0.3‒1 моль/л и результаты расчета константы растворимости соли CrPic3 ⋅ H2O (I = 1).
Таблица 2.
Результаты расчета константы растворимости KS соли CrPic3 ∙ H2O по данным ее растворимости (Kh1 (Cr3+) = 7.1 × 10−5; B1 = 1.62 × 105; I = 1; λ = 440 нм), lg KS = −21.52 ± 0.29
| № | $C_{{{\text{HCl}}}}^{0}$l = h, моль/л | f | ɷ | C(CrPic3 ∙ H2O), моль/л | –lgKS CrPic3 ∙ H2O |
|---|---|---|---|---|---|
| 1 | 0.300 | 4.74 × 104 | 1.00024 | 7.53 × 10–3 | 21.09 |
| 2 | 0.336 | 5.31 × 104 | 1.00021 | 7.99 × 10–3 | 21.13 |
| 3 | 0.446 | 7.05 × 104 | 1.00016 | 8.45 × 10–3 | 21.41 |
| 4 | 0.520 | 8.22 × 104 | 1.00014 | 9.56 × 10–3 | 21.39 |
| 5 | 0.600 | 9.48 × 104 | 1.00012 | 9.74 × 10–3 | 21.54 |
| 6 | 0.678 | 1.07 × 105 | 1.00010 | 9.79 × 10–3 | 21.69 |
| 7 | 0.758 | 1.20 × 105 | 1.00009 | 1.05 × 10–2 | 21.72 |
| 8 | 0.918 | 1.45 × 105 | 1.00008 | 1.14 × 10–2 | 21.83 |
| 9 | 1.000 | 1.58 × 105 | 1.00007 | 1.17 × 10–2 | 21.89 |
Комплексообразование в системах Cr3+‒HnL (HnL = HPic, HNic, H3Cit) изучено методом изомолярных серий и pH-потенциометрически при ионной силе I = 0.3, создаваемой раствором NaNO3 (фоновый электролит имеет общий ион с компонентом растворов Cr(NO3)3). Фотометрически методом изомолярных серий было установлено, что во всех системах доминирует комплекс состава 1 : 1. На рис. 4 для примера приведена изомолярная серия системы Cr3+‒HNic.
Рис. 4.
Зависимость D, DM и ΔD от мольной доли лиганда в изомолярных растворах системы Cr(NO3)3–HNic–NaNO3 ($C_{{{\text{Cr}}}}^{0}$ = $C_{{{\text{Nic}}}}^{0}$ = 0.05 моль/л; Vобщ = 10 мл; pH ~3.1; I = 0.3; λ = 400 нм).

Учитывая, что данные фотометрии указывают на доминирование в изучаемых системах комплекса состава 1 : 1, при рН-потенциометрическом определении устойчивости комплексов соотношение металл : лиганд задавалось равным 1 : 1. В смесь раствора соли Cr(NO3)3 со свободной кислотностью СH = 1 × 10−3 моль/л (HNO3) и раствора соответствующей органической кислоты вносили различные объемы NaOH и выдерживали растворы 3 сут для достижения равновесия. В табл. 3 для примера приведены данные по приготовлению растворов, измерению в них величины pH и расчету по программе Бьеррум 1 [17] логарифма константы устойчивости комплекса [CrPic]2+ (lg β1 = 5.58 ± 0.26). Для комплексных ионов [CrNic]2+ и [CrCit], по данным pH-потенциометрии, lg β1 равен соответственно 4.14 ± 0.26 и 7.15 ± 0.11.
Таблица 3.
Данные определения константы устойчивости комплекса [CrPic]2+ pH-потенциометрическим методом ($C_{{\text{L}}}^{0}$ = 5 × 10−3 моль/л, $C_{{{\text{Cr}}}}^{0}$ = 5 × 10−3 моль/л с СH = 1 × 10−3 моль/л, $C_{{{\text{щел}}}}^{0}$ = 1.07 × 10−2 моль/л, I = 0.3, lg B1 = 5.15 (пересчет с I = 0.1)), lg β1 = 5.58 ± 0.26
| № | VСr, мл | VHPic, мл | VNaOH, мл | pH | lg β1 |
|---|---|---|---|---|---|
| 1 | 5.0 | 5.0 | 0.22 | 2.74 | 5.71 |
| 2 | 5.0 | 5.0 | 0.44 | 2.90 | 5.20 |
| 3 | 5.0 | 5.0 | 0.66 | 2.89 | 5.55 |
| 4 | 5.0 | 5.0 | 0.88 | 3.01 | 5.35 |
| 5 | 5.0 | 5.0 | 1.10 | 3.12 | 5.27 |
| 6 | 5.0 | 5.0 | 1.32 | 3.14 | 5.53 |
| 7 | 5.0 | 5.0 | 1.54 | 3.18 | 5.77 |
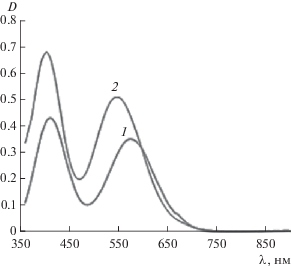
Для систем Сr(NO3)3−H2O, Сr(NO3)3−HPic и Сr(NO3)3−HNic (СCr = CL = 0.025 моль/л; Vобщ = = 10 мл; I = 0.3 (NaNO3)) в видимой области спектра сняты ЭСП. Во всех растворах рН создавали растворами HNO3 или NaOH, растворы оставляли на 3 сут для достижения равновесия (рН 2.9‒3.1). На рис. 5 приведены спектры поглощения нитрата хрома(III), смеси соли металла и пиколиновой кислоты. Спектры поглощения систем Сr(NO3)3−HNic и Сr(NO3)3−H3Cit похожи на спектр системы Сr(NO3)3−HPic.
Рис. 5.
ЭСП систем: 1 − Сr(NO3)3−H2O (СCr = = 0.025 моль/л); 2 − Сr(NO3)3−HPic (СCr = CL = = 0.025 моль/л).
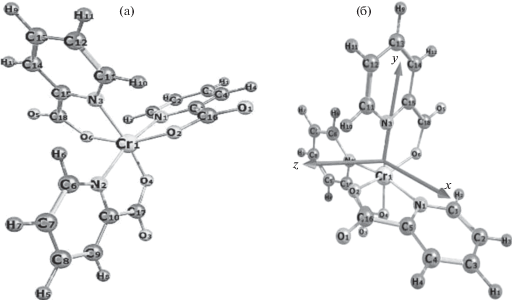
Квантово-химический расчет структуры пиколината хрома(III) проведен с помощью программы Gaussian 09 [18] при использовании метода функционала плотности (DFT) с функционалом B3LYP и базисным набором 6−31G (d). При помощи полной оптимизации молекулы находили стационарные точки на поверхности потенциальной энергии. В результате проведены расчеты предполагаемой структуры пиколината хрома(III) в газовой фазе (расположение в пространстве центрального атома и лигандов, длины связей, валентные углы), полной и относительной энергии газообразной молекулы, а также ИК-спектра пиколината хрома с целью сравнения его с экспериментально полученным. Рассчитанная структура исследуемой молекулы показана на рис. 6.
Рис. 6.
Рассчитанная структура пиколината хрома(III): а – общий вид молекулы CrPic3; б – ориентация молекулы CrPic3 относительно декартовой системы координат.
Результаты квантово-химического расчета полной и относительной (разность значений полной энергии молекулы Еполн и энергии нулевых колебаний ЕZPE) энергий пиколината хрома(III) приведены в табл. 4.
В соответствии с рис. 6 проведены расчеты геометрических параметров структуры ‒ длин связей, валентных углов плоских пятичленных циклов в молекуле хрома(III) с пиколиновой кислотой (табл. S1, S2). Сравнение рассчитанных и экспериментально полученных частот колебаний ИК-спектра молекулы пиколината хрома(III) представлено в табл. S3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При внесении в раствор соли хрома(III) лиганда наблюдается изменение кислотности, повышение оптической плотности, небольшое смещение максимумов полос поглощения комплексов хрома(III) по сравнению с гидратированным ионом металла, отличие молярных коэффициентов поглощения от значений молярных коэффициентов поглощения исходных веществ. Максимумы полос поглощения, соответствующие им значения оптической плотности, а также разность этих величин в системах Сr(NO3)3−H2O, Сr(NO3)3−HNic(HPic)−H2O с одинаковой концентрацией компонентов и близким значением pH представлены в табл. 5 (для величин ∆λ гипсохромное смещение обозначено знаком минус). Невысокие коэффициенты молярного поглощения растворов, содержащих акваионы хрома(III) и его комплексы, при длинах волн 411–399, 575–544 нм (17.24–26.76, 14.08–20.40 соответственно) указывают на то, что полосы при этих длинах волн принадлежат d–d-переходам электронов иона Cr3+ (d3). В спектрах изученных систем наблюдаются две полосы поглощения, которые можно отнести к электронным d−d-переходам иона Cr3+ (d3): 4A2g → 4T1g (в диапазоне 399−411 нм) и 4A2g → 4T2g (в диапазоне 544−575 нм), что подтверждается данными работ [9, 19]. Из табл. 5 видно, что в системах с лигандами наблюдается гипсохромный сдвиг максимумов полос поглощения (λmax) акваионов хрома(III), который указывает на увеличение энергии расщепления атомных d-орбиталей хрома(III) кристаллическим полем лигандов по сравнению с расщеплением в случае акваиона хрома(III). Это расщепление больше в случае пиколинат-иона, образующего более устойчивый хелатный комплекс с ионом Cr3+, чем никотинат-ион.
Таблица 5.
Результаты исследования систем Сr(NO3)3−H2O, Сr(NO3)3−HNic(HPic)−H2O (СCr= CL = 0.025 моль/л; τ = 3 сут)
| Система | p[Н]° | p[Н]τ | λmax, нм | Dmax | ∆λ, нм | ε, л/(см моль) | ∆D |
|---|---|---|---|---|---|---|---|
| Cr(NO3)3–H2O | 3.5 | 2.9 | 412; 575 |
0.431; 0.352 |
− − |
17.24; 14.08 |
− |
| Cr(NO3)3–HNic | 3.6 | 3.1 | 411 574 |
0.465 0.467 |
−1 −1 |
25.80; 18.68 |
0.034 0.115 |
| Cr(NO3)3–HPic | 3.7 | 2.9 | 399 544 |
0.669 0.510 |
−13 −31 |
26.76; 20.40 |
0.238 0.158 |
В табл. 6 приведены данные по константам устойчивости комплексов хрома(III) с анионами лимонной, пиколиновой и никотиновой кислот, определенные в настоящей работе, и для сравнения представлены литературные данные по устойчивости комплексов железа(III) с этими же лигандами. Близость ионных радиусов трехвалентных хрома и железа обусловливает близость констант устойчивости их комплексов. Несколько бóльшую устойчивость комплексов иона Fe3+ (d5) по сравнению с ионом Cr3+ (d3) с кислород- и азотсодержащими лигандами можно объяснить большей электростатичностью иона железа(III) и бóльшим его сродством к донорным атомам кислорода и азота. Увеличение устойчивости комплексов хрома(III) в ряду [CrNic]2+, [CrPic]2+, [CrCit] находится в соответствии с зарядами анионов и основностью кислот (lg B1 4.81, 5.15, 5.49 соответственно).
Из данных квантово-химических расчетов для газообразной молекулы пиколината хрома(III) можно сделать вывод, что частица CrPic3, как и ожидалось, располагается в пространстве в форме октаэдра. Центральный ион хрома(III) образует три плоских пятичленных цикла посредством донорных атомов кислорода и азота бидентатных лигандов пиколиновой кислоты. Полученная большая отрицательная величина энергии молекулы пиколината хрома(III) (табл. 4 ) свидетельствует о высокой устойчивости данного соединения. Предположительно, это можно объяснить образованием прочной связи центрального атома хрома(III) с донорными атомами кислорода и азота пиридин-2-карбоновой кислоты в пятичленных циклах.
Сумма валентных углов плоского пятиугольника составляет 540.0°, сумма рассчитанных валентных углов пятичленных циклов 1, 2, 3 в молекуле пиколината хрома(III), по данным табл. S2 , составляет 543.4°, 539.9° и 539.7° соответственно, что говорит о плоском расположении их в пространстве с учетом погрешности. Малая величина валентных углов O2Cr1N1, O4Cr1N2, N3Cr1O6 (78°–83°), отличающаяся от 108° (валентный угол в плоском пятиугольнике), объясняется тем, что при октаэдрической координации при образовании пятичленных циклов ионом хрома(III) происходит вытягивание связей Cr‒O, Cr‒N и вследствие этого уменьшение валентного угла. Значения этих длин связей в табл. S1 выделены полужирным шрифтом. В работе [21] методом рентгеновской кристаллографии найдены структурные характеристики CrPic3 ∙ H2O (длины связей, валентные углы), близкие полученным квантово-химическим методом в данной работе (табл. 7). Расхождение значений длин связей в молекуле пиколината хрома(III) между теоретическим расчетом в программе Gaussian 09 и данными, полученными методом рентгеновской кристаллографии [21], составляет: 0.01‒0.06 Å для связей Cri‒Nn и 0.04‒0.07 Å для связей Cri‒On, что можно считать удовлетворительным. Авторы работы указывают, что в кристалле пиколината атом хрома координирует три атома азота, три атома кислорода и имеет искаженную октаэдрическую геометрию. Каждая молекула воды играет роль мостика водородной связи и соединяет два соседних комплекса. В работе [5] структура пиколинатов родия(III) и иридия(III) определена методом рентгеновской кристаллографии, структурные характеристики близки к таковым в настоящей работе. Например, величина угла N2Cr1O4 (рис. 6, табл. S2 ) составляет 82.8°, а в работах [5] и [21] – 81.75° (пиколинат родия(III)), 80.72° (пиколинат иридия(III)) и 80.5° (пиколинат хрома(III)).
Таблица 7.
Длины связей (Å) в молекуле пиколината хрома(III), полученные квантово-химическим расчетом и методом рентгеновской кристаллографии
| Квантово-химический расчет в программе Gaussian 09 |
Рентгеновская кристаллография [21] | ||
|---|---|---|---|
| Cri‒On | Cri‒Nn | Cri‒On | Cri‒Nn |
| 1.877 1.902 1.900 |
2.054 2.089 2.122 |
1.945 1.946 1.955 |
2.045 2.055 2.063 |
Удовлетворительное совпадение рассчитанного в программе Gaussian 09 и экспериментально полученного ИК-спектров (табл. S3 ) свидетельствует о том, что в пиколинате хрома(III) CrPic3 ∙ H2O центральный атом хрома имеет октаэдрическое окружение, а кристаллизационная молекула воды располагается вне этого окружения.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Таблица S1 . Рассчитанные значения длин связей в молекуле пиколината хрома(III).
Таблица S2 . Рассчитанные значения валентных углов плоских пятичленных циклов в молекуле пиколината хрома(III).
Таблица S3 . Сравнение экспериментально полученных и рассчитанных частот ИК-спектра пиколината хрома(III).
Список литературы
Корнев В.И., Микрюкова Г.А. // Вестник Удмуртского университета. Химия. 2006. № 8. С. 163.
Лаврухина А.К., Юкина Л.В. Аналитическая химия хрома. М.: Наука, 1979. 222 с.
Gabriel C., Raptopoulou C.P., Drouza C. et al. // Polyhedron. 2009. V. 28. P. 3209. https://doi.org/10.1016/j.poly.2009.05.077
Boynton Herb, Evans Gary W. et al. Pat. US 5087623A. Publicated: The February of 11, 1992.
Semanti Basu, Peng Shie-Ming, Lee Gene-Hsiang, Bhattacharya Samaresh // Polyhedron. 2005. V. 24. № 1. P. 157. https://doi.org/10.1016/j.poly.2004.10.015
Chakov N.E., Collins R.A., Vincent J.B. // Polyhedron. 1999. V. 18. Issue 22. P. 2891. https://doi.org/10.1016/S0277-5387(99)00208-9
Gonazler-Vergara E., Hegenauer J., Saltman P. et al. // Inorg. Chim. Acta. 1982. V. 66. P. 115. https://doi.org/10.1016/S0020-1693(00)85799-0
Green C.A., Bianchini R.J., Legg J.I. // Inorg. Chem. 1984. V. 23. P. 2713. https://doi.org/10.1021/ic00185a032
Vicens M., Fiol J.J., Terrbn A. // Inorg. Chim. Acta. 1992. V. 192. P. 139. https://doi.org/10.1016/S0020-1693(00)83183-7
Cooper J.A., Anderson B.F., Buckley P.D., Blackwell L.F. // Inorg. Chim. Acta. 1984. V. 91. P. 1. https://doi.org/10.1016/S0020-1693(00)84211-5
Broadhurst C.L., Schmidt W.F., Reeves III J.B. et al. // J. Inorg. Biochem. 1997. V. 66. № 2. P. 119.
Sillen L.G., Martell A.E. Stability constants of metal-ion complexes. London: Chemical society. 1964. Part 3 (1). P. 435. https://lib.ugent.be/catalog/rug01:000022724
Корнев В.И., Микрюкова Г.А. // Химическая физика и мезоскопия. 2005. Т. 7. № 1. С. 71.
Jie Chai, Yanfei Liu, Jinglong Dong et al. // Inorg. Chim. Acta. 2017. V. 466. P. 151. https://doi.org/10.1016/j.ica.2017.05.041
Uddin K.M., Alrawashdeh A.I., Debnath T. et al. // J. Mol. Struct. 2019. V. 1189. P. 28. https://doi.org/10.1016/j.molstruc.2019.04.015
Rodríguez Cordero M.I., Piscitelli V., Borras C. et al. // J. Mol. Liquids. 2015. V. 211. P. 401. https://doi.org/10.1016/j.molliq.2015.07.019
Скорик Н.А., Чернов Е.Б. Расчеты с использованием персональных компьютеров в курсе химии комплексных соединений. Томск: Изд. ТГУ, 2009. 92 с.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09, Revision A.01. Gaussian, Inc., Wallingford CT, 2009.
Мезенцев К.В., Михайленко Ю.А. // Вестник КузГТУ. 2010. № 6. С. 121.
Пальчевский В.В., Хорунжий В.В., Щербакова В.И. // Коорд. химия. 1984. Т. 10. № 8. С. 1076.
Mohammad Hakimi // J. Korean Chem. Society. 2013. V. 57. № 6. P. 721.
Дополнительные материалы
- скачать Suppl_materials.docx
- ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Инструменты
Журнал неорганической химии