Журнал неорганической химии, 2020, T. 65, № 1, стр. 86-91
Синтез и термодинамические свойства оксопивалата кадмия CdPiv2 · Cd4OPiv6
Д. Б. Каюмова a, *, И. П. Малкерова a, Н. Н. Камкин b, А. С. Алиханян a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Московский государственный педагогический университет
119435 Москва, Малая Пироговская ул., 1/1, Россия
* E-mail: dkayumova@gmail.com
Поступила в редакцию 24.06.2019
После доработки 20.07.2019
Принята к публикации 19.08.2019
Аннотация
Синтезирован оксопивалатный комплекс кадмия состава CdPiv2 ∙ Cd4OPiv6. Эффузионным методом Кнудсена с масс-спектральным анализом состава газовой фазы исследованы его термодинамические характеристики. Установлено, что процесс парообразования этого комплекса протекает конгруэнтно и насыщенный пар над ним состоит из молекул Cd2Piv4, Cd4Piv8, Cd4ОPiv6. Определены стандартные энтальпии сублимации этих молекул, парообразования комплекса CdPiv2 ∙ Cd4OPiv6${{\Delta }_{S}}H_{{298}}^{^\circ }$ = 297.0 ± 12.1 кДж/моль и стандартная энтальпия диссоциации молекулы Cd4Piv8 по второму и третьему законам термодинамики ${{\Delta }_{D}}H_{{298}}^{^\circ }$ = 133.2 ± 16.8 кДж/моль. Показано, что оксопивалатный комплекс кадмия может быть использован в качестве прекурсора в методике MO CVD при получении оксидных пленок и покрытий.
ВВЕДЕНИЕ
В последнее время вырос интерес к многокомпонентным электропроводящим системам, содержащим оксид кадмия [1, 2], которые по электрическим [3, 4], оптическим [5–7] и каталитическим [8] свойствам могут составить конкуренцию наиболее востребованному TCO-оксидному материалу ITO (Indium-Tin Oxide). Для получения функциональных пленочных материалов на основе вышеперечисленных многокомпонентных оксидных систем можно использовать метод химического парофазного осаждения (CVD-метод) [9], в котором в качестве прекурсоров применяются летучие комплексные соединения триметил-уксусной кислоты [10].
В работе, посвященной исследованию пивалата кадмия с полимерным строением, показано, что процесс его парообразования сопровождается полным термическим разложением с образованием атомов кадмия, диоксида углерода, карбонильных, карбоксильных и других газообразных продуктов разложения и окисления лиганда [11]. Чтобы исключить процессы полимеризации конденсированной фазы и тем самым увеличить летучесть комплекса, используется прием, связанный с насыщением координационной сферы комплексообразователя дополнительным лигандом. В работе [12] продемонстрировано, что пивалатный комплекс кадмия с дополнительным лигандом о-фенантролином СdPiv2 ∙ Phen характеризуется высокой летучестью и конгруэнтным процессом парообразования, причем газовая фаза над ним состоит только из молекул СdPiv2 ∙ Phen. Похожие результаты были получены при исследовании пивалата серебра с трибутилфосфином [13]. Необходимо отметить, что термодинамические характеристики этих комплексов оставались постоянными в течение нескольких месяцев, что весьма важно при их практическом использовании в методиках CVD [14]. Однако существует и более простой способ трансформации труднолетучего комплекса в летучее соединение. Ранее было показано, что пивалаты р- и d-переходных металлов легко гидролизуются с образованием термически устойчивых оксопивалатов, которые характеризуются высокой летучестью [15–18]. В связи с этим цель настоящей работы – синтез и исследование термодинамики процессов парообразования оксокомплексов на основе пивалата кадмия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез оксокомплексов кадмия
Способ I. Навеску 1 г препарата CdPiv2 · 2H2O, синтезированного по известной методике [19], помещали в кварцевой пробирке в вакуумную установку ВУП-5 и нагревали до 573 K при остаточном давлении р = 1.3 × 10–3 Па. По истечении 10 ч нагрева на холодном конце пробирки сконденсировалось ~0.31 г летучего вещества белого цвета (I, сублимат), масса нелетучего остатка составила 0.2 г, который, по данным РФА, оказался оксидом кадмия.
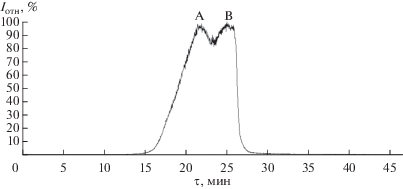
Молекулярный анализ сублимата I был выполнен на серийном квадрупольном масс-спектрометре Thermo Finnigan DSQ II с системой прямого ввода. На рис. 1 показана политерма сублимации летучего продукта синтеза, построенная по полному току ионов масс-спектра газовой фазы. Заметная ее асимметрия и анализ масс-спектра газовой фазы (табл. 1) позволяют заключить, что парообразование сублимата I может быть описано переходом в газовую фазу двух веществ с заметно различающейся летучестью. Согласно масс-спектральному анализу, начальная стадия (А) парообразования соответствует сублимации вещества в основном в виде молекул Cd4ОPiv6, вторая стадия (В) отражает сублимацию вещества преимущественно в виде молекул Cd4ОPiv6 и Cd2Piv4.
Таблица 1.
Масс-спектр* газовой фазы соединения I (T = 508 K, Uиониз = 70 В, Iиониз = 1.5 мА)
| m/z | Ион | Относительная интенсивность, % | |
|---|---|---|---|
| cтадия А | cтадия В | ||
| 114 | Cd+ | 3.3 | 8.9 |
| 215 | [CdPiv]+ | 1.1 | 36 |
| 327 | [Cd2(Piv)]+ | – | 1.8 |
| 556 | [Cd3O(Piv)2]+ | 3 | 3 |
| 529 | [Cd2(Piv)3]+ | 1.3 | 32 |
| 657 | [Cd3O(Piv)3]+ | 12 | 9.1 |
| 843 | [Cd3(Piv)5]+ | – | 2.5 |
| 813 | [Cd4O(Piv)4-57]+ | 42 | 30 |
| 972 | [Cd4O(Piv)5]+ | 100 | 100 |
| 1042 | [Cd4O(Piv)6]+-30 | 10 | 10 |
Полученные результаты позволяют заключить, что процесс парообразования CdPiv2 · 2H2O в вакууме в интервале температур 298–550 K сопровождается дегидратацией, частичным гидролизом и переходом в газовую фазу молекул Cd2Piv4 и Cd4ОPiv6:
(1)
$2{\text{CdPi}}{{{\text{v}}}_{2}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{(тв)}}}}} = 4{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{(газ)}}}}} + {\text{C}}{{{\text{d}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}_{{{\text{4(газ)}}}}},$(2)
${\text{CdPi}}{{{\text{v}}}_{2}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{(тв)}}}}}\, = \,\,{\text{Cd}}{{{\text{O}}}_{{{\text{(тв)}}}}} + 2{\text{НPi}}{{{\text{v}}}_{{{\text{(газ)}}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{(газ)}}}}},$(3)
$\begin{gathered} 4{\text{CdPi}}{{{\text{v}}}_{2}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{(тв)}}}}} = \\ = 7{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{(газ)}}}}} + {\text{C}}{{{\text{d}}}_{{\text{4}}}}{\text{ОPi}}{{{\text{v}}}_{{{\text{6(газ)}}}}} + {\text{2НPi}}{{{\text{v}}}_{{{\text{(газ)}}}}}. \\ \end{gathered} $Масс-спектральный анализ согласуется с данными СНN-анализа летучего продукта (сублимат I) высокотемпературного гидролиза, выполненного в ЦКП ИОНХ РАН на CHN-анализаторе Евровектор 300, которые соответствуют смеси двух комплексов – Cd4ОPiv6 и CdPiv2.
| С | Н | |
|---|---|---|
| Найдено, %: | 34.06; | 6.24. |
| Для Cd4C30H54O13 | ||
| вычислено, %: | 33.59; | 5.04. |
| Для CdC10H18O4 | ||
| вычислено, %: | 38.17; | 5.73. |
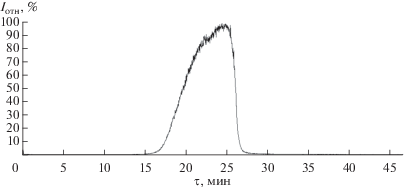
Способ II. Металлический кадмий (КД1-99.3 мас. %) растворяли в соляной кислоте “Сигма Тек” (ос. ч.). К этому раствору медленно при перемешивании добавляли раствор щелочи, полученный растворением навески KOH (ч. д. а.) в бидистиллированной воде, до прекращения выпадения осадка. Выпавший осадок гидроксида кадмия(II) белого цвета промывали бидистиллированной водой методом центрифугирования. Затем навеску пивалиновой кислоты (Aldrich) в виде водной суспензии смешивали с осадком гидроксида кадмия. Образовавшееся вязкое белое вещество отфильтровывали и промывали на воронке Бюхнера бидистиллированной водой. Высушенный образец сублимировали на вакуумной установке ВУП-5 при остаточном давлении р = = 1.3 × 10–3 Па и Т = 420–500 K. Идентификацию полученного продукта, очищенного сублимацией, проводили так же, как и в первом случае. Вид политермы испарения (рис. 2) отражает сублимацию индивидуального соединения, а масс-спектр соответствует парообразованию вещества в виде двух молекул – Cd4ОPiv6 и Cd2Piv4. Результаты СНN-анализа не противоречат масс-спектральному анализу. Таким образом, второй метод приводит, по-видимому, к синтезу индивидуального соединения II.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование термодинамических характеристик продукта II выполняли эффузионным методом Кнудсена с масс-спектральным анализом газовой фазы на приборе МС 1301, предназначенном для термодинамических исследований, с использованием стандартной молибденовой эффузионной ячейки с отношением площади испарения к площади эффузии ≥600. Температуру измеряли Pt–Pt/Rh-термопарой и поддерживали постоянной с точностью ±2 град.
Интенсивности основных ионов, зарегистрированные в масс-спектре насыщенного пара в интервале температур 470–530 K, приведены в табл. 2.
Таблица 2.
Масс-спектр газовой фазы соединения II (T = 508 K, Uиониз = 70 В, Iиониз = 1.5 мА)
| m/z | Ион | I, % | |
|---|---|---|---|
| MC-1301 | DSQII | ||
| 114 | Cd+ | 17 | 5 |
| 215 | [CdPiv]+ | 19 | 8 |
| 327 | [Cd2Piv]+ | 15 | 5 |
| 428 | [Cd2Piv2]+ | 3 | 1 |
| 529 | [Cd2Piv3]+ | 53 | 19 |
| 657 | [Cd3Piv3 + ОН]+ | 11 | 11 |
| 815 | [Cd4O(Piv)4-57]+ | – | 28 |
| 843 | [Cd3Piv5]+ | 2 | 9 |
| 871 | [Cd4O(Piv)4]+ | 23 | 18 |
| 972 | [Cd4O(Piv)5]+ | 100 | 100 |
Анализ экспериментальных данных, представленных в табл. 2, и исследование зависимости масс-спектра от энергии ионизирующих электронов позволили заключить, что в насыщенном паре над соединением кадмия II присутствуют главным образом молекулы Cd4O(Piv)6 и Cd2(Piv)4. Знание индивидуального масс-спектра молекулы Cd4O(Piv)6 (табл. 1) позволило простым вычитанием найти масс-спектр молекулы Cd2(Piv)4 и расшифровать масс-спектр насыщенного пара над соединением II (табл. 3). Относительно небольшой диапазон массовых чисел прибора МС-1301 не позволил нам только по масс-спектральным данным однозначно отнести ионные токи ${\text{C}}{{{\text{d}}}_{{\text{3}}}}{\text{Piv}}_{5}^{ + }$ и [Cd3Piv3 + ОН]+ к определенному сорту молекул. Поэтому для окончательного ответа о составе газовой фазы были привлечены литературные данные [20] по масс-спектральным исследованиям пивалатных комплексов двухвалентных d-переходных металлов. Такой подход позволил заключить, что молекулярным предшественником этих ионов являются молекулы Cd4(Piv)8.
Таблица 3.
Индивидуальные масс-спектры молекул газовой фазы над соединением II
| Cd4O(Piv)6 | Cd2Piv4 | Cd4(Piv)8 (оценка) | |||
|---|---|---|---|---|---|
| ион | I, % | ион | I, % | ион | I, % |
| Cd+ | 8 | Cd+ | 16 | Cd+ | 10 |
| [Cd4O(Piv)4]+ | 11 | [CdPiv]+ | 37 | [CdPiv]+ | 10 |
| [Cd4O(Piv)5]+ | 100 | [Cd2Piv]+ | 6 | [Cd3Piv4 + 18]+ | 15 |
| [Cd4O(Piv)6]+ | 10 | [Cd2Piv2]+ | 23 | [Cd3Piv5]+ | 20 |
| [Cd2Piv3]+ | 100 | [Cd4Piv7]+ | 100 | ||
Для определения характера парообразования комплекса и расчета абсолютных величин парциальных давлений выполняли эксперименты по полной изотермической сублимации известной навески соединения II. Результаты одного из нескольких опытов приведены на рис. 3.
Рис. 3.
Изотермы полной сублимации навески комплекса II (T = 508 K): 1 – [Cd4OPiv5]+, 2 – [Cd2Piv3]+, 3 – [Cd3Piv5]+. Интенсивность [Cd3Piv5]+ увеличена в 5 раз.
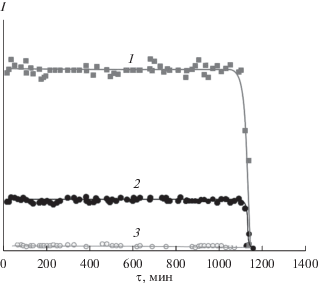
Результаты эксперимента показывают, что процесс парообразования комплекса II характеризуется постоянством интенсивностей всех ионных токов (величин парциальных давлений молекул) вплоть до полного выгорания навески. Этот факт и отсутствие нелетучего остатка в эффузионной камере после завершения эксперимента свидетельствуют о конгруэнтном характере парообразования комплекса в виде молекул Cd4OPiv6, Cd2(Piv)4 и Cd4(Piv)8.
Конгруэнтный характер парообразования комплекса кадмия II и знание масс-спектров молекул, присутствующих в насыщенном паре, позволили записать уравнение Герца–Кнудсена для сложного состава газовой фазы и рассчитать абсолютные величины парциальных давлений компонентов насыщенного пара:
(4)
$\begin{gathered} {{q}_{{{\text{II}}}}} = {{S}_{{{\text{эф}}}}}\frac{k}{{{{\sigma }_{{{\text{C}}{{{\text{d}}}_{2}}{\text{Pi}}{{{\text{v}}}_{4}}}}}}}tB\left( {M_{{{\text{C}}{{{\text{d}}}_{2}}{\text{Pi}}{{{\text{v}}}_{4}}}}^{{1/2}}{{I}_{{{\text{C}}{{{\text{d}}}_{2}}{\text{Pi}}{{{\text{v}}}_{4}}}}} + \frac{{{{\sigma }_{{{\text{C}}{{{\text{d}}}_{2}}{\text{Pi}}{{{\text{v}}}_{4}}}}}}}{{{{\sigma }_{{{\text{C}}{{{\text{d}}}_{2}}{\text{Pi}}{{{\text{v}}}_{8}}}}}}}} \right. \times \\ \times \,\,\left. {M_{{{\text{C}}{{{\text{d}}}_{2}}{\text{Pi}}{{{\text{v}}}_{8}}}}^{{1/2}}{{I}_{{{\text{C}}{{{\text{d}}}_{4}}{\text{Pi}}{{{\text{v}}}_{8}}}}} + \frac{{{{\sigma }_{{{\text{C}}{{{\text{d}}}_{2}}{\text{Pi}}{{{\text{v}}}_{4}}}}}}}{{{{\sigma }_{{{\text{C}}{{{\text{d}}}_{2}}{\text{OPi}}{{{\text{v}}}_{6}}}}}}}M_{{{\text{C}}{{{\text{d}}}_{2}}{\text{Pi}}{{{\text{v}}}_{6}}}}^{{1/2}}{{I}_{{{\text{C}}{{{\text{d}}}_{4}}{\text{OPi}}{{{\text{v}}}_{6}}}}}} \right), \\ {{р}_{i}} = k/{{\sigma }_{i}}{{I}_{i}}T, \\ \end{gathered} $Полные сечения ионизации были рассчитаны по правилу аддитивности [21] по данным [22]. Найденные таким образом значения парциальных давлений при Т = 508 K приведены в табл. 4. Там же приведены величины парциальных давлений компонентов газовой фазы, отвечающие минимуму общего давления, которые устанавливаются в замкнутом объеме при отсутствии эффузии пара.
Таблица 4.
Абсолютные величины парциальных давлений компонентов насыщенного пара над комплексом II, Па
| Условие сублимации | Cd4O(Piv)6 | Cd2(Piv)4 | Cd4Piv8 | Общее давление |
|---|---|---|---|---|
| Эффузионная камера | 6.04 × 10–2 | 2.53 × 10–2 | 3.35 × 10–4 | 8.58 × 10–2 |
| Замкнутый объем | 3.90 × 10–2 | 3.90 × 10–2 | 2.05 × 10–4 | 7.8 × 10–2 |
Конгруэнтный характер парообразования комплекса II и абсолютные величины парциальных давлений дают возможность рассчитать состав этого комплекса, который должен быть равен составу молекулярного потока, покидающего эффузионную камеру. Если рассматривать этот комплекс в рамках двухкомпонентной системы CdPiv2–Cd4O(Piv)6, то отношение
(5)
$\frac{n}{m} = \frac{{\left( {\frac{{2{{p}_{{{\text{C}}{{{\text{d}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}}}}}}}{{\sqrt {{{M}_{{{\text{C}}{{{\text{d}}}_{{\text{2}}}}{\text{Pi}}{{{\text{v}}}_{{\text{4}}}}}}}} }} + \frac{{4{{p}_{{{\text{C}}{{{\text{d}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{8}}}}}}}}}{{\sqrt {{{M}_{{{\text{C}}{{{\text{d}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{8}}}}}}}} }}} \right)}}{{\frac{{{{p}_{{{\text{C}}{{{\text{d}}}_{{\text{4}}}}{\text{OPi}}{{{\text{v}}}_{{\text{6}}}}}}}}}{{\surd {{M}_{{{\text{C}}{{{\text{d}}}_{{\text{4}}}}{\text{OPi}}{{{\text{v}}}_{{\text{6}}}}}}}}}}}$(6)
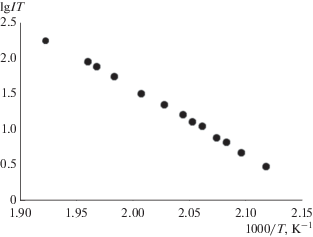
$\begin{gathered} {\text{CdPi}}{{{\text{v}}}_{{\text{2}}}} \cdot {\text{C}}{{{\text{d}}}_{{\text{4}}}}{\text{O}}{{\left( {{\text{Piv}}} \right)}_{{{\text{6(тв)}}}}} = \\ = 0.5{\text{C}}{{{\text{d}}}_{{\text{2}}}}{{\left( {{\text{Piv}}} \right)}_{{{\text{4(газ)}}}}} + {\text{C}}{{{\text{d}}}_{{\text{4}}}}{\text{O}}{{\left( {{\text{Piv}}} \right)}_{{{\text{6(газ)}}}}}. \\ \end{gathered} $При исследовании температурных зависимостей интенсивности ионных токов $I_{{{\text{[C}}{{{\text{d}}}_{{\text{2}}}}{{{{\text{(Piv)}}}}_{{\text{3}}}}{\text{]}}}}^{ + },$ $I_{{{\text{[C}}{{{\text{d}}}_{{\text{4}}}}{\text{O(Piv}}{{{\text{)}}}_{{\text{4}}}}{\text{]}}}}^{ + },$ $I_{{{\text{[C}}{{{\text{d}}}_{{\text{3}}}}{{{{\text{(Piv)}}}}_{{\text{5}}}}{\text{]}}}}^{ + },$ $I_{{{\text{[C}}{{{\text{d}}}_{{\text{4}}}}{{{{\text{(Piv)}}}}_{{\text{4}}}}{\text{ + 18]}}}}^{ + }$ (парциальных давлений молекул) в интервале температур 470–530 K по уравнению Клаузиуса–Клапейрона и Вант-Гоффа методом наименьших квадратов были рассчитаны стандартные энтальпии перехода молекул Cd2(Piv)4, Cd4O(Piv)6, Cd4(Piv)8 из конденсированной фазы комплекса II в газовую фазу (табл. 5). На рис. 4 в качестве примера приведены результаты одного из экспериментов для иона [Cd2Piv3]+.
Таблица 5.
Значения энтальпий перехода молекул Cd2(Piv)4, Cd4O(Piv)6 и Cd4(Piv)8 из конденсированной в газовую фазу (Т = 470–530 K), кДж/моль
| Cd2(Piv)4 | Cd4O(Piv)6 | Cd4(Piv)8 | |
|---|---|---|---|
| Cd2$\left( {{\text{Piv}}} \right)_{3}^{ + }$ | Cd4O$\left( {{\text{Piv}}} \right)_{4}^{ + }$ | Cd3$\left( {{\text{Piv}}} \right)_{5}^{ + }$ | Cd3O$\left( {{\text{Piv}}} \right)_{3}^{ + }$ |
| 207.2 ± 8.6 | 195.8 ± 8.1 | 277.7 ± 13.1 | 249.7 ± 3.3 |
| 203.7 ± 5.1 | 189.2 ± 4.3 | 266.9 ± 3.8 | 269.6 ± 4.2 |
| 196.4 ± 4.0 | 198.7 ± 2.8 | 269.1 ± 3.1 | 275.5 ± 5.0 |
| 202.7 ± 4.3 | 180.9 ± 5.8 | 241.3 ± 7.3 | 263.8 ± 5.1 |
| 189.0 ± 5.5 | 190.1 ± 3.5 | 268.3 ± 4.8 | 244.7 ± 4.7 |
| 205.1 ± 4.3 | 212.2 ± 8.3 | 254.1 ± 6.6 | 270.6 ± 2.5 |
| 200.1 ± 5.6 | 205.7 ± 5.4 | 263.6 ± 6.8 | 264.2 ± 3.7 |
| 199.4 ± 3.2 | 212.0 ± 4.1 | 272.2 ± 4.9 | 243.0 ± 3.6 |
| 197.3 ± 1.4 | 191.6 ± 2.1 | 272.4 ± 2.6 | 255.3 ± 10.3 |
| 206.2 ± 4.1 | 211.4 ± 7.3 | 281.2 ± 5.3 | 250.2 ± 9.7 |
| 194.9 ± 8.7 | 198.3 ± 2.8 | 243.0 ± 9.9 | 242.4 ±7.2 |
| 207.6 ± 6.2 | 186.6 ± 11.0 | – | – |
| 202.8 ± 8.7 | 191.5 ± 2.0 | – | – |
| 195.2 ± 5.2 | – | – | – |
| 196.8 ± 6.1 | – | – | – |
| 189.7 ± 2.4 | – | – | – |
| Среднее | |||
| 199.5 ± 7.3 | 197.2 ± 11.9 | 264.5 ± 13.1 | 254.1 ± 13.3 |
Учитывая низкие температуры эксперимента, было принято, что полученные величины соответствуют температуре 298.15 K, приведенные погрешности представляют собой среднюю квадратичную ошибку единичного измерения. Необходимо отметить, что равенство энтальпий парообразования молекул Cd2(Piv)4 и Cd4O(Piv)6 является еще одним прямым доказательством конгруэнтной сублимации комплекса II [23].
По найденным термодинамическим характеристикам процессов парообразования молекул Cd2(Piv)4, Cd4O(Piv)6, Cd4(Piv)8 рассчитали стандартную энтальпию реакции (6) конгруэнтной сублимации соединения CdPiv2 ∙ Cd4O(Piv)6${{\Delta }_{S}}H_{{298}}^{^\circ }$ = 297.0 ± 12.1 кДж/моль и стандартную энтальпию реакции диссоциации тетрамерной молекулы Cd4(Piv)8
(7)
$\begin{gathered} {\text{C}}{{{\text{d}}}_{{\text{4}}}}{{\left( {{\text{Piv}}} \right)}_{{{\text{8 (газ)}}}}} = 2{\text{C}}{{{\text{d}}}_{{\text{2}}}}{{\left( {{\text{Piv}}} \right)}_{{{\text{4 (газ)}}}}}, \\ {{\Delta }_{D}}H_{{298}}^{^\circ } = 139.7 \pm 16.8\,{\text{кДж}}/{\text{моль}}. \\ \end{gathered} $Последняя термодинамическая характеристика была рассчитана и по третьему закону термодинамики. При расчете изменение энтропии реакции диссоциации было принято равным 146.4 Дж/(моль K), значение константы равновесия при Т = 508 K было найдено по величинам парциальных давлений, приведенным в табл. 4. Рассчитанная таким образом энтальпия диссоциации оказалась равной 126.6 ± 14.3 кДж/моль. Совпадение этой термодинамической характеристики, полученной двумя независимыми методами, свидетельствует о корректности найденного нами состава насыщенного пара над конгруэнтно сублимирующимся комплексом II.
На основании экспериментальных данных уравнение зависимости общего давления (Па) насыщенного пара над комплексом CdPiv2 ∙ Cd4O(Piv)6 в замкнутом объеме от температуры может быть представлено в следующем виде:
ЗАКЛЮЧЕНИЕ
Найденные термодинамические характеристики парообразования комплекса кадмия CdPiv2 ∙ Cd4O(Piv)6 позволяют рекомендовать это соединение в качестве прекурсора в методике CVD при получении оксидных пленок или покрытий. Это обусловлено его высокой летучестью, относительно простым составом насыщенного пара, конгруэнтным характером парообразования, постоянством термодинамических свойств в течение длительного периода хранения и простотой синтеза.
Список литературы
Hoel C.A., Mason T.O., Gaillard J.-F., Poeppelmeier K.R. // Chem. Mater. 2010. V. 22. № 12. P. 3569. https://doi.org/10.1021/cm1004592
Shubin A.A., Sidorak A.V., Ivanov V.V. // Russ. J. Appl. Chem. 2014. V. 87. № 3. P. 258. https://doi.org/10.1134/S1070427214030021
Chang J., Todkar V.V., Mane R.S. et al. // Physica E. 2009. V. 41. P. 1741. https://doi.org/10.1016/j.physe.2009.05.005
Abrutis A., Valincius G., Baltrunas G. et al. // Thin Solid Films. 2007. V. 515. P. 6817. https://doi.org/10.1016/j.tsf.2007.02.075
Henari F.Z., Dakhel A.A. // Laser Phys. 2008. V. 18. P. 1557. https://doi.org/10.1134/S1054660X08120281
Liu C.P., Foo Y., Kamruzzaman M. et al. // Phys. Rev. Appl. 2016. V. 6. P. 064018. https://doi.org/10.1103/PhysRevApplied.6.064018
Dakhel A.A. // J. Sol-Gel Sci. Techn. 2018. V. 85. № 2. P. 311. https://doi.org/10.1007/s10971-017-4567-9
Reddy Ch.V., Babu B., Shim J. // J. Phys. Chem. Solids. 2018. V. 112. P. 20. https://doi.org/10.1016/j.jpcs.2017.09.003
Сыркин В.Г. CVD-метод. Химическое парофазное осаждение М.: Наука, 2000. 496 с.
Samoilenkov S., Stefan M., Wahl G. et al. // Chem. Vap. Deposition. 2002. № 8. P. 74. https://doi.org/10.1002/1521-3862(20020304)8:2<74::AID-CVDE74>3.0.CO;2-B
Kayumova D.B., Malkerova I.P., Shmelev M.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 125. https://doi.org/10.1134/S0036023619010121
Kayumova D.B., Malkerova I.P., Shmelev M.A. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 12. P. 728. https://doi.org/10.1134/S1070328418120035
Kuzmina N., Malkerova I., Alikhanyan A. et al. // J. Phys. IV. 2001. № 11. P. r3645. https://doi.org/10.1051/jp4:2001382
Jones A.C., Hitchman M.L. Chemical Vapour Deposition: Precursors, Processes and Applications. Royal Society of Chemistry. 2009. 582 p.
Малкерова И.П., Камкин Н.Н., Доброхотова Ж.В. и др. // Журн. неорган. химии. 2014. Т. 59. № 7. С. 873. https://doi.org/10.7868/S0044457X14070216
Kuz’mina N.P., Altsybeev A.E., Malkerova I.P. et al. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1750. https://doi.org/10.1134/S0036023606110118
Iljina E., Korjeva A., Kuzmina N. et al. // Mater. Sci. Eng. B. 1993. V. 18. P. 234. https://doi.org/10.1016/0921-5107(93)90139-E
Каюмова Д.Б., Камкин Н.Н., Ярышев Н.Г. // Журн. неорган. химии. 2013. Т. 58. С. 946. https://doi.org/10.7868/S0044457X13070131
Gogoleva N.V., Sidorov A.A., Nelyubina Yu.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 473. https://doi.org/10.1134/S107032841808002X
Morozova E.A., Malkerova I.P., Kiskin M.A. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1436. https://doi.org/10.1134/S0036023618110128
Otwos J.W., Stevenson D.P. // J. Am. Chem. Soc. 1956. V. 78. P. 536.
Mann J.B. // J. Chem. Phys. 1967. V. 46. P. 1646.
Сидоров Л.Н., Коробов М.В., Журавлева Л.В. Масс-спектральные термодинамические исследования. М.: Изд-во Моск. ун-та, 1985. 208 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии