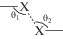Журнал неорганической химии, 2020, T. 65, № 1, стр. 25-33
Синтез, строение и фотохимические свойства комплексов Ar3Sb[OC(O)C6HF4-2,3,4,5]2, Ar3Sb[OC(O)CF2Br]2, Ar3Sb[OC(O)CF2CF2CF3]2 (Ar = C6H3OMe-2-Br-5)
Е. В. Артемьева a, *, О. К. Шарутина a, В. В. Шарутин a, А. В. Буланова a
a Национальный исследовательский Южно-Уральский государственный университет
454080 Челябинск, пр-т Ленина, 76, Россия
* E-mail: katriona-art@yandex.ru
Поступила в редакцию 27.05.2019
После доработки 16.07.2019
Принята к публикации 27.08.2019
Аннотация
По реакции окислительного присоединения синтезированы и структурно исследованы комплексы трис(5-бром-2-метоксифенил)сурьмы с 2,3,4,5-тетрафторбензойной, бромдифторуксусной и гептафторбутановой кислотами. По данным рентгеноструктурного анализа, продуктами реакций являются дикарбоксилаты триарилсурьмы общей формулы (2-MeO-5-Br-C6H3)3Sb(OC(O)R)2, где R = C6HF4-2,3,4,5 (1), CF2Br (2), CF2CF2CF3 (3). Атомы сурьмы в молекулах 1–3 имеют тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. Средние значения длин экваториальных связей Sb–C составляют 2.119 (1), 2.106 (2), 2.109 Å (3), связей Sb–O – 2.112 (1), 2.104 (2), 2.118 Å (3). Углы ОSbО равны 177.5(2)° (1), 172.6(4)° (2), 176.8(3)° (3), OSbC – 89.3(3)°–93.5(3)° (1), 84.4(5)°–97.0(5)° (2), 84.2(3)°–98.9(3)° (3). Изучена фотокаталитическая активность синтезированных соединений на примере фотодеструкции органических красителей – метиленового синего и метилового фиолетового.
ВВЕДЕНИЕ
Дикарбоксилаты триарилсурьмы общей формулы Ar3Sb(OC(O)R)2 являются биологически активными соединениями, оказывающими противоопухолевое, антилейшманиозное и антибактериальное действие [1–9], обладающими электрохимическими и фотолюминесцентными свойствами [10, 11]. Имеются примеры их использования в качестве фотокатализаторов [12]. Такие соединения могут быть получены по реакциям дигалогенидов триарилсурьмы с натриевыми солями карбоновых кислот или карбоновыми кислотами в присутствии триэтиламина [1–8, 13–16]. Удобным одностадийным методом синтеза дикарбоксилатов триарилсурьмы является окислительный метод. Так, например, были получены производные трифенилсурьмы [17], три(п-толил)сурьмы [18], трис(3-фторфенил)сурьмы [19].
В настоящей работе мы продолжили изучение окислительного метода синтеза арильных соединений сурьмы(V), выбрав в качестве объекта исследования трис(5-бром-2-метоксифенил)сурьму, и осуществили проверку фотокаталитической активности полученных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Трис(5-бром-2-метоксифенил)сурьма синтезирована по методике [20]. Карбоновые кислоты (2,3,4,5-тетрафторбензойная, бромдифторуксусная, гептафторбутановая кислоты) приобретены в ЗАО НПО “ПиМ-Инвест”.
Синтез бис(2,3,4,5-тетрафторбензоато)трис(5-бром-2-метоксифенил)сурьмы (1). К 0.100 г (0.15 ммоль) трис(5-бром-2-метоксифенил)сурьмы и 0.057 г (0.30 ммоль) 2,3,4,5-тетрафторбензойной кислоты в 20 мл диэтилового эфира добавляли 0.019 г (0.15 ммоль) 70%-ного водного раствора трет-бутилгидропероксида. Смесь выдерживали 24 ч при комнатной температуре, получили бесцветные кристаллы массой 0.136 г (87%), tпл = 224°С.
ИК-спектр (ν, см–1): 1668 (C=O), 1300 (O–Me), 1281, 1254 (C–F), 1146, 1098 (C–Br), 523 (Sb–C), 446 (Sb–O).
Синтез бис(бромдифторацетато)трис(5-бром-2-метоксифенил)сурьмы (2) и бис(гептафторбутилато)трис(5-бром-2-метоксифенил)сурьмы (3) выполнен по аналогичной методике. Выход соединения 2 составил 73%, tпл = 180°С.
ИК-спектр (ν, см–1): 1715 (C=O), 1281 (O–Me), 1258, 1171 (C–F), 1152, 1134, 1048 (C–Br), 1013, 525 (Sb–C), 432 (Sb–O).
Выход соединения 3 – 94%, tпл = 143°С.
ИК-спектр (ν, см–1): 1709 (C=O), 1283 (O–Me), 1260, 1217 (C–F), 1047 (C–Br), 1016, 529 (Sb–C), 446 (Sb–O).
Рентгеноструктурный анализ (РСА) соединений 1−3 проведен на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор, Т = 293 K).
Сбор, первичная обработка данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [21, 22]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [23], OLEX2 [24]. Структуры соединений 1−3 определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положения атомов водорода рассчитаны геометрически и включены в уточнение в модели “наездника”.
Основные кристаллографические данные:
1 (C35H20O7F8Br3Sb, M = 1065.99 г/моль): триклинная, пр. гр. P$\bar {1}$, a = 12.484(14), b =13.650(15), c = 3.671(17) Å, α = 102.29(3)°, β = 114.56(5)°, γ = = 96.38(3)°, V = 2017(4) Å3, Z = 2, μMo = 3.735 мм–1, ρвыч = 1.745 г/см3. Измерено 12520 отражений, 4558 независимых отражений (Rint = 0.0251), 500 уточняемых параметров, GOOF = 1.048, R-факторы по F 2 > 2σ(F2): R1 = 0.0481, wR2 = 0.1415, R-факторы по всем отражениям: R1 = 0.0577, wR2 = = 0.1494.
2 (C25H18O7F4Br5Sb, M = 1027.69 г/моль): моноклинная, пр. гр. P21/c, a = 12.556(18), b = = 16.427(17), c = 16.664(17) Å, β = 109.46(5)°, V = = 3241(7) Å3, Z = 4, μMo = 7.079 мм–1, ρвыч = = 2.106 г/см3. Измерено 18333 отражения, 2664 независимых отражения (Rint = 0.0464), число уточняемых параметров 383, GOOF = 1.052, R-факторы по F2 > 2σ(F2): R1 = 0.0587, wR2 = 0.1513, R-факторы по всем отражениям: R1 = 0.0742, wR2 = 0.1652.
3 (C29H18O7F14SbBr3, M = 1105.91 г/моль): моноклинная, пр. гр. P21, a = 12.991(11), b = 11.354(7), c = = 13.495(11) Å, β = 107.62(5)°, V = 1897(3) Å3, Z = 4, μMo = 7.994 мм–1, ρвыч = 3.872 г/см3. Измерено 9781 отражение, 5009 независимых отражений (Rint = = 0.0201), число уточняемых параметров 491, GOOF = 1.034, R-факторы по F2 > 2σ(F2): R1 = = 0.0416, wR2 = 0.1128, R-факторы по всем отражениям: R1 = 0.0451, wR2 = 0.1155.
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1 822 063, 1 822 052, 1 882 813 для соединений 1, 2, 3; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Фотокаталитическую активность соединений 1–3 оценивали путем фотодеградации в их присутствии водных растворов красителей метиленового синего (МС) и метилового фиолетового (МФ) при температуре окружающей среды 20°С. Фотокаталитические реакции выполнены по стандартной методике [12]. Навески 1–3 массой 20 мг добавляли к 50 мл водного раствора МС или МФ концентрации 5 и 4 мг/л соответственно. Для установления адсорбционно-десорбционного равновесия полученную суспензию перемешивали в темноте в течение 30 мин, затем суспензию облучали под УФ-лампой (ртутная лампа высокого давления Osram мощностью 125 Вт) при постоянном перемешивании в течение 1 ч. Отбор проб проводили каждые 15 мин. Отобранную пробу центрифугировали для отделения карбоксилатов трис(5-бром-2-метоксифенил)сурьмы. Измерение концентрации МС и МФ осуществляли методом УФ-спектроскопии.
Видимый УФ-спектр диффузного отражения получен в интервале 200–800 нм с помощью спектрометра Shimadzu UV2700, в котором в качестве стандарта использовали сульфат бария с коэффициентом отражения 100%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мы установили, что в присутствии трет-бутил-гидропероксида трис(5-бром-2-метоксифенил)сурьма реагирует с 2,3,4,5-тетрафторбензойной, бромдифторуксусной и гептафторбутановой кислотами при мольном соотношении реагентов 1 : 2 : 1 с образованием дикарбоксилатов трис(5-бром-2-метоксифенил)сурьмы 1–3:
Соединения 1–3 охарактеризованы методами ИК-спектроскопии и РСА.
В ИК-спектрах 1–3 присутствуют полосы поглощения в области 523–529 см–1, относящиеся к колебаниям фрагмента SbC3 [25]. В области 432–446 см–1 наблюдаются полосы, отвечающие колебаниям связи Sb–O [26]. В интервале 1668–1715 см−1 присутствуют интенсивные полосы поглощения валентных колебаний карбонильных групп С=O, в интервале 1171–1254 см−1 – связей С–F. Полосы поглощения в областях 1047–1146 и 1281–1300 см−1 характеризуют колебания связей CAr–Br и CAr–OCH3 соответственно.
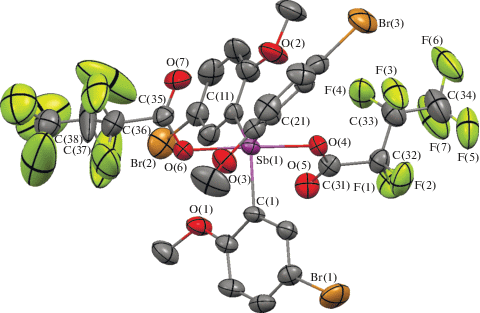
По данным РСА, атомы сурьмы в молекулах 1–3 имеют тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях (рис. 1–3).
Рис. 1.
Структура соединения 1, атомы показаны в виде эллипсоидов тепловых колебаний с вероятностью 40%. Атомы водорода не приведены.
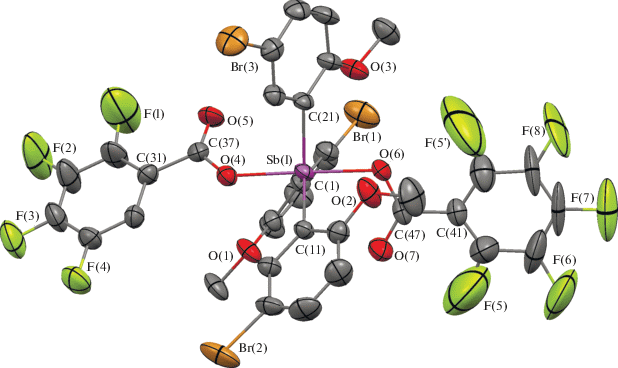
Рис. 2.
Структура соединения 2, атомы показаны в виде эллипсоидов тепловых колебаний с вероятностью 40%. Атомы водорода не приведены.
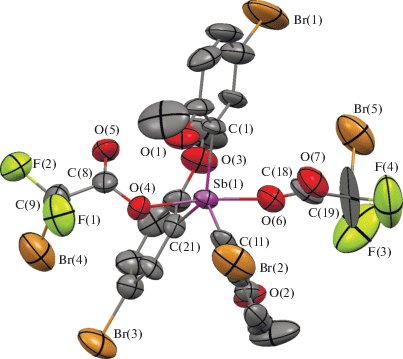
Рис. 3.
Структура соединения 3, атомы показаны в виде эллипсоидов тепловых колебаний с вероятностью 40%. Атомы водорода не приведены.
Суммы валентных углов CSbC в экваториальной плоскости молекул 1–3 практически равны 360°. Как и в других дикарбоксилатах трис(5-бром-2-метоксифенил)сурьмы [27, 28], в молекулах 1–3 по два экваториальных угла принимают значение, близкое к идеальному (120°): 124.7(3)°, 121.8(3)°, 113.3(3)° (1), 123.6(6)°, 116.3(6)°, 120.0(6)° (2), 125.8(4)°, 124.1(4)°, 110.0(4)° (3). В молекулах дикарбоксилатов три(п-толил)сурьмы [1, 4, 7, 18] и трифенилсурьмы [1, 4–6, 14, 15, 17], напротив, два экваториальных угла меньше идеального значения, а третий существенно больше.
Особенность строения молекул 1–3 объясняется нарушением типичной для дикарбоксилатов триарилсурьмы цис-ориентации карбоксилатных лигандов относительно фрагмента SbC3. Углы между плоскостями карбоксильных групп составляют 53.13°, 62.43° и 45.90° в 1–3 соответственно.
Атом сурьмы отклоняется от экваториальной плоскости на 0.043 Å (1), 0.024 Å (2) и 0.050 Å (3). Аксиальные углы ОSbО составляют 177.5(2)° (1), 172.6(4)° (2) и 176.8(3)° (3). Углы OSbC варьируют в пределах 84.0(3)°–93.5(3)° (1), 84.3(5)°–97.0(5)° (2), 84.2(3)°–98.9(3)° (3).
Средние значения длин связей Sb–O (2.112 Å (1), 2.104 Å (2), 2.118 Å (3)) и Sb–C (2.119 Å (1), 2.106 Å (2), 2.109 Å (3)) близки.
Карбоксилатные лиганды дополнительно координируются на атом сурьмы карбонильным атомом кислорода; расстояния Sb···O=С равны 3.200(8), 3.032(7) Å (1), 3.16(1), 3.14(2) Å (2), 3.151(8), 3.15(1) Å (3). Кроме того, в молекулах 1–3 присутствуют короткие контакты Sb···OMe (3.148(6)–3.204(7) Å (1), 3.02(1)–3.17(1) Å (2), 3.079(8)–3.187(8) Å (3)).
В молекулах всех соединений имеются слабые межмолекулярные водородные связи с участием атомов кислорода карбоксилатных лигандов: HAr···O(=C) (2.493, 2.411 Å (1), 2.60, 2.37 Å (2), 2.42, 2.462 Å (3). Кроме того, в 1 есть водородные связи с участием атома фтора HAr···F (2.63, 2.668 Å), в 2 – связи HMe···O(=C) (2.54 Å), H···Br (3.012 Å). Присутствуют короткие межмолекулярные контакты C···O (3.160(9) Å), C···F (3.15(1), 3.14(2) Å), CAr···CAr (3.27(2) Å) (1), F···O(=C) (2.87(2) Å) (2).
В настоящее время при изучении кристаллических структур наряду с водородными связями особое внимание уделяется контактам галоген···галоген в кристаллах [29–32]. Поскольку в молекулах 1–3 содержится достаточно большое количество атомов галогенов, рассмотрим такие взаимодействия подробнее.
Структурная организация в кристаллах 1–3 обусловлена межмолекулярными взаимодействиями, классифицируемыми, согласно [29], как взаимодействия типа I (0° ≤ |θ1 – θ2| ≤ 15°), II (30° ≤ |θ 1 – θ2|) и квази-I/II типа (15° ≤ |θ1 – θ2| ≤ ≤ 30°) между атомами галогенов, где значение углов θ1 и θ2 становится понятным из схемы:
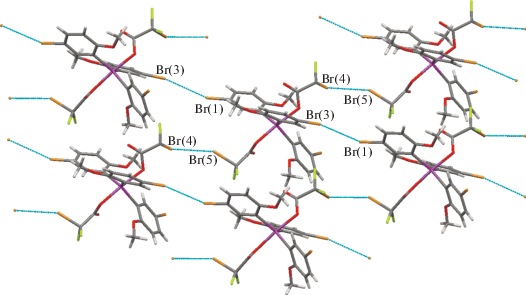
В кристалле 1 присутствуют квази-I/II взаимодействия F···F (|θ1 – θ2| = 25(2)°) и слабые взаимодействия Br···Br I типа (θ1 = θ2) (рис. 4).
Рис. 4.
Взаимодействия галоген···галоген в кристалле 1. Расстояния и углы: F(3)···F(9) 2.58(2) Å, C(34)F(3)F(9) 117.4(9)°, C(46)F(9)F(3) 142(2)°; Br(1)···Br(1) 3.620(5) Å, C(5)Br(1)Br(1) 150.4(3)°.
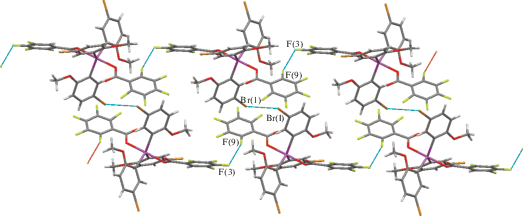
В кристалле 2 наблюдаются межмолекулярные взаимодействия Br···Br I типа (|θ1 – θ2| = 7.1(7)°) между атомами Br карбоксилатных лигандов и II типа (|θ1 – θ2| = 49.5(9)°) между атомами Br арильных радикалов (рис. 5).
Рис. 5.
Взаимодействия галоген···галоген в кристалле 2. Расстояния и углы: Br(1)···Br(3) 3.56(5) Å, C(5)Br(1)Br(3) 159.6(7)°, C(25)Br(3)Br(1) 166.7(6)°; Br(4)···Br(5) 3.450(5) Å, C(19)Br(5)Br(4) 145.9(9)°, C(9)Br(4)Br(5) 96.4(7)°.
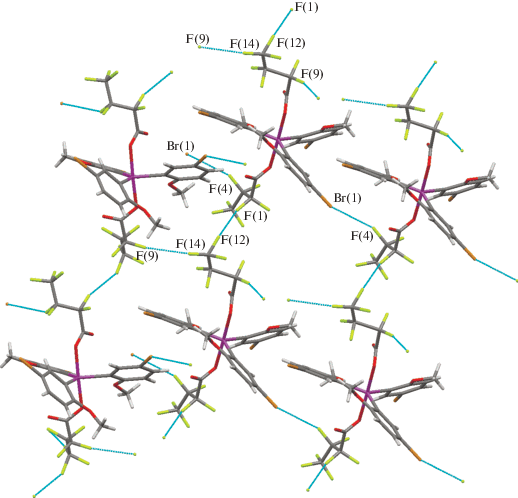
В кристалле 3 имеются межмолекулярные взаимодействия F···F (|θ1 – θ2| = 13(2)°, 15(1)°) и F···Br I типа (|θ1 – θ2| = 3.2(9)°) (рис. 6).
Рис. 6.
Взаимодействия галоген···галоген в кристалле 3. Расстояния и углы: F(1)···F(12) 2.67(1) Å, С(32)F(1)F(12) 163(1)°, C(38)F(12)F(1) 148(1)°; F(9)···F(14) 2.90(3) Å, C(36)F(9)F(14) 161(1)°, C(38)F(14)F(9) 174(2)°; Br(1)···F(4) 3.303(9) Å, C(5)Br(1)F(4) 140.2(4)°, C(33)F(4)Br(1) 143.4(9)°.
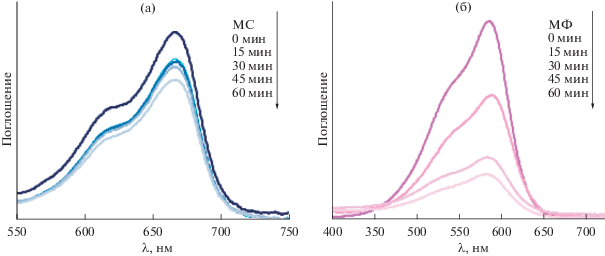
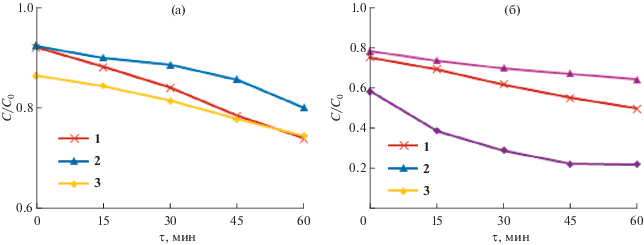
Установлено, что фотокаталитическая активность 1–3 различна. Об изменении концентрации красителей в растворе судили по изменению величины пика поглощения в УФ-спектрах при 665 и 554 нм для МС и МФ соответственно (рис. 7). В контрольном эксперименте, проведенном в аналогичных условиях, в водных растворах красителей без добавления дикарбоксилатов трис(5-бром-2-метоксифенил)сурьмы разложения МС и МФ под действием УФ-излучения не происходило.
Соединение 3 проявило наибольшую фотокаталитическую активность по отношению к раствору МФ, фотокаталитические свойства 1 и 2 достаточно низкие по отношению к растворам обоих красителей (рис. 8). Очевидно, что эффективность всех комплексов как фотокатализаторов выше при разложении МФ, чем МС. Так, при облучении в течение 60 мин растворов, содержащих 1–3, разложение МС составило 25.99, 19.88, 25.47%, МФ – 50.45, 21.87, 73.61% соответственно. Очевидно, что комплексы 1–3 проявляют фотокаталитическую активность, сопоставимую с активностью дикарбоксилатов трифенилсурьмы, приводящих к распаду приблизительно 25, 50% МС и 65, 80% МФ за такой же промежуток времени [12].
Рис. 8.
Изменение приведенной концентрации (С/С0) при УФ-облучении (τ, мин) растворов красителей МС (а) и МФ (б) в присутствии 1–3.
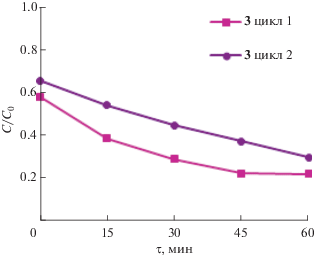
Чтобы оценить возможность повторного использования фотокатализаторов, изучили процесс циркулирующего (повторяющегося) фотокатализа МФ в присутствии 3. После полного распада красителя соединение 3 осаждали центрифугированием, растворитель декантировали и использовали осадок для следующего цикла (рис. 9). В результате двух циклов фотодеструкции масса 3 после промывания и высушивания уменьшилась на 50%, фотокаталитическая активность комплекса изменилась незначительно, что говорит о его стабильности.
ЗАКЛЮЧЕНИЕ
Реакция окислительного присоединения трис(5-бром-2-метоксифенил)сурьмы с 2,3,4,5-тетрафторбензойной, бромдифторуксусной и пентафторбутановой кислотами протекает по обычной схеме с образованием дикарбоксилатов триарилсурьмы с тригонально-бипирамидальной координацией атома сурьмы. В полученных соединениях не соблюдается типичная для дикарбоксилатов триарилсурьмы цис-ориентация карбоксилатных лигандов относительно экваториальной плоскости. Структурная организация молекул в кристаллах обусловлена межмолекулярными взаимодействиями галоген···галоген и водородными связями с участием карбонильных атомов кислорода. Дикарбоксилаты трис(5-бром-2-метоксифенил)сурьмы приводят к фотодеструкции органических красителей – метилового фиолетового и метиленового синего. Наибольшую фотокаталитическую активность проявляет бис(гептафторбутилато)трис(5-бром-2-метоксифенил)сурьма по отношению к раствору метилового фиолетового.
Список литературы
Iftikhar T., Rauf M.K., Sarwar S. et al. // J. Organomet. Chem. 2017. V. 851. P. 89. https://doi.org/10.1016/j.jorganchem.2017.09.002
Yu L., Ma Y.Q., Wang G.C., Li J.S. // Heteroat. Chem. 2004. V. 15. P. 32. https://doi.org/10.1002/hc.10208
Saleem L., Altaf A.A., Badshah A. et al. // Inorg. Chim. Acta. 2018. V. 474. P. 148. https://doi.org/10.1016/j.ica.2018.01.036
Mushtaq R., Rauf M.K., Bolte M. et al. // Appl. Organomet. Chem. 2016. V. 30. P. 1. https://doi.org/10.1002/aoc.3456
Mushtaq R., Rauf M.K., Bond M. et al. // Appl. Organomet. Chem. 2015. V. 31. P. 1. https://doi.org/10.1002/aoc.3606
Islam A., Da Silva J.G., Berbet F.M. // Molecules. 2014. V. 19. P. 6009. https://doi.org/10.3390/molecules19056009
Ali M.I., Rauf M.K., Badshah A. et al. // J. Chem. Soc., Dalton Trans. 2013. V. 42. P. 16733. https://doi.org/10.1039/c3dt51382c
Ma Y.Q., Yu L., Li J.S. // Heteroat. Chem. 2002. V. 13. P. 299. https://doi.org/10.1002/hc.10033
Sharma P., Perez D., Cabrera A. et al. // Acta Pharm. Sinica. 2008. V. 29. P. 881. https://doi.org/10.1111/j.1745-7254.2008.00818.x
Abdolmaleki S., Yarmohammadi S., Adib N. et al. // Polyhedron. 2019. V. 159. P. 239. https://doi.org/10.1016/J.POLY.2018.11.063
Qi H.X., Jo H., Lee H.E. et al. // J. Solid State Chem. Academic Press. 2019. V. 274. P. 69. https://doi.org/10.1016/J.JSSC.2019.03.018
Zhang X.Y., Cui L.S., Zhang X. et al. // J. Mol. Struct. 2017. V. 1134. P. 742. https://doi.org/10.1016/j.molstruc.2017.01.039
Agnihotri S., Raj P., Singhal K. // Synt. React. Inorg. Met.-Org. Chem. 2002. V. 32. P. 449. https://doi.org/10.1081/SIM-120003788
Geng H., Hong M., Yang Y. et al. // J. Coord. Chem. 2015. V. 68. № 16. P. 2938. https://doi.org/10.1080/00958972.2015.1060322
Wen L., Yin H., Li W. et al. // Inorg. Chim. Acta. 2010. V. 363. № 4. P. 676. https://doi.org/10.1016/j.ica.2009.11.022
Yu L., Ma Y.Q., Liu R.C. et al. // Polyhedron. 2004. V. 23. P. 823. https://doi.org/10.1016/j.poly.2003.12.002
Duffin R.N., Blair V.L., Kedzierski L. et al. // J. Chem. Soc., Dalton Trans. 2018. V. 47. P. 971. https://doi.org/10.1039/C7DT04171C
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Gen. Chem. 2012. V. 82. № 1. P. 95. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 2012. Т. 82. № 1. С. 99.] https://doi.org/10.1134/S1070363212010161
Sharutin V.V., Sharutina O.K., Reshetnikova R.V. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 11. P. 1450. [Шарутин В.В., Шарутина О.К., Решетникова Р.В. и др. // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1457.] https://doi.org/10.1134/S003602361711016X
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 10. P. 1561. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1640.] https://doi.org/10.1134/S0036023611100196
Bruker (2000) SMART. Bruker Molecular Analysis Research Tool, Versions 5.625 Bruker AXS, Madison, Wisconsin, USA.
Bruker (2000) SAINTPlus Data Reduction and Correction Program Versions 6.02a, Bruker AXS, Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Doak G.O., Long G.G., Freedman L.D. // J. Organomet. Chem. 1965. V. 4. № 1. P. 82. https://doi.org/10.1016/S0022-328X(0000)823700-0
Gupta A., Sharma R.K., Bohra R. et al. // Polyhedron. 2002. V. 21. № 23. P. 2387. https://doi.org/10.1016/S0277-5387(02)01155-5
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Coord. Chem. 2011. V. 37. № 10. P. 781. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Коорд. химия. 2011. Т. 37. № 10. С. 782.] https://doi.org/10.1134/S1070328411090089
Sharutin V.V., Sharutina O.K., Senchurin V.S., Chagarova O.V. // Russ. J. Gen. Chem. 2012. V. 82. № 10. P. 1665. [Шарутин В.В., Шарутина О.К., Сенчурин В.С., Чагарова О.В. // Журн. общ. химии. 2012. Т. 82. № 10. С. 1646.] https://doi.org/10.1134/ S1070363212100064
Tothadi S., Joseph S., Desiraju G.R. // Cryst. Growth Des. 2013. V. 13. № 7. P. 3242. https://doi.org/1 0.1021/cg400735f
Muzalevskiy V.M., Magerramov A.M., Shihaliev N.G. el al. // Russ. Chem. Bull. 2016. V. 65. № 6. P. 1541. [Музалевский В.М., Магеррамов A.M., Шихалиев Н.Г. // Изв. АН. Сер. хим. 2016. Т. 65. № 6. С. 1541.] https://doi.org/10.1007/s11172-016-1480-2
Smith J.A., Singh-Wilmot M.A., Carter K.P. et al. // Cryst. Growth Des. 2019. V. 19. № 1. P. 305. https://doi.org/10.1021/acs.cgd.8b01426
Shimizu K., Ferreira da Silva J. // Molecules. 2018. V. 23. № 11. P. 2959. https://doi.org/10.3390/molecules23112959
Дополнительные материалы
- скачать 1.zip
- checkCIF/PLATON report. Structure factors have been supplied for datablock(s) platon_sq
- скачать 2.zip
- checkCIF/PLATON report. Structure factors have been supplied for datablock(s) 1057_0m_a
- скачать 3.zip
- checkCIF/PLATON report. Structure factors have been supplied for datablock(s) 1147_0m_a
Инструменты
Журнал неорганической химии