Журнал неорганической химии, 2019, T. 64, № 9, стр. 991-996
Физико-химический анализ системы Zr(SO4)2–К2SO4–H2SO4(10%)–H2O при 25°С
Г. С. Скиба 1, *, Г. В. Пономаренко 2, В. Я. Кузнецов 1, М. П. Рыськина 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева
ФИЦ “Кольский научный центр РАН”,
184209 Апатиты, Академгородок, 26а, Россия
2 Мурманский государственный технический университет
183010 Мурманск, ул. Спортивная, 13, Россия
* E-mail: skiba@chemy.kolasc.net.ru
Поступила в редакцию 07.02.2019
После доработки 18.02.2019
Принята к публикации 15.03.2019
Аннотация
Изучена растворимость соединений, образующихся в системе Zr(SO4)2–К2SO4–H2SO4–H2O в разрезе 10 мас. % H2SO4 в изотермических условиях при 25°С в сечениях с постоянным содержанием растворителя (H2O + H2SO4) 60 мас. %. Равновесие в системе устанавливалось в течение 16 ч при непрерывном перемешивании. В этом разрезе равновесные твердые фазы представлены соединениями: K2Zr(SO4)3 ⋅ 2H2O, K3Zr(OH)(SO4)3 ⋅ 2H2O, K6Zr(SO4)5 ⋅ 3H2О и β-К2SO4. Выделенные соединения изучены методами рентгенофазового, кристаллооптического, термографического анализа и ИК-спектроскопии. Установлено значительное снижение растворимости соединений сульфатов калия и циркония по сравнению с соединениями натрия и циркония. Результаты имеют практическое значение для сернокислотной переработки эвдиалита – цирконийсодержащего минерала, запасы которого имеются на Кольском полуострове.
ВВЕДЕНИЕ
Выбор объекта исследований связан с перспективностью переработки эвдиалита – цирконийсодержащего минерала, огромные запасы которого располагаются на Кольском полуострове в Ловозерском районе [1, 2]. Минерал Na12Ca6Fe3Zr3[Si3O9]2[Si9O24(OH)3]2 содержит также стронций, калий и группу РЗЭ с высоким содержанием тяжелых элементов (Tb–Lu). Общее содержание РЗЭ в эвдиалитовом концентрате составляет ∼2%, но доля наиболее ценных элементов средней и тяжелой групп, отнесенных в большинстве высокоразвитых стран к “критичным” материалам [3–5], достигает 50%. При извлечении всех ценных компонентов, включая диоксид кремния, переработка эвдиалита может быть экономически эффективной.
Разрабатываются различные кислотные методы его переработки [6–13]. Из-за высокого содержания кремния в эвдиалите большое внимание уделяется изучению процесса вскрытия эвдиалита серной кислотой, которая, как известно, хорошо коагулирует гели кремниевой кислоты [14]. К преимуществам сернокислотного вскрытия относятся также доступность реагента и простота обезвреживания сбросных растворов, возможность получения пригодных к дальнейшей переработке устойчивых растворов, невысокая летучесть, отделение вместе с нерастворимым осадком некоторых балластных компонентов. Для изучения процессов выщелачивания циркония и снижения его потерь с кремнеземным осадком необходимо знать растворимость двойных солей циркония и щелочных металлов. Ранее были получены данные по растворимости в системе Zr(SO4)2–Na2SO4–H2SO4–H2O в разрезе 10 мас. % H2SO4 [15].
Исследование многокомпонентных систем, содержащих цирконий, осложнено многообразием его соединений в кислых средах. Важно знать растворимость соединений циркония в растворах 10–20%-ной H2SO4, что связано с остаточной кислотностью растворов после вскрытия эвдиалита и отделения кремнеземного остатка. В литературе имеются данные по свойствам некоторых сульфатоцирконатов, полученных препаративными методами [16]. В работах [17, 18] приведены дополнительные данные по свойствам сульфатоцирконатов, а также по растворимости в системе ZrО2–SO3–KCl–H2O при 20°С, при этом определено содержание в жидких фазах циркония и сульфат-иона и нет данных по содержанию калия. В работе [19] приведены результаты изучения системы ZrО2–Н2SO4–K2SO4 (KCl)–H2O при 75°С.
Цель работы – изучение взаимодействия сульфатов калия и циркония в растворах 10%-ной серной кислоты, определение растворимости, изучение свойств образующихся соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для изучения растворимости в системе готовили серии исходных смесей, расположенных в разрезе 10% H2SO4, в сечении с постоянной концентрацией растворителя. В качестве исходных веществ использовали реактивы марки “х. ч.”: Zr(SO4)2 · 4Н2О, безводный К2SO4, серную кислоту и дистиллированную воду. Рассчитанные навески солей взвешивали на аналитических весах с точностью 0.0001 г. Необходимое количество кислоты отмеряли с помощью микробюретки.
Исследования проводили в изотермических условиях при постоянном перемешивании водно-солевой смеси, помещенной в герметичные фторопластовые сосуды специальной конструкции [20]. Герметизацию сосудов обеспечивало применение резинового сильфона, закрепленного на трубчатой мешалке и вкладыше, уплотненном резиновой прокладкой, системой гаек и прижимной втулкой.
Фторопластовые сосуды выдерживали в термостате, обеспечивающем постоянную температуру 25 ± 0.1°С. Термостат снабжен двумя мешалками для перемешивания термостатируемой жидкости, нагревателем, реле, контактным термометром, крышкой и стойками для крепления приводов к мешалкам, обеспечивающим перемешивание одновременно в десяти сосудах.
Время установления равновесия в системе определяли путем анализа последовательно отобранных проб жидкой фазы. Содержание диоксида циркония находили весовым методом по массе остатка, полученного после упаривания равновесных жидких фаз, прокаливания при 950°С и отмывания водой растворимого сульфата калия. Равновесие в системе при постоянном перемешивании достигалось за 16 ч.
Равновесные твердые фазы подсушивали при комнатной температуре и исследовали различными физико-химическими методами: термографическим, кристаллооптическим, рентгенофазовым и ИК- спектроскопии.
Рентгенофазовый анализ проводили с помощью рентгеновского дифрактометра ДРОН-2 (СuKα-излучение, графитовый монохроматор). Для идентификации соединений использовали базу данных Международного Центра дифракционных данных ICDD-2002.
Термографический анализ проводили на синхронном термоанализаторе STA 409 PC фирмы Netzsch. Навески помещали в корундовые тигли, скорость нагревания в токе неосушенного аргона составляла 10 град/мин.
ИК-спектры регистрировали на спектрометре Nicolet 6700.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучена зависимость содержания диоксида циркония и сульфата калия в равновесных жидких фазах в разрезе 10 мас. % H2SO4 от солевого состава исходных смесей в сечениях с постоянным содержанием растворителя (H2O + H2SO4) 60 мас. %. Данные по составу исходных смесей и равновесных фаз приведены в табл. 1.
Таблица 1.
Составы исходных и равновесных фаз в системе Zr(SO4)2 · 4H2O–К2SO4–H2SO4–H2O при 25°С, разрез 10%-ной H2SO4
| № состава | Состав исходной смеси, мас. % | Содержание в жидкой фазе, мас. % | Состав твердых фаз | ||||
|---|---|---|---|---|---|---|---|
| Zr(SO4)2 · ⋅ 4H2O | К2SO4 | (H2SO4 + + H2O) |
ZrO2 | К2SO4 | (H2SO4 + + H2O) | ||
| 1 | 40 | 0 | 60 | 12.56 | 0.00 | 87.44 | – |
| 2 | 36 | 4 | 60 | 10.40 | 3.01 | 86.59 | Рентгеноаморфное соединение |
| 3 | 32 | 8 | 60 | 8.62 | 2.25 | 89.13 | K2Zr(SO4)3 ⋅ 2H2O + K3Zr(OH)(SO4)3 ⋅ 2H2O |
| 4 | 28 | 12 | 60 | 5.78 | 3.65 | 90.57 | K2Zr(SO4)3 ⋅ 2H2O + K3Zr(OH)(SO4)3 ⋅ 2H2O |
| 5 | 24 | 16 | 60 | 4.20 | 5.75 | 90.05 | K2Zr(SO4)3 ⋅ 2H2O + K3Zr(OH)(SO4)3 ⋅ 2H2O |
| 6 | 20 | 20 | 60 | 3.22 | 7.11 | 89.67 | K3Zr(OH)(SO4)3 ⋅ 2H2O |
| 7 | 16 | 24 | 60 | 0.86 | 9.15 | 89.99 | K3Zr(OH)(SO4)3 ⋅ 2H2O + K6Zr(SO4)5 ⋅ 3H2O |
| 8 | 12 | 28 | 60 | 0.78 | 9.53 | 89.69 | K3Zr(OH)(SO4)3 ⋅ 2H2O + K6Zr(SO4)5 ⋅ 3H2O |
| 9 | 8 | 32 | 60 | 0.37 | 18.90 | 80.73 | K3Zr(OH)(SO4)3 ⋅ 2H2O + K6Zr(SO4)5 ⋅ 3H2O + K2SO4 |
| 10 | 0 | 40 | 60 | 0.00 | 18.44 | 81.56 | K2SO4 |
Из приведенных данных видно, что областям различных фазовых равновесий соответствуют сильно различающиеся значения растворимости циркония.
Область четырехфазного равновесия реализуется при соотношении исходных солей Zr(SO4)2 · ⋅ 4H2O : К2SO4 = 2 : 8. Состав эвтонического раствора, мас. %: ZrO2 – 0.37, K2SO4 – 18.90, (H2SO4 + + H2O) – 80.73.
Используя данные по растворимости, полученные ранее в системе Zr(SO4)2–Na2SO4–H2SO4–H2O при 25°С в разрезе 10 мас. % H2SO4 [15], можно сравнить влияние щелочного металла на растворимость соединений циркония (табл. 2).
Таблица 2.
Сравнение влияния щелочного элемента на растворимость, мас. %
| № состава | Соотношение солей в исходной смеси | Содержание в жидкой фазе | Содержание в жидкой фазе | |||
|---|---|---|---|---|---|---|
| Zr(SO4)2 · 4H2O | К2SO4(Na2SO4) | ZrO2 | К2SO4 | ZrO2 | Na2SO4 | |
| 4 | 7 | 3 | 5.78 | 3.65 | 8.39 | 15.16 |
| 5 | 6 | 4 | 4.20 | 5.75 | 6.38 | 16.05 |
| 6 | 5 | 5 | 3.22 | 7.11 | 5.30 | 18.02 |
| 7 | 4 | 6 | 0.86 | 9.15 | 2.73 | 24.31 |
| 8 | 3 | 7 | 0.78 | 9.53 | 3.08 | 26.55 |
| 9 | 2 | 8 | 0.37 | 18.90 | 1.92 | 31.33 |
| 11 | 0 | 10 | 0.00 | 18.44 | 0.00 | 28.16 |
Из данных табл. 2 видно, что в системе, содержащей К2SO4, значения растворимости значительно ниже, чем в системе с Na2SO4. Аналогичная зависимость уменьшения растворимости наблюдается для алюмощелочных квасцов в ряду от натрия к цезию.
В области высоких концентраций циркония разрез проходит через область эвтонических растворов, насыщенных соединениями K2Zr(SO4)3 ⋅ ⋅ 2H2O (I) (№ 73-634 в базе ICDD-2002) и K3Zr(OH)(SO4)3 ⋅ 2H2O (II) (№ 77-674). Соединение II образуется при соотношении в исходной смеси Zr(SO4)2 · 4H2O : К2SO4 = (8 : 2)–(2 : 8), причем образующиеся равновесные твердые фазы являются многофазными. Только при соотношении в исходной смеси Zr(SO4)2 · 4H2O : К2SO4 = 5 : 5 образуются одна фаза соединения II. В области меньших концентраций циркония имеется область эвтонических растворов, насыщенных соединениями II и K6Zr(SO4)5 ⋅ 3H2O (III) (№ 21-722).
Свойства соединения K3Zr(OH)(SO4)3 ⋅ 2H2O (II)
По результатам кристаллооптического анализа, соединение II представлено, как правило, в радиально-лучистых сростках. Погасание ч-асто волнистое, характерное обычно для физически деформированных (напряженных) кристаллов.
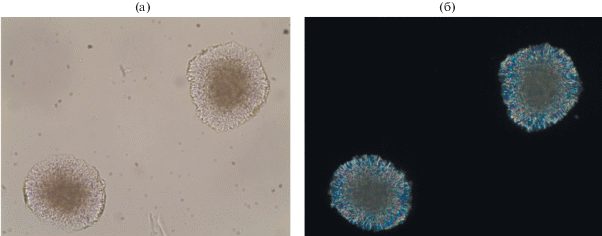
Микрофотографии соединения II сделаны с помощью поляризационного микроскопа Leica DM 2500Р в проходящем и отраженном свете (рис. 1). Видно, что кристаллы обладают двулучепреломлением, т.е. являются анизотропными.
Рис. 1.
Микрофотографии округлых радиально-лучистых образований K3Zr(OH)(SO4)3 ⋅ 2H2O: а – в проходящем свете, б – в скрещенных николях.
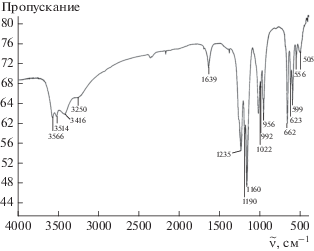
На рис. S1 приведена дифрактограмма с нанесенными значениями межплоскостных расстояний, на рис. 2 – ИК-спектр соединения II.
В области валентных колебаний ${\text{SO}}_{4}^{{2 - }}$-группы в спектре наблюдается снятие вырождения трижды вырожденной полосы поглощения колебания ν3 (1160, 1190 и 1235 см–1), свидетельствующее о понижении симметрии сульфатного полиэдра. Полносимметричная полоса поглощения ν1 (992, 1022 см–1) является синглетной, следовательно, сульфатные группы в этом соединении, по крайней мере, двух типов.
Рассмотрение валентных колебаний, связанных с водородом, приводит к выводу о наличии в этом соединении полос поглощения воды (3250 и 3416 см–1), образующей водородные связи либо координированной цирконием. Низкочастотные полосы поглощения, вероятно, относятся к валентным колебаниям О–Н-групп. В этом соединении имеется один тип воды, о чем свидетельствует синглетная полоса поглощения в области деформационных колебаний воды при 1639 см–1 [16].
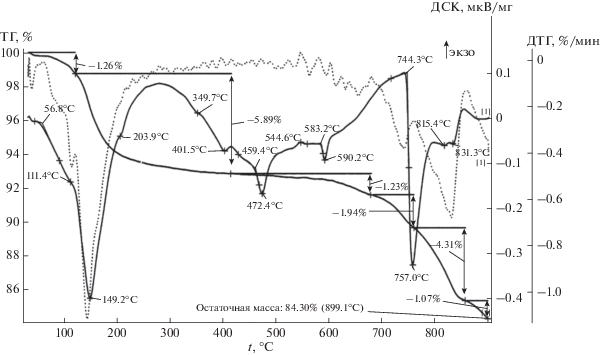
Результаты термических исследований соединения II, полученного при соотношении в исходной смеси Zr(SO4)2 · 4H2O : К2SO4 = 5 : 5, приведены на рис. 3.
Эндотермический эффект при температуре 149.2°C вызван удалением воды. Судя по потерям массы, K3Zr(OH)(SO4)3 ⋅ 2H2O теряет воду в два этапа.
Эндотермический эффект при 757.0°C обусловлен разрывом связи Zr–SO4 и одновременным удалением SO3.
Изучение соединений K2Zr(SO4)3 ⋅ 2H2O (I) и K3Zr(OH)(SO4)3 ⋅ 2H2O (II)
Эти соединения образуются в системе при соотношении в исходной смеси Zr(SO4)2 · 4H2O : К2SO4 = = (8 : 2)–(6 : 4). Фазы индивидуально не раскристаллизованы, наблюдаются поликристаллические образования без какого-либо определенного облика, поэтому анализировать отдельно фазу I не представляется возможным.
На рис. S2 приведены данные РФА смеси двух соединений.
Свойства соединений K3Zr(OH)(SO4)3 ⋅ 2H2O (II) и K6Zr(SO4)5 ⋅ 3H2O (III)
Соединение III существует в системе при соотношении в исходной смеси Zr(SO4)2 · 4H2O : К2SO4 = = (4 : 6)–(2 : 8). В этих условиях в твердой фазе помимо соединения III присутствуют еще соединение II и β-K2SO4 (арканит) (IV). По данным кристаллооптического анализа, вещество твердой фазы составляют:
– поликристаллические образования, сростки фаз II и III;
– индивидуально раскристаллизованное соединение IV;
– округлые радиально-лучистые образования соединения II.
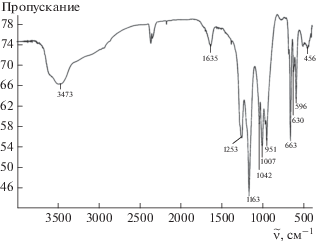
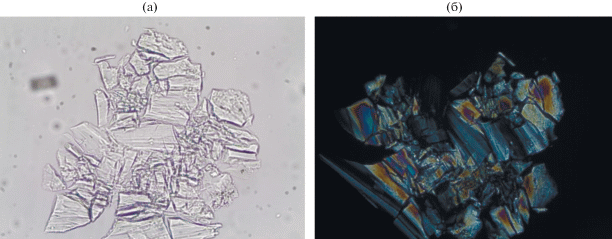
Ниже приведены данные кристаллооптического (рис. 4) и рентгенофазового анализа твердой фазы (рис. S3 ), а также данные ИК-спектроскопии (рис. 5).
Рис. 4.
Микрофотографии K3Zr(OH)(SO4)3 ⋅ 2H2O (II) + K6Zr(SO4)5 ⋅ 3H2O (III): а – в проходящем свете, б – в скрещенных николях.
При 3473 см–1 наблюдается полоса поглощения валентных колебаний воды. При 3600 см–1, вероятно, проявляется полоса поглощения валентных колебаний гидроксила, относящаяся к соединению K3Zr(OH)(SO4)3 ⋅ 2H2O. Полоса поглощения деформационных колебаний воды (1635 см–1) не расщеплена, это свидетельствует о том, что вода является кристаллогидратной. Полоса поглощения валентных колебаний ν3${\text{SO}}_{4}^{{2 - }}$-группы является трижды вырожденной, что говорит о ее пониженной симметрии. Наличие двух полос поглощения ν1 (951 и 1007 см–1) свидетельствует о двух типах ${\text{SO}}_{4}^{{2 - }}$-группы.
Список литературы
Маслобоев В.А., Лебедев В.Н. Редкоземельное сырье Кольского полуострова и проблемы его кислотной переработки. Апатиты: КФ АН СССР, 1991. 151 с.
Поляков Е.Г., Нечаев А.В., Смирнов А.В. Металлургия редкоземельных металлов. М.: Металлургиздат, 2018. 732 с.
De Boer M.A., Lammertsma K. // Chem. Sus. Chem. 2013. V. 6. P. 2045.
Zepf V. Rare Earth Elements. A New Approach to the Nexus of Sapply, Demand and Use: Exemplified along the Use of Neodymium in Permanent Magnets. Berlin, Heideberg: Springer, 2013. 157 p.
Goodenough K.M., Wall F., Merriman D. // Nat. Resour. Res. 2017. https://doi.org/10.1007/s11053-017-9336-5
Voßenkaul D., Birich A., Müller N. et al. // J. Sustainable Metallurgy. 2016. V. 3. P. 1.
Мотов Д.Л., Лештаева Т.Г. // Химическая технология редкометального сырья. М.–Л.: Наука, 1966. С. 5.
Мотов Д.Л., Лештаева Т.Г. // Химическая технология редкометального сырья. М.–Л.: Наука, 1966. С. 16.
Захаров В.И., Кислых В.В., Маслобоев В.А. и др. // Химическая технология редких элементов и минерального сырья. Апатиты: КНЦ РАН, 1986. С. 5.
Лебедев В.Н., Локшин Э.П., Маслобоев В.А. // Цветные металлы. 1997. № 8. С. 46.
Дибров И.А., Чиркст Д.Э., Матвеева Т.Е. // Цветные металлы. 2002. № 12. С. 38.
Захаров В.И., Воскобойников Н.Б., Скиба Г.С. и др. // Записки Горного ин-та. 2005. Т. 165. С. 83.
Захаров В.И., Скиба Г.С., Соловьев А.В. и др. // Цветные металлы. 2011. № 11. С. 25.
Матвеев В.А., Майоров Д.В., Соловьев А.В. // Цветные металлы. 2018. № 1. С. 20.
Shulyak D.V., Skiba G.S., Kuznetsov V.Ya. // Russ. J. Inorg. Chem. 2016. V. 61. № 6. P. 776. [Шуляк Д.В., Скиба Г.С., Кузнецов В.Я. // Журн. неорган. химии. 2016. Т. 61. № 6. С. 813.]https://doi.org/10.1134/S0036023616060188
Атанов И.Г., Зайцев Л.М. // Журн. неорган. химии. 1967. Т. 12. № 2. С. 365.
Годнева М.М., Охрименко Р.Ф., Громова Л.И. и др. // Журн. неорган. химии. 1980. Т. 25. № 11. С. 3104.
Годнева М.М., Никитина С.Д., Михайлова Н.Л. // Химия, хим. технология и металлургия редких элементов. Апатиты: КФ АН СССР, 1982. С. 51.
Motov D.L., Sozinova Yu.P., Ras’kina M.P. // Russ. J. Inorg. Chem. 1986. V. 31. № 1. P. 130. [Мотов Д.Л., Созинова Ю.П., Рыськина М.П. // Журн. неорган. химии. 1986. Т. 31. № 1. С. 230.]
Воскобойников Н.Б., Скиба Г.С., Калинкин А.М. Новые методы исследования растворимости в водно-солевых системах. Л.: Наука, 1986. 147 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии