Журнал неорганической химии, 2019, T. 64, № 9, стр. 957-964
Особенности взаимодействия пентафенилсурьмы с бифункциональными кислотами. Строение глутарата бис(тетрафенилсурьмы), сольвата 1,4-циклогександикарбоксилата бис(тетрафенилсурьмы) с бензолом, сольвата 3-гидроксибензоата тетрафенилсурьмы с диоксаном и аддукта 3-гидроксибензоата тетрафенилсурьмы с 3-тетрафенилстибоксибензоатом тетрафенилсурьмы и толуолом
В. В. Шарутин 1, О. К. Шарутина 1, Ю. О. Губанова 1, *, О. С. Ельцов 2
1 Национальный исследовательский Южно-Уральский государственный университет
454080 Челябинск, пр-т им. В.И. Ленина, 76, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, России
* E-mail: ulchik_7757@mail.ru
Поступила в редакцию 14.09.2018
После доработки 09.10.2018
Принята к публикации 15.03.2019
Аннотация
Установлено, что пентафенилсурьма взаимодействует с глутаровой и 1,4-циклогександикарбоновой кислотами с образованием глутарата (I) и 1,4-циклогександикарбоксилата (II, сольват с бензолом) бис(тетрафенилсурьмы). По данным РСА, в молекулах Iа и Iб атомы сурьмы имеют различную координацию: искаженную тригонально-бипирамидальную (аксиальный угол CSbO 178.67(9)° (179.63(9)°), сумма экваториальных углов СSbC 358.02(11)° (357.13(11)°), расстояние Sb−O 2.204(2) Å (2.215(2) Å)) и искаженную октаэдрическую (углы CSbO 149.49(9)°, 163.48(9)° (145.15(9)°, 169.18(9)°), CSbC 157.58(11)° (157.70(11)°), расстояния Sb−O 2.289(2), 2.413(2) Å (2.272(2), 2.417(2) Å)). В центросимметричной молекуле II координация атомов сурьмы искаженная тригонально-бипирамидальная (аксиальный угол 174.25(17)°, сумма экваториальных углов 356.7(2)°, расстояние Sb−O 2.245(1) Å). Продуктом реакции пентафенилсурьмы с 3-гидроксибензойной кислотой (2 : 1 мольн.) является сольват аддукта 3-гидроксибензоата тетрафенилсурьмы и 3-тетрафенилстибоксибензоата тетрафенилсурьмы с толуолом (III) (толуол, 100°С) или сольват 3-гидроксибензоата тетрафенилсурьмы с диоксаном (IV) (диоксан, 20°С). Атомы сурьмы в молекулах III и IV имеют искаженную в разной степени тригонально-бипирамидальную координацию.
ВВЕДЕНИЕ
Карбоксилаты тетрафенилсурьмы достаточно хорошо изучены. Установлено, что они проявляют биологическую активность [1–3], могут выступать в качестве реагентов в органическом синтезе, применяются при получении сурьмасодержащих полимеров [4, 5]. Одним из распространенных способов получения карбоксилатов тетрафенилсурьмы, описанных в литературе, является реакция галогенидов тетрафенилсурьмы с солями карбоновых кислот [1–3, 6, 7]. Однако известно, что карбоксилаты тетрафенилсурьмы можно получать непосредственно из пентафенилсурьмы, которую карбоновые кислоты легко дефенилируют [8]. Продуктами взаимодействия пентафенилсурьмы с дикарбоновыми кислотами являются кислые карбоксилаты тетрафенилсурьмы или карбоксилаты бис(тетрафенилсурьмы), в которых остаток кислоты как лиганд может быть моно- [9, 10], би- [11–13] или тетрадентатным [14]. Отметим, что сурьмаорганические производные с остатками дикарбоновых кислот в качестве мостиковых бидентатных лигандов получены также в реакциях замещения из дихлоридов трифенилсурьмы и соответствующей кислоты в присутствии алкоголята натрия [15, 16]. Установлено, что некоторые дикарбоновые кислоты в ходе реакции с пентафенилсурьмой декарбоксилируются, давая карбоксилаты тетрафенилсурьмы [11, 12].
Пентафенилсурьма вступает в аналогичные реакции и с другими Н-кислотами, образуя производные Ph4SbX (X – остаток кислоты) [17–19]. Для органических соединений, содержащих различные функциональные группы, реакции с пентафенилсурьмой являются своеобразным показателем подвижности атомов водорода в этих группах. Так, взаимодействие пентафенилсурьмы с салициловой и 5-бромсалициловой кислотами протекает только по карбоксильной группе даже при избытке пентафенилсурьмы [20, 21]. В реакции пентафенилсурьмы с 2,4-дигидроксибензойной кислотой независимо от соотношения реагентов участвуют карбоксильная и пара-гидроксильная группы, в результате чего образуется 2-гидрокси-4-тетрафенилстибоксибензоат тетрафенилсурьмы [22].
Настоящая работа посвящена изучению взаимодействия пентафенилсурьмы с глутаровой, 1,4-циклогександикарбоновой, 3-гидроксибензойной кислотами и установлению строения продуктов реакций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединения I. Смесь 0.3 г (0.6 ммоль) пентафенилсурьмы и 0.04 г (0.3 ммоль) глутаровой кислоты в 5 мл толуола помещали в стеклянную ампулу, запаивали и нагревали на водяной бане в течение 1 ч. Растворитель удаляли, осадок перекристаллизовывали из диметилформамида. Получили 0.154 г (78%) бесцветных кристаллов с tпл = 166°С.
ИК-спектр (ν, см–1): 3050, 2924, 2851, 1628, 1520, 1479, 1430, 1339, 1307, 1061, 995, 727, 694, 469, 445.
Спектр ЯМР 1H (δ, м. д.): 7.525 (c., 16H, HAr), 7.435 (c., 16H, HAr), 1.597 (c., 4H, CH2), 1.234 (c., 2H, CH2).
Аналогично синтезировали соединения II и III.
Соединение II. После перекристаллизации из бензола выход составил 75%, получены бесцветные кристаллы с tпл = 201°С.
ИК-спектр (ν, см–1): 3095, 3040, 2925, 2602, 1676, 1575, 1560, 1478, 1421, 1261, 1200, 1170, 1053, 998, 743, 698, 452.
Спектр ЯМР 1H (δ, м. д.): 7.546 (c.,16H, HAr), 7.463(c., 16H, HAr), 7.269−7.212 (д., 8H, HAr ) 2.545 (c., 2H, CH).
Соединение III. Выход 70%, бесцветные кристаллы с tпл = 148°С (с разложением).
ИК-спектр (ν, см–1): 3081, 3029, 1715, 1690, 1509, 1500, 1482, 1452, 1418, 1381, 1344, 1307, 1291,1257, 1225, 1220, 1170, 1159, 1098, 1071, 1027, 999, 952, 888, 852, 780, 729, 699, 632, 450.
Спектр ЯМР 1H (δ, м. д.): 7.761 (c., 24H, HAr), 7.6 (c., 24H, HAr), 7.47−7.46 (д., 12H, HAr ).
Синтез соединения IV. Смесь 0.25 г (0.5 ммоль) пентафенилсурьмы и 0.04 г (0.25 ммоль) 3-гидроксибензойной кислоты в 5 мл диоксана помещали в стеклянную ампулу, запаивали, выдерживали при комнатной температуре в течение суток. Растворитель удаляли. Получили 0.25 г (85%) бесцветных кристаллов с tпл = 187°С.
ИК-спектр (ν, см–1) 3049, 1688, 1553, 1477, 1418, 1381, 1344, 1307, 1291,1257, 1225, 1177, 1168, 1100, 1070, 1022, 1000, 959, 879, 781, 726, 699, 638, 443.
ИК-спектры комплексов I−IV регистрировали на ИК-Фурье-спектрометре Shimadzu IR Affinity-1S в таблетке KBr.
Спектры ЯМР 1Н (400 МГц) записывали на приборе Bruker DRX-400, внутренний стандарт – ТМС, растворитель – ДМСО-d6.
РСА кристаллов I−IV проводили на дифрактометре D8 Quest фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [23]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [24] и OLEX2 [25]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Атомы водорода помещены в геометрически рассчитанные позиции и включены в уточнение в модели “наездника”. Основные кристаллографические данные и результаты уточнения структур I−IV приведены в табл. 1, основные длины связей и валентные углы − в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I−IV
| Параметр | I | II | III | IV |
|---|---|---|---|---|
| Сингония | Триклинная | Триклинная | Триклинная | Триклинная |
| T, K | 293.15 | 293.15 | 293.15 | 293.15 |
| Пр. гр. | P1 | P1 | P1 | P1 |
| a, Å | 10.314(4) | 8.403(9) | 16.948(10) | 9.58(2) |
| b, Å | 18.830(8) | 9.343(8) | 18.737(10) | 10.39(3) |
| c, Å | 24.383(10) | 18.569(14) | 27.689(16) | 14.86(3) |
| α, град | 92.45(2) | 86.73(4) | 97.89(2) | 99.18(15) |
| β, град | 98.54(2) | 85.18(5) | 106.13(3) | 92.93(6) |
| γ, град | 105.851(18) | 70.23(5) | 107.75(2) | 102.69(8) |
| V, Å3 | 4487(3) | 1366(2) | 7805(8) | 1419(6) |
| Z | 2 | 2 | 2 | 2 |
| ρвыч, г/см3 | 0.995 | 1.347 | 1.4091 | 1.431 |
| μ, мм−1 | 1.222 | 1.033 | 1.085 | 1.007 |
| F(000) | 1356.0 | 562.0 | 3338.0 | 620.0 |
| Размер кристалла, мм | 0.73 × 0.42 × 0.18 | 0.31 × 0.21 × 0.11 | 0.3 × 0.2 × 0.12 | 0.59 × 0.54 × 0.48 |
| Область сбора данных по 2θ, град | 5.76−63.36 | 6.3−54.28 | 4.68−46.64 | 6.1−53.82 |
| Интервалы индексов отражений | −15 ≤ h ≤ 15, −27 ≤ k ≤ 27, −35 ≤ l ≤ 35 |
−10 ≤ h ≤ 10, −11 ≤ k ≤ 11, −23 ≤ l ≤ 23 |
−18 ≤ h ≤ 18, −20 ≤ k ≤ 20, −30 ≤ l ≤ 30 | −12 ≤ h ≤ 12, −13 ≤ k ≤ 13, −18 ≤ l ≤ 18 |
| Всего отражений | 165 828 | 12 810 | 115 890 | 17 514 |
| Независимых отражений | 29 854 | 5848 | 22400 | 5930 |
| Число уточняемых параметров | 1063 | 307 | 1841 | 345 |
| GOOF | 1.036 | 1.042 | 1.149 | 1.277 |
| R-факторы по F2 > 2σ(F2) | R1 = 0.0396, wR2 = 0.0741 |
R1 = 0.0591, wR2 = 0.1744 |
R1 = 0.0329, wR2 = 0.0719 | R1 = 0.0617, wR2 = 0.1401 |
| R-факторы по всем отражениям | R1 = 0.0739, wR2 = 0.0856 |
R1 = 0.0680, wR2 = 0.1817 |
R1 = 0.0907, wR2 = 0.1124 | R1 = 0.0694, wR2 = 0.1454 |
| Остаточная электронная плотность (min/max), е/Å3 | 1.35/−1.27 | 3.22/−1.02 | 0.99/−0.94 | 1.11/−1.42 |
Таблица 2.
Основные длины связей и валентные углы в структурах I−IV
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| I | |||
| Sb(1)−O(2) | 2.289(2) | C(71)Sb(2)O(3) | 178.67(9) |
| Sb(1)–O(1) | 2.413(2) | C(41)Sb(2)C(61) | 112.73(11) |
| Sb(1)−C(1) | 2.125(3) | C(51)Sb(2)C(41) | 112.08(11) |
| Sb(1)−C(11) | 2.157(3) | C(51)Sb(2)C(61) | 133.21(11) |
| Sb(1)−C(21) | 2.161(3) | C(1)Sb(1)O(1) | 149.49(9) |
| Sb(1)−C(31) | 2.149(3) | C(11)Sb(1)O(2) | 163.48(9) |
| Sb(2)−С(71) | 2.180(3) | C(31)Sb(1)С(21) | 157.58(11) |
| Sb(2)−O(3) | 2.204(2) | C(1)Sb(1)C(31) | 98.77(11) |
| Sb(2)−C(41) | 2.124(3) | C(1)Sb(1)C(21) | 98.13(11) |
| Sb(2)–C(61) | 2.118(3) | C(11)Sb(1)C(21) | 95.19(11) |
| Sb(2)–C(51) | 2.117(3) | C(11)Sb(1)O(1) | 108.19(10) |
| II | |||
| Sb(1)−O(1) | 2.245(4) | C(1)Sb(1)O(1) | 81.98(19) |
| Sb(1)−C(1) | 2.131(5) | C(1)Sb(1)C(31) | 93.5(2) |
| Sb(1)−C(11) | 2.093(6) | C(11)Sb(1)O(1) | 87.6(2) |
| Sb(1)–C(31) | 2.183(6) | C(11)Sb(1)C(31) | 97.5(2) |
| Sb(1) –C(21) | 2.137(6) | C(31)Sb(1)O(1) | 174.25(17) |
| O(1)−C(10) | 1.289(7) | C(21)Sb(1)O(1) | 85.8(2) |
| O(2)–C(10) | 1.234(7) | C(21)Sb(1)C(31) | 95.4(2) |
| III | |||
| Sb(1)−C(11) | 2.136(10) | O(1)Sb(1)C(11) | 84.2(3) |
| Sb(1)−C(21) | 2.108(11) | C(31)Sb(1)C(11) | 94.9(4) |
| Sb(1)−O(1) | 2.208(7) | C(31)Sb(1)C(21) | 98.0(4) |
| Sb(1)−C(1) | 2.117(12) | C(31)Sb(1)O(1) | 176.1(4) |
| Sb(1)−C(31) | 2.177(12) | C(31)Sb(1)C(1) | 94.1(4) |
| Sb(2)−O(4) | 2.287(7) | C(61)Sb(2)O(4) | 85.4(3) |
| Sb(2)−C(61) | 2.083(11) | C(81)Sb(2)O(4) | 177.5(4) |
| Sb(2)−C(81) | 2.168(11) | C(81)Sb(2)C(61) | 93.9(4) |
| Sb(2)−C(71) | 2.145(10) | C(71)Sb(2)C(81) | 96.0(4) |
| Sb(2)−C(51) | 2.139(10) | C(51)Sb(2)C(81) | 97.7(4) |
| IV | |||
| Sb(1)–O(1) | 2.276(6) | C(41)Sb(1)O(1) | 175.26(19) |
| Sb(1)–C(41) | 2.184(7) | C(11)Sb(1)C(1) | 110.0(3) |
| Sb(1)–C(11) | 2.126(7) | C(11)Sb(1)C(21) | 136.8(2) |
| Sb(1)–C(1) | 2.127(8) | C(1)Sb(1)C(41) | 98.8(3) |
| Sb(1)–C(21) | 2.128(7) | C(1)Sb(1)C(21) | 108.2(3) |
| Sb(1)–C(61) | 1.369(8) | C(21)Sb(1)C(41) | 98.3(2) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных: № 1576626 (I), 1856595 (II), 1822182 (III), 1853664 (IV) (deposit@ ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мы установили, что реакции пентафенилсурьмы с глутаровой и циклогександикарбоновой кислотами (мольное соотношение 2 : 1 или 1 : 1) в толуоле при нагревании приводят к образованию только биядерных сурьмаорганических продуктов:
Глутарат (I) и циклогександикарбоксилат бис(тетрафенилсурьмы) (II) были выделены из реакционной смеси с выходом ~80%. Соединение II для получения монокристаллов, пригодных для РСА, перекристаллизовывали из бензола.
В ИК-спектрах синтезированных соединений наиболее информативными являются полосы поглощения, характерные для карбонильных групп, при 1628 (I) и 1676 см−1 (II), которые смещены в область низкочастотных колебаний по сравнению с ИК-спектрами соответствующих кислот и справочными значениями 1680−1725 см−1 [26].
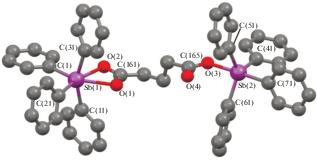
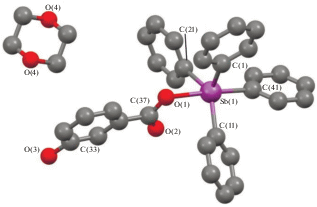
По данным РСА, кристаллы соединения I содержат два типа кристаллографически независимых молекул (а, б), геометрические параметры которых незначительно различаются между собой. На рис. 1 представлена структура молекулы Iа. Особенностью структуры I является то, что в молекулах атомы сурьмы имеют сильно различающуюся координацию. Так, один из атомов (Sb(2) в молекуле а) характеризуется искаженной тригонально-бипирамидальной координацией с тремя фенильными лигандами в экваториальных положениях, четвертым фенильным и карбоксилатным лигандом – в аксиальных. Аксиальный угол О(3)Sb(2)C(71) равен 178.67(9)° (в скобках приведены соответствующие параметры для молекулы б). Сумма углов СSb(2)C в экваториальной плоскости меньше 360° и составляет 358.02(11)° (357.13(11)°). Атом Sb(2) выходит из экваториальной плоскости на 0.170 Å (0.206 Å) в сторону аксиального атома углерода. Углы между экваториальными и аксиальными связями СаксSb(2)Cэкв 92.72(11)°−96.65(10)° (94.73(10)°−96.57(11)°) больше 90°. Аксиальная связь Sb(2)−C(71) 2.179(3) Å (2.180(3) Å) длиннее экваториальных связей, значения которых лежат в интервале 2.117(3)−2.124(3) Å (2.109(3)−2.120(3) Å). Связь Sb(2)−O(3) составляет 2.204(2) Å (2.215(2) Å). Внутримолекулярное расстояние между атомом сурьмы и карбонильным атомом кислорода Sb(2)⋅⋅⋅O(4) равно 3.050(3) Å (3.141(2) Å). В карбоксильной группе одинарные и двойные связи С−О имеют разные значения: С(165)−О(3) 1.302(4) Å (1.302(3) Å), С(165)−О(4) 1.216(4) Å (1.206(3) Å). Угол О(3)С(165)О(4) составляет 123.7(2)° (123.8(2)°).
Координацию атома Sb(1) можно рассматривать как искаженную октаэдрическую. Транс-углы О(1)Sb(1)C(1), О(2)Sb(1)C(11) и С(21)Sb(1)C(31) равны 149.49(9)°, 163.48(9)° и 157.58(11)° (145.15(9)°, 169.18(9)° и 157.70(11)°). Расстояния Sb(1)−С изменяются в интервале 2.125(3)−2.161(3) Å (2.136(3)−2.165(3) Å). Связи Sb(1)−О(2) и Sb(1)−О(1) равны 2.289(2) и 2.413(2) Å (2.272(2) и 2.417(2) Å). Небольшая асимметрия координации карбоксилатного лиганда коррелирует с близкими значениями связей С(161)−О(1) и С(161)−О(2): 1.247(3) и 1.272(3) Å (1.262(3) и 1.252(3) Å), что свидетельствует о делокализации электронной плотности. Угол О(1)С(161)О(2) равен 120.3(3)° (120.3(3)°), т.е. совпадает с теоретическим значением угла в карбоксилат-анионе.
В работе [27] было предложено считать мерой асимметрии бидентатного лиганда в карбоксилатных комплексах металлов отношение расстояния М⋅⋅⋅O=C к длине связи М–О (отношение равно 1 для симметрично координированного бидентатного лиганда). Асимметрия координации лиганда на атом Sb(2) в I составляет 1.38 (1.42), на атом Sb(1) – 1.05 (1.06).
Практически симметричная координация карбоксилатного лиганда наблюдается в производных сурьмы не часто. Примером могут служить молекулы ферроценилкарбоксилата, где расстояния Sb−О равны в пределах погрешности эксперимента [28], ферроценилакрилата тетрафенилсурьмы (отношение расстояний Sb−O составляет 1.06) [29], сукцината бис(тетрафенилсурьмы) (1.09) [13].
Отметим, что в литературе имеются сведения о биядерных структурах, в которых атомы сурьмы имеют различную координацию, например μ2-карбонато-бис(тетрафенилсурьма) или (μ2-4-оксибензоато-О,О',O'')-бис(тетрафенилсурьма) [30], в которых один из атомов сурьмы имеет КЧ 5, а другой − КЧ 6.
Структурная организация в кристалле I обусловлена сложной системой слабых межмолекулярных водородных связей типа НPh⋅⋅⋅О(2), НPh⋅⋅⋅О(6), НPh⋅⋅⋅О(4).
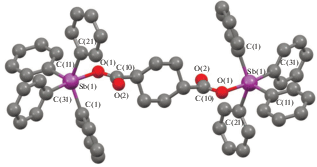
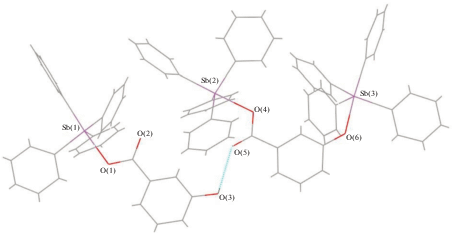
По данным РСА, соединение II кристаллизуется в форме сольвата с бензолом. Молекула II является центросимметричной с атомами сурьмы с искаженной тригонально-бипирамидальной координацией (рис. 2). Аксиальный угол O(1)SbC(31) равен 174.25(17)°, сумма углов СSbC в экваториальной плоскости − 356.7(2)°, при этом индивидуальные углы изменяются в интервале 105.9(2)°−138.9(2)°. Атом сурьмы выходит из экваториальной плоскости на 0.194 Å в сторону С(31), поэтому углы между аксиальной и экваториальными связями Sb−C больше 90° (93.5(2)°–97.5(2)°). Аксиальная связь Sb−C(31) (2.183(6) Å) длиннее экваториальных связей Sb−C (2.093(6)–2.137(6) Å). Длина связи Sb–O(1) составляет 2.245(1) Å, внутримолекулярное расстояние Sb⋅⋅⋅O(2) − 2.916(5) Å. Асимметрия координации карбоксилатного лиганда характеризуется значением 1.30. Расстояния О(1)−С(10) (1.289(7) Å) и О(2)−С(10) (1.234(7) Å) соответствуют одинарной и двойной связям [31]. Угол О(1)С(10)О(2) равен 123.4(5)°. Циклогексановый фрагмент имеет наиболее энергетически выгодную конформацию “кресла” [32].
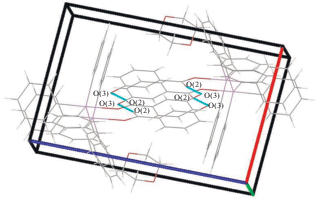
В кристалле II молекулы карбоксилата бис(тетрафенилсурьмы) связаны между собой слабыми водородными связями типа НPh⋅⋅⋅О(2) (2.45 Å), с молекулами бензола − посредством НPh⋅⋅⋅Сπ-взаимодействий (рис. 3).
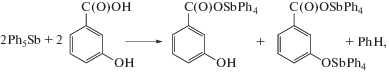
Реакция пентафенилсурьмы с 3-гидроксибензойной кислотой (2 : 1 мольн., толуол, 100°С, 1 ч) протекает с образованием двух продуктов: 3-гидроксибензоата тетрафенилсурьмы и 3-тетрафенилстибоксибензоата тетрафенилсурьмы:
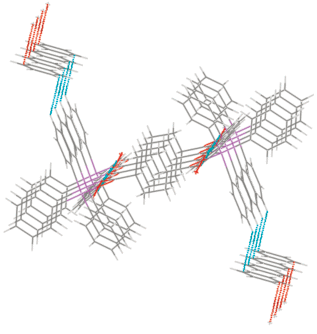
По данным РСА, продукты кристаллизуются в виде аддукта с сольватным толуолом Ph4SbOC(O)C6H4(OH-3) ⋅ ⋅ Ph4SbOC(O)C6H4(OSbPh4-3) ⋅ РhСН3 (III).
В случае проведения реакции при комнатной температуре в диоксане (2 : 1 мольн.) замещается атом водорода только в карбоксильной группе с образованием 3-гидроксибензоата тетрафенилсурьмы Ph4SbOC(O)C6H4(OH-3) (IV). Получение аддукта III свидетельствует о ступенчатом характере замещения атомов водорода в 3-гидроксибензойной кислоте.
В кристаллической ячейке аддукта III присутствует по два типа кристаллографически независимых молекул каждого вида (Ph4SbOC(O)C6H4(OH-3) − 1а, 1б и Ph4SbOC(O) C6H4(OSbPh4-3) − 2а, 2б) и две молекулы сольватного толуола.
Геометрические параметры молекул III 1а, 1б и IV несколько отличаются между собой. Пентакоординированные атомы Sb(1) в III 1а и IV выходят из экваториальных плоскостей в сторону аксиально расположенных атомов углерода на 0.200 (0.191 – в скобках указаны геометрические параметры молекулы III 1б) и 0.271 Å (рис. 4, 5). Суммы углов в экваториальных плоскостях составляют 357.1(4)° (357.5(5)°) и 355.0(4)°, аксиальные углы OSbCакс − 176.1(4)° (174.5(3)°) и 175.26(19)°, углы между аксиальными и экваториальными связями − 94.1(4)°−98.0(4)° (92.6(5)°−99.4(4)°) и 95.3(3)°−98.8(3)° в III и IV соответственно. Аксиальные связи 2.177(12) Å (2.205(11) Å) и 2.184(7) Å длиннее экваториальных связей 2.108(11)−2.136(10) Å (2.116(12)−2.131(11) Å) и 2.126(7)−2.128(7) Å. Связи Sb−O равны 2.208(7) Å (2.232(7) Å) и 2.276(6) Å. Внутримолекулярные расстояния Sb⋅⋅⋅O составляют 3.011 Å (3.085 Å) и 3.052 Å.
Рис. 4.
Молекулярная структура аддукта III (приведено по одному типу кристаллографически независимых молекул 1а и 2а, молекула толуола и атомы водорода не показаны).
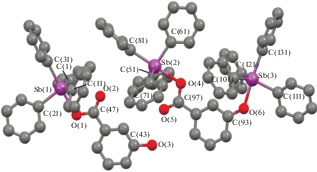
В молекуле III 2а тригонально-бипирамидальная координация атомов сурьмы Sb(2) и Sb(3) искажена в различной степени. Атом Sb(2), связанный с карбоксильной группой, выходит из экваториальной плоскости на 0.222 Å (0.218 Å − в скобках указаны геометрические параметры молекулы 2б), Sb(3), образующий связь с гидроксильным атомом кислорода, – на 0.179 Å (0.184 Å), при этом суммы углов в экваториальной плоскости равны 356.8(4)° (356.8(4)°) и 357.9(4)° (357.8(4)°) соответственно. Расстояние Sb(2)−O(4) 2.287(7) Å (2.267(7) Å) значительно больше расстояния Sb(3)−O(6) 2.144(8) Å (2.143(7) Å). Внутримолекулярное расстояние Sb(2)⋅⋅⋅O(5) равно 3.083 (3.131) Å. В карбоксильных группах практически не наблюдается выравнивания одинарной и двойной связей.
В аддукте III присутствуют внутримолекулярные водородные связи (рис. 6) между карбонильным атомом кислорода молекулы 2 и свободной гидроксильной группой молекулы 1 с параметрами: О−Н 0.82 Å, О⋅⋅⋅Н−О 1.89 Å (1.99 Å), О⋅⋅⋅О 2.68(1) Å (2.68(1) Å); угол ОНО 161° (141°).
Молекулы IV образуют димеры (рис. 7) посредством водородных связей О(3)−Н(3)⋅⋅⋅О(2) с параметрами: расстояния О(3)−Н(3) 0.82 Å, Н(3)⋅⋅⋅О(2) 1.91 Å, О(3)⋅⋅⋅О(2) 2.73(1) Å, угол О(3)Н(3)О(2) 172°. Сольватная молекула диоксана не принимает участия в образовании межмолекулярных связей.
ЗАКЛЮЧЕНИЕ
Установлено, что реакции пентафенилсурьмы с глутаровой и 1,4-циклогександикарбоновой кислотами (2 : 1, толуол, нагревание) протекают с замещением атомов водорода на фрагмент Ph4Sb в двух карбоксильных группах. В отличие от центросимметричной молекулы 1,4-циклогександикарбоксилата бис(тетрафенилсурьмы), в молекуле глутарата бис(тетрафенилсурьмы) атомы сурьмы имеют различную координацию. При взаимодействии пентафенилсурьмы с 3-гидроксибензойной кислотой возможно последовательное замещение атомов водорода в карбоксильной и гидроксильной группах в зависимости от условий проведения реакции. Установлено, что моноядерное (3-гидроксибензоат тетрафенилсурьмы) и биядерное (3-тетрафенилстибоксибензоат тетрафенилсурьмы) производные сурьмы кристаллизуются из бензола в виде аддукта. В молекуле 3-тетрафенилстибоксибензоата тетрафенилсурьмы атомы сурьмы структурно неэквивалентны.
Список литературы
Li J.-S., Ma Y.-Q., Cui J.-R. et al. // Appl. Organomet. Chem. 2001. V. 15. № 7. P. 639. https://doi.org/10.1002/aoc.491
Ma Y., Li J., Xuan Z. et al. // J. Organomet. Chem. 2001. V. 620. № 2. P. 235. https://doi.org/10.1016/S0022-328X(00)00799-3
Liu R.-C., Ma Y.-Q., Yu L. et al. // Appl. Organomet. Chem. 2003. V. 17. № 9. P. 662. https://doi.org/10.1002/aoc.491
Moiseev D.V., Morugova V.A., Gushchin A.V. et al. // J. Organomet. Chem. 2004. V. 689. № 4. P. 731. https://doi.org/10.1016/j.jorganchem.2003.11.025
Гущин А.В., Шашкин Д.В., Щербакова Т.С. и др. // Вестн. Нижегородск. ун-та им. Н.И. Лобачевского. 2010. № 6. С. 68.
Wen L., Yin H., Li W. et al. // Inorg. Chim. Acta. 2010. V. 363. № 4. P. 676. https://doi.org/10.1016/j.ica.2009.11.022
Yin H.-D., Wen L.-Y., Cui J.-C. et al. // Polyhedron. 2009. V. 28. № 14. P. 2919. https://doi.org/10.1016/j.poly.2009.06.065
Schmidbaur H., Mitschke K.H. // Angew. Chem. 1971. V. 83. № 4. P. 149. https://doi.org/10.1002/ange.19710830414
Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Бутлеровские сообщения. 2014. Т. 39. № 7. С. 139.
Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem. 2014. V. 59. № 2. P. 115. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. // Журн. неорган. химии. 2014. Т. 59. № 2. С. 247.]https://doi.org/10.1134/S1070328417040054
Sharutin V.V., Sharutina O.K., Gubanova Yu.O. // Bull. South Ural State Univer. Ser. Chem. 2015. V. 7. № 4. P. 17. https://doi.org/10.14529/chem150403
Sharutin V.V., Sharutina O.K., Gubanova Yu.O. et al. // J. Organomet. Chem. 2015. V. 798. P. 41. https://doi.org/10.1016/j.jorganchem.2015.09.002
Sharutin V.V., Sharutina O.K. // Russ. J. Coord. Chem. 2014. V. 40. № 9. P. 643. [Шарутин В.В., Шарутина О.К. // Коорд. химия. 2014. Т. 40. № 9. С. 559.]https://doi.org/10.1134/S1070328414090073
Millington P.L., Sowerby D.B. // J. Chem. Soc., Dalton Trans. 1992. № 7. P. 1199. https://doi.org/10.1039/DT9920001199
Quan L., Yin H., Fu W. // Acta Crystallogr., Sect. E. 2011. V. 67. P. 713. https://doi.org/10.1107/S1600536811016114
Hong M., Yin H.-D., Li W.-K. et al. // Inorg. Chem. Commun. 2011. V. 14. № 10. P. 1616. https://doi.org/10.1016/j.inoche.2011.06.023
McEwen W.E., Briles G.H., Giddings B.E. // J. Am. Chem. Soc. 1969. V. 91. № 25. P. 7079. https://doi.org/10.1021/ja01053a031
Sharutin V.V., Sharutina O.K. // Russ. J. Coord. Chem. 2017. V. 43. № 4. P. 232. [Шарутин В.В., Шарутина О.К. // Коорд. химия. 2017. Т. 43. № 11. С. 244.]https://doi.org/10.1134/S1070328417040054
Sharutin V.V., Sharutina O.K., Efremov A.N. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 10. P. 1319. [Шарутин В.В., Шарутина О.К., Ефремов А.Н. и др. // Журн. неорган. химии. 2017. Т. 62. № 10. С. 1330.]https://doi.org/10.1134/S0036023617100163
Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Журн. общ. химии. 1997. Т. 67. № 9. С. 1536.
Quan L., Yin J.C., Hong M. et al. // J. Organomet. Chem. 2009. V. 694. № 23. P. 3708. https://doi.org/10.1016/j.jorganchem.2009.07.040
Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Вестн. ЮУрГУ. Сер. хим. 2017. Т. 9. № 4. С. 56. https://doi.org/10.14529/chem170409
Bruker. SMART and SAINT-Plus. Vers. 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA. 1998
Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA. 1998
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Тарасевич Б.Н. ИК спектры основных классов органических соединений. Справочные материалы. М.: МГУ им. М.В. Ломоносова, 2012.
Ferguson G., Kaitner B., Glidewell C. et al. // J. Organomet. Chem. 1991. V. 419. № 3. P. 283. https://doi.org/10.1016/0022-328X(91)80241-B
Liu R.-C., Ma Y.-Q., Yu L. et al. // Appl. Organomet. Chem. 2003. V. 17. № 9. P. 662. https://doi.org/10.1002/aoc.491
Li J.-S., Liu R.-C., Chi X.-B. et al. // Inorg. Chim. Acta. 2004. V. 357. № 7. P. 2176. https://doi.org/10.1016/j.ica.2003.12.012
Quan L., Yin H., Cui J. et al. // J. Organomet. Chem. 2009. V. 694. № 23. P. 3683.https://doi.org/10.1016/j.jorganchem.2009.07.041
Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. Ч. 2. М.: Лаборатория знаний, 2012.
Травень В.Ф. Органическая химия: учебник для ву-зов. М.: ИКЦ Академкнига, 2004. Т. 2.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии