Журнал неорганической химии, 2019, T. 64, № 9, стр. 933-937
Изовалентные замещения в композите-катализаторе Na/W/Mn/SiO2
Г. Д. Нипан 1, *, А. С. Локтев 1, 2, 3, А. Г. Дедов 1, 2, 3, И. И. Моисеев 1, 2, 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Российский государственный университет нефти и газа (НИУ) им. И.М. Губкина
119991 Москва, Ленинский пр-т, 65/1, Россия
3 Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский пр-т, 29, Россия
* E-mail: nipan@igic.ras.ru
Поступила в редакцию 31.01.2019
После доработки 31.01.2019
Принята к публикации 15.03.2019
Аннотация
Методом рентгенофазового анализа исследованы изовалентные аналоги композита-катализатора Na/W/Mn/SiO2, синтезированные твердофазным способом: Li/Na(Rb)/W/Mn/SiO2, Na(Li, Rb, Cs)/Mo/Mn/SiO2, Na/W/Re/SiO2 и Na/W/Mn/GeO2, а также неизовалентные Mg(Ca, Sr, Ba)/W/Mn/SiO2. Композиты Li/Na/W/Mn/SiO2 и Li/Rb/W/Mn/SiO2 с эквимолярным содержанием щелочных элементов при неаддитивном изменении полиморфизма матрицы SiO2 и образовании смешанных вольфраматов демонстрируют одинаково высокий выход продуктов окислительной конденсации метана (23–24%), сопоставимый с наблюдаемым при использовании Na/W/Mn/SiO2. Замещение W на Mo, Mn на Re, Si на Ge в композите Na/W/Mn/SiO2, а также Na на Mg, Ca, Sr и Ba приводит к изменению фазового состава композита и снижению его каталитической активности.
ВВЕДЕНИЕ
Феномен композита Na/W/Mn/SiO2, позволяющего в процессе окислительной конденсации метана (ОКМ) конвертировать 25% CH4 в С2+-продукты (этилен, этан, пропан и более тяжелые углеводороды), до сих пор не получил непротиворечивого объяснения, хотя первые публикации о катализаторе состава 5% Na2WO4/1.9% Mn/SiO2 (вес. %) появились более четверти века назад [1].
При фиксированных параметрах процесса (температура, общее давление, парциальное давление метана и кислорода, время контакта с катализатором) активность Na/W/Mn/SiO2 в ОКМ связывали с содержанием Na (0.4–2.3%), W (2.2–8.9%) и Mn (0.5–3.0%) [2]. Тестирование 1536 образцов позволило установить концентрационную область составов (0.04–2.03 Na, 0.09–8.55 W и 4.81–9.62 вес. % Mn), при которых композиты Na/W/Mn/SiO2 поддерживают стабильную эффективность ОКМ, однако выход С2+ не превысил 24% [3].
Не менее важную роль при ОКМ играют фазовые превращения в композите Na/W/Mn/SiO2 [4]. В результате совместной кристаллизации кремнезема SiO2, вольфрамата натрия Na2WO4 и оксида марганца Mn2O3 формируется эффективный композит-катализатор на основе кристобалита – полиморфной модификации SiO2, метастабильной ниже 1300°C [5]. Кристаллический Na2WO4, сублимирующийся на воздухе с потерей Na2O, при температурах ОКМ плавится [6]. Образующийся расплав инконгруэнтно испаряется и способствует превращению кристобалита в стабильные тридимит [7] или кварц [8]. Благодаря разной растворимости Na2O в полиморфных кристаллических модификациях SiO2 [9] между ними происходит обмен катионами Na+ и, соответственно, диффузия анионов кислорода, поддерживающая процесс ОКМ. Кроме того, в ОКМ участвует подвижный “решеточный” кислород нестехиометрического биксбиита Mn2O3 ± δ [10], который при низком парциальном давлении кислорода переходит в гаусманит Mn3O4 и манганозит MnO – оксиды, образующие с WO3 каталитически инертный гюбнерит MnWO4.
Изовалентные катионные замещения в фазах, составляющих Na/W/Mn/SiO2, позволяют оценить вклад каждого элемента при фазообразовании композита-катализатора. В ряде работ вместо Na в композит вводили Li, K, Rb или Cs [11–15], а также в качестве прекурсора при синтезе использовали соли аммония ${\text{NH}}_{{\text{4}}}^{ + }$ [13]. В композитах Li(K,Rb,Cs)2WO4/55SiO2 [11] вольфраматы не были определены экспериментально, образовывался кристобалит (в случае Li с кварцем [16]), а добавление Mn не только увеличивало, но и снижало выход C2+ при ОКМ [11]. Заметно отличался состав Li2WO4–Mn/SiO2 и K2WO4–Mn/SiO2 [12] в образцах с мольным соотношением, тождественным 5 вес. % Na2WO4–2 вес. % Mn/SiO2: совместно с Li2WO4 (примесь Li6WO6 или Li6W2O9 [16]) и биксбиитом Mn2O3 кристаллизовался только кварц, а с K2WO4 и Mn2O3 – кристобалит с примесью тридимита [12]. Детальный анализ композитов 2Li(Na,K,Rb,Cs)/W/2.14Mn/91SiO2 (соответствует 5% Na2WO4/2.0% Mn/SiO2), синтезированных керамическим методом, показал, что вольфраматы Li(Na,K,Rb,Cs)2WO4 на кристаллическом носителе SiO2 (кристобалит + кварц для Li, Na, кристобалит + тридимит для Na, K, Rb, Cs) обладают разной структурой [13], следовательно, изовалентное замещение Na на Li, K, Rb и Cs приводит к изменению фазового состава композита. Сохраняется только биксбиит Mn2O3 (в случае K/W/Mn/SiO2 образуется криптомелан KMn8O16 [13]), присутствие которого, наряду с MnWO4 и WO3, в композите W/2.14Mn/91SiO2 обеспечивает выход C2+-продуктов при ОКМ 10–15% [13]. При золь-гель синтезе в свежеприготовленных Li-композитах отмечено образование Li6W2O9 [17]. Исходные композиты 5% Li(Na,K,Cs)2WO4/4%Mn/SiO2 помимо кварца с примесью кристобалита (Li) или кристобалита с примесью тридимита (Na,K,Cs) содержали вольфраматы Li(Na,K)2WO4 (кроме Cs2WO4), но в процессе ОКМ появлялся MnWO4 [14]. Кроме того, установлено, что в композитах 2Na(K,Rb)/W/2.14Mn/91SiO2 вместе с кристобалитом, тридимитом и биксбиитом Mn2O3 могут кристаллизоваться вольфраматы с разным соотношением катионов: Na2WO4, K6W2O9 и Rb2W2O7 [15].
Изовалентное замещение W на Mo не изменяет фазовый состав композита при температурах ниже 600°C, так как совместно с кристобалитом, тридимитом и Mn2O3 образуется Na2MoO4, изоморфный кубическому Na2WO4 [6, 18, 19]. Однако в отличие от вольфрамата, сохраняющего кубическую структуру вплоть до плавления при температурах ОКМ, молибдат при 600°C претерпевает полиморфное превращение и плавится гексагональная модификация Na2MoO4 [18]. В идентичных условиях ОКМ расплав Na2MoO4 испаряется быстрее, чем Na2WO4 (кристаллы не обнаруживаются после 500 ч ОКМ [1]), так как парциальное давление над Na2MoO4 почти на два порядка выше [20]. В конечном итоге каталитическая эффективность Na/Mo/Mn/SiO2 в ОКМ снижается по сравнению с Na/W/Mn/SiO2 [6, 18, 19], хотя сообщается о высоком выходе C2+-продуктов для композита 4% Na2MoO4–10% Mn–O/SiO2 [21].
При неизовалентном замещении Na на щелочноземельные элементы Mg, Ca и Ba не происходит кристаллизации кремнезема, и, как следствие, композиты, содержащие моноклинный (вероятно) MgWO4 [11] или тетрагональные CaWO4 [11, 12] и BaWO4 [12], каталитически малоактивны [11, 12]. В присутствии Mn образуется MnWO4 [12]. При температурах ОКМ эти вольфраматы не плавятся и парциальные давления над ними ниже чувствительности экспериментальных методов [20].
В результате замещения Mn в Na/W/Mn/SiO2 на V, Cr, Fe, Co, Zn вместе с кристобалитом и Na2WO4 получали соответствующие простые оксиды [22], но каталитическая эффективность полученных композитов в ОКМ-процессе сопоставима с эффективностью газофазных реакций в пустом реакторе [23].
При проведении ОКМ с использованием различных подложек для смеси 2% MnxOy–5% Na2WO4 показано, что в качестве матрицы для композита-катализатора структура кристобалита SiO2 предпочтительней, чем структуры флюорита ZrO2, рутила TiO2 и анатаза TiO2 [24].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В настоящей работе исследовано фазовое состояние оксидных композитов с заданным соотношением катионов MI : MVI : MIII : MIV = = 2 : 1 : 2.14 : 91 при изовалентном замещении в Na/W/Mn/SiO2. Синтезированы композиты:
– Li/Na/W/2.14Mn/91SiO2 и Li/Rb/W/2.14Mn/ 91SiO2 с эквимолярным соотношением щелочных элементов для определения их взаимовлияния на кристаллизацию кремнезема,
– 2Li(Na,Rb,Cs)/Mo/2.14Mn/91SiO2 для оценки возможности изоморфного замещения вольфраматов на молибдаты,
– 2Mg(Ca, Sr, Ba)/W/2.14Mn/91SiO2 с неизовалентным замещением для подавления кристаллизации MnWO4,
– 2Na/W/2.14Re/91SiO2 для проверки влияния поливалентности оксидов Mn,
– 2Na/W/2.14Mn/ 91GeO2 для моделирования полиморфных превращений в матрице.
Ряд синтезированных композитов испытан в ОКМ.
Твердофазный синтез композитных материалов и оценку их каталитической активности проводили по методикам, описанным в работе [13]. РФА композитов в интервале углов 2θ = 10°–60° выполняли на дифрактометрах Bruker Advance D8 (CuKα-излучение), Rigaku MiniFlex 600 (CuKα), STOE STADI P (CuKα) и ДРОН-3М (CuKα).
Методики проведения каталитических экспериментов по ОКМ и анализа продуктов реакции аналогичны описанным в [13, 16, 17]. В обогреваемый кварцевый реактор подавали смесь CH4/O2 = = 2–3; W = 50–60 л/(г катализатора в час); t = = 840–900°C. Загрузка катализатора 0.1 г.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Замещение половины атомов Na на Li в составе композита Na/W/Mn/SiO2 (катализаторы Li–Na/ W/Mn/SiO2) не оказало существенного влияния на результаты ОКМ. На натриевом композите [13] конверсия метана составляла 37%, селективность по С2+-продуктам – 62%, а их выход – 23%. При катализе Li–Na/W/Mn/SiO2 конверсия метана возросла до 44%, селективность по С2+-продуктам снизилась до 52%, в результате их выход (24%) практически не изменился. При замене Na на смесь Li и Rb каталитическая эффективность композита в ОКМ усредняется и также мало отличается от результатов на Na/W/Mn/SiO2 [13]: конверсия метана составила 43%, селективность по С2+-продуктам – 52%, их выход – 22%.
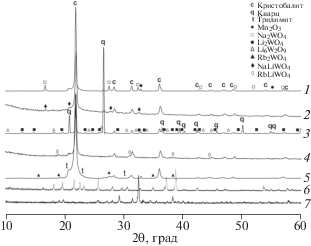
Фазовые составы композитов Li–Na и Li–Rb претерпевают некоторые изменения по сравнению с композитами, содержащими только Na, Li или Rb (рис. 1, дифрактограммы 1–5). При сохранении основной фазы кристобалита в композитах Li–Na и Li–Rb подавляется кристаллизация кварца, биксбиита Mn2O3 и вольфраматов Na2WO4, Li2WO4, Li6W2O9 и Rb2WO4 (рис. 1, кривые 1–5). При отсутствии MnWO4 кристаллизуются смешанные вольфраматы – орторомбический NaLiWO4 [25] (рис. 1, кривая 2) и кубический RbLiWO4 [26] (рис. 1, кривая 4). Во избежание неверной интерпретации, связанной с образованием смешанных силикатов, были синтезированы силикаты брутто-составов LiNaSiO3, Li3NaSiO4, LiRbSiO3 и Li2Rb2SiO4. В первом случае, в соответствии с [27], получили смесь фаз: орторомбической Li2SiO3 и гексагональной Na2SiO3. В случае Li3NaSiO4 образовалась гомогенная тетрагональная фаза (рис. 1, кривая 6) [28]. Для состава LiRbSiO3 получена новая фаза (рис. 1, кривая 7) с орторомбической структурой (a = = 14.38, b = 13.46, c = 5.28 Å). Триклинная фаза Li2Rb2SiO4, охарактеризованная в [29], не образовалась в условиях синтеза на воздухе, но среди неидентифицированных рефлексов (самый интенсивный при 2θ = 30.00°) отсутствуют принадлежащие орторомбической фазе LiRbSiO3, что косвенно свидетельствует о возможном существовании другой полиморфной модификации Li2Rb2SiO4 с низкой симметрией.
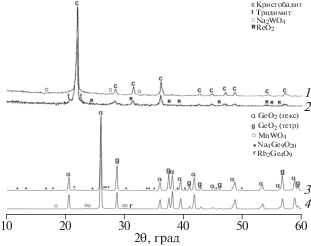
Рис. 1.
Дифрактограммы композитов и индивидуальных фаз Na/W/Mn/SiO2 (1), Li/Na/W/Mn/SiO2 (2), Li/W/Mn/SiO2 (3), Li/Rb/W/Mn/SiO2 (4), Rb/W/Mn/SiO2 (5), Li3NaSiO4 (6) и LiRbSiO3 (7).
Молибденсодержащие композиты при тех же соотношениях катионов 2 : 1 : 2.14 : 91, методиках твердофазного синтеза и условиях проведения ОКМ, что и для вольфрамсодержащих композитов [13], кристаллизуются значительно хуже и обладают меньшей каталитической активностью. На Na/Mo/Mn/SiO2-композите конверсия метана составила 34%, селективность по С2+-продуктам – 32%, а выход С2+ – 11%. Фазовые составы 2Li/Mo/2.14Mn/91SiO2 (кристобалит, низкотемпературный силикат Li2Si2O5, моноклинный M-nMoO4 и биксбиит Mn2O3) и 2Li/W/2.14Mn/91SiO2 (кварц, кристобалит, полиморфные модификации Li2WO4 и биксбиит Mn2O3) значительно отличаются. В композитах 2Na(Rb,Cs)/Mo/ 2.14Mn/91SiO2 кристобалит образуется в сочетании с тридимитом, биксбиитом Mn2O3 и молибдатами: кубическим Na2MoO4, гексагональным Rb2MoO4 и орторомбическим Cs2MoO4. Снижение содержания натрия в два раза по сравнению с 2Na/Mo/2.14Mn/91SiO2 (рис. 2, кривая 1) привело к получению малоактивного композита Na/Mo/2.14Mn/91SiO2, в котором дополнительно кристаллизовался MnMoO4 (рис. 2, кривая 2).
Рис. 2.
Дифрактограммы композитов Na/Mo/Mn/SiO2 (1, 2), Ca/W/Mn/SiO2 (3), Sr/W/Mn/SiO2 (4) и Ba/W/Mn/SiO2 (5).
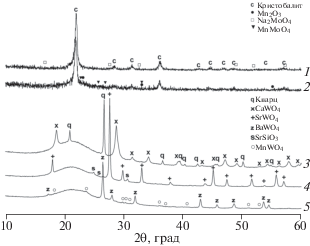
В исследованных нами композитах 2Mg(Ca, Sr, Ba)/W/2.14Mn/91SiO2, характеризующихся двукратным по сравнению с описанным в [11, 12] увеличением содержания щелочноземельных элементов, кристаллизуются моноклинный MgWO4 или тетрагональные CaWO4 (рис. 2, кривая 3), SrWO4 (рис. 2, кривая 4) и BaWO4 (рис. 2, кривая 5). Во всех композитах сохраняется аморфный кремнезем, хотя в Mg- и Ca-композитах кристаллизуется кварц (рис. 2, кривая 3), в Sr-композите – SrSiO3 (рис. 2, кривая 4), в Ba-композите – MnWO4 (рис. 2, кривая 5), а манганиты щелочноземельных элементов не образуются [30]. Высокое содержание щелочноземельного элемента не приводит к повышению каталитической активности [11, 12], и если сравнивать, например, композиты с кварцем, то в Ca/W/Mn/SiO2, в отличие от Li/W/Mn/SiO2, не обнаруживается биксбиит Mn2O3. В проведенных нами экспериментах по ОКМ на Sr/Mn/W/SiO2 конверсия метана не превышала 23–24%, а выход С2+ – 10%. Композит Mg/Mn/W/SiO2 показал аналогичные результаты.
При изовалентном замещении Mn на Re возникает инертный в ОКМ композит Na/W/Re/SiO2, в котором кристаллизуются кристобалит и кубический Na2WO4 (рис. 3, кривая 1). В результате повышения температуры отжига с 850 до 950°C образуются тридимит, орторомбический ReO2 (рис. 3, кривая 2) и, вероятно, поливольфраматы натрия, например Na2W2O7, которым принадлежат дополнительные рефлексы.
Использование в качестве матрицы оксида германия вместо кремнезема также не позволяет получить эффективный катализатор ОКМ. При использовании в ОКМ Na/W/Mn/GeO2 выход С2+ не превышал 6%, а в присутствии Rb/W/Mn/GeO2 – 8%. Как и в случае SiO2, композиты Na/W/Mn/GeO2 (рис. 3, кривая 3) и Rb/W/Mn/GeO2 (рис. 3, кривая 4) содержат носитель в виде двух полиморфных модификаций: гексагональной, подобной α-кварцу, и тетрагональной (аргутит), кристаллизующейся, подобно тридимиту, только в присутствии щелочного элемента. Однако, в отличие от Na/W/Mn/SiO2 и Rb/W/Mn/SiO2 [13], оксиды щелочных металлов взаимодействуют с GeO2 с образованием новых фаз Na4Ge9O20 (рис. 3, 3) и Rb2Ge4O9 (рис. 3, кривая 4), а вместо биксбиита Mn2O3 появляется гюбнерит MnWO4 (рис. 3, кривые 3 и 4).
ЗАКЛЮЧЕНИЕ
Одинарное изовалентное замещение W на Mo, Mn на Re, Si на Ge в композите Na/W/Mn/SiO2, как и неизовалентное замещение Na на Mg, Ca, Sr и Ba, приводит к изменению фазового состава композита, что служит одной из причин снижения его каталитической активности в реакции ОКМ. Двойное изовалентное замещение Na на Li, Rb и Cs, а W на Mo дает такой же результат. Каталитическая активность в ОКМ сохраняется в композитах Li/Na/W/Mn/SiO2 и Li/Rb/W/Mn/SiO2 с эквимолярным содержанием щелочных элементов при неаддитивном изменении полиморфизма матрицы SiO2 и образовании смешанных вольфраматов.
Список литературы
Li S. // J. Nat. Gas Chem. 2003. V. 12. № 1. P. 1.
Ji S., Xiao T., Li S. et al. // Appl. Catal. A: Gen. 2002. V. 225. № 1–2. P. 271. https://doi.org/10.1016/S0926-860X(01)00864-X
Li Z., Wang S., Hong W. et al. // Chem. NanoMat. 2018. V. 4. № 5. P. 487. https://doi.org/10.1002/cnma.201800019
Nipan G.D. // Inorg. Mater. 2014. V. 50. № 10. P. 1012. [Нипан Г.Д. // Неорган. материалы. 2014. Т. 50. № 10. С. 1096.]https://doi.org/10.1134/S0020168514100112
Palermo A., Varquez J.P.H., Lee A.F. et al. // J. Catal. 1998. V. 177. № 2. P. 259. https://doi.org/10.1006/jcat.1998.2109
Hou S., Cao Y., Xiong W. et al. // Ind. Eng. Chem. Res. 2006. V. 45. № 21. P. 7077. https://doi.org/10.1021/ie060269c
Simon U., Görke O., Berthold A. et al. // Chem. Eng. J. 2011. V. 168. № 3. P. 1352. https://doi.org/10.1016/j.cej.2011.02.013
Koirala R., Büchel R., Pratsinis S.E., Baiker A. // Appl. Catal. A: Gen. 2014. V. 484. P. 97.https://doi.org/10.1016/j.apcata.2014.07.013
Polyakova I.G. // Glass: Selected Properties and Crystallization. Berlin–Boston: Walter de Gruyter GmbH, 2014. P. 197–268.
Казенас Е.К., Цветков Ю.В. Испарение оксидов. М.: Наука, 1997. 543 с.
Palermo A., Varquez J.P.H., Lambert R.M. // Catal. Lett. 2000. V. 68. № 3–4. P. 191. https://doi.org/10.1023/A:1019072512423
Ji S., Xiao T., Li S. et al. // J. Catal. 2003. V. 220. № 1. P. 47. https://doi.org/10.1016/S0021-9517(03)00248-3
Dedov A.G., Nipan G.D., Loktev A.S. et al. // Appl. Catal. A: Gen. 2011. V. 406. № 1–2. P. 1. https://doi.org/10.1016/j.apcata.2011.06.022
Gholipour Z., Malekzadeh A., Ghiasi M. et al. // Iranian J. Sci. Technol. 2012. V. 36. № A2. P. 189.
Ismagilov I.Z., Matus E.V., Popkova V.S. et al. // Kinetics and Catalysis. 2017. V. 58. № 5. P. 622. [Исмагилов И.З., Матус Е.В., Попкова В.С. и др. // Кинетика и катализ. 2017. Т. 58. № 5. С. 634.]https://doi.org/10.1134/S0023158417050068
Nipan G.D. // Inorg. Mater. 2015. V. 51. № 4. P. 389. [Нипан Г.Д. // Неорган. материалы. 2015. Т. 51. № 4. С. 442. https://doi.org/10.7868/S0002337X15040107]https://doi.org/10.1134/S002016851504010X
Nipan G.D., Loktev A.S., Parkhomenko K.V. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 8. P. 887. [Нипан Г.Д., Локтев А.С., Пархоменко К.В. и др. // Журн. неорган. химии. 2013. Т. 58. № 8. С. 999.]https://doi.org/10.1134/S0036023613080160
Hou S., Cao Y., Xiong W. et al. // Chin. J. Catal. 2006. V. 27. № 7. P. 553.
Mahmoodi S., Ehsani M.R., Ghoreisi S.M. // J. Ind. Eng. Chem. 2010. V. 16. P. 923. https://doi.org/10.1016/j.jiec.2010.09.007
Казенас Е.К. Термодинамика испарения двойных оксидов. М.: Наука, 2004. 551 с.
Семикин К.В., Кузичкин Н.В. // Изв. СПбГТИ (ТУ). 2014. № 23. С. 52.
Malekzadeh A., Dalai A.K., Khodadadi A., Mortazavi Y. // Catal. Commun. 2008. V. 9. № 5. P. 960. https://doi.org/10.1016/j.catcom.2007.09.026
Beck B., Fleisher V., Arndt S. et al. // Catal. Today. 2014. V. 238. P. 212. https://doi.org/10.1016/j.cattod.2013.11.059
Yildiz M., Simon U., Otremba T. et al. // Catal. Today. 2014. V. 228. P. 5. https://doi.org/10.1016/j.cattod.2013.12.024
Choudhary S.N., Choudhary R.N.P. // Mater. Lett. 1998. V. 34. № 3–6. P. 411.
Okada K., Ossaka J. // Acta Crystallogr. 1980. V. B36. P. 657.
Konar B., Hudon P., Jung I.-H. // J. Eur. Ceram. Soc. 2018. V. 38. P. 2074. https://doi.org/10.1016/j.jeurceramsoc.2017.10.024
Nowitzki B., Hoppe R. // Rev. Chim. Miner. 1986. V. 23. № 2. P. 217.
Hofmann R., Nowitzki B., Hoppe R. // Z. Naturforsch. 1985. V. 40b. P. 1441.
Янкин А.М., Балакирев В.Ф., Федорова О.М., Голиков Ю.В. Манганиты редкоземельных и щелочноземельных элементов. Физико-химический анализ. Екатеринбург: УрО РАН, 2009. 290 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии