Журнал неорганической химии, 2019, T. 64, № 9, стр. 965-970
Структура и термическое разложение 2-тиобарбитуратов Nd(III), Gd(III) и Tb(III)
Н. Н. Головнев 1, *, М. С. Молокеев 1, 2, 3, И. В. Стерхова 4
1 Сибирский федеральный университет
660041 Красноярск, пр-т Свободный, 79, Россия
2 Институт физики им. Л.В. Киренского ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, 50, стр. 38, Россия
3 Дальневосточный государственный университет путей сообщения
680021 Хабаровск, ул. Серышева, 47, Россия
4 Институт химии им. А.Е. Фаворского СО РАН
664033 Иркутск, ул. Фаворского, 1, Россия
* E-mail: ngolovnev@sfu-kras.ru
Поступила в редакцию 28.12.2018
После доработки 15.02.2019
Принята к публикации 15.03.2019
Аннотация
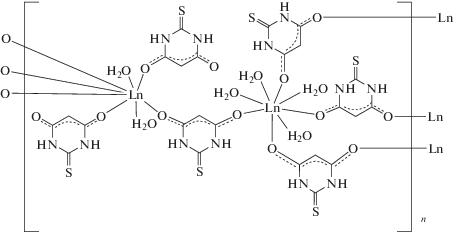
Получены комплексы [Ln2(H2O)6(μ2-Htba−О,O')4(Htba−О)2]n (Ln = Tb (I), Gd (II), Nd (III); Н2tba – 2-тиобарбитуровая кислота). По данным монокристального РСА, моноклинные кристаллы I–III изоструктурны. Они содержат три независимых лиганда Htba– (один концевой и два мостиковых) и два независимых иона Ln3+. Один ион Ln3+ координирует шесть ионов Htba– (два концевых и четыре O,O'-мостиковых) и две молекулы воды, другой − четыре O,O'-мостиковых иона Htba– и четыре молекулы воды с образованием квадратных антипризм. Антипризмы связаны мостиковыми ионами Htba– в слои. Многочисленные водородные связи и π–π-взаимодействия стабилизируют структуру соединений. При термическом разложении на воздухе III переходит в Nd2O2SО4, а I и II превращаются в смеси, содержащие оксиды и оксисульфаты.
ВВЕДЕНИЕ
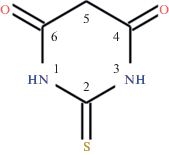
Металлоорганические координационные полимеры лантанидов(III) обладают высокой монохроматичностью люминесцентного излучения и используются в клинической диагностике и биотехнологии, органических светодиодах, дисплеях, оптических усилителях, лазерах [1–4]. Одним из многофункциональных лигандов, способных образовывать с ионами металлов координационные полимеры различного строения, является 2‑тиобарбитуровая кислота (рис. 1) [5], производные которой – тиобарбитураты – используются в качестве лекарственных средств [6]. В настоящей работе в рамках систематического изучения структуры и свойств 2-тиобарбитуратных и 1,3‑диэтил-2-тиобарбитуратных комплексов лантанидов [7–10] получены и структурно охарактеризованы три изоструктурных комплекса [Ln2(H2O)6(H2tba)6] (Ln = Tb (I), Gd (II), Nd (III)) с потенциально полезными люминесцентными и магнитными свойствами [3, 4]. Исследовано их термическое разложение в воздушной атмосфере.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали без дополнительной очистки TbCl3 ⋅ 6H2O, GdCl3 ⋅ 6H2O, Nd(NO3)3 ⋅ 6H2O, H2tba и NaOH (все марки “х. ч.”).
Синтез [Ln2(H2O)6(Htba)6]n (Ln = Tb (I), Gd (II) и Nd (III)). Гидраты солей лантанидов (0.463 ммоль) растворяли в 10 мл воды и добавляли 0.200 г (1.39 ммоль) твердой H2tba, затем смесь нейтрализовали 1 М раствором NaOH до рН 4. Образовались мелкокристаллические осадки I (желтый), II (красный) и III (фиолетовый), которые отфильтровывали через 8 ч. Выход соединений 60–70%.
| С | H | N | S | |
| Найдено, %: | 22.1; | 2.47; | 12.8; | 14.8. |
| Для C24H30N12O18S6Tb2 (I) | ||||
| вычислено, %: | 22.4; | 2.35; | 13.1; | 15.0. |
| С | H | N | S | |
| Найдено, %: | 22.1; | 2.55; | 12.9; | 14.7. |
| Для C24H30Gd2N12O18S6 (II) | ||||
| вычислено, %: | 22.5; | 2.36; | 13.1; | 15.0. |
| С | H | N | S | |
| Найдено, %: | 22.7; | 2.66; | 13.0; | 15.0. |
| Для C24H30N12Nd2O18S6 (III) | ||||
| вычислено, %: | 23.0; | 2.41; | 13.4; | 15.3. |
При медленном испарении фильтратов в течение 2–4 нед. образовывались соответствующие монокристаллы, которые отделяли фильтрованием и сушили на воздухе между листами фильтровальной бумаги. Интенсивность рентгеновских отражений от призматических кристаллов I–III с размерами 0.2 × 0.3 × 0.4 мм измерена при 100 K с помощью монокристального дифрактометра D8 VENTURE (Bruker AXS, MoKα-излучение). Экспериментальные поправки на поглощение введены с помощью программы SADABS [11] методом мультисканирования. Модель структуры установлена прямыми методами и уточнена с помощью комплекса программ SHELXTL [12]. Из разностных синтезов электронной плотности определены положения атомов водорода, которые затем идеализировали и уточняли в связанной с основными атомами форме. В табл. 1 приведены параметры экспериментов и результаты уточнения структур.
Таблица 1.
Параметры эксперимента и результаты уточнения структур
| Кристалл | I | II | III |
|---|---|---|---|
| Цвет | Желтый | Красный | Фиолетовый |
| Брутто-формула | C24H30N12O18S6Tb2 | C24H30Gd2N12O18S6 | C24H30N12Nd2O18S6 |
| Mr | 1284.80 | 1281.46 | 1255.44 |
| Пр. гр., Z | P2/n, 2 | P2/n, 2 | P2/n, 2 |
| a, Å | 13.9922 (4) | 14.026 (1) | 14.1330 (8) |
| b, Å | 10.0297 (3) | 10.0613 (8) | 10.1339 (6) |
| c, Å | 15.3486 (5) | 15.325 (1) | 15.3565 (8) |
| β, град | 109.981 (1) | 110.017 (2) | 110.750 (2) |
| V, Å3 | 2024.3 (1) | 2032.0 (3) | 2056.7 (2) |
| ρвыч, г/см3 | 2.108 | 2.094 | 2.027 |
| μ, мм−1 | 3.864 | 3.633 | 2.889 |
| Всего отражений | 59004 | 62552 | 62764 |
| 2θmax, град | 60.158 | 60.42 | 60.822 |
| Независимых отражений N1 (Rint) | 5935 (0.0445) | 5994 (0.0457) | 6082 (0.0410) |
| Число отражений с F > 4σ(F), N2 | 5566 | 5602 | 5562 |
| Диапазон индексов h, k, l | –19 ≤ h ≤ 15, –14 ≤ k ≤ 14, –21 ≤ l ≤ 21 |
–19 ≤ h ≤ 19, –14 ≤ k ≤ 14, –19 ≤ l ≤ 21 |
–19 ≤ h ≤ 19, –14 ≤ k ≤ 14, –21 ≤ l ≤ 21 |
| Весовая схема по F2 | w = 1/[σ2($F_{{\text{o}}}^{2}$) + + (0.0202P)2 + 4.4974P] | w = 1/[σ2($F_{{\text{o}}}^{2}$) + + (0.0301P)2 + 4.401P] | w = 1/[σ2($F_{{\text{o}}}^{2}$) + + (0.0238P)2 + 3.9105P] |
| P = max($F_{{\text{o}}}^{2}$ + 2$F_{{\text{c}}}^{2}$)/3 | |||
| Число уточняемых параметров | 299 | 299 | 299 |
| R (по N1 рефлексам) | 0.0223 | 0.0242 | 0.0255 |
| R (по N2 рефлексам) | 0.0199 | 0.0213 | 0.0217 |
| wR(F2) (по N1 рефлексам) | 0.0513 | 0.0581 | 0.0570 |
| wR(F2) (по N2 рефлексам) | 0.0502 | 0.0565 | 0.0554 |
| GOOF | 1.055 | 1.012 | 1.121 |
| Коэффициент экстинкции | Не уточнялся | Не уточнялся | Не уточнялся |
| (∆/σ)max | <0.001 | <0.001 | <0.001 |
| ∆ρmax/∆ρmin, e/Å3 | 0.529/–1.785 | 0.708/–2.043 | 0.707/–1.680 |
Экспериментальные рентгенограммы мелкокристаллических порошков I–III совпадают с теоретически рассчитанными из данных РСА для соответствующих монокристаллов, что подтверждает их фазовую идентичность. Сравнение этих рентгенограмм приведено на рис. S1 .
Структуры I–III депонированы в Кембриджском банке структурных данных (№ 1576288, 1576438 и 1576287 соответственно); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif.
Термическое разложение соединений изучено на термическом анализаторе SDT-Q600, совмещенном с FT-IR спектрометром Nicolet380 для качественного определения выделяющихся газов (cкорость воздушного потока 50 мл/мин, скорость нагревания 10 град/мин, температурный интервал 24–850°C).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
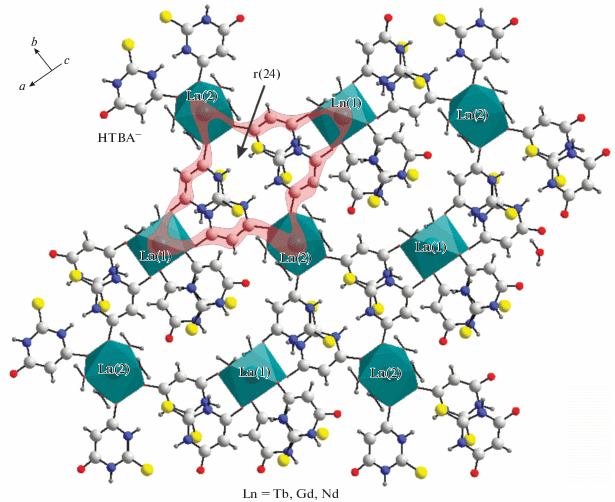
Комплексы I–III вместе с [Eu2(H2O)6(Htba)6]n [7] и [Sm2(H2O)6(Htba)6]n [10] составляют ряд изоструктурных соединений [Ln2(H2O)6(Htba)6]n. В независимой части ячеек содержатся два иона Ln3+ в частных позициях, три иона Htba– и три молекулы воды в общих позициях. Ионы Htba– связаны с катионами Ln3+ только через атомы O. Два независимых иона Ln3+ имеют разное координационное окружение (рис. 2). Полиэдры Ln(1)O8 и Ln(2)O8 – квадратные антипризмы, связанные друг с другом мостиковыми Нtba− с формированием бесконечного слоя в плоскости, перпендикулярной направлению a + c (рис. 3). В результате мостиковой O,O'-координации ионов Htba– к Ln3+ образуются 24-членные циклы. Cтроение рассматриваемых комплексов соответствует общей формуле [Ln2(H2O)6(Htba−О,O')4(Htba−О)2]n.
Рис. 3.
Строение слоя, перпендикулярного направлению a + c. Циклический фрагмент структуры выделен полосой.
Основные геометрические характеристики соединений I–III даны в Приложении (табл. S1 ). Длины связей Ln−O лежат в интервале 2.3−2.5 Å и имеют обычные значения [13]. Они, как и объемы элементарных ячеек V (табл. 1), закономерно увеличиваются при переходе от соединения I к III, что объясняется монотонным увеличением кристаллографического радиуса (r) иона Ln3+ [14]. Структуры [Sm2(H2O)6(Htba)6]n [10] и [Eu2(H2O)6(Htba)6]n [7] определены при других температурах (соответственно 296 и 300 K), поэтому зависимость V от r для комплексов [Ln2(H2O)6(Htba)6]n (Ln = Tb, Gd, Eu, Sm, Nd) оказалась немонотонной.
Геометрические параметры независимых ионов Htba– (одного концевого и двух мостиковых) во всех трех соединениях практически совпадают (табл. S1 ), например, длины связей С−О (1.257(2)–1.273(2) Å), C(4)–C(5) и C(5)–C(6) (1.389(3)–1.398(3) Å), C–S (1.678(2)–1.684(2) Å) и валентный угол C(6A)–C(5A)–C(4A) (119.8°–119.9°).
В I–III образуются двенадцать водородных связей (ВC) N−H⋅⋅⋅O, N−H⋅⋅⋅S, O−H⋅⋅⋅O и O−H⋅⋅⋅S (табл. S2 ), в которых участвуют все ионы Htba– и все молекулы воды. ВС образуют трехмерный каркас, в котором можно выделить супрамолекулярные мотивы ${\text{R}}_{{\text{2}}}^{{\text{2}}}$(8), S(6), ${\text{R}}_{{\text{2}}}^{{\text{2}}}$(28) и ${\text{R}}_{{\text{4}}}^{{\text{4}}}$(26) [15]. При помощи программы PLATON [16] определены параметры π–π-взаимодействия между ионами Htba– (табл. S3 ) типа “голова–к хвосту”.
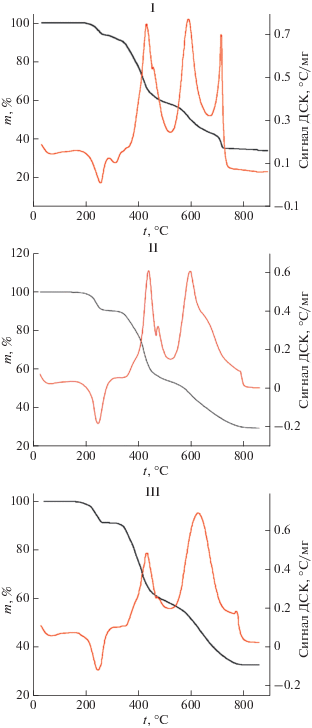
Термическое разложение I–III протекает в несколько стадий (рис. 4). На первой стадии происходит дегидратация комплексов с образованием не идентифицированных РФА кристаллических фаз. Экспериментальные потери массы веществ (Δmэксп) оказались близки к вычисленным (Δmвыч) в предположении удаления всех шести молекул Н2О (для I Δmэксп = 8.71%, Δmвыч = 8.41%; для II Δmэксп = 9.03%, Δmвыч = 8.50%; для III Δmэксп = = 8.60%, Δmвыч = 8.61%). Дегидратация сопровождается эндоэффектами на кривых ДСК (255°, 311° для I; 247° – II и 246° – III). Окисление органического лиганда в I–III начинается при ~300°C. В диапазоне 400−800°C этот процесс сопровождается двумя–тремя экзоэффектами и выделением газов Н2О, СО2, COS, NO и SO2. По данным РФА, при 800°C конечным продуктом разложения III, как и в случае термолиза [Nd(H2O)2(Htba)2(CH3COO)] ⋅ 2H2O [8], является чистый Nd2O2SO4 (Δmэксп = 33.0%, Δmвыч = 33.2%). Оксисульфаты Ln2O2SO4 обладают большой емкостью по атомам кислорода [17] и перспективны в качестве устойчивых к отравлению серой катализаторов реакции получения водорода из СО и Н2О [18]. Термическое разложение III можно рассматривать как альтернативный способ получения оксисульфата Nd(III), который, в свою очередь, может служить прекурсором для получения перспективного лазерного материала Nd2O2S [19]. Конечные продукты разложения I и II представляют смеси соответствующих оксидов и оксисульфатов. Состав промежуточных продуктов разложения соединений не изучали.
ЗАКЛЮЧЕНИЕ
При 800°С одни тиобарбитуратные комплексы переходят в оксисульфаты Ln2O2SO4 (Ln = Nd (комплекс III), Sm [10], Eu [7]), а другие (I и II) превращаются в смеси, содержащие преимущественно оксиды TbO2, Tb2O3 и Gd2O3 соответственно и относительно небольшие количества Ln2O2SO4 (Ln = Gd, Tb). Различный состав продуктов термического разложения [Ln2(H2O)6(Htba)6]n можно объяснить уменьшением энтальпий образования оксидов Ln2O3 с увеличением порядкового номера лантанида [20].
Список литературы
Heffern M.C, Matosziuk L.M., Meade T.J. // Chem. Rev. 2014. V. 114. № 8. P. 4496. https://doi.org/10.1021/cr400477t
Yang Y., Zhao Q., Feng W., Li F. // Chem. Rev. 2013. V. 113. № 1. P. 192. https://doi.org/10.1021/cr2004103
Cotton S. Lanthanide and Actinide Chemistry. UK, Uppingham, Rutland: Wiley, 2006. 263 p.
Binnemans K. // Chem. Rev. 2009. V. 109. P. 4283. https://doi.org/10.1021/cr8003983
Головнев Н.Н., Молокеев М.С. 2-Тиобарбитуровая кислота и ее комплексы с металлами: синтез, структура и свойства. Красноярск: Сиб. федер. ун-т, 2014. 252 с. [Golovnev N.N., Molokeev M.S. 2-Thiobarbituric Acid and its Complexes with Metals: Synthesis, Structure, and Properties [in Russian], Sib. Feder. Univ, Krasnoyarsk (2014).]
Машковский М.Д. Лекарственные средства: пособие для врачей. М.: РИА “Новая волна”: Издатель Умеренков, 2008. 1206 с.
Golovnev N.N., Molokeev M.S. // Russ. J. Coord. Chem. 2014. V. 40. № 9. P. 648. [Головнев Н.Н., Молокеев М.С. // Коорд. химия. 2014. Т. 40. № 9. С. 564. https://doi.org/10.7868/S0132344X14090035]https://doi.org/10.1134/S1070328414090036
Golovnev N.N., Molokeev M.S., Vereshchagin S.N., Atuchin V.V. // J. Coord. Chem. 2015. V. 68. № 11. P. 1865. https://doi.org/10.1080/00958972.2015.1031119
Golovnev N.N., Molokeev M.S., Vereshchagin S.N. // J. Struct. Chem. 2016. V. 57. № 1. P. 167. [Головнев Н.Н., Молокеев М.С., Верещагин С.Н. // Журн. структур. химии. 2016. Т. 57. № 1. С. 193. https://doi.org/10.15372/JSC20160122]https://doi.org/10.1134/S0022476616010200
Golovnev N.N., Molokeev M.S., Sterkhova I.V. et al. // J. Struct. Chem. 2017. V. 58. № 3. P. 539. [Головнев Н.Н., Молокеев М.С., Стерхова И.В. и др. // Журн. структур. химии. 2017. Т. 58. № 3. С. 584. https://doi.org/10.15372/JSC20170316]https://doi.org/10.1134/S0022476617030155
Sheldrick G.M. SADABS. Version 2.01. Madison (WI, USA): Bruker AXS Inc., 2004.
Sheldrick G.M. SHELXTL. Version 6.10. Madison (WI, USA): Bruker AXS Inc., 2004.
Cambridge Structural Database, Version 5.37. Cambridge, UK: Univ. of Cambridge, 2015.
Shannon R.D., Prewitt C.T. // Acta Crystallogr., Sect. B. 1969. V. 25. № 5. P. 925. https://doi.org/10.1107/S0567740869003220
Стид Дж.В., Этвуд Дж.Л. Супрамолекулярная химия. Ч. 1–2. / Пер. с англ. под ред. Цивадзе А.Ю., Арсланова В.В., Гарновского А.Д. М.: ИКЦ “Академкнига”, 2007. 895 с.
PLATON – A Multipurpose Crystallographic Tool. Utrecht University, Utrecht, The Netherlands. 2008.
Machida M., Kawamura K., Ito K., Ikeue K. // Chem. Mater. 2005. V. 17. № 6. P. 1487. https://doi.org/10.1021/cm0479640
Valsamakis I., Flytzani-Stephanopoulos M. // Appl. Catal. 2011. B. 106. P. 255. https://doi.org/10.1016/j.apcatb.2011.05.037
Lessard J.D., Valsamakis I., Flytzani-Stephanopoulos M. // Chem. Commun. 2012. V. 48. №. 40. P. 4857. https://doi.org/10.1039/C2CC31105D
Andreev P.O., Sal’nikova E.I., Kislitsyn A.A. // Russ. J. Phys. Chem. A. 2013. V. 87. № 9. P. 1482. [Андреев Р.О., Сальникова Е.И., Кислицын А.А. // Журн. физ. химии. А. 2013. Т. 87. № 9. С. 1499.]https://doi.org/10.1134/S0036024413080050
Хамидов Ф.А., Мирсаидов И.У., Бадалов А. // Докл. АН Республики Таджикистан. 2014. Т. 57. № 8. С. 676.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии