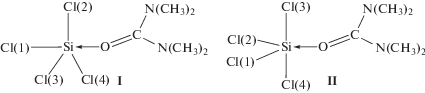Журнал неорганической химии, 2019, T. 64, № 9, стр. 975-979
Строение комплекса SiCl4←O=C[N(CH3)2]2 и перераспределение электронной плотности при его образовании по результатам расчетов ab initio
В. П. Фешин 1, *, Е. В. Фешина 1
1 Институт технической химии УрО РАН
614013 Пермь, ул. Академика Королева, 3, Россия
* E-mail: vpfeshin@mail.ru
Поступила в редакцию 21.01.2019
После доработки 05.03.2019
Принята к публикации 15.03.2019
Аннотация
Для установления строения комплекса SiCl4 с тетраметилмочевиной выполнены расчеты его возможных структур состава 1 : 1 и 1 : 2 методами RHF, B3LYP и МР2 c базисным набором 6-31G(d). Подтверждено, что этот комплекс имеет состав 1 : 1 и строение тригональной бипирамиды с необычным расположением лиганда не в аксиальном, а в экваториальном положении. При образовании комплекса происходит перенос электронной плотности с атомов водорода, карбонильного углерода и атомов азота – донора электронов – на атомы хлора – акцептора, а также на карбонильный атом кислорода и атомы углерода метильных групп самого донора электронов. Переноса ее с координационного центра донора на координационный центр акцептора не происходит.
ВВЕДЕНИЕ
Интерес к координационным соединениям элементов 14 группы не ослабевает на протяжении многих десятилетий. Их изучению посвящено большое число публикаций, например [1–11]. Образование комплекса сопровождается перераспределением электронной плотности путем ее переноса с электронодонорного фрагмента молекулы на электроноакцепторный, а также поляризацией связей внутри этих фрагментов [1, 2]. Это перераспределение можно оценить количественно, проанализировав изменения зарядов атомов, полученных в результате квантово-химических расчетов системы, и сопоставив их с результатами расчетов исходных компонентов. Изменения зарядов атомов при образовании комплексов проанализированы нами в целом ряде систем, в том числе и при образовании комплекса SiCl4 c тетраметилмочевиной [1, 2, 12]. Однако при расчете комплекса Сl4Si←O=C[N(CH3)2]2 мы принимали фрагмент Cl–Si←О=С линейным [2, 12]. Для этого, как рекомендуется при расчетах линейных фрагментов [13], вводили мнимый атом Х, связанный с атомом О карбонильной группы, углы ХOSi и С(1)ОХ принимали равными 90°, двугранный угол ХОSiCl(2) = 0°, а угол С(1)ОХSi = 180°.
Как показали наши дальнейшие исследования, карбонильная группа не находится на одной прямой с аксиальной связью Cl–Si, поскольку в образовании координационной связи Si←O участвует одна из двух неподеленных пар электронов карбонильного атома кислорода (p- или sp-гибридизованная) [14]. Поэтому для изучения перераспределения электронной плотности при образовании этого комплекса и подтверждения его строения необходимо выполнить квантово-химический расчет корректно, с полной оптимизацией геометрии молекулы, не используя мнимый атом Х.
На основании спектра ядерного квадрупольного резонанса (ЯКР) на ядрах 35Сl комплекса SiCl4 c тетраметилмочевиной мы полагали, что этот комплекс имеет необычное тригонально-бипирамидальное строение, при котором лиганд занимает не аксиальное, как в других подобных комплексах, а экваториальное положение тригональной бипирамиды [15].
Спектр ЯКР 35Сl этого комплекса состоит из двух значительно удаленных друг от друга дублетов. Высокочастотный дублет (21.653 и 21.155 МГц) отнесен к двум экваториальным атомам хлора, а низкочастотный (18.448 и 17.343 МГц) – к двум аксиальным. С таким строением комплекса Сl4Si←O=C[N(CH3)2]2 согласуются и параметры асимметрии градиента электрического поля (ГЭП) на ядрах 35Cl: высокочастотному дублету соответствуют большие величины параметров асимметрии (43.1 ± 4.1 и 38.8 ± 2.6%), характерные для экваториальных атомов хлора, а низкочастотному – незначительные (7.5 ± 2.0 и 1.7 ± ± 0.5%) [16].
Поскольку линии в спектре ЯКР 35Сl системы Сl4Si←O=C[N(CH3)2]2 состава 1 : 2 значительно интенсивней, чем состава 1 : 1, можно полагать, что SiCl4 c O=C[N(CH3)2]2 образует также комплекс состава 1 : 2 цис-октаэдрического строения, в котором два атома хлора занимают аксиальные положения, а два других – экваториальные [1, 2, 15]. Экспериментальные частоты ЯКР 35Cl и параметры асимметрии ГЭП на ядрах 35Cl этого комплекса не противоречат такому строению.
Для уточнения строения комплекса SiCl4 c O=C[N(CH3)2]2 и изучения перераспределения электронной плотности при его образовании мы выполнили неэмпирические расчеты этого комплекса тригонально-бипирамидального (состав 1 : 1) и цис-октаэдрического строения (состав 1 : 2) несколькими методами с полной оптимизацией геометрии молекул, а также расчеты методом МР2/6-31G(d) его исходных компонентов. Корректность установления строения контролировали по экспериментальным спектрам ЯКР 35Сl.
РАСЧЕТНАЯ ЧАСТЬ
Все расчеты выполнены по программе GAUSSIAN 03W [17] ограниченным методом Хартри–Фока (RHF), методом Хартри–Фока с учетом корреляции электронов по методу Меллера–Плессета второго порядка (МР2), а также методом функционала плотности (B3LYP) с полной оптимизацией геометрии молекул без использования мнимого атома Х. Все расчеты выполнены с базисным набором 6-31G(d) без ограничений по симметрии. Структура II рассчитана также методом RHF/6-31 + G(d,p). Оптимизированные структуры соответствуют минимуму на поверхности потенциальной энергии, поскольку мнимые частоты валентных колебаний отсутствуют. Результаты расчетов использованы для оценки частот ЯКР и параметров асимметрии ГЭП на ядрах 35Сl. При расчетах начало системы координат помещали в место расположения ядра атома хлора, параметры ЯКР которого намерены оценить. Во всех случаях ось z системы координат совпадает с соответствующей связью Cl–Si. Рассчитанные параметры ЯКР 35Сl сопоставлены с имеющимися экспериментальными данными.
Частоты ЯКР (ν) и параметры асимметрии ГЭП (η) на ядрах 35Сl рассчитывали по уравнениям (1) и (2) соответственно [18], в которых использовали не полные заселенности валентных p‑орбиталей атомов хлора (Npx, Npy и Npz), а лишь их менее диффузных 3p-составляющих (N3px, N3py и N3pz), полученные в результате квантово-химических и DFT-расчетов. Расчеты по этой методике приводят к удовлетворительному соответствию между экспериментальными и вычисленными параметрами ЯКР различных хлорсодержащих органических и элементоорганических соединений [1, 19, 20].
(1)
$\begin{gathered} \nu = {{({{e}^{2}}Q{{q}_{{ат}}}} \mathord{\left/ {\vphantom {{({{e}^{2}}Q{{q}_{{ат}}}} {2}}} \right. \kern-0em} {2}})[--N3{{p}_{z}} + \\ + \,\,{{(N3{{p}_{x}} + N3{{p}_{y}})} \mathord{\left/ {\vphantom {{(N3{{p}_{x}} + N3{{p}_{y}})} 2}} \right. \kern-0em} 2}]{{({{1{\text{ }} + {{\eta }^{2}}} \mathord{\left/ {\vphantom {{1{\text{ }} + {{\eta }^{2}}} 3}} \right. \kern-0em} 3})}^{{1/2}}}, \\ \end{gathered} $(2)
$\eta = \left| {{{3(N3{{p}_{x}}--N3{{p}_{y}})} \mathord{\left/ {\vphantom {{3(N3{{p}_{x}}--N3{{p}_{y}})} {(2N3{{p}_{z}}--N3{{p}_{x}}--N3{{p}_{y}})}}} \right. \kern-0em} {(2N3{{p}_{z}}--N3{{p}_{x}}--N3{{p}_{y}})}}} \right|,$РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты расчета методом RHF/6-31G(d) системы Сl4Si←O=C[N(CH3)2]2 тригонально-бипирамидального строения (I) с лигандом в аксиальном положении тригональной бипирамиды с полной оптимизацией геометрии молекулы практически не отличаются от полученных ранее [1, 12] при использовании мнимого атома Х. Например, при этих расчетах расстояние Si…O остается таким же (табл. 1), близким к сумме ван-деp-ваальсовых радиусов атомов Si и O [21] и свидетельствующим об отсутствии комплексообразования. По заселенностям 3p-составляющих валентных p-орбиталей атомов хлора и уравнениям (1) и (2) мы оценили частоты ЯКР 35Сl и параметры асимметрии ГЭП на ядрах 35Сl атомов хлора в наиболее длинной и наиболее короткой связях. Частоты ЯКР оказались близки между собой, а параметры асимметрии ГЭП близки или равны нулю (табл. 2). Такие параметры ЯКР не соответствуют экспериментальным данным.
Таблица 1.
Длины связей Si–Cl, Si←O (Å) и угол SiOC (град) в структурах I–III, рассчитанных методами RH-F/6‑31G(d), МР2/6-31G(d) и B3LYP /6-31G(d)
| Связь, угол | I | II | III | ||||
|---|---|---|---|---|---|---|---|
| RHF | MP2 | RHF | MP2 | B3LYP | RHF | B3LYP | |
| Si–Cl(1) Si–Cl(2) Si–Cl(3) Si–Cl(4) Si←O |
2.041 2.027 2.027 2.029 3.548 |
2.040 2.033 2.023 2.024 3.297 |
2.075 2.083 2.261 2.161 1.750 |
2.076 2.088 2.234 2.144 1.790 |
2.098 2.113 2.268 2.175 1.790 |
2.145 2.160 2.207 2.169 1.88; 2,02 |
2.164 2.184 2.242 2.198 1.90; 2.03 |
| SiOC | 162.52 | 121.79 | 138.14 | 129.39 | 133.86 | 155.9; 138.0 | 149.4; 135.6 |
Таблица 2.
Заселенности 3p-составляющих валентных p-орбиталей атомов хлора (N3p) в структуре I, рассчитанной методами RHF/6-31G(d) и МР2/6-31G(d), вычисленные по ним частоты ЯКР 35Сl (νв) и параметры асимметрии (ηв) ГЭП на ядрах 35Сl
| Метод | Атом | N3px, e | N3py, e | N3pz, e | νв, МГц | ηв, % |
|---|---|---|---|---|---|---|
| RHF |
Cl(1) Cl(2) |
1.279 1.288 |
1.279 1.277 |
1.055 1.050 |
20.853 21.646 |
0.0 2.37 |
| MP2 | Cl(1) Cl(2) |
1.279 1.288 |
1.279 1.275 |
1.056 1.053 |
20.433 20.962 |
0.0 8.53 |
Согласно результатам расчета методом RHF/6-31G(d) системы Cl4Ge←O=C[N(CH3)2]2 такого же строения расстояние Ge…O также близко к сумме ван-деp-ваальсовых радиусов атомов Ge и O, а параметры ЯКР 35Сl, вычисленные по результатам этих расчетов, существенно отличаются от экспериментальных. Однако при расчете этой системы методом МР2/6-31G(d) получено значительно меньшее расстояние Ge…O, а вычисленные по этим результатам параметры ЯКР 35Сl близки к экспериментальным [22]. Поэтому можно полагать, что расчет системы Сl4Si←O=C[N(CH3)2]2 методом МР2/6-31G(d) также может привести к удовлетворительному соответствию с экспериментальными данными. Мы выполнили эти расчеты. К сожалению, расстояние Si…O оказалось лишь незначительно меньше (табл. 1), чем при расчете методом RHF/6-31G(d), а вычисленные по результатам этих расчетов параметры ЯКР 35Сl значительно отличаются от экспериментальных (табл. 2). Длины связей Si–Cl в структуре I, рассчитанные методами RHF/6-31G(d) и МР2/6-31G(d), различаются незначительно, тогда как углы SiOC – существенно.
По-видимому, комплекс Сl4Si←O=C[N(CH3)2]2, как мы полагали ранее [1, 2, 12], все же имеет необычное тригонально-бипирамидальное строение, при котором лиганд занимает одно из экваториальных положений бипирамиды II. Расчет такой структуры методами RHF/6-31G(d), МР2/6-31G(d) и B3LYP /6-31G(d) привел к несколько различающимся результатам. Однако соотношение длин связей Si–Cl, рассчитанных этими методами, одинаково: две наиболее короткие связи Si–Cl и две заметно различающиеся длинные. Длина координационной связи Si←O, по результатам расчетов этими тремя методами, практически одинакова, так же как и углы SiOC. Соотношение частот ЯКР 35Сl и параметров асимметрии ГЭП на ядрах 35Сl, вычисленных по заселенностям 3p-составляющих валентных p-орбиталей атомов хлора, полученных из расчетов этими тремя методами и по уравнениям (1) и (2) (табл. 3), соответствует экспериментальным: две высокочастотные линии с небольшим расщеплением, принадлежащие экваториальным атомам хлора, и две низкочастотные со значительным расщеплением, принадлежащие аксиальным атомам хлора. Первым соответствуют большие значения параметров асимметрии, вторым – малые (табл. 3). Наиболее близки к экспериментальным частоты ЯКР, вычисленные по результатам расчетов структуры II методом МР2/6-31G(d). При этом существенно ниже экспериментальной оказалась частота ЯКР аксиального атома Cl(3). Частота ЯКР аксиального атома Cl(4), вычисленная по результатам расчетов структуры II методом B3LYP/6-31G(d), существенно выше экспериментальной, тогда как частоты трех других атомов хлора также близки к экспериментальным. Расчет структуры II методом RHF/6-31G(d) привел к заметному отличию от экспериментальной не только частоты аксиального атома хлора, но и одного из экваториальных. Кроме особенностей расчетных методов некоторое несоответствие между вычисленными и экспериментальными параметрами ЯКР 35Сl для комплекса Сl4Si←O=C[N(CH3)2]2 может быть обусловлено тем, что экспериментальные данные получены для кристаллического вещества при 77 K, а расчеты выполнены для индивидуальной молекулы комплекса в стандартных условиях.
Таблица 3.
Заселенности 3p-составляющих валентных p-орбиталей атомов хлора (N3p) в структуре II, рассчитанной методами RHF/6-31G(d), МР2/6-31G(d) и B3LYP/6-31G(d), а также атома Cl(3) в этой структуре, рассчитанной методом RHF/6-31 + G(d,p), вычисленные по ним частоты ЯКР 35Сl (νв) и параметры асимметрии (ηв) ГЭП на ядрах 35Сl
| Метод | Атом | N3px, e | N3py, e | N3pz, e | νв, МГц | ηв, % |
|---|---|---|---|---|---|---|
| RHF |
Cl(1) Cl(2) Cl(3) Cl(4) |
1.307 1.309 1.258 1.271 |
1.255 1.252 1.253 1.266 |
1.047 1.046 1.087 1.067 |
22.183 22.309 15.631 18.763 |
33.33 36.46 4.45 3.72 |
| RHF | Cl(3) | 1.260 | 1.256 | 1.090 | 15.428 | 3.57 |
| MP2 | Cl(1) Cl(2) Cl(3) Cl(4) |
1.305 1.308 1.262 1.274 |
1.256 1.251 1.257 1.267 |
1.049 1.046 1.089 1.067 |
21.565 21.867 15.627 18.654 |
31.75 36.62 4.40 5.16 |
B3LYP |
Cl(1) Cl(2) Cl(3) Cl(4) |
1.317 1.319 1.275 1.287 |
1.267 1.262 1.268 1.278 |
1.056 1.054 1.085 1.069 |
22.328 22.007 17.364 19.881 |
31.78 36.15 5.63 6.32 |
Молекула комплекса Сl4Si←O=C[N(CH3)2]2 содержит атомы с неподеленными парами электронов. Согласно [3], при расчете таких систем необходимо использовать базисные наборы с диффузными функциями. Поскольку в молекуле комплекса содержится большое количество атомов водорода, рекомендуется также использовать поляризованный базисный набор, дополненный p-функциями атомов водорода [13]. Чтобы проверить, насколько эти поправки изменят полученные нами результаты расчетов, мы выполнили расчет структуры II методом RHF с базисным набором 6-31 + G(d,p), содержащим такие функции (табл. 3). При этом начало системы координат поместили в место расположения ядра аксиального атома Cl(3), для которого, по результатам расчетов методами RHF/6-31G(d) и МР2/6-31G(d), получена частота ЯКР 35Сl, существенно отличающаяся от экспериментальной. Как видно из табл. 3, учет этих поправок не приводит к существенным изменениям ни частоты ЯКР, ни параметра асимметрии ГЭП. Поэтому дальнейшие расчеты с таким базисным набором мы не выполняли.
Согласно расчетам комплекса Сl4Si←O=C[N(CH3)2]2 методом МР2/6-31G(d), полная энергия комплекса структуры II на 7.2 ккал/моль выше, чем структуры I. Это подтверждает сделанный ранее вывод [1, 2] о том, что комплексы соединений элементов 14 группы зачастую не имеют энергетически наиболее выгодной формы. Для их образования необходимо некоторое повышение полной энергии молекулы. Возможно, предпочтительное образование структуры II, а не структуры I обусловлено тем, что в структуре II частичный отрицательный заряд атома кислорода и положительный заряд атома кремния выше (–0.760 и 1.245 е по результатам расчетов методом МР2/6-31G(d)), чем в структуре I (–0.671 и 0.983 е).
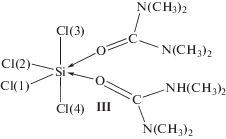
Соотношение частот ЯКР 35Сl и параметров асимметрии ГЭП на ядрах 35Сl, установленное экспериментально для комплекса SiCl4 c тетраметилмочевиной, может соответствовать также структуре III цис-октаэдрического строения, тем более что интенсивность линий в спектре ЯКР 35Сl образца состава 1 : 2, как уже отмечалось, выше, чем состава 1 : 1.
Для проверки этого предположения мы выполнили расчет такой структуры методами RHF/6-31G(d) и B3LYP /6-31G(d). Связь Cl(3)–Si оказалась несколько длиннее трех других, довольно близких между собой. По заселенностям 3p-составляющих валентных p-орбиталей атомов хлора и уравнениям (1) и (2) оценили частоты ЯКР 35Сl и параметры асимметрии ГЭП на ядрах 35Сl соответственно (табл. 4). По результатам расчетов методом B3LYP/6-31G(d) оценили параметры ЯКР 35Сl только двух атомов хлора наиболее короткой и наиболее длинной связей Cl–Si. Частоты ЯКР, вычисленные по результатам расчетов обоими методами, находятся в том же диапазоне, что и экспериментальный спектр ЯКР, однако они близки между собой, как и параметры асимметрии, что не соответствует экспериментальным данным. По-видимому, более высокая интенсивность линий в спектре ЯКР 35Сl образца состава 1 : 2, чем 1 : 1, может быть обусловлена большей упорядоченностью его кристаллической структуры.
Таблица 4.
Заселенности 3p-составляющих валентных p-орбиталей атомов хлора (N3p) в структуре III, рассчитанной методами RHF/6-31G(d) и B3LYP/6-31G(d), вычисленные по ним частоты ЯКР 35Сl (νв) и параметры асимметрии (ηв) ГЭП на ядрах 35Сl
| Метод | Атом | N3px, e | N3py, e | N3pz, e | νв, МГц | ηв, % |
|---|---|---|---|---|---|---|
| RHF | Cl(1) Cl(2) Cl(3) Cl(4) |
1.274 1.277 1.265 1.273 |
1.277 1.269 1.268 1.270 |
1.056 1.062 1.072 1.066 |
20.434 19.653 18.108 19.132 |
2.05 5.69 2.31 2.19 |
| B3LYP | Cl(1) Cl(3) |
1.288 1.279 |
1.290 1.279 |
1.059 1.077 |
21.404 18.798 |
1.3 0.0 |
Таким образом, результаты выполненных расчетов различными методами показывают, что экспериментальным данным ЯКР наиболее соответствует структура II комплекса Сl4Si←O=C[N(CH3)2]2, что подтверждает сделанные ранее выводы [1, 2, 12] о необычной структуре этого соединения. При этом наилучшее соответствие с экспериментальными данными ЯКР 35Сl получено при расчете этого комплекса методом МР2/6-31G(d). Полученные данные показывают также, что корректность квантово-химических и DFT расчетов необходимо контролировать по экспериментальным данным, поскольку результаты расчетов различными методами могут заметно различаться между собой.
Для количественного анализа перераспределения электронной плотности при образовании комплекса Сl4Si←O=C[N(CH3)2]2 необычной структуры II нами выполнены также квантово-химические расчеты его исходных компонентов методом МР2/6-31G(d). В табл. 5 представлены малликеновские заряды атомов в этом комплексе и его исходных компонентах. При образовании комплекса возрастают частичные отрицательные заряды атомов хлора (на 0.637 е), особенно аксиальных, а также положительный заряд атома кремния по сравнению с соответствующими атомами в исходных компонентах. При этом частичные отрицательные заряды атомов хлора возрастают не только за счет перенесенного заряда с донора электронов (–0.32 е), но и за счет поляризации связей Si–Cl, в результате которой электронная плотность с атома кремния переходит на атомы хлора (0.316 е). При образовании комплекса в молекуле донора электронов уменьшается электронная плотность атомов водорода, карбонильного углерода и атомов азота (на 0.526 е). Она перераспределяется между акцептором электронов (–0.32 е), атомом кислорода и атомами углерода метильных групп донора электронов (–0.206 е).
Таблица 5.
Малликеновские заряды (q) атомов в структуре II и в исходных компонентах комплекса (qкомп), рассчитанных методом МР2/6-31G(d), а также изменение их в структуре II (Δq) по сравнению с исходными компонентами
| Атомы | q, е | qкомп, е | Δq, е |
|---|---|---|---|
| 2Clакс 2Clэкв Si O Cкарб 2N 4C 12H |
–0.954 –0.613 1.245 –0.760 1.070 –1.264 –1.262 2.536 |
–0.465 –0.465 0.929 –0.646 0.982 –1.320 –1.170 2.154 |
–0.489 –0.148 0.316 –0.114 0.088 –0.056 –0.092 0.382 |
Таким образом, при образовании комплекса Сl4Si←O=C[N(CH3)2]2 (структура II) происходит перераспределение электронной плотности с атомов водорода, карбонильного углерода и атомов азота – донора электронов на атомы хлора – акцептора электронов, а также на карбонильный атом кислорода и атомы углерода метильных групп самого донора электронов. Переноса электронной плотности с координационного центра донора электронов на координационный центр акцептора электронов не происходит. Эти центры служат проводниками электронной плотности в основном с периферийных атомов водорода донора электронов на атомы хлора – акцептора.
Список литературы
Фешин В. Природа координационной связи в соединениях элементов 14 группы. Саарбрюккен: LAMBERT Academic Publishing, 2018. 124 с.
Фешин В.П. Проблемы координационных соединений элементов IVA группы по данным ЯКР и квантовой химии. Пермь: УрО РАН, 2015. 366 с.
Korlyukov A.A. // Russ. Chem. Rev. 2015. V. 84. № 4. P. 422. https://doi.org/10.1070/RCR4466
Nikolin A.A., Negrebecky V.V. // Russ. Chem. Rev. 2014. V. 83. № 9. P. 848. https://doi.org/10.1070/RC2014v083n09ABEH004385
Кравченко Э.А., Кузнецов Н.Т., Новоторцев В.М. Ядерный квадрупольный резонанс в координационной химии. М.: Красанд, 2013. 260 с.
Puri J.K., Singh R., Chahal V.K. // Chem. Soc. Rev. 2011. V. 40. № 3. P. 1791.
Negrebecky V.V., Tandura S.N., Baukov Yu.I. // Russ. Chem. Rev. 2009. V. 78. № 1. P. 24. https://doi.org/10.1070/RC2009v078n01ABEH003888
Trofimov A.B., Zakrzewsky V.G., Dolgounitcheva O. et al. // J. Am. Chem. Soc. 2005. V. 27. № 3. P. 986.
Kravchenko E.A., Buslaev Yu.A. // Russ. Chem. Rev. 1999. V. 68. № 9. P. 787. https://doi.org/10.1070/RC1999v068n09ABEH000497
Feshin V.P. // Main Group Met. Chem. 1993. V. 16. № 6. P. 377.
Feshin V.P., Polygalova G.A. // J. Organomet. Chem. 1991. V. 409. P. 1.
Feshin V.P., Feshina E.V. // Russ. J. Gen. Chem. 2007. V. 77. № 5. P. 792. [Фешин В.П., Фешина Е.В. // Журн. общей химии. 2007. Т. 77. Вып. 5. С. 792.]
Foresman J.B., Frisch A.E. // Exploring Chemistry with Electronic Structure Methods. Second Edition. Pittsbourgh: Gaussian Inc., 1996. 302 p.
Яновская Л.А. Современные теоретические основы органической химии. М.: Химия, 1978. 358 с.
Feshin V.P., Dolgushin G.V., Lazarev I.M. et al. // The Proc. of the USSR Academy of Sciences. 1987. V. 295. № 6. P. 1415. [Фешин В.П., Долгушин Г.В., Лазарев И.М. и др. // Докл. АН СССР. 1987. Т. 295. № 6. С. 1415.]
Buslaev Yu.A., Kravchenko E.A., Morgunov E.G. et al. // The Proc. of the USSR Academy of Sciences. 1988. V. 301. № 6. P. 1407. [Буслаев Ю.А., Кравченко Э.А., Моргунов В.Г. и др. // Докл. АН СССР. 1988. Т. 301. № 6. С. 1408.]
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 03W. Revision D.1. Gaussian, Inc. Wallingford. CT. 2005.
Das T.P., Hahn E.L. Nuclear Quadrupole Resonance Spectroscopy. N.Y.: Acad. Press, 1958. 223 p.
Feshin V.P., Feshina E.V. // Z. Naturforsch. A. 2000. Bd. 55. № 2. S. 555.
Фешин В.П. Геминальное взаимодействие в органической и элементоорганической химии. Екатеринбург: УрО РАН, 2009. 265 с.
Бацанов С.С. // Изв. АН. Сер. хим. 1995. № 1. С. 24.
Feshin V.P., Feshina E.V. // Russ. J. Inorg. Chem. 2019. V. 64. № 5. P. 624. [Фешин В.П., Фешина Е.В. // Журн. неорган. химии. 2019. Т. 64. № 5. С. 510.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии