Журнал неорганической химии, 2019, T. 64, № 9, стр. 988-990
Исследование системы AgGaS2–PbS и некоторые свойства фаз переменного состава
С. К. Джахангирова 1, Ш. Г. Мамедов 2, *, Д. С. Аждарова 2, О. М. Алиев 2, Г. Р. Курбанов 3
1 Азербайджанский государственный педагогический университет
AZ1000 Баку, пр-т Г. Гаджибекли, 68, Азербайджан
2 Институт катализа и неорганический химии им. М. Нагиева НАН Азербайджана
Az1143 Баку, пр-т Г. Джавида, 113, Азербайджан
3 Азербайджанский государственный университет нефти и промышленности
AZ1010 Баку, пр-т Азадлыг, 20, Азербайджан
* E-mail: azxim@mail.ru
Поступила в редакцию 28.09.2018
После доработки 14.02.2019
Принята к публикации 15.03.2019
Аннотация
Методами физико-химического анализа (дифференциального термического, рентгенофазового и металлографического) изучен квазибинарный разрез AgGaS2–PbS в тройной системе Ag2S–Ga2S3–PbS. Построена диаграмма состояния системы и установлено образование четверного соединения состава AgPb2GaS4, образующегося по перитектической реакции при 1225 K. Определены условия образования и изучены его физико-химические свойства. Установлено, что соединение AgPb2GaS4 кристаллизуется в орторомбической сингонии с параметрами кристаллической решетки: а = 8.20, b = 6.84, с = 6.62 Å, пр. гр. Рmn21. По данным физико-химического анализа установлено образование узких областей твердых растворов на основе исходных компонентов.
ВВЕДЕНИЕ
Интерес к изучению систем, содержащих сульфиды серебра и свинца, обусловлен прежде всего возможностями их практического использования при изготовлении солнечных батарей, фотодиодов, люминофоров и др. [1–9].
Исходные компоненты, составляющие четверную систему AgGaS2–PbS, подробно изучены в [10–19]. Наряду с Ag9GaS6 и Ag2Ga20S31 соединение AgGaS2 установлено при исследовании двойной системы Ag2S–Ga2S3 [13, 20, 21]. Соединение Ag2Ga20S31 образуется по перитектической реакции при 1268 K, а AgGaS2 и Ag9GaS6 плавятся конгруэнтно при 1270 и 1063 K соответственно. Соединение AgGaS2 кристаллизуется в структурном типе халькопирита (а = 5.7544, с = 10.299 Å, пр. гр. I42d) [14] и является полупроводником р‑типа проводимости с шириной запрещенный зоны (ΔЕ) 2.75 эВ [22]. Соединение PbS, плавящееся конгруэнтно при 1400 K [23], встречается в природе в виде минерала галенита, являющегося одним из наиболее распространенных свинцовых минералов. Синтез PbS осуществляют различными методами [15, 24]. В работе [24] отмечена возможность выращивания монокристалла PbS размером до 2 мм высокой чистоты в силикагелях при обычных температурах. Полупроводник PbS с шириной запрещенной зоны 0.42 эВ [23, 25] кристаллизуется в кубической решетке (пр. гр. Fm3m) с параметром а = 5.935 Å [5]. Структура PbS состоит из сплошных стенок октаэдров с КЧ = 6. На основании данных магнитных измерений высказано предположение о преимущественно ковалентном характере связи PbS [23, 25]. Для получения материалов с полифункциональными свойствами изучение системы AgGaS2–PbS имеет большое значение.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы для исследования системы AgGaS2–PbS синтезировали из лигатур Ag2S, Ga2S3 и PbS при 1250–1400 K в откачанных кварцевых ампулах. Лигатуры получали из особо чистых элементов: серебра “16”, галлия “Гл-ООО”, серы “17-3”, свинца “В4”. При максимальной температуре образцы выдерживали в течение 1 ч, затем температуру медленно (со скоростью 40 град/ч) снижали до 1100 K и в этом режиме гомогенизировали в течение 2 нед, что обеспечивало однородность слитков.
Отожженные сплавы системы AgGaS2–PbS исследовали методами дифференциального термического (ДТА-НТР-93, хромель-алюмелевая термопара, скорость нагревания 10 град/мин, эталон – прокаленный Al2O3), рентгенофазового (РФА-Д2 Рhaser, CuKα-излучение, Ni-фильтр), микроструктурного (микроскоп МИМ-7) анализа и измерением микротвердости (РМТ-3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
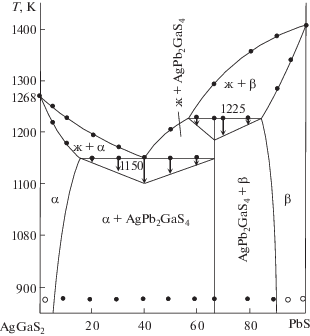
Построенная на основании данных физико-химического анализа диаграмма состояния системы AgGaS2–PbS приведена на рис. 1. Система является квазибинарной и характеризуется образованием (при соотношении компонентов 1 : 2) четверного соединения AgPb2GaS4 по перитектической реакции: ж + β(PbS) = AgPb2GaS4 при 1225 K. Соединение AgPb2GaS4 образует эвтектику с тиогаллатом серебра; координаты эвтектической точки: 40 мол. % PbS и Т = 1150 K. Растворимость на основе тройного соединения AgGaS2 составляет 5 мол. % PbS, а на основе сульфида свинца область гомогенности простирается до 10 мол. %.
Ликвидус системы AgGaS2–PbS состоит из трех ветвей первичной кристаллизации фаз: α (твердый раствоp на основе AgGaS2), AgPb2GaS4 и β (твердый pаствоp на основе сульфида свинца). Для идентификации соединения AgPb2GaS4 методом ДТА был выбран температурный режим отжига (1175 K), при котором сплавы с содержанием 60–90 мол. % PbS выдерживали в течение 300 ч, а затем вновь исследовали методами ДТА и РФА.
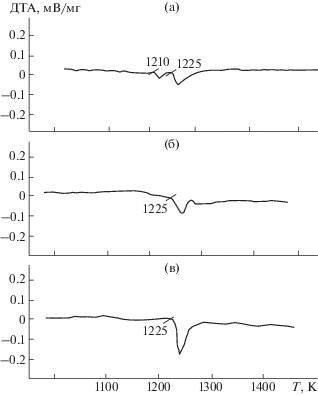
Повторное исследование с помощью ДТА и РФА показало, что термограмма сплава, содержащего 66.67 мол. % PbS, после термической обработки значительно отличается от термограммы неотожженного образца (рис. 2б). Интенсивность низкотемпературных эндоэффектов значительно уменьшилась, а площади высокотемпературных пиков, наоборот, увеличились. С другой стороны, на порошковых рентгенограммах этих сплавов присутствие других фаз указывает на незавершенность синтеза. Поэтому для ускорения взаимодействия на межфазных границах литые образцы были перетерты в порошок в агатовой ступке, тщательно перемешаны, запрессованы в таблетки и отожжены при 1200 K в течение 1100 ч. Результаты ДТА и РФА этих образцов свидетельствуют об их однофазности (рис. 2в).
Рис. 2.
Термограмма сплава, содержащего 66.67 мол. % PbS: а – после отжига при 1175 К в течение 300 ч, б – после отжига при 1175 К в течение 400 ч, в – после отжига при 1200 К в течение 1100 ч.
Измерение микротвердости сплавов системы AgGaS2–PbS показало, что в зависимости от состава наблюдаются три набора значений микротвердости: 3650–3660, 2350–2540 и 720–800 МПа, относящихся к α-твердым растворам на основе AgGaS2, четверному соединению AgPb2GaS4 и β-твердым растворам на основе сульфида свинца.
Результаты РФА подтвердили образование в системе AgGaS2–PbS четверного соединения состава AgPb2GaS4 (табл. 1).
Таблица 1.
Расчет рентгенограмм соединения AgPb2GaS4
| dэксп, Å | I, % | 1/d2экcп, Å | 1/d2выч, Å | hkl |
|---|---|---|---|---|
| 5.01814 | 1.5 | 0.039714 | 0.03798 | 101 |
| 3.42273 | 32 | 0.0851 | 0.0831 | 020 |
| 3.19092 | 23.6 | 0.0982 | 0.10306 | 211, 201 |
| 2.9000 | 100 | 0.1187 | 0.1120 | 012 |
| 2.87704 | 2.0 | 0.1208 | 0.1207 | 121 |
| 2.49627 | 1.0 | 0.1605 | 0.1653 | 311 |
| 2.09748 | 21.8 | 0.2274 | 0.22596 | 013 |
| 2.03436 | 3.0 | 0.2417 | 0.2408 | 113 |
| 1.91816 | 5.0 | 0.2718 | 0.27807 | 032 |
| 1.78913 | 13.6 | 0.3124 | 0.3082 | 322 |
| 1.71435 | 7.3 | 0.3404 | 0.3435 | 421, 331 |
| 1.58185 | 1.0 | 0.3496 | 0.39276 | 510, 114 |
| 1.48322 | 8.0 | 0.4547 | 0.4550 | 520 |
| 1.38150 | 2.0 | 0.5236 | 0.5259 | 333, 050 |
| 1.32704 | 6.3 | 0.5679 | 0.5700 | 003 |
| 1.24865 | 1.0 | 0.6421 | 0.6477 | 612 |
| 1.21139 | 3.0 | 0.6819 | 0.6855 | 334 |
При сравнении рентгенограммы сплава состава 2 : 1 (AgPb2GaS4) с рентгенограммами исходных сульфидов (PbS, AgGaS2) видно, что на рентгенограмме AgPb2GaS4 появляется ряд дифракционных линий, подтверждающих образование в системе AgGaS2–PbS новой фазы.
Расчет рентгенограмм соединения AgPb2GaS4 показывает, что оно изоструктурно с соединением AgCd2GaS4 и кристаллизуется в орторомбической сингонии с параметрами решетки: а = 8.20, b = 6.84, с = 6.62 Å, пр. гр. Pmn21.
Таким образом, впервые изучена и построена T–х диаграмма состояния разреза AgGaS2–PbS в квазитройной системе Ag2S–Ga2S3–PbS. Установлено образование четверного соединения состава AgPb2GaS4, образующегося по перитектической реакции при 1225 K и кристаллизующегося в орторомбической сингонии.
ЗАКЛЮЧЕНИЕ
1. Методами физико-химического анализа построена Т–х диаграмма системы AgGaS2–PbS. Установлено, что при соотношении AgGaS2 : PbS = = 1 : 2 по перитектической реакции образуется четверное соединение состава AgPb2GaS4.
2. Четверное соединение AgPb2GaS4 кристаллизуется в орторомбической сингонии с параметрами а = 8.20, b = 6.84, с = 6.62 Å.
Список литературы
Zhao Beijun, Zhu Shifu, Li Zhenghui et al. // Chin. Sci. Bull. 2001. V. 46. № 23. P. 2009.
Chemla D.S., Kapacek P.J., Robertson D.S. et al. // Opt. Commun. 1991. V. 3. № 1. P. 29.
Noblanc J.P., Loudette J., Duraffourg G. et al. // Appl. Phys. Lett. 1972. V. 20. № 7. P. 257.
Горюнова Н.А. Сложные алмазоподобные полупроводники. М.: Сов. радио, 1968. 215 с.
Абрикосов Н.Х., Шелимова Л.Е. Полупроводниковые материалы на основе соединений АIVBVI. М.: Наука, 1975. 195 с.
Kushwaha A.K., Khenata R., Bouhemadou A. et al. // J. Electron. Mater. 2017. V. 46. № 7. P. 4109. https://doi.org/10.1007/s11664-017-5290-6
Uematsu Taro., Doi Toshihiro, Torimoto Tsukasa et al. // J. Phys. Chem. Lett. 2010. V. 1. № 22. P. 3283. https://doi.org/10.1021/jz101295w
Karaagac H., Parlak M. // J. Solid Films. 2011. V. 519. № 7. P. 2055.https://doi.org/10.1016/j.tsf.2010.10.027
Karunagaran N., Ramasamy P. // Mater. Sci. Semicond. Process. 2016. V. 41. P. 54. https://doi.org/10.1016/j.mssp.2015.08.012
Baojun Chen, Shifu Zhu, Beijun Zhao et al. // J. Cryst. Growth. 2008. V. 310. № 3. P. 635. https://doi.org/10.1016/j.jcrysgro.2007.10.067
Sinyakova E.F., Kosyakov V.I., Kokh K.A. // Inorg. Mater. 2009. V. 45. № 11. P. 1217. [Синякова Е.Ф., Косяков В.И., Кох К.А. // Неорган. материалы. 2009. Т. 45. № 11. С. 1298.]https://doi.org/10.1134/S0020168509110041
Chykhrij S.I., Parasyuk O.V., Halka V.O. // J. Alloys Compd. 2000. V. 312. № 1–2. P. 189. https://doi.org/10.1016/S0925-8388(00)01145-2
Руднев Н.А., Мелихов И.В., Тузова А.М. // Журн. аналит. химии. 1973. Т. 28. № 4. С. 635.
Olekseyuk I.D., Parasyuk O.V., Halka V.O. et al. // J. A-lloys Compd. 2001. V. 325. № 10. P. 167. https://doi.org/10.1016/S0925-8388(01)01361-5
Singh N.B., Hopkins R.H., Feichiner J.D. // J. Mater Sci. 1986. V. 21. P. 837.
Cary C.C., David B. // MRS Bull. 1998. № 7. P. 28.
Zhaq B.Y., Zhu S.F., Yu F.L. // Cryst. Res. Technol. 1998. V. 33. № 6. P. 943.
Xiu Zhiliang, Liu Suwen, Jiaoxian Yu et al. // J. Alloys Compd. 2008. V. 457. № 12. P. 9. https://doi.org/10.1016/j.jallcom.2007.03.060
Власенко О.И., Левицкий С.М., Криоков Ц.А. // Физика и химия твердого тела. 2006. Т. 7. № 4. С. 660.
Brand G., Kramer V. // Mater. Res. Bull. 1976. № 11. P. 1381.
Лазарев В.Б., Киш З.З., Переш Е.Ю. и др. Сложные халькогениды в системе АI–ВIII–СVI. М.: Металлургия, 1993. 229 с.
Угай Я.А. Введение в химию полупроводников. М.: Высш. школа, 1975. 302 с.
Комарова Т.Н. // Изв. Физ.-хим. ин-та при Иркутском ун-те. 1986. Т. 27. № 1. С. 23.
Самсонов Г.В., Дроздова С.В. Сульфиды. М.: Металлургия, 1972. 304 с.
Заргарова М.И., Мамедов А.Н., Аждарова Д.С. и др. Неорганические вещества, синтезированные и исследованные в Азербайджане. Баку: Элм, 2004. 462 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии