Журнал неорганической химии, 2019, T. 64, № 9, стр. 984-987
Применение физико-химического анализа при разработке и исследовании противогололедных реагентов
В. П. Данилов 1, *, Е. А. Фролова 1, Д. Ф. Кондаков 1, Л. Б. Свешникова 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: vpdanilov@igic.ras.ru
Поступила в редакцию 27.12.2018
После доработки 30.01.2019
Принята к публикации 15.02.2019
Аннотация
Показана целесообразность применения физико-химического анализа при разработке и исследовании противогололедных реагентов. Описана методология, использованная при разработке новых противогололедных реагентов, включающая критерий выбора солей, методику исследования фазовых равновесий в водно-солевых системах (визуально-политермический анализ), определение противогололедных свойств солей и солевых композиций (температуры эвтектики и плавящей способности). Предложен критерий количественной оценки эффективности противогололедных реагентов – плавящая способность реагента по отношению ко льду при различных температурах. Приведены данные о фазовых равновесиях в двойных и тройных водно-солевых системах при температурах ниже 0°С и данные о новых разработанных противогололедных реагентах, включающие состав реагентов, параметры эвтектик, образуемых со льдом (температуру и концентрацию раствора) и плавящую способность реагентов по отношению ко льду при температурах –5, –10 и –20°С.
ВВЕДЕНИЕ
Применение методов физико-химического анализа при исследовании эффективности существующих и разработке новых противогололедных реагентов, как показывают наши исследования [1–13], позволяет проводить эти работы на хорошей научной основе. В настоящее время, судя по научным публикациям [13–19], при разработке и исследовании противогололедных реагентов физико-химический анализ, как правило, не применяется.
При исследовании противогололедных свойств солей и разработке противогололедных реагентов на их основе возникает вопрос, какие физические свойства солей определяют их способность эффективно понижать температуру замерзания раствора по сравнению с растворителем.
Существует криоскопическая формула: Δt = kc, по которой достичь существенного понижения температуры замерзания солевого раствора по сравнению с растворителем можно повышением концентрации раствора, поэтому необходимым условием для выбора солей при разработке противогололедных реагентов является их хорошая растворимость в воде. К солям с хорошей растворимостью, как известно, относятся хлориды, нитраты, ацетаты и формиаты щелочных и щелочноземельных металлов.
В качестве противогололедных реагентов, как правило, используются либо хорошо растворимые индивидуальные соли (хлориды, нитраты, ацетаты и формиаты щелочных и щелочноземельных металлов), либо их смеси, которые характеризуются достаточно низкими температурами эвтектик в системах реагент–вода. К таким солям относятся ацетат калия с температурой эвтектики –62°С и формиат калия с температурой эвтектики –55°С. На основе ацетата и формиата калия разработаны и применяются на аэродромах жидкие противогололедные реагенты. Что касается твердых реагентов, в настоящее время на аэродромах России применяются формиат натрия, реагент НКММ (нитраты кальция, магния, мочевина), представляющий собой смесь двух комплексных соединений – нитратов кальция и магния с мочевиной. За рубежом (в США, Канаде, Европейских государствах) в качестве противогололедных реагентов применяются хлорид магния и его растворы, хлорид натрия, мочевина и ацетат магния-кальция.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для разработки противогололедных реагентов на основе солевых композиций нами изучены фазовые равновесия в разрезах водно-солевых систем, содержащих две или более соли при температурах ниже 0°С. В качестве метода исследования использовали визуально-политермический анализ [3]. Соотношение солевых компонентов в разрезах систем варьировалось от 3 : 1 до 1 : 3. Целью исследования являлось определение температур низкотемпературных эвтектик в системах соль (соли)–вода при различном соотношении компонентов и построение политерм плавления (кристаллизации) льда в этих системах при температурах ниже 0°C. По этим политермам рассчитывали плавящую способность солей и солевых композиций при разных температурах.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Использованная в наших работах экспериментальная методика не дает возможности выявить полную картину фазовых равновесий, включающую области кристаллизации различных солей и льда на диаграмме состав–свойства, но позволяет определить минимальные (наиболее низкие) температуры эвтектик, образуемых солью или солевой композицией со льдом.
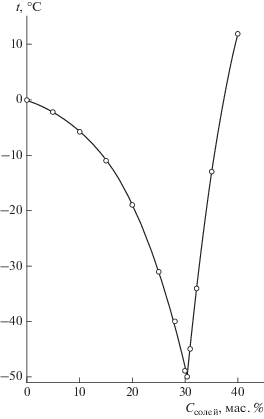
Результаты эксперимента представлены в виде диаграммы фазовых равновесий, изображенной на рис. 1, или в виде табличных данных (табл. 1, 2).
Таблица 1.
Данные о характеристиках эвтектик в водных системах, содержащих карбамид, формиат натрия и реагент НКММ, и плавящей способности по отношению ко льду солей, карбамидно-формиатных композиций и реагента НКММ
| Система | Характеристика эвтектик | Плавящая способность по отношению ко льду, г/г | |||
|---|---|---|---|---|---|
| t, оС | C, мас. % | –5°С | –10°С | –20°С | |
| CO(NH2)2–H2O | –11.5 | 33.0 | 4.7 | 2.3 | 0 |
| HCOONa–H2O | – 16.0 | 24.7 | 9.1 | 4.7 | 0 |
| CO(NH2)2 + HCOONa (3 : 1)–H2O | – 16.0 | 34.0 | 6.1 | 3.2 | 0 |
| CO(NH2)2 + HCOONa (2 : 1)–H2O | –18.0 | 34.0 | 6.1 | 3.2 | 0 |
| CO(NH2)2 + HCOONa (1 : 1)–H2O | –22.0 | 36.0 | 6.4 | 3.7 | 2.0 |
| CO(NH2)2 + HCOONa (1 : 2)–H2O | –19.0 | 30.0 | 7.3 | 4.3 | 0 |
| CO(NH2)2 + HCOONa (1 : 3)–H2O | –18.0 | 27.0 | 8.1 | 4.6 | 0 |
| НКММ | –22.0 | 55.0 | 4.3 | 2.0 | 1.0 |
Таблица 2.
Данные о понижении температуры эвтектики в тройных системах
| Система | Характеристика эвтектик солевая композиция–вода |
Плавящая способность композиции, г/г | |||
|---|---|---|---|---|---|
| t, °С | C, мас. % | –5°С | –10°С | –20°С | |
| Ca(NO3)2–Mg(NO3)2 (1 : 1)–H2O | – 41.0 | 40.0 | 6.8 | 4.0 | 2.4 |
| Mg(NO3)2–H2O | –31.2 | 32.2 | 7.7 | 4.5 | 2.7 |
| Ca(NO3)2–H2O | –29.0 | 42.0 | 5.7 | 3.2 | 2.1 |
| CO(NH2)2–H2O | –11.5 | 33.0 | 4.7 | 2.3 | 0 |
| HCOONa–H2O | – 16.0 | 24.7 | 9.1 | 4.7 | 0 |
| CO(NH2)2 + HCOONa (1 : 1)–H2O | –22.0 | 36.0 | 6.4 | 3.7 | 1.9 |
| CH3COONa –H2O | –18.0 | 23.0 | 9.0 | 5.1 | 0 |
| HCOONa–H2O | –16.0 | 24.0 | 9.0 | 4.7 | 0 |
| CH3COONa + HCOONa (1 : 1)–H2O | –22.0 | 27.0 | 10.1 | 5.4 | 3.0 |
В качестве примера приведем результаты исследования фазовых равновесий в системе формиат натрия–карбамид–вода [13].
В этой системе весовое соотношение формиата натрия и карбамида варьировалось от 3 : 1 до 1 : 3. Полученные результаты приведены в табл. 1. Как следует из приведенных данных, варьирование соотношений солевых компонентов позволило определить минимальную (наиболее низкую) температуру эвтектики (–22°С), образуемой солевой композицией со льдом, при содержании солей в растворе 36% и весовом соотношении формиата натрия и карбамида 1 : 1.
Для оценки эффективности противогололедных реагентов мы предложили сравнивать их плавящую способность по отношению ко льду при определенных температурах (–5 и –10°С) в равновесных условиях. Плавящую способность рассчитывали из данных по фазовым равновесиям в системе реагент–вода по формуле: At = (100 – Ct)/Ct, где At – плавящая способность при температуре t, Ct – концентрация реагента в растворе. Этот критерий позволяет сравнивать эффективность различных противогололедных реагентов.
При разработке противогололедных реагентов на основе солевых композиций нами исследованы фазовые равновесия при температурах ниже 0°С в разрезах в широком круге двойных (соль–вода), тройных (две соли–вода) и четверных (три соли–вода) систем, включающих хлориды, нитраты, карбонаты, ацетаты и формиаты щелочных и щелочноземельных металлов с целью нахождения низкотемпературных эвтектик [1–12].
Применение физико-химического анализа позволило обнаружить в ряде тройных систем полезное явление: понижение температуры двойной эвтектики по сравнению с эвтектиками в составляющих двойных системах соль–вода. Это понижение температуры эвтектики позволяет расширить рабочий температурный интервал противогололедных реагентов, состоящих из двух солей, т.е. дает возможность применять их при более низких температурах по сравнению с реагентами, включающими одну соль (табл. 2).
Поскольку к противогололедным реагентам, предназначенным для применения на аэродромах, предъявляется ряд специальных требований (они не должны вызывать коррозии металлов, авиационных сплавов и цементобетона, т.е. взлетно-посадочных полос), все разрабатываемые реагенты должны подвергаться коррозионным испытаниям по отношению к металлам и цементобетону.
В наших работах такие испытания были выполнены совместно с ВИАМ и Испытательным центром ООО “Опытное”. При обнаружении коррозионных свойств по отношению к металлам в состав реагентов вводили ингибиторы коррозии.
В заключение представляем перечень разработанных нами противогололедных реагентов (табл. 3).
Таблица 3.
Разработанные в ИОНХ РАН противогололедные реагенты
| Состав реагента | Параметры эвтектики со льдом | Плавящая способность реагента г/г при температуре |
tmin приме-нения, °С | |||
|---|---|---|---|---|---|---|
| t, °С | C, мас. % | –5°С | –10°С | –20°С | ||
| НКММ | –22.0 | 55.0 | 4.3 | 2.0 | 1.0 | –15 |
| НКММ + 40% Mg(CH3CO2) | –30.0 | 50.0 | 5.7 | 3.0 | 1.5 | –25 |
| Mg(NO3)2 + Ca(NO3)2 (1 : 1) | –41.0 | 40.0 | 6.8 | 4.0 | 2.4 | –35 |
| Mg(NO3)2. Ca(NO3)2. 2.7H2O | –38.0 | 48.0 | 5.7 | 3.2 | 1.9 | –32 |
| Ca(NO3)2 безводный | –29.0 | 42.0 | 5.7 | 3.2 | 2.1 | –20 |
| CO(NH2)2 + HCOONa (1 : 1) | –22.0 | 36.0 | 6.4 | 3.7 | 1.9 | –19 |
| CH3COONa + HCOONa (1 : 1) | –22.0 | 27.0 | 10.1 | 5.45 | 3.0 | –19 |
| NaNO3 + CH3COONa (1 : 1) | –24.5 | 40.0 | 8.0 | 4.26 | 2.3 | –21 |
| Mg(CH3CO2) + NaCl (1 : 1) | –26.0 | 27.2 | 10.0 | 5.7 | 3.2 | –22 |
Список литературы
Frolova E.A., Kondakov D.F., Orlova V.T. et al. // Theor. Found. Chem. Eng. 2013. V. 47. № 4. P. 422. [Фролова Е.А., Кондаков Д.Ф., Орлова В.Т. и др. // Хим. технология. 2012. Т. 13. № 5. С. 257.]https://doi.org/10.1134/S0040579513040076
Achkeeva M.V., Romanyuk N.V., Frolova E.A. et al. // Theor. Found. Chem. Eng. 2015. V. 49. № 4. P. 481. [Ачкеева М.В., Романюк Н.В., Фролова Е.А. и др. // Хим. технология. 2014. Т. 15. № 3. С. 139.]https://doi.org/10.1134/S0040579515040028
Данилов В.П., Фролова Е.А., Кондаков Д.Ф. и др. // Хим. технология. 2010. Т. 11. № 4. С. 193.
Danilov V.P., Frolova E.A., Kondakov D.F. et al. // Theor. Found. Chem. Eng. 2012. V. 46. № 5. P. 528. [Данилов В.П., Фролова Е.А., Кондаков Д.Ф. и др. // Хим. технология. 2011. Т. 12. № 3. С. 134.]https://doi.org/10.1134/S0040579512050028
Achkeeva M.V., Romanyuk N.V., Avdyushkina L.I. et al. // Theor. Found. Chem. Eng. 2014. V. 48. № 4. P. 461. [Ачкеева М.В., Романюк Н.В., Авдюшкина Л.И. и др. // Хим. технология. 2013. Т. 14. № 4. С. 193.]https://doi.org/10.1134/S0040579514040022
Данилов В.П., Кондаков Д.Ф., Николаев В.В. и др. // Хим. технология. 2013. Т. 14. № 6. С. 321.
Frolova E.A., Kondakov D.F., Nikolaev V.V. et al. // Theor. Found. Chem. Eng. 2015. V. 49. № 5. P. 719. [Фролова Е.А., Кондаков Д.Ф., Николаев В.В. и др. // Хим. технология. 2014. Т. 15. № 8. С. 449.]https://doi.org/10.1134/S004057951505005X
Danilov V.P., Frolova E.A., Kondakov D.F. et al. // Theor. Found. Chem. Eng. 2016. V. 50. № 4. P. 480. [Данилов В.П., Фролова Е.А., Кондаков Д.Ф. и др. // Хим. технология. 2015. Т. 16. № 2. С. 87.]https://doi.org/10.1134/S0040579516040084
Frolova E.A., Kondakov D.F., Avdyushkina L.I. et al. // Theor. Found. Chem. Eng. 2017. V. 51. № 4. P. 524. [Фролова Е.А., Кондаков Д.Ф., Авдюшкина Л.И. и др. // Хим. технология. 2016. Т. 17. № 6. С. 242.]https://doi.org/10.1134/S0040579517040066
Фролова Е.А. Кондаков Д.Ф. Авдюшкина Л.И. и др. // Хим. технология. 2017. Т. 18. № 1. С. 15.
Danilov V.P., Frolova E.A., Kondakov D.F. // Theor. Found. Chem. Eng. 2018. V. 52. № 5. P. 859. [Данилов В.П., Фролова Е.А., Кондаков Д.Ф. // Хим. технология. 2017. Т. 18. № 8. С. 338.]https://doi.org/10.1134/S004057951805007X
Данилов В.П., Фролова Е.А., Кондаков Д.Ф и др. // Хим. технология. 2018. Т. 19. № 3. С. 9.
Данилов В.П., Кондаков Д.Ф., Фролова Е.А. и др. // Хим. технология. 2018. Т. 19. № 2. С. 61.
Данилов В.П., Фролова Е.А., Кондаков Д.Ф. и др. // Хим. технология. 2018. Т. 19. № 7. С. 296. https://doi.org/10.31044/1684-5811-2018-19-7-296-302
Данилов В.П. // Хим. технология. 2018. Т. 19. № 13. С. 589. https://doi.org/10.31044/1684-5811-2018-19-13-589-595
Борисюк Н.В. // Зимнее содержание городских дорог. М., 2005. С. 115.
Розов С.Ю., Паткина И.А., Розов Ю.Н., Шестаченко А.Ю. // Дороги и мосты. 2016. № 2 (36). С. 5.
Орлов В.А. Теория и практика борьбы с гололедом. М.: Воздушный транспорт, 2010.
Васильев А.П., Ушаков В.В. Анализ современного зарубежного опыта зимнего содержания дорог и разработка предложений по его использованию в условиях России. М.: Информавтодор, 2003. 60 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии