Журнал неорганической химии, 2019, T. 64, № 9, стр. 951-956
Синтез и структура каркасных ксиларатогерманатных солей с протонированным фенантролином и его комплексами с Fe(II) и Ni(II) в качестве катионов
Е. А. Чебаненко 1, И. И. Сейфуллина 1, Е. Э. Марцинко 1, *, В. В. Дьяконенко 2, С. В. Шишкина 2, 3
1 Одесский национальный университет им. И.И. Мечникова
65082 Одесса, ул. Дворянская, 2, Украина
2 Научно-технологический комплекс “Институт монокристаллов” НАН Украины
61072 Харьков, пр-т Науки, 60, Украина
3 Харьковский национальный университет им. В.Н. Каразина
61072 Харьков, пл. Свободы, 4, Украина
* E-mail: lborn@ukr.net
Поступила в редакцию 17.02.2019
После доработки 04.04.2019
Принята к публикации 15.04.2019
Аннотация
Разработаны методики синтеза новых супрамолекулярных ксиларатогерманатных солей с различными катионами: (HPhen)4[(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2] · 13H2O (I), [Fe(Phen)3]2[(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2] · 6H2O · C2H5OH (II), [Ni(Phen)3]2[(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2] · 8H2O (III). Соединения изучены методами рентгеноструктурного анализа, ИК-спектроскопии, термогравиметрии. Определена их молекулярная и кристаллическая структура. В соединениях I–III реализуется одинаковый тетрамерный μ-дигидроксиксиларатогерманатный анион [(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2]4–, в котором лиганд проявляет себя как дитопный, одна из трех его гидроксильных групп не координируется к германию(IV), а образует внутримолекулярную водородную связь.
ВВЕДЕНИЕ
Стремительный прогресс координационной и супрамолекулярной химии, наметившийся в последние годы, тесно связан с успехами, достигнутыми в области синтеза и конструирования множества гомо- и гетерометаллических разнолигандных, молекулярных и полимерных структурных ансамблей с полезными практическими свойствами [1, 2]. Значительную роль в их формировании играет подбор металлов-комплексообразователей и комплементарных по отношению к ним полинуклеотивных, хелатирующих, гибких, способных выполнять мостиковую функцию органических лигандов.Большое число таких супрамолекулярных ансамблей впервые было получено нами на основе германия(IV), “металлов жизни” – Mn(II), Fe(II), Co(II), Ni(II), Cu(II) и биологически активных гидроксикарбоновых кислот [3, 4], в том числе тригидроксидикарбоновой кислоты (ксиларовой, H5Xylar) [5]. Остается открытым вопрос, какое влияние на структурообразование соответствующих ксиларатогерманатов окажет введение в их состав дополнительного лиганда – 1,10-фенантролина (Phen), широко применяемого в супрамолекулярной химии [6–10].
Цель настоящей работы – разработка методик синтеза и структурное исследование супрамолекулярных солей, содержащих ксиларатогерманатный анион и фенантролин в протонированной форме и его комплексы с Fe(II), Ni(II) в качестве катионов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез (HPhen)4[(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2] · 13H2O (I). Исходными веществами служили GeO2 (Sigma-Aldrich), ксиларовая кислота и 1,10-фенантролин (Fluka). К смеси сухих навесок GeO2 (0.1046 г, 1 ммоль), H5Xylar (0.18 г, 1 ммоль) и Phen (0.198 г, 1 ммоль) приливали смесь растворителей ацетонитрил–вода (20–20 мл). Полученную взвесь кипятили с обратным холодильником при t = 70–80°C в течение 5 ч. Через 6 сут образовывался кристаллический осадок розового цвета.
ИК-спектр (ν, см–1): 3403 ν(Н2О), 3068 νs(C–H), 1668 νas(СОО–), 1597, 1544 ν(C–Cаром), 1453, 1420 νs(СОО–), 1137 δ(С–ОН), 1071 ν(С–О), 847 νas(GeOGe), 822 δ(Ge–OH), 718 ν(Ge–O).
| С | Н | Ge | N | |
| Найдено, %: | 40.43; | 3.94; | 14.42; | 5.75. |
| Для C68H82Ge4N8O45, | ||||
| вычислено, %: | 40.36; | 4.06; | 14.36; | 5.54. |
Синтез [Fe(Phen)3]2[(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2] · 6H2O · C2H5OH (II). Комплекс синтезировали постадийно. На первой стадии к смеси навесок GeO2 (0.1046 г, 1 ммоль) и H5Xylar (0.18 г, 1 ммоль) добавляли 100 мл воды. Образовавшуюся взвесь при постоянном перемешивании и нагревании (t = 80–90°C) растворяли, а затем упаривали на водяной бане при t = 60–70°C до 10 мл. На второй стадии после охлаждения до комнатной температуры приливали 10 мл 95%-ного этанола, содержащего 0.5 ммоль FeSO4 · 7H2O (Sigma-Aldrich) и 1.5 ммоль Phen. В течение суток из полученного раствора выпадал кристаллический осадок темно-красного цвета.
ИК-спектр (ν, см–1): 3372 ν(Н2О), 3054 νs(C–H), 1685, 1659 νas(СОО–), 1580 ν(C–Cаром), 1428, 1413 νs(СОО–), 1140 δ(С–ОН), 1066 ν(С–О), 842 νas(GeOGe), 824 δ(Ge–OH), 722 ν(Ge–O).
| С | Н | Fe | Ge | N | |
| Найдено, %: | 46.91; | 4.53; | 4.71; | 12.16; | 7.11. |
| Для C94H86Fe2Ge4N12O39 | |||||
| вычислено, %: | 46.82; | 3.57; | 4.63; | 12.06; | 6.97. |
Синтез [Ni(Phen)3]2[(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2] · 8H2O (III). Комплекс был получен по методике, аналогичной для комплекса II, с добавлением на второй стадии синтеза 10 мл 95%-ного раствора этанола, содержащего 0.5 ммоль NiCl2 · ⋅ 6H2O (Aldrich) и 1.5 ммоль Phen. Через 2 сут из полученного раствора выпадал кристаллический осадок розового цвета.
ИК-спектр (ν, см–1): 3420 ν(Н2О), 3060 νs(C–H), 1689 νas(СОО–), 1587, 1517 ν(C–Cаром), 1497, 1426 νs(СОО–), 1144 δ(С–ОН), 1068 ν(С–О), 849 νas(GeOGe), 820 δ(Ge–OH), 726 ν(Ge–O).
| С | Н | Ge | N | Ni | |
| Найдено, %: | 47.02; | 3.55; | 12.13; | 7.12; | 4.95. |
| Для C92H84Ge4N12Ni2O40 | |||||
| вычислено, %: | 45.90; | 3.49; | 12.08; | 6.98; | 4.88. |
Монокристаллы I–III, пригодные для РСА, были отобраны из реакционных сред.
Элементный анализ проводили с помощью полуавтоматического C,N,H-анализатора Elemental Analyzer CE-440. Содержание германия, железа и никеля определяли методом атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой на приборе Optima 2000 DV фирмы Perkin–Elmer.
ИК-спектры поглощения (400–4000 см–1) комплексов в виде таблеток с KBr записывали на спектрофотометре Frontier фирмы Perkin–Elmer.
Термогравиметрический анализ проводили на дериватографе Q-1500Д (воздушная атмосфера, интервал температур 20–1000°С, скорость нагрева 10 град/мин).
Рентгеноструктурный анализ. Кристаллы I триклинные, пр. гр. Р$\overline 1 ,$ T = 100 K, a = 12.5685(5), b = = 15.0180(6), c = 21.6835(8) Å, α = 81.872(3)°, β = 74.462(4)°, γ = 85.928(3)°, V = 3901.3(3) Å3, Z = 2, μ(MoKα) = 1.639 мм–1, ρвыч = 1.721 г/см3, измерено 33335 отражений, 17914 независимых (Rint = = 0.039). Окончательные значения: R1 = 0.046 (для 13849 отражений с интенсивностью I > 2σ(I)) и wR2 = 0.103 (для всех отражений), S = 1.02.
Кристаллы II триклинные, пр. гр. Р$\overline 1 ,$ T = 293 K, a = 16.048(4), b = 16.762(3), c = 19.115(4) Å, α = 85.119(15)°, β = 77.443(18)°, γ = 76.742(18)°, V = = 4881.8(18) Å3, Z = 2, μ(MoKα) = 1.603 мм–1, ρвыч = = 1.639 г/см3, измерено 45297 отражений, 19 146 независимых (Rint = 0.164). Окончательные значения: R1 = 0.106 (для 8199 отражений с интенсивностью I > 2σ(I)) и wR2 = 0.281 (для всех отражений), S = 0.98.
Кристаллы III триклинные, пр. гр. Р$\overline 1 ,$ T = 294 K, a = 13.6416(6), b = 13.6664(7), c = 14.0617(6) Å, α = = 100.204(4)°, β = 105.207(4)°, γ = 98.174(4)°, V = = 2440.1(2) Å3, Z = 1, ρвыч = 1.637 г/см3, измерено 19 360 отражений, 9572 независимых (Rint = 0.079). Окончательные значения: R1= 0.076 (для 5942 отражений с интенсивностью I > 2σ(I)) и wR2 = 0.214 (для всех отражений), S = 1.04.
Рентгеноструктурные данные для соединений I–III получены на дифрактометре Xcalibur-3 (MoKα-излучение, ССD-детектор, графитовый монохроматор, ω-сканирование). Структуры расшифрованы прямым методом и уточнены по F2 полноматричным МНК в анизотропном приближении для неводородных атомов с использованием комплекса программ SHELXTL [11, 12]. Положения атомов водорода выявлены из разностного синтеза электронной плотности и уточнены по модели “наездника” с Uизо = nUэкв неводородного атома, связанного с данным водородным (n = 1.5 для молекул воды и n = 1.2 для остальных атомов водорода). Координаты атомов, а также полные таблицы длин связей и валентных углов депонированы в Кембриджском банке структурных данных (e-mail: deposit@ccdc.cam.ac.uk) (CCDC 1883675 (І), 1883676 (ІІ), 1883677 (III)).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По данным РСА, I–III представляют собой комплексные соединения катион-анионного типа, в которых в качестве аниона выступает [(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2]4– (рис. 1), а катионами служат четыре молекулы фенантролина в протонированной форме (I), два комплекса [Fe(Phen)3]2+ (II) либо [Ni(Phen)3]2+ (III) (рис. S1 ).
Рис. 1.
Строение аниона [(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2]4–. Внутримолекулярные водородные связи обозначены пунктирной линией. Нумерация атомов приведена для структуры I, находящейся в общем положении.
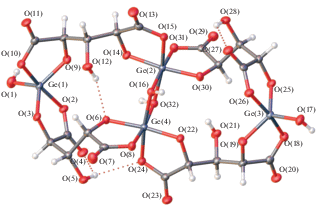
Комплексный анион [(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2]4– в структурах I–III представляет собой симметричный четырехъядерный комплекс. Анион в структурах II и III находится в частном положении относительно центра инверсии, при этом в II он состоит из двух симметрически независимых изоморфных молекул А и Б. Атомы германия в анионе структур I–III имеют два разных типа координации. Координационные полиэдры атомов Ge(1) (I–III) и Ge(3) (I) – искаженные тригональные бипирамиды, в экваториальной плоскости которых находятся два атома кислорода карбоксильных групп лигандов Xylar5– и атом кислорода гидроксильного аниона, а в аксиальном положении – два атома кислорода двух депротонированных карбоксильных групп лигандов Xylar5–. Длина связей Ge–O в экваториальном направлении изменяется в пределах 1.737(2)–1.807(7) Å, а в аксиальном направлении – в интервале 1.831(9)–1.934(4) Å (табл. 1). Валентные углы ОGeO в экваториальном направлении изменяются в пределах 112.9(4)°–129.7(9)°, а в аксиальном направлении – 86.4(9)°–96.7(3)°. Координационные полиэдры двух центральных атомов германия комплексного аниона [(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2]4– в I–III (Ge(2) (I–III), Ge(4) (I)) представляют собой искаженные октаэдры, образованные четырьмя атомами кислорода депротонированных гидроксильной и карбоксильной групп двух лигандов Xylar5– и двумя атомами кислорода гидроксолиганда. При этом атомы кислорода гидроксолигандов являются мостиковыми между двумя центральными атомами германия. Длины связей Ge–O изменяются в пределах 1.749(2)–1.958(7) Å, а валентные углы ОGeO – в интервале 78.2(3)°–97.0(3)°. Гидроксильные группы лигандов Xylar5– участвуют в образовании внутримолекулярных водородных связей (табл. S1 ).
Таблица 1.
Некоторые длины связи (d, Å) и валентные углы (ω, град) в соединениях I–III
| Связь | d, Å | Связь | d, Å |
| Соединение I | |||
| Ge(1)–O(1) | 1.7369(19) | Ge(4)–O(32) | 1.9252(18) |
| Ge(1)–O(10) | 1.915(2) | Ge(4)–O(16) | 1.8850(19) |
| Ge(1)–O(9) | 1.7864(19) | Ge(4)–O(6) | 1.8217(18) |
| Ge(1)–O(2) | 1.934(2) | Ge(4)–O(8) | 1.9387(18) |
| Ge(1)–O(3) | 1.7791(19) | Ge(4)–O(24) | 1.913(2) |
| Ge(2)–O(14) | 1.8163(18) | Ge(4)–O(22) | 1.8187(18) |
| Ge(2)–O(15) | 1.921(2) | Ge(3)–O(25) | 1.7842(19) |
| Ge(2)–O(32) | 1.9255(19) | Ge(3)–O(26) | 1.898(2) |
| Ge(2)–O(16) | 1.9064(18) | Ge(3)–O(17) | 1.7495(19) |
| Ge(2)–O(31) | 1.9337(18) | Ge(3)–O(18) | 1.912(2) |
| Ge(2)–O(30) | 1.8201(18) | Ge(3)–O(19) | 1.7871(19) |
| Соединение II | |||
| Молекула А | Молекула Б | ||
| Ge(1)–O(1) | 1.807(6) | Ge(1)–O(1) | 1.831(9) |
| Ge(1)–O(2) | 1.754(7) | Ge(1)–O(2) | 1.753(8) |
| Ge(1)–O(3) | 1.813(7) | Ge(1)–O(3) | 1.745(8) |
| Ge(1)–O(9) | 1.915(8) | Ge(1)–O(9) | 1.914(9) |
| Ge(1)–O(10) | 1.899(8) | Ge(1)–O(10) | 1.778(8) |
| Ge(2)–O(16) | 1.963(9) | Ge(2)–O(16) | 1.967(10) |
| Ge(2)–O(15) | 1.961(9) | Ge(2)–O(15) | 1.997(9) |
| Ge(2)–O(14) | 1.962(8) | Ge(2)–O(14) | 1.971(9) |
| Соединение III | |||
| Ge(2)–O(16) | 1.916(5) | Ge(1)–O(1) | 1.749(5) |
| Ge(2)–O(14) | 1.828(4) | Ge(1)–O(2) | 1.894(6) |
| Ge(2)–O(15) | 1.903(4) | Ge(1)–O(10) | 1.917(6) |
| Ge(1)–O(3) | 1.790(5) | Ge(1)–O(9) | 1.783(5) |
| Угол | ω, град | Угол | ω, град |
| Соединение I | |||
| O(1)Ge(1)O(10) | 94.71(9) | O(30)Ge(2)O(31) | 85.96(8) |
| O(1)Ge(1)O(9) | 118.28(9) | O(25)Ge(3)O(18) | 88.64(9) |
| O(1)Ge(1)O(2) | 96.48(9) | O(25)Ge(3)O(19) | 129.75(9) |
| O(1)Ge(1)O(3) | 114.58(9) | O(17)Ge(3)O(25) | 114.37(9) |
| O(9)Ge(1)O(2) | 87.45(8) | O(17)Ge(3)O(26) | 95.42(9) |
| O(3)Ge(1)O(10) | 88.76(8) | O(17)Ge(3)O(18) | 96.18(9) |
| O(3)Ge(1)O(9) | 127.14(9) | O(17)Ge(3)O(19) | 115.86(9) |
| O(3)Ge(1)O(2) | 86.45(8) | O(19)Ge(3)O(26) | 87.15(9) |
| O(14)Ge(2)O(15) | 86.15(8) | O(19)Ge(3)O(18) | 87.17(8) |
| O(14)Ge(2)O(32) | 89.57(8) | O(16)Ge(4)O(32) | 78.78(8) |
| O(14)Ge(2)O(16) | 95.84(8) | O(16)Ge(4)O(8) | 93.51(8) |
| O(14)Ge(2)O(31) | 85.96(8) | O(6)Ge(4)O(32) | 90.66(8) |
| O(15)Ge(2)O(31) | 99.99(8) | O(6)Ge(4)O(8) | 85.68(8) |
| O(16)Ge(2)O(15) | 87.15(8) | O(6)Ge(4)O(24) | 91.17(8) |
| O(16)Ge(2)O(32) | 78.26(8) | O(24)Ge(4)O(32) | 93.03(8) |
| O(30)Ge(2)O(15) | 92.73(8) | O(24)Ge(4)O(8) | 95.04(8) |
| O(30)Ge(2)O(32) | 93.64(8) | O(22)Ge(4)O(16) | 89.07(8) |
| O(30)Ge(2)O(16) | 92.49(8) | O(22)Ge(4)O(8) | 88.30(8) |
| Угол | ω, град | Угол | ω, град |
| Соединение II | |||
| Молекула А | Молекула Б | ||
| O(16)Ge(2)O(15) | 94.1(3) | O(16)Ge(2)O(15) | 95.0(3) |
| O(14)Ge(2)O(16) | 94.9(3) | O(14)Ge(2)O(16) | 94.4(3) |
| O(14)Ge(2)O(15) | 86.4(3) | O(14)Ge(2)O(15) | 84.8(3) |
| O(9)Ge(1)O(3) | 89.6(4) | O(9)Ge(1)O(3) | 129.7(3) |
| O(9)Ge(1)O(10) | 86.9(4) | O(9)Ge(1)O(10) | 86.8(3) |
| O(2)Ge(1)O(3) | 87.5(4) | O(2)Ge(1)O(3) | 88.3(3) |
| O(2)Ge(1)O(9) | 129.2(4) | O(2)Ge(1)O(9) | 130.2(4) |
| O(2)Ge(1)O(10) | 87.8(4) | O(2)Ge(1)O(10) | 87.5(3) |
| O(1)Ge(1)O(3) | 94.7(5) | O(1)Ge(1)O(3) | 112.9(4) |
| O(1)Ge(1)O(9) | 115.8(4) | O(1)Ge(1)O(9) | 117.3(4) |
| O(1)Ge(1)O(10) | 94.8(6) | O(1)Ge(1)O(10) | 96.6(4) |
| Соединение III | |||
| O(14)Ge(2)O(16) | 93.8(2) | O(9)Ge(1)O(2) | 90.2(3) |
| O(14)Ge(2)O(15) | 86.20(19) | O(9)Ge(1)O(10) | 87.0(3) |
| O(15)Ge(2)O(16) | 95.0(2) | O(1)Ge(1)O(3) | 116.6(3) |
| O(3)Ge(1)O(2) | 88.1(2) | O(1)Ge(1)O(2) | 96.7(3) |
| O(3)Ge(1)O(10) | 86.5(2) | O(1)Ge(1)O(10) | 92.8(3) |
| O(9)Ge(1)O(3) | 129.0(2) | O(1)Ge(1)O(9) | 114.2(3) |
Катионы в структуре I представляют собой монопротонированный 1,10-фенантролин (рис. S1 ). Его образование подтверждают выявленные из разностного синтеза электронной плотности атомы водорода при N(1), N(3), N(5) и N(7).
Симметрически независимые катионы [Fe(phen)3]2+ (А и Б) в структуре II и [Ni(phen)3]2+ в структуре III изоструктурны (рис. S2 ). Ионы металла в комплексах связаны с тремя молекулами фенантролина, при этом координационные полиэдры для катионов железа и никеля в структурах II и III – октаэдры. В структуре II длины связей Fe–N изменяются в пределах 1.959(9)–2.002(9) Å, а валентные углы NFeN – в интервале 82.5(3)°–95.4(4)°. В структуре III длины связей Ni–N изменяются в пределах 2.068(6)°–2.121(5) Å, а валентные углы NNiN – в интервале 79.6(2)°–99.3(2)°.
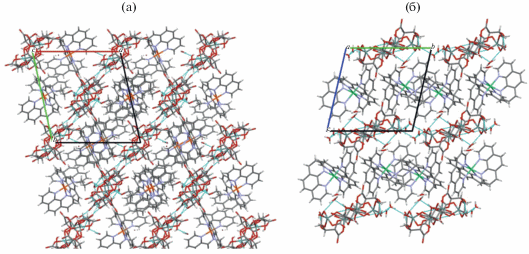
В кристаллической структуре соединений I–III анионы, катионы, а также молекулы воды образуют чередующиеся слои, параллельные кристаллографическим плоскостям (101), (110) и (110) для I, II и III соответственно (рис. 2, 3). Образующиеся слои можно разделить на два вида: слои, содержащие анионы и молекулы воды, связанные друг с другом межмолекулярными водородными связями (табл. S1 ), и слои, содержащие катионы.
Рис. 3.
Кристаллическая структура соединений II (а – вид вдоль кристаллографической оси с) и III (б – вид вдоль кристаллографической оси а).
Термическое разложение соединений I–III имеет однотипный характер, начинается с эндотермического эффекта в интервале температур 100–210 (130°С↓) для I, 80–150 (100°С↓) для II, 70–160 (100°С↓) для III; убыль массы соответствует удалению 13 (Δm = 11.5%, I) и 8 (Δm = 6%, III) молекул воды, для II – 6 молекул воды и 1 молекулы этанола (Δm = 6.3%). Дальнейший термораспад комплексов сопровождается серией экзоэффектов: 220–400 (360°С↑), 400–620 (550°С↑), 620–950 (650°С↑) для I; 300–390 (350°С↑), 390–500 (400°С↑), 550–700 (620°С↑) для II; 300–400 (350°С↑), 400–490 (410°С↑), 490–610°С (570°С↑) для III, в результате которых происходит разрушение и окислительная деструкция комплексов. Конечными продуктами термораспада при 1000°С являются GeO2 (для I), смесь FeGeO3 + + GeO2 (для II), NiGeO3 + GeO2 (для III).
В ИК-спектрах комплексов I–III присутствует подобный набор полос поглощения. Их отнесение сделано путем сравнения со спектрами, полученными для ксиларовой кислоты и 1,10-фенантролина. Данные ИК-спектроскопии полностью согласуются с результатами РСА. В спектрах I–III отсутствует полоса валентных колебаний свободной карбоксильной группы ν(С=О) = 1732 см–1 и появляются полосы асимметричных νas(СОО–) ∼ ~ 1689 см–1, симметричных νs(СОО–) ∼ 1453 см–1 валентных колебаний карбоксилатных групп и ν(С–О) ∼ 1071 см–1 алкоголятного типа [13]. При этом сохраняется полоса δ(С–ОН) ∼ 1144 см–1, характерная для ксиларовой кислоты. Обнаружены полосы поглощения ν(Ge–O) ∼ 726 см–1, νas(GeOGe) ∼ 849 см–1, свидетельствующие о связывании германия с ксиларовой кислотой и образовании мостиковой группировки Ge–O–Ge [14]. В комплексах реализуется гидролизованная форма германия, на что указывает полоса δ(Ge–ОН) ∼ 824 см–1. О наличии в I–III молекул кристаллизационной воды и 1,10-фенантролина свидетельствует следующий набор полос: ν(ОН) ∼ ~ 3420; νs(C–Hаром) 3068 (I), 3054 (II), 3060 см–1 (III); ν(C–Cаром) 1597, 1544 (I), 1580 (II), 1587, 1517 см–1 (III) соответственно [15].
ЗАКЛЮЧЕНИЕ
Установлено, что в соединениях I–III независимо от природы катиона реализуется одинаковый тетраядерный ксиларатогерманатный анион HXylar4–. Такой же комплексный анион обнаружен в структурах [Fe(bipy)3]2[(OH)2Ge2(µ-HXylar)4Ge2(µ-OH)2] · 12H2O · 2CH3CN и [Ni(bipy)3]2[(OH)2Ge2(μ-HXylar)4Ge2(μ-OH)2] · ⋅ 20Н2О · 2C2H5OH [16]. Из этого следует, что тетрамерный ксиларатогерманатный анион характеризуется высокой устойчивостью в растворе и его можно рассматривать в качестве конструкционного блока в составе соединений такого типа. Последнее очень важно для создания и дизайна новых катион-анионных гидроксикарбоксилатогерманатных комплексных соединений с заданной структурой.
Список литературы
Gale P.A. // Coord. Chem. Rev. 2003. V. 240. № 1–2. P. 191. https://doi.org/10.1016/S0010-8545(02)00258-8
Zhang C., Jin G.-C., Chen J.-X. et al. // Coord. Chem. Rev. 2001. V. 213. № 1. P. 51. https://doi.org/10.1016/S0010-8545(00)00377-5
Марцинко Е.Э., Миначева Л.Х., Чебаненко Е.А. и др. // Журн. неорган. химии. 2013. Т. 58. № 5. С. 588. [Martsinko E.E., Minacheva L.Kh., Chebanenko E.A. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 5. P. 515. https://doi.org/10.1134/S003602361305015X]https://doi.org/10.7868/S0044457X13050152
Сейфуллина И.И., Илюхин А.Б., Марцинко Е.Э. и др. // Журн. неорган. химии. 2014. Т. 59. № 4. С. 452. [Seifullina I.I., Ilyukhin A.B., Martsinko E.E. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 4. P. 298. https://doi.org/10.1134/S0036023614040172]https://doi.org/10.7868/S0044457X14040187
Марцинко Е.Э., Миначева Л.Х., Сейфуллина И.И. и др. // Журн. неорган. химии. 2013. Т. 58. № 2. С. 187. [Martsinko E.E., Minacheva L.Kh., Seifullina I.I. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 2. P. 152. https://doi.org/10.1134/S0036023613020174]https://doi.org/10.7868/S0044457X13020177
Guo Y., Xiao D., Wang E. et al. // J. Solid State Chem. 2005. V. 178. P. 776. https://doi.org/10.1016/j.jssc.2004.12.042
Lu J., Chu D.-Q., Yu J.-H. F. et al. // Inorg. Chim. A-cta. 2006. V. 359. P. 2495. https://doi.org/10.1016/j.ica.2006.02.043
Xu X., Lu Y., Wang E. et al. // Inorg. Chim. Acta. 2007. V. 360. P. 455. https://doi.org/10.1016/j.ica.2006.07.111
Chen D., Wang Y., Lin Z. et al. // J. Mol. Struct. 2010. V. 966. № 1–3. P. 59. https://doi.org/10.1016/j.molstruc.2009.12.007
Dong G.-Y., He C.-H., Liu T.-F. et al. // Acta Crystallogr. 2011. V. E67. P. m1005. https://doi.org/10.1107/S1600536811024780
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: Изд-во МГУ, 2012.
Гар Т.К., Минаева Н.А., Миронов В.Ф. и др. Инфракрасные спектры поглощения соединений германия. М.: Наука, 1977.
Иванов С.М., Зубарев А.А. // Успехи в химии и химической технологии. 2014. Т. 28. № 4. С. 47.
Чебаненко Е.А., Марцинко Е.Э., Сейфуллина И.И. и др. // Журн. структур. химии. 2018. Т. 59. № 6. С. 1514. [Chebanenko E.A., Martsinko E.E., Seifullina I.I. et al. // J. Struct. Chem. 2018. V. 59. № 6. P. 1462. https://doi.org/10.1134/S0022476618060318]https://doi.org/10.26902/JSC20180631
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии