Журнал неорганической химии, 2019, T. 64, № 8, стр. 889-893
Фазовая диаграмма системы моноэтаноламин–диметилсульфоксид по данным дифференциальной сканирующей калориметрии
И. А. Солонина 1, М. Н. Родникова 1, *, М. Р. Киселев 2, А. В. Хорошилов 1, С. В. Макаев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Россия, Ленинский пр-т, 31, корп. 4, Москва
* E-mail: rodnikova@igic.ras.ru
Поступила в редакцию 19.12.2018
После доработки 31.01.2019
Принята к публикации 15.03.2019
Аннотация
Методом дифференциальной сканирующей калориметрии исследована фазовая диаграмма системы моноэтаноламин (МЭА)–диметилсульфоксид (ДМСО) в интервалах температур от +25 до –140°С и от –140 до +40°С. Получена фазовая диаграмма МЭА–ДМСО эвтектического типа (температура плавления эвтектического состава –10°С при концентрации ~50 мол. % ДМСО), которая характеризуется сильным переохлаждением жидкой фазы и расстекловыванием при температуре около –120°С. Проведено сравнение с литературными данными результатов исследования фазовых диаграмм вода (Н2О)–ДМСО и этиленгликоль (ЭГ)–ДМСО. Возможность сильного переохлаждения жидкой фазы в системах МЭА–ДМСО, ЭГ–ДМСО, Н2О–ДМСО и их тенденция к стеклованию объясняются устойчивостью пространственных сеток водородных связей самих растворителей.
ВВЕДЕНИЕ
Моноэтаноламин (МЭА) – простейший представитель класса аминоспиртов. Наличие в молекуле аминной и гидроксильной групп позволяет образовывать пространственную сетку водородных связей в конденсированных фазах. Конформации его молекулы в газообразном, жидком и твердом состоянии были исследованы методами квантовой химии [1–3], колебательной спектроскопии [4–6], рентгеноструктурного анализа [7, 8] и молекулярной динамики [9–12]. Была показана предпочтительность гош-конформации [1] в газовой фазе, легкость конформационного перехода при переходе в жидкую фазу [9, 10] и превалирование транс-конформации в кристаллическом состоянии МЭА [7].
Широкая область применения объясняется особыми свойствами МЭА, связанными в основном с существованием пространственной сетки водородных связей в жидком МЭА. Наличие пространственной сетки в жидком МЭА обусловливает его переохлаждение, трудность кристаллизации и легкость стеклообразования [13]. С этими свойствами связано и его применение в криобиологии [14, 15].
Диметилсульфоксид (ДМСО) имеет высокую практическую значимость. Помимо широкого применения в органическом синтезе [16] он успешно применяется в медицине в качестве транспорта лекарственных веществ в ткани в форме водных и этиленгликолевых растворов ДМСО, в биологии – в качестве криоагента биологических систем [17–22].
Фазовая диаграмма Н2О–ДМСО, изученная авторами [23, 24], имеет конгруэнтно плавящееся при –63°С соединение состава ДМСО · 3Н2О и два инконгруэнтно плавящихся при более низкой температуре (–70°С) соединения состава ДМСО · · 2Н2О и ДМСО · H2О.
Фазовая диаграмма этиленгликоль (ЭГ)–ДМСО, полученная в [25], характеризуется сильным переохлаждением жидкой фазы, стеклованием при –125°С и образованием соединения состава ДМСО · 2ЭГ с температурой плавления ~ –60°С, достаточно близкой к температуре плавления соседних эвтектик (–75 и –70°С). Заметим, что в системе зарегистрировано падение базовой линии при температуре +8…–5°С в интервале концентраций 5–50 мол. % ДМСО, что позволяет предположить существование расслаивания в этой области.
Представляло интерес исследовать фазовую диаграмму системы МЭА–ДМСО и сравнить ее с фазовыми диаграммами Н2О–ДМСО и ЭГ–ДМСО, чтобы выявить влияние особенностей пространственных сеток Н2О, ЭГ и МЭА на фазовые диаграммы их систем.
Физико-химические характеристики исследуемых МЭА и ДМСО представлены в табл. 1 [26–33]. В обоих веществах отмечается близкий интервал жидкой фазы, близкие значения плотности, но колоссальная разница в вязкости – вязкость МЭА почти в 9 раз больше, чем ДМСО (наличие пространственной сетки Н-связей). Следует отметить большой дипольный момент молекулы ДМСО. Молекула ДМСО амфифильна: сольвофобную часть составляют две СН3-группы, сольвофильную – >S=О группа. Пирамидальное строение молекулы ДМСО с атомом S в вершине показано в [34]. Радиус молекулы достаточно большой, расчет пор в жидком МЭА методом молекулярной динамики показал меньший радиус [35]. Но сетка МЭА лабильна и способна образовывать достаточно большие пустоты [36].
Таблица 1.
| Параметр | МЭА | ЭГ | Н2О | ДМСО |
|---|---|---|---|---|
| М [26] | 61 | 62 | 18 | 78 |
| μ, D [27] | 2.27 | 2.88 | 1.83 | 3.96 |
| $D{{N}_{{{\text{SbC}}{{{\text{l}}}_{5}}}}}$ [28] | 41 [29] | 18.5 [29] | 18 | 29.8 |
| ∆vapH, кДж/моль [30] | 49.83 | 50 | 40.66 | 54.39 |
| Постоянная Трутона ∆Hисп/Ткип, кал/моль K |
26.9 | 25.5 | 26.05 | – |
| Тпл, °С [26] | 10.3 | –12.9 | 0 | 18.5 |
| Ткип, °С [26] | 170 | 197 | 100 | 189 |
| ρ(25°C), кг/м3 ×103 [26] | 1.012 | 1.113 | 0.99707 | 1.0955 |
| η(25°C), Па с × 10–3 | 18.95 [31] | 16.16 [32] | 0.8903 [32] | 2.194 [33] |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы ДМСО в МЭА готовили гравиметрически в безводной атмосфере в токе азота. Для приготовления образцов использовали МЭА марки “Acros” (99%) без дополнительной очистки и свежеперегнанный ДМСО марки “Acros”. Чистоту растворителей определяли хроматографически. Содержание воды в образцах не превышало 0.1% (по методу Фишера). Отбор проб и заполнение кювет проводили в сухой камере в токе азота. Термическое поведение образцов системы МЭА–ДМСО исследовали методом дифференциальной сканирующей калориметрии на установках ТА Instruments Q100 DSC (при температурах от +25 до –90°С и от –90 до +40°С, скорость сканирования 3 град/мин, измерения в токе аргона высокой чистоты, погрешность измерений ±1°С) и METTLER TA4000 (Швейцария) в режиме DSC30 (быстрое охлаждение образца парами жидкого азота и нагревание со скоростью 3 град/мин в интервале температур от –140 до +40°С, погрешность измерений ±5°С).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Температуры фазовых переходов в системе МЭА–ДМСО представлены в табл. 2, величины изменения энтальпии (в кДж/моль) в системе МЭА–ДМСО в зависимости от мольной концентрации ДМСО – в табл. 3. Полученные термограммы использованы для построения фазовой диаграммы системы МЭА–ДМСО (рис. 1).
Таблица 2.
Температуры фазовых переходов (°C) в системе МЭА–ДМСО в зависимости от концентрации ДМСО
| ДМСО, мол. % | Ткр↓ | Ткр2↓ | Трасстекл↑ | Ткр↑ | Ткр2↑ | Тпл↑ | Тэвт↑ |
|---|---|---|---|---|---|---|---|
| 0 | –33 | –127 | 10 | ||||
| 0.61 | –33 | –119 | 9 | ||||
| 2.77 | –35 | –121 | 8 | ||||
| 5.12 | –30 | –121 | 10 | –10 | |||
| 6.47 | –32 | –92 | 10 | –10 | |||
| 8.33 | –33 | –117 | 9 | –9 | |||
| 10.00 | –38 | –120 | –55 | 6 | –10 | ||
| 11.93 | –36 | –113 | –67 | 8 | –10 | ||
| 14.67 | –41 | –112 | –66 | 6 | –12 | ||
| 19.96 | –44 | –112 | –72 | –47 | 5 | –9 | |
| 25.00 | –48 | –118 | –58 | –40 | 3 | –11 | |
| 29.55 | –60 | –113 | –73 | 1 | –9 | ||
| 33.17 | –60 | –114 | –72 | –41 | 1 | –9 | |
| 41.87 | –40 | –35 | –118 | –55 | –9 | ||
| 50.61 | –39 | –32 | –114 | –43 | –8 | ||
| 61.66 | –44 | –19 | –118 | –56 | –3 | –11 | |
| 69.71 | –51 | –7 | –118 | –62 | 3 | –12 | |
| 79.96 | –50 | –5 | –119 | –55 | 7 | –12 | |
| 90.05 | –40 | 2 | –119 | –53 | 11 | –11 | |
| 100 | 10 | 19 | |||||
Примечание. Ткр↓ – температура кристаллизации (°C) образца при его охлаждении со скоростью 3 град/мин (ТА Instruments Q100), Tрасстекл↑ – температура расстекловывания (°C) быстро охлажденного образца (Mettler TA4000), Ткр↑ – температура кристаллизации (°C) образца при его нагревании со скоростью 3 град/мин (Mettler TA4000), Тпл↑ – температура плавления (°C) образца при его нагревании со скоростью 3 град/мин (ТА Instruments Q100, Mettler TA4000).
Таблица 3.
Величины изменения энтальпии (кДж/моль) в системе МЭА–ДМСО в зависимости от концентрации ДМСО
| ДМСО, мол. % | ΔНкр↓ | ΔНкр2↓ | ΔНпл↑ | ΔНэвт↑ |
|---|---|---|---|---|
| 0 | –10.13 | 11.53 | ||
| 0.61 | –6.11 | 6.84 | ||
| 2.77 | –8.79 | 10.33 | ||
| 5.12 | –11.51 | 12.06 | 0.19 | |
| 6.47 | –11.36 | 11.92 | 0.31 | |
| 8.33 | –10.92 | 9.92 | 0.62 | |
| 10.00 | –10.28 | 10.09 | 1.13 | |
| 14.67 | –10.67 | 6.79 | 2.48 | |
| 19.96 | –10.95 | 9.47 | 6.37 | |
| 25.00 | –10.57 | 10.96 | 3.65 | |
| 29.55 | –7.33 | 4.82 | 8.32 | |
| 33.17 | –7.40 | 2.73 | 10.93 | |
| 41.87 | –7.63 | –3.75 | 13.62 | |
| 50.61 | –6.68 | –4.73 | 13.50 | |
| 61.66 | –2.64 | –5.08 | 2.43 | 9.79 |
| 69.71 | –3.21 | –6.63 | 2.91 | 3.64 |
| 79.96 | –1.57 | –8.06 | 5.30 | 1.64 |
| 90.05 | –0.99 | –10.38 | 8.85 | 1.30 |
| 100 | –12.17 | 12.32 | ||
Рис. 1.
Фазовая диаграмма системы МЭА–ДМСО: Тпл1–Е–Тпл2 – линия ликвидуса; Тэвт1–Е–Тэвт2 – эвтектическая линия; Tрасстекл1–Tрасстекл2 – линия расстекловывания, Е – точка эвтектики.
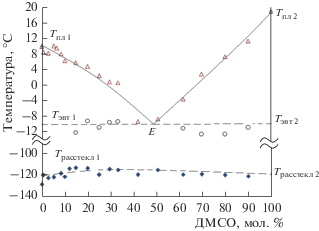
На термограммах при охлаждении образцов со скоростью 3 град/мин (ТА Instruments Q100) зарегистрированы экзотермические пики, отвечающие кристаллизации переохлажденных образцов (Ткр↓).
С увеличением концентрации ДМСО до ~42 мол. % экзотермический пик кристаллизации переохлажденных образцов смещается в сторону меньших температур (Ткр↓ от –33 до –60°С), площадь экзотермического пика с увеличением концентрации ДМСО уменьшается по абсолютной величине (ΔНкр↓ от –10.13 до –7.63 кДж/моль).
Начиная с ~42 мол. % ДМСО, в области отрицательных температур фиксируются два экзотермических пика кристаллизации переохлажденных образцов: Ткр↓ и Ткр2↓ (табл. 2), площадь которых с увеличением концентрации ДМСО ΔНкр↓ уменьшается, а ΔНкр2↓ увеличивается (табл. 3).
При нагревании быстро охлажденных образцов (Mettler TA4000) со скоростью 3 град/мин на термограммах зарегистрировано падение базовой линии при низких температурах (в области ~ −120°С), которое соответствует температуре превращения стекла в переохлажденную жидкость (Tрасстекл1–Tрасстекл2 – линия расстекловывания, табл. 2, рис. 1). При последующем увеличении температуры отмечены экзотермические пики кристаллизации переохлажденной жидкости на этапе нагрева (Tкр↑ и Tкр2↑, табл. 2).
При дальнейшем повышении температуры со скоростью 3 град/мин зафиксированы эндотермические пики (Тпл↑ и Тэвт↑, табл. 2), которым соответствует температура плавления образцов эвтектического состава (Тэвт1–Е–Тэвт2 – эвтектическая линия) и температура плавления образцов (Тпл1–Е–Тпл2 – линия ликвидуса) – рис. 1.
Максимум площади эндотермического пика при плавлении эвтектик приходится на ~50 мол. % ДМСО (ΔНэвт ~ 13.62 кДж/моль). Площадь эндотермических пиков при плавлении образцов (ΔНпл↑) уменьшается от 0 до 33 мол. % ДМСО и начинает увеличиваться от 60 до 100 мол. % ДМСО (табл. 3).
На линии ликвидуса имеется стабильная эвтектика при температуре ~ −10°С и концентрации ~50 мол. % ДМСО. Положение линии ликвидуса (Тпл1–Е–Тпл2) и эвтектических точек (Тэвт1–Е–Тэвт2) на диаграмме состояний системы МЭА–ДМСО (рис. 1) в пределах погрешности измерений хорошо совпадает с результатами, полученными на двух установках (ТА Instruments Q100 и Mettler TA4000) с использованием двух способов охлаждения образцов.
ЗАКЛЮЧЕНИЕ
Получена фазовая диаграмма системы МЭА–ДМСО. Она обладает простой эвтектикой при ~50 мол. % ДМСО. Фазовая диаграмма системы Н2О–ДМСО имеет три гидрата: ДМСО · 3Н2О, ДМСО · 2Н2О и ДМСО · Н2О, а фазовая диаграмма системы ЭГ–ДМСО – соединение состава ДМСО · 2ЭГ и область расслаивания от 5 до 50 мол. % ДМСО при температуре +8…−5°С. В системе МЭА–ДМСО не отмечено ни соединений, ни расслаивания, во всяком случае в исследованном нами интервале температур и давлений.
Различие фазовых диаграмм указанных диметилсульфоксидных систем можно объяснить характеристиками молекул растворителей – Н2О, ЭГ и МЭА и их способностью образовывать водородные связи. Наибольшая энергия межмолекулярных Н-связей – в МЭА [37]. Сходство физических состояний систем МЭА–ДМСО, ЭГ–ДМСО и Н2О–ДМСО на основе растворителей с пространственной сеткой водородных связей – это возможность сильного переохлаждения жидкой фазы в этих системах и тенденция систем к стеклованию, что определяется устойчивостью пространственных сеток водородных связей самих растворителей.
Список литературы
Novakovskaya Yu.V., Rodnikova M.N. // Russ. J. Inorg. Chem. 2014. V. 59. № 11. Р. 1290. [Новаковская Ю.В., Родникова М.Н. // Журн. неорган. химии. 2014. Т. 59. № 11. С. 1534.] https://doi.org/10.1134/S0036023614110175
Vorobyov I., Yappert M.C., DuPre D.B. // J. Phys. Chem. A. 2002. V. 106. P. 668. https://doi.org/10.1021/jp013211e
Silva C.F.P., Duarte M.L.T.S., Fausto R. // J. Mol. Struct. 1999. V. 482/483. P. 591. https://doi.org/10.1016/s0022-2860(98)00794-7
Харитонов Ю.Я., Хошабова Э.Г., Родникова М.Н. и др. // Докл. АН СССР. 1989. Т. 304. № 4. С. 917.
Krueger P.J., Mettee H.D. // Can. J. Chem. 1965. V. 43. P. 2970.
Lane J.R., Schroder S.D., Saunders G.C. et al. // J. Phys. Chem. A. 2016. V. 120. № 32. P. 6371. https://doi.org/10.1021/acs.jpca.6b05898
Rodnikova M.N., Solonina I.A., Solovei A.B. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 12. Р. 1461. [Родникова М.Н., Солонина И.А., Соловей А.Б. и др. // Журн. неорган. химии. 2013. Т. 58. № 12. С. 1628.] https://doi.org/10.1134/S0036023613120176
Mootz D., Brodalla D., Wiebcke M. // Acta Crystallogr. 1989. V. 45. P. 754.
Novakovskaya Yu.V., Rodnikova M.N. // Dokl. Phys. Chem. 2016. V. 467. № 2. Р. 60. [Новаковская Ю.В., Родникова М.Н. // Докл. АН. 2016. Т. 467. № 6. С. 679.] https://doi.org/10.1134/S0012501616040047
Gubskaya A.V., Kusalik P.G. // J. Phys. Chem. A. 2004. V. 108. P. 7151. https://doi.org/10.1021/jp0489222
Alejandre J., Rivera J.L., Mora M.A. et al. // J. Phys. Chem. B. 2000. V. 104. P. 1332. https://doi.org/10.1021/jp993101w
da Silva E.F., Kuznetsova T., Kvamme B. et al. // J. Phys. Chem. B. 2007. V. 111. P. 3695. https://doi.org/10.1021/jp068227p
Solonina I.A., Rodnikova M.N., Kiselev M.P. et al. // Russ. J. Phys. Chem. A. 2015. V. 89. № 5. P. 910. [Солонина И.А., Родникова М.Н., Киселев М.Р. и др. // Журн. физ. химии. 2015. Т. 89. № 5. С. 882.]https://doi.org/10.1134/S0036024415050301
Грищенко В.И. // Проблемы криобиологии. 2005. Т. 15. № 3. С. 231.
Baudot A., Cacela C., Duarte M.L. et al. // Cryobiology. 2002. V. 44. P. 150. https://doi.org/10.1016/s0011-2240(02)00017-2
Martin D., Weise A., Niclas H.-J. // J. Angew. Chem., Int. Engl. Ed. 1967. V. 6. № 4. P. 318.
Martin D., Hanthal H.G. Dimethyl Sulfoxide. N.Y.: Wiley, 1975. 401 p.
Slade L., Levine H. // Crit. Rev. Food Sci. Nutr. 1991. V. 30. P. 115.
Buera M.P., Roos Y., Levine H. et al. // Pure Appl. Chem. 2011. V. 83. № 8. P. 1567. https://doi.org/10.1351/PAC-REP-10-07-02
Clegg J.S. // Comp. Biochem. Physiol. 2001. V. 128. P. 613.
Shalaev E., Franks F. // Amorphous Food and Pharmaceutical Systems / Ed. Levine H. RSC Publishing, Cambridge, UK, 2002. P. 200–215.
Pichugin Yu., Fahy G.M., Morin R. // Cryobiology. 2006. V. 52. P. 228.
Rasmussen D.H., Mackenzie A.P. // Nature (London). 1968. 220. P. 1315.
Murthy S.S.N. // Cryobiology. 1998. V. 36. P. 84. https://doi.org/10.1006/cryo.1997.2064
Solonina I.A., Rodnikova M.N., Kiselev M.R. et al. // Russ. J. Phys. Chem. A. 2018. V. 92. № 5. P. 918. [Солонина И.А., Родникова М.Н., Киселев М.Р. и др. // Журн. физ. химии. 2018. Т. 92. № 5. С. 751.]https://doi.org/10.1134/S0036024418050291
Aldrich. Handbook, 1989.
Осипов О.Я., Минкин В.И., Грановский А.Д. Справочник по дипольным моментам. М.: Высш. школа, 1971.
Гутман В. Химия координационных соединений в неводных растворах. М.: Мир, 1971. 220 с.
Родникова М.Н. Особенности растворителей с пространственной сеткой водородных связей Дис. д-ра …хим. наук. М., 1998.
CRC Handbook of Chem. Phys. 85th ed. 2004.
Maham Y., Liew C.-N., Mather A.E. // J. Solution Chem. 2002. V. 31. № 9. P. 743. https://doi.org/10.1023/A:1021133008053
Quijada-Maldonado E., Meindersma G.W., de Haan A.B. // J. Chem. Thermodyn. 2013. V. 57. P. 500. https://doi.org/10.1016/j.jct.2012.08.024
Palaiologou M.M., Molinou I.E., Tsierkezos N.G. // J. Chem. Eng. Data. 2002. 47. № 5. P.1285. https://doi.org/10.1021/je020063s
Thomas R., Shoemaker C.B., Eriks K. // Acta Crystallogr. 1966. V. 21. № 1. P. 12. https://doi.org/10.1107/s0365110x66002263
Belashchenko D.K., Rodnikova M.N., Balabaev N.K. et al. // Russ. J. Phys. Chem. A. 2016. V. 90. № 1. Р. 100. [Белащенко Д.К., Родникова М.Н., Балабаев Н.К. и др. // Журн. физ. химии. 2016. Т. 90. № 1. С. 64.] https://doi.org/10.1134/S0036024416010052
Rodnikova M.N., Solonina I.A., Troitskii V.M. et al. // Russ. J. Phys. Chem. A. 2015. V. 89. № 3. P. 512. [Родникова М.Н., Солонина И.А., Троицкий В.М. и др. // Журн. физ. химии. 2015. Т. 89. № 3. С. 513.]https://doi.org/10.1134/S0036024415030255
Balabaev N.K., Belashchenko D.K., Rodnikova M.N. et al. // Russ. J. Phys. Chem. A. 2015. V. 89. № 3. P. 398. [Балабаев Н.К., Белащенко Д.К., Родникова М.Н. и др. // Журн. физ. химии. 2015. Т. 89. № 3. С. 401.]https://doi.org/10.1134/S003602441503005X
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


