Журнал неорганической химии, 2019, T. 64, № 8, стр. 811-817
Производные клозо-декаборатного аниона с полиаминами
Е. Ю. Матвеев 1, 2, *, И. П. Лимарев 1, А. И. Ничуговский 2, А. Ю. Быков 1, К. Ю. Жижин 1, 2, Н. Т. Кузнецов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
* E-mail: cat1983@yandex.ru
Поступила в редакцию 27.02.2019
После доработки 04.03.2019
Принята к публикации 15.03.2019
Аннотация
Исследовано взаимодействие 1,4-диоксанового производного клозо-декаборатного аниона с гидразином и рядом полиаминов (тетраэтиленпентаамином, триэтилентетраамином, трис(2-аминоэтил)амином, бис(3-аминопропил)амином, N,N'-бис(3-аминопропил)-1,4-диаминобутаном) в спиртовой среде. Показано, что в результате этих реакций, где полиамины выступают в качестве нуклеофилов, происходит раскрытие циклического заместителя с присоединением соответствующей пендантной функциональной группы. Полученные производные клозо-декаборатного аниона с полиаминными фрагментами, связанными с борным кластером через алкоксильную спейсерную цепь, представляют собой перспективные соединения для получения новых веществ с потенциальной фармакологической активностью для применения в 10B-нейтронозахватной терапии злокачественных опухолей. При этом введенные полиаминные группы дают возможность полученным клозо-боратам связываться с различными полианионными мишенями в клетке (ДНК, РНК, фосфолипидами, заряженными участками белков и т.д.). Полученные соединения исследованы различными методами физико-химического анализа (ИК- и гетероядерной ЯМР-спектроскопи, ESI-MS спектрометрии).
ВВЕДЕНИЕ
Производные высших бороводородных анионов [BnHn]2– (n = 10, 12) с циклическими заместителями оксониевого и тиониевого типов являются прекрасными стартовыми соединениями для получения клозо-боратов с пендантными функциональными группами. Такие реакции протекают при действии как отрицательно заряженных, так и нейтральных нуклеофильных реагентов и сопровождаются раскрытием циклического заместителя. Присоединенные через алкоксильную спейсерную цепь и обособленные таким способом функциональные группы могут представлять собой как относительно малые частицы (–OH, –SH, ‒NO2, –F, –C≡CH и т.д.), так и фрагменты больших молекул, в том числе биологически активных (аминокислот, нуклеотидов, углеводов, краун-эфиров и т.д.) [1–15]. В настоящее время актуальной является разработка методов введения обоих типов групп. Синтезированные соединения с “малыми” реакционноспособными пендантными группами могут быть модифицированы с целью получения производных для применения в 10B-нейтронозахватной терапии (10B-НЗТ) злокачественных опухолей, а соединения с целиком введенными биологически активными фрагментами могут применяться непосредственно в 10B-НЗТ либо использоваться в качестве лигандов в синтезе комплексных соединений с той же конечной целью [16–19].
Биологические полиамины (спермин, спермидин, путресцин и др.) являются важными для метаболизма и достаточно распространенными биологически активными молекулами в живых системах. При физиологических значениях рН полиамины полностью протонированы и по сути являются уникальными поликатионными соединениями, поэтому они могут связываться с различными полианионными мишенями, такими как нуклеиновые кислоты, основные белки, фосфолипиды и др. [20]. Такие процессы связывания протекают при очень низких концентрациях полиаминов. Учитывая этот фактор и крайне широкий диапазон внутриклеточных мишеней для полиаминов, логично предположить, что производные клозо-боратов с полиаминными группами могут стать перспективными соединениями для применения в 10B-НЗТ.
В настоящей работе сообщается об исследовании реакций 1,4-диоксанового производного клозо-декаборатного аниона с гидразином и полиаминами различного строения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Соединение [2-(1-(1,4-диоксаний))]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)[B10H9O2C4H8] синтезировали по разработанной ранее методике [21]. 1,4-Диоксан, тетрагидропиран и тетрагидрофуран очищали согласно [22]. Метанол (99.9%, Merck), этанол (95%), хлорид тетрафенилфосфония (99.9%, Aldrich), тетраэтиленпентаамин (Aldrich, 97%), триэтилентетраамин (Aldrich, 97%), трис(2-аминоэтил)амин (Aldrich, 96%), бис(3-аминопропил)амин (Aldrich, 98%), N,N'-бис(3-аминопропил)-1,4-диаминобутан (Aldrich, 97%) использовали без дополнительной очистки.
Методы физико-химического анализа
Элементный анализ на углерод, водород, азот и серу осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Определение бора методом ICP-MS выполнено на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo в ЦКП Исследовательский научно-аналитический центр ФГУП “ИРЕА”.
ИК-спектры синтезированных соединений записывали на ИК-Фурье-спектрометре ИНФРАЛЮМ ФТ-02 (НПФ АП “Люмекс”) в области 7000–300 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензий в вазелиновом (Aldrich) или фторированном масле “Fluorolube” (Merck).
Спектры ЯМР (1Н, 11B и 13С) растворов записывали на спектрометре Bruker Advance II-300 на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали ТМС и эфират трехфтористого бора (11B).
Масс-спектры с электроспрей-ионизацией пробы для растворов исследуемых веществ в воде и ацетонитриле записывали на спектрометре Bruker MicrOTOF-Q (Bruker Daltonik, Germany). Условия ионизации: Apollo II, источник ионизации – электроспрей, напряжение +(–)4500 V, температура 200°C, поток 3 мкл/мин.
Эксперимент
Взаимодействие с гидразином. 2-[2-(2-гидразиниоэтокси)этокси]нонагидро-клозо-декаборат тетрабутиламмония (Bu4N)[B10H9O(CH2)2O(CH2)2N2H4]. К суспензии (Bu4N)[B10H9O2C4H8] (0.90 г, 2 ммоль) в этиловом спирте (95%, 20 мл) приливали гидрат гидразина (0.11 мл, 2 ммоль) и кипятили реакционную смесь в течение 1 ч. Полученный раствор упаривали на роторном испарителе, остаток высушивали в вакууме масляного насоса при температуре 60°С и остаточном давлении 10–1 мм рт. ст. в течение 1 ч. Продукт перекристаллизовывали из 1-гексанола. Выход 0.76 г (79%.)
Спектр ЯМР 1H (сигналы от катиона не указаны) (CD3CN, δ, м. д.): 3.38 (т, 2H, CН2 (δ)), 3.46 (т, 2H, CН2 (γ)), 3.53 (т, 2H, CН2 (β)), 3.78 (т, 2H, CН2 (α)), 6.53 (с, 4H, +N2Н4); ЯМР 11B (CD3CN, δ, м. д.): –1.4 (c, BO (2)), –4.4, –7.5 (оба д, по 1B, BH (10, 1)), –24.2 (м, BH (3, 5, 6, 9)), –28.7 (д, 2В, ВН (7, 8)), –34.6 (д, 1В, BH (4)); ЯМР 13C (CD3CN, δ, м. д.): 51.0 (СН2 (δ)), 65.4 (СН2 (γ)), 70.0 (СН2 (α)), 71.8 (СН2 (β)). ИК-спектр, см–1: 3084 (ν(N+–H)), 2453 (ν(В–H)), 1543 (δ(H–N+–H)).
ESI-MS.
Найдено, а. е. м.: 237.29 [B10H9O(CH2)2O(CH2)2N2H4]–, (B10C4O2N2H21).
Вычислено: М = 237.26.
Взаимодействие с полиаминами. Раствор, содержащий 0.3 г (0.55 ммоль) (Bu4N)[B10H9O2C4H8], 1.1 моль полиамина (208 мкл тетраэтиленпентаамина, 164 мкл триэтилентетраамина, 165 мкл трис(2-аминоэтил)амина, 154 мкл бис(3-аминопропил)амина или 0.220 мг N,N'-бис(3-аминопропил)-1,4-диаминобутана) и 10 мл этанола (95%), нагревали при перемешивании в течение 2 ч при температуре кипения. К полученному раствору светло-желтого цвета добавляли раствор 0.42 г хлорида тетрафенилфосфония в 20 мл воды. Образовавшийся светло-желтый осадок отфильтровывали, перекристаллизовывали из смеси вода–метанол (1 : 1) и высушивали в глубоком вакууме.
[Тетраэтиленпентааминоэтоксиэтокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)2O(CH2)2NH(CH2)2NH(CH2)2 NH(CH2)2NH(CH2)2NH2]. Выход 0.38 г (67%). ИК-спектр (KBr, см–1): 3262, 3165 (ν(N–H)), 2464 (ν(В–H)), 1590, 1555 (δ(H–N–H)). Спектр ЯМР 11B (CD3CN, δ, м. д.): –1.8 (c, B(2)), –4.7, –8.3 (д, B(10, 1)), –24.0 (м, B(3, 5, 6, 9)), –28.8, –34.7 (д, B (4, 7, 8)); ЯМР 1Н (CD3CN, δ, м. д.): 3.26 (т, СН2 (δ)), 3.29, 3.37 (тт., СН2 (β, γ)), 3.46 (т, СН2 (α)), 2.35–2.85 (м, –NH(CH2)2NH(CH2)2NH(CH2)2NH(CH2)2NH2), 2.00 (с, –NH(CH2)2NH(CH2)2NH(CH2)2NH(CH2)2NH2); ЯМР 13С {1Н} (CD3CN, δ, м. д.): 38.1 (СН2 (δ)), 68.4, 69.5 (СН2 (β, γ)) и 72.4 (СН2 (α)), 41.6, 46.2, 49.2, 52.4, 53.3, 54.7, 61.2, 61.0 (‒NH(CH2)2NH(CH2)2 NH(CH2)2NH(CH2)2NH2).
ESI-MS.
Найдено, а. е. м.: 394.64 [B10H9O(CH2)2O(CH2)2NH2(CH2)2NH(CH2)2NH (CH2)2NH(CH2)2NH2]–, (B10C12O2N5H40).
Вычислено: М = 394.67.
[Триэтилентетрааминоэтоксиэтокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)2O(CH2)2NH(CH2)2NH(CH2)2 NH(CH2)2NH2]. Выход 0.36 г (65%). ИК-спектр (KBr, см–1): 3264, 3171 (ν(N–H)), 2464 (ν(В–H)), 1598, 1558 (δ(H–N–H)). Спектр ЯМР 11B (CD3CN, δ, м. д.): –1.7 (c, B(2)), –4.5, –8.2 (д, B(10, 1)), –24.1 (м, B(3, 5, 6, 9)), –29.2, –34.8 (д, B(4, 7, 8)); ЯМР 1Н (CD3CN, δ, м.д.): 3.25 (т, СН2 (δ)), 3.28, 3.36 (тт., СН2 (β, γ)), 3.44 (т, СН2 (α)), 2.35–2.85 (м, ‒NH(CH2)2NH(CH2)2NH(CH2)2NH2), 2.00 (с, ‒NH(CH2)2NH(CH2)2NH(CH2)2NH2); ЯМР 13С {1Н} (CD3CN, δ, м.д.): 38.1 (СН2 (δ)), 68.4, 69.5 (СН2 (β, γ)) и 72.4 (СН2 (α)), 41.5, 45.3, 49.2, 52.2, 54.7, 61.0 (–NH(CH2)2NH(CH2)2 NH(CH2)2NH2).
ESI-MS.
Найдено, а. е. м.: 351.54 [B10H9O(CH2)2O(CH2)2NH2(CH2)2NH(CH2)2 NH(CH2)2NH2]–, (B10C10O2N4H35).
Вычислено: М = 351.59.
[Трис(2-аминоэтил)аминоэтоксиэтокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)2O(CH2)2NH(CH2)2N(NH2(CH2)2)2]. Выход 0.40 г (72%). ИК-спектр (KBr, см–1): 3267, 3169 (ν(N–H)), 2465 (ν(В–H)), 1592, 1556 (δ(H–N–H)). Спектр ЯМР 11B (CD3CN, δ, м.д.): –1.7 (c, B(2)), –4.7, –8.4 (д, B(10, 1)), –24.1 (м, B(3, 5, 6, 9)), –28.9, –34.9 (д, B(4, 7, 8)); ЯМР 1Н (CD3CN, δ, м. д.): 3.23 (т, СН2 (δ)), 3.27, 3.35 (тт., СН2 (β, γ)), 3.45 (т, СН2 (α)), 2.50–2.68 (м, –NH(CH2)2N(NH2(CH2)2)2), 1.8 (с, ‒NH(CH2)2N(NH2(CH2)2)2); ЯМР 13С {1Н} (CD3CN, δ, м. д.): 38.0 (СН2 (δ)), 68.3, 69.3 (СН2 (β, γ)) и 72.2 (СН2 (α)), 39.8, 57.2, 61.3, 70.8 (–NH(CH2)2N(NH2(CH2)2)2).
ESI-MS.
Найдено, а. е. м.: 351.57 [B10H9O(CH2)2O(CH2)2NH2(CH2)2N(NH2(CH2)2)2]–, (B10C10O2N4H35).
Вычислено: М = 351.59.
[Бис(3-аминопропил)аминоэтоксиэтокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)2O(CH2)2NH(CH2)3NH(CH2)3NH2]. Выход 0.35 г (62%). ИК-спектр (KBr, см–1): 3265, 3171 (ν(N–H)), 2459 (ν(В–H)), 1593, 1560 (δ(H–N–H)) ЯМР 11B (CD3CN, δ, м.д.): –1.9 (c, B(2)), –4.8, –8.6 (д, B(10, 1)), –24.2 (м, B(3, 5, 6, 9)), –29.0, –34.8 (д, BH(4, 7, 8)). ЯМР 1Н (CD3CN, δ, м.д.): 3.25 (т, СН2 (δ)), 3.27, 3.34 (тт., СН2 (β, γ)), 3.42 (т, СН2 (α)), 2.52–2.84, 1.54–1.75 (мм, ‒NH(CH2)3NH(CH2)3NH2), 2.35 (с, ‒NH(CH2)3NH(CH2)3NH2). 13С {1Н} ЯМР (CD3CN, δ, м. д.): 38.2 (СН2 (δ)), 68.4, 69.5 (СН2 (β, γ)) и 72.3 (СН2 (α)), 28.5, 28.7, 45.3, 49.4, 52.6, 53.5 (‒NH(CH2)3NH(CH2)3NH2).
ESI-MS.
Найдено, а. е. м.: 335.52 [B10H9O(CH2)2O(CH2)2NH2(CH2)3NH(CH2)3NH2]–. (B10C10O2N3H33).
Вычислено: М = 335.56.
[N,N'-бис(3-аминопропил)-1,4-диаминобутаноэтоксиэтокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)2O(CH2)2NH(CH2)3NH(CH2)4NH(CH2)3NH2]. Выход 0.36 г (61%). ИК-спектр (KBr, см–1): 3251, 3159 (ν(N–H)), 2460 (ν(В–H)), 1587, 1552 (δ(H–N–H)). Спектр ЯМР 11B (CD3CN, δ, м. д.): –1.8 (c, B(2)), –4.8, –8.3 (д, B(10, 1)), –24.2 (м, B(3, 5, 6, 9)), –28.9, –34.7 (д, BH(4, 7, 8)); ЯМР 1Н (CD3CN, δ, м. д.): 3.23 (т, СН2 (δ)), 3.26, 3.32 (тт., СН2 (β, γ)), 3.40 (т, СН2 (α)), 2.15–2.80, 1.60–1.85 (мм, –NH(CH2)3NH (CH2)4NH(CH2)3NH2), 2.15 (с, –NH(CH2)3NH (CH2)4NH(CH2)3NH2); ЯМР 13С {1Н} (CD3CN, δ, м. д.): 38.4 (СН2 (δ)), 68.5, 69.8 (СН2 (β, γ)) и 72.4 (СН2 (α)), 27.8, 28.9, 30.1, 30.4, 45.3, 49.4, 52.6, 53.5 (‒NH(CH2)3NH(CH2)4NH(CH2)3NH2).
ESI-MS.
Найдено, а. е. м.: 406.68 [B10H9O(CH2)2O(CH2)2NH2(CH2)3NH(CH2)4NH(CH2)3NH2]–, (B10C14O2N4H42).
Вычислено: М = 406.70.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из литературы известно, что взаимодействие нуклеофильного реагента с замещенным производным клозо-декаборатного аниона оксониевого типа приводит к раскрытию циклического заместителя с последующим присоединением функциональной группы через алкоксильную спейсерную цепь [1–15]. Такие реакции позволяют присоединять O-, N-, S-, С-нуклеофилы и получать соединения с соответствующими пендантными группами.
Ранее нами было исследовано взаимодействие производных клозо-декаборатного аниона с заместителями оксониевого типа [B10H9O2C4H8]–, [B10H9OC4H8]– и [B10H9OC5H10]– с рядом как отрицательно заряженных (–NO2, –N3, –N(CO)2C6H4, –NHC6H5), так и нейтральных (NH3, NH2CH2CH2NH2) N-нуклеофилов [1, 15]. В настоящей работе изучено взаимодействие 1,4-диоксанового производного аниона [B10H10]2– с гидразином и полиаминами различного строения (тетраэтиленпентаамином, триэтилентетраамином, трис(2-аминоэтил)амином, бис(3-аминопропил)амином, N,N'-бис(3-аминопропил)-1,4-диаминобутаном).
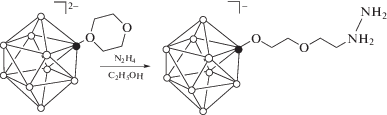
Показано, что в результате реакции с гидразином протекает раскрытие циклического заместителя с присоединением пендантной гидразиниевой группы (схема 1 ) с образованием единственного продукта –[B10H9O(CH2)2O(CH2)2N2H4]–.
Схема 1 . Взаимодействие 1,4-диоксанового производного аниона [B10H10]2– с гидразином в этаноле.
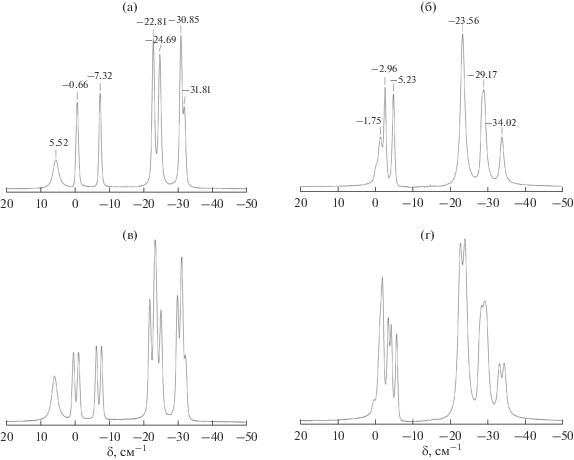
Первичную информацию о строении полученных замещенных производных можно извлечь из их спектров ЯМР 11В. В частности, спектр продукта реакции 1,4-диоксанового производного аниона [B10H10]2– с гидразином сохраняет общий вид, характерный для клозо-декаборатов с заместителем в экваториальном поясе, однако в нем наблюдается значительная перегруппировка сигналов от атомов бора по сравнению со спектром исходного производного клозо-декаборатного аниона (рис. 1). Например, сигнал от ипсо-атома бора при 5.52 м. д. смещается в сторону сильного поля до –1.75 м. д. вследствие изменения типа атома заместителя с оксониевого на алкоксильный и снижения полярности связи В–О. Сигналы от двух неэквивалентных апикальных вершин полиэдра в спектре продукта реакции сближаются и меняют свое положение с –0.66 и –7.32 м. д. до –2.96 и –5.23 м. д. соответственно. Также происходит перераспределение интенсивности сигналов в области сильного поля: в спектре продукта реакции присутствуют сигналы при –23.56, –29.17 и –34.02 м. д.
Рис. 1.
Спектры ЯМР 11В {1H} и 11B анионов [B10H9O2C4H8]2– (а и в соответственно) и [B10H9O(CH2)2O(CH2)2NH2NH2]– (б и г соответственно).
В спектрах ЯМР 1Н и 13С наблюдаются значительные изменения по сравнению со спектрами исходного продукта. Например, в спектре ЯМР 13С тетрабутиламмониевой соли продукта появляются четыре синглета от атомов углерода алкоксильного спейсера при 71.8 (СН2 (α)), 70.0 (СН2 (β)), 65.4 (СН2 (γ)) и 51.0 м. д. (СН2 (δ)). В спектре ЯМР 1Н этого же соединения также появляются четыре триплета от протонов спейсерной цепи: 3.78 (СН2 (α)), 3.53 (СН2 (β)), 3.46 (СН2 (γ)), 3.38 м. д. (СН2 (δ)). Кроме того, в спектре появляются сигналы от протонов гидразиниевой группы при 6.53 м. д.
В ИК-спектре аниона с раскрытым циклическим заместителем наблюдается перераспределение интенсивности в области валентных и деформационных колебаний по сравнению с 1,4-диоксановым производным клозо-декаборатного аниона. В спектрах соединений наблюдаются полосы поглощения в области 2990–3084 см–1, отвечающие валентным колебаниям связей +N–H, а также полосы при 1543–1590 см–1, соответствующие деформационным колебаниям связей H–N+–H.
В анионной части ESI-MS спектра полученного вещества присутствует пик от однозарядного аниона [B10H9O(CH2)2O(CH2)2NH2NH2]– при 237.29 а. е. м., что хорошо согласуется с вычисленным значением (237.26 а. е. м.).
Таким образом, совокупность данных физических и физико-химических методов анализа однозначно указывает на получение производных с пендантной гидразиниевой группой. Следует отметить, что образование протонированных форм продуктов характерно для данного типа реакций и описано в литературе на примере взаимодействия аниона [B12H11O2C4H8]– с водным раствором аммиака [23].
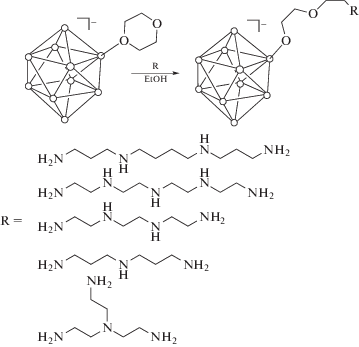
На основании проведенных исследований и анализа литературных данных можно предположить, что в реакции раскрытия циклического заместителя монозамещенного производного клозо-декаборатного аниона могут вступать вещества, содержащие большее число аминогрупп. В результате таких реакций образуются соединения, способные к дальнейшим модификациям (например, к комплексообразованию или “сшивке” нескольких кластеров) и пригодные для использования в качестве биологически активных веществ, в частности для 10В-НЗТ. Вследствие этого нами была проведена серия экспериментов с участием различных полиаминов (схема 2 ).
Схема 2 . Раскрытие циклического заместителя в 1,4-диоксановом производном клозо-декаборатного аниона с помощью полиаминов.
Как и ожидалось, такие реакции протекают аналогично взаимодействию 1,4-диоксанового производного клозо-декаборатного аниона с гидразином, т.е. происходит раскрытие циклического заместителя с присоединением азотсодержащих функциональных групп через алкоксильную спейсерную цепочку. Реакционноспособными в данном случае являются только терминальные атомы азота полиаминов. Именно они участвуют в процессе раскрытия оксониевого цикла в исходном клозо-декаборате, и поэтому в результате каждой реакции образуется единственный продукт. Отсутствие взаимодействия с нетерминальными атомами азота полиаминов, по-видимому, связано со стерическими затруднениями.
Как и в общем случае реакций раскрытия циклических заместителей в производных клозо-декаборатного аниона, спектры ЯМР 11В продуктов взаимодействия аниона [B10H9O2C4H8]– с полиаминами весьма схожи и позволяют судить только о степени протекания исследуемых реакций. Информацию о строении экзо-полиэдрического заместителя можно извлечь из спектров ЯМР 1Н и 13С. Следует отметить, что сигналы от метиленовых групп пендантного полиаминного фрагмента имеют очень схожие химические сдвиги и поэтому представлены в спектрах в виде одного сложного мультиплета.
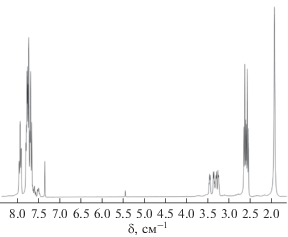
В качестве примера на рис. 2 приведен спектр ЯМР 1Н продукта взаимодействия 1,4-диоксанового производного клозо-декаборатного аниона с трис(2-аминоэтил)амином. В спектре наблюдается интенсивный мультиплет от атомов водорода тетрафенилфосфониевого катиона в слабом поле при 8.0–7.5 м. д. В сильном поле присутствуют четыре триплета от α-, β-, γ-, δ-метиленовых групп алкоксильного спейсера при 3.45, 3.35, 3.27, 3.23 м.д. соответственно, мультиплет от метиленовых групп присоединенного полиамина при 2.50–2.68 м. д, а также один синглет от протонов, связанных с концевыми аминогруппами полиамина при 1.8 м. д.
В спектре ЯМР 13С фиксируются аналогичные изменения. Присутствуют четыре синглета от α-, β-, γ-, δ-метиленовых групп алкоксильной спейсерной цепочки при 72.2, 69.3, 68.3, 38.0 м. д. соответственно, два синглета от этиленового фрагмента вторичной аминогруппы присоединенного полиамина при 39.8 и 57.2 м. д. и два синглета от химически эквивалентных этиленовых фрагментов третичной аминогруппы полиамина при 61.3 и 70.8 м. д.
В ходе исследования был разработан новый эффективный способ функционализации аниона [В10Н10]2–, позволяющий с высоким выходом получать клозо-бораты с пендантными N-содержащими функциональными группами. Введение гидразиниевой компоненты дает возможность дальнейшей разносторонней модификации синтезированных производных. Соединения с фрагментами полиаминов представляют интерес как потенциальные лиганды для получения обширного круга координационных соединений. Используя полиамины различного состава и длины, можно легко регулировать строение и свойства пендантного экзо-полиэдрического заместителя.
Полученные производные с пендантными азотсодержащими функциональными группами представляют собой перспективные соединения для получения новых веществ с потенциальной фармакологической активностью для применения в 10B-нейтронозахватной терапии злокачественных опухолей. При этом введенные полиаминные группы дадут возможность полученным клозо-боратам связываться с различными полианионными мишенями в клетке (ДНК, РНК, фосфолипидами, заряженными участками белков и т.д.) [20].
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований и при финансовой поддержке гранта ведущих научных школ Российской Федерации НШ-2845.2018.3.
Аналитические исследования выполнены в ЦКП (РТУ-МИРЭА) и ЦКП “Исследовательский научно-аналитический центр ФГУП “ИРЕА”.
Список литературы
Matveev E.Yu., Retivov V.M., Razgonyaeva G.A. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 10. P. 1549. [Матвеев Е.Ю., Ретивов В.М., Разгоняева Г.А. и др. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1628.]https://doi.org/10.1134/S0036023611100160
Prikaznov A.V., Shmal’ko A.V., Sivaev I.B. et al. // Polyhedron. 2011. V. 30. P. 1494. https://doi.org/10.1016/j.poly.2011.02.055
Matveev E.Yu., Razgonyaeva G.A., Mustyatsa V.N. et al. // Russ. Chem. Bull. 2010. V. 59. № 3. P. 556. [Матвеев Е.Ю., Разгоняева Г.А., Мустяца В.Н. и др. // Изв. АН. Сер. хим. 2010. № 3. С. 544.]https://doi.org/10.1007/s11172-010-0125-0
Semioshkin A.S., Sivaev I.B., Bregadze V.I. // Dalton Trans. 2008. P. 977. https://doi.org/10.1039/B715363E
Orlova A.V., Kondakov N.N., Kimel B.G. et al. // Appl. Organomet. Chem. 2007. V. 21. P. 98. https://doi.org/10.1002/aoc.1151
Matveev E.Yu., Akimov S.S., Kubasov A.S. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 6. P. 808. [Матвеев Е.Ю., Акимов С.С., Кубасов А.С. и др. // Журн. неорган. химии. 2017. Т. 62. № 6. С. 827.]https://doi.org/10.1134/S0036023617060146
Zhizhin K.Yu., Mustyatsa V.N., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2005. V. 50. № 2. P. 245. [Жижин К.Ю., Мустяца В.Н., Малинина Е.А. и др. // Журн. неорган. химии. 2005. Т. 50. № 2. С. 243.]
Peymann T., Kuck K., Gabel D. // Inorg. Chem. 1997. V. 36. P. 5138. https://doi.org/10.1021/ic970647t
Grin M.A., Semioshkin A.A., Titeev R.A. et al. // Mendeleev Commun. 2007. V. 17. P. 14. https://doi.org/10.1016/j.mencom.2007.01.005
Sivaev I.B., Semioshkin A.A., Brellochs B. et al. // Polyhedron. 2000. V. 19. P. 627. https://doi.org/10.1016/S0277-5387(00)00293-X
Prikaznov A.V., Laskova Yu.N., Semioshkin A.A. et al. // Russ. Chem. Bull. 2011. V. 60. № 12. P. 2550. https://doi.org/10.1007/s11172-011-0392-4 [Приказнов А.В., Ласкова Ю.Н., Семиошкин А.А. и др. // Изв. АН. Сер. хим. 2011. № 12. С. 2501.]
Laskova J., Kozlova A., Białek-Pietras M. et al. // J. Organomet. Chem. 2016. V. 807. P. 29. https://doi.org/10.1016/j.jorganchem.2016.02.009
Kikuchi S., Kanoh D., Sato S. et al. // J. Controlled Release. 2016. V. 237. P. 160. https://doi.org/10.1016/j.jconrel.2016.07.017
Laskova J., Kozlova A., Ananyev I. et al. // J. Organomet. Chem. 2017. V. 834. P. 64. https://doi.org/10.1016/j.jorganchem.2017.02.009
Kubasov A.S., Matveev E.Yu., Retivov V.M. et al. // Russ. Chem. Bull. 2011. V. 63. № 1. P. 187 [Кубасов А.С., Матвеев Е.Ю., Ретивов В.М. и др. // Изв. АН. Сер. хим. 2014. № 1. С. 187.]https://doi.org/10.1007/s11172-014-0412-2
Bregadze V.I., Sivaev I.B., Lobanova I.A. // Appl. Radiat. Isot. 2009. V. 67. S101. https://doi.org/10.1016/j.apradiso.2009.03.024
Barth R.F. // Appl. Radiat. Isot. 2009. V. 67. № S3. https://doi.org/10.1016/j.apradiso.2009.03.102
Moss R.L. // Appl. Radiat. Isot. 2014. V. 88. P. 2. https://doi.org/10.1016/j.apradiso.2013.11.109
Barth R.F., Vicente MGraca H., Harling O.K. et al. // Radiation Oncology. 2012. V. 7. P. 146. https://doi.org/10.1186/1748-717X-7-146
Силачев Д.Н., Плотников Е.Ю., Горюнов К.В. и др. // Цитология. 2018. Т. 60. № 3. С. 164.
Zhizhin K.Yu., Mustyatsa V.N., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2004. V. 49. № 2. P. 180. [Жижин К.Ю., Мустяца В.Н., Малинина Е.А. и др. // Журн. неорган. химии. 2004. Т. 49. № 2. С. 221.]
Органикум. Пер. с нем. Т. 1. М.: Мир, 1992.
Semioshkin A., Nizhnik E., Godovikov I. et al. // J. Organomet. Chem. 2007. V. 692. P. 4020. https://doi.org/10.1016/j.jorganchem.2007.06.00
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии