Журнал неорганической химии, 2019, T. 64, № 8, стр. 850-861
Неожиданное образование алкоголятного мостика в координационном полимере аддукта Zn(OOCPh)2[O(H)Me]4 и бидентатного γ,γ'-дипиридила
А. А. Гринева 1, О. Д. Грехова 1, Р. Р. Датчук 1, М. А. Уварова 1, С. Е. Нефедов 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: snef@igic.ras.ru
Поступила в редакцию 24.09.2018
После доработки 31.01.2019
Принята к публикации 15.03.2019
Аннотация
Установлено, что перекристаллизация Zn(OOCPh)2[O(H)Me]4 (1) (диффузия хлороформа в раствор в метаноле, растворение порошка в кипящем MeCN, выдерживание метанольного раствора при комнатной температуре) сопровождается образованием монокристаллов полимера {Zn(µ-OOCPh)3Zn(µ-OOCPh)}n. Диффузия раствора γ,γ'-дипиридила в MeOH в раствор 1 (соотношение 1 : 1) в метаноле приводит к образованию полимера {Zn(µ-dipy)(η2-OOCPh)(OOCPh)}n, а аналогичная реакция, но при соотношении 2 : 1 и сильном разбавлении – к депротонированию метанола с образованием {Zn[(µ-OMe)(µ-OOCPh)Zn(OOCPh)]2(µ-dipy)2}n. Полученные соединения охарактеризованы данными химического анализа, ИК-спектрами, а также методом РСА.
ВВЕДЕНИЕ
Органические молекулы, имеющие несколько донорных центров и/или функциональных групп, используются в современной координационной химии для получения сложных гомо- и гетерометаллических комплексов, и кластеров, а также при построении полимерных металлсодержащих молекул с регулируемыми размерами пор, способных, как и природные цеолиты, сорбировать малые молекулы и газы и/или выступать в качестве их детекторов. В последние годы такие координационные полимеры (КП) активно синтезируются и изучаются из-за необычных физико-химических свойств (магнитных, каталитических, электронно-оптических и т.д.) [1–9].
Одним из популярных синтетических подходов к получению КП и увеличению их размерности является формирование полимеров в результате реакций сильных N-донорных молекул, например 4,4'-дипиридила и его производных, с электронодефицитными моно- или полиядерными комплексами [1–9].
Ранее обнаружено, что реакции классического γ,γ'-дипиридила с моноядерными аддуктами цинка(II), кобальта(II) и никеля(II) – M[(OOCC5H4)Mn(CO)3]2[O(H)Me]4, содержащими лабильные молекулы метанола [10–12], приводят к образованию 1D-КП, причем их строение определяется природой переходного металла [13].
В настоящей работе на основании данных РСА сообщается о формировании 1D-КП, полученных реакцией метанольного аддукта бензоата цинка [14] с γ,γ'-дипиридилом, а также обсуждается строение необычного полимера, содержащего алкоголятные мостики, образующиеся в результате депротонирования координированного метанола.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции по синтезу и выделению комплексов проводили в атмосфере чистого аргона с использованием абсолютированных растворителей.
ИК-спектры кристаллических образцов регистрировали в интервале 4000–550 см–1 методом нарушенного полного внутреннего отражения на ИК-Фурье-спектрометре NEXUS фирмы Nicolet с использованием приставки MIRacle фирмы PIKE Technologies с алмазным кристаллом.
Рентгеноструктурные исследования выполнены по стандартной методике на автоматическом дифрактометре Bruker SMART Apex II, оборудованном CCD-детектором (λMo, графитовый монохроматор, ω-сканирование). Расчеты структур проводили с использованием комплекса программ SHELXTL PLUS (PC-версия), уточнение структур – с помощью программы SHELXTL-97 [15–17].
Кристаллографические данные и детали уточнения приведены в табл. 1, основные геометрические параметры изученных комплексов – в табл. 2–4. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC № 1886160-1886163).
Таблица 1.
Кристаллографические параметры и детали уточнения структур комплексов 2–4
| Параметр | 2 | 3 | 4 |
|---|---|---|---|
| Номер CCDC | 1 886 163 | 1 886 160 | 1 886 161 |
| Брутто-формула | C28H20O8Zn2 | C24H18N2O4Zn | C50H42N4O10Zn3 |
| М | 615.18 | 463.77 | 1054.99 |
| T, K | 150(2) | 150(2) | 150(2) |
| Цвет | Бесцветный | Бесцветный | Бесцветный |
| Сингония | Моноклинная | Моноклинная | Триклинная |
| Пр. гр. | P2(1)/c | C2/c | P |
| a, Ǻ | 10.7937(16) | 27.340(2) | 9.6333(8) |
| b, Ǻ | 12.6801(18) | 22.671(2) | 11.3552(10) |
| c, Ǻ | 18.887(3) | 7.5757(6) | 11.3810(10) |
| α, град | 90 | 90 | 98.005(2) |
| β, град | 100.329(3) | 104.004(2) | 105.106(2) |
| γ, град | 90 | 90 | 110.4660(10) |
| V, Å3 | 2543.0(6) | 4555.9(7) | 1088.92(16) |
| Z | 4 | 8 | 1 |
| dрасч, мг/м3 | 1.607 | 1.352 | 1.609 |
| μ, мм–1 | 1.937 | 1.109 | 1.707 |
| F(000) | 1248 | 1904 | 540 |
| Размеры кристалла, мм | 0.26 × 0.24 × 0.22 | 0.18 × 0.16 × 0.14 | 0.24 × 0.22 × 0.20 |
| θ-область сканирования, град | 2.50– 30 | 2.84–25.000 | 2.38–29.99 |
| Интервалы индексов отражений | –15 ≤ h ≤ 10, –15 ≤ k ≤ 17, –12 ≤ l ≤ 26 |
–32 ≤ h ≤ 32, –26 ≤ k ≤ 26, –9 ≤ l ≤ 9 |
–13 ≤ h ≤ 11, –15 ≤ k ≤ 15, –15 ≤ l ≤ 15 |
| Число отражений | 9562 | 18112 | 8461 |
| Число независимых отражений | 6827 [Rint = 0.0222] | 3926 [Rint = 0.0677] | 5837 [Rint = 0.0314] |
| GOOF | 1.011 | 1.014 | 1.011 |
| R[I > 2σ(I)] | R1 = 0.0406, wR2 = 0.0907 | R1 = 0.0949, wR2 = 0.2326 | R1 = 0.0509, wR2 = 0.1003 |
| R (по всем рефлексам) | R1 = 0.0693, wR2 = 0.1045 | R1 = 0.1404, wR2 = 0.2706 | R1 = 0.0852, wR2 = 0.1150 |
| max/min пики электронной плотности, e Å–3 | 0.984 и –0.977 | 1.657 и –1.402 | 0.664…–0.547 |
Таблица 2.
Основные длины связей и величины валентных углов в комплексе 2
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Zn(1)–O(3) | 1.931(2) | Zn(1)–O(7) | 1.932(2) |
| Zn(1)–O(5) | 1.933(2) | Zn(1)–O(1) | 1.949(2) |
| Zn(2)–O(2) | 1.936(2) | Zn(2)–O(4) | 1.9380(19) |
| Zn(2)–O(8) | 1.939(2) | Zn(2)–O(6) | 1.956(2) |
| Угол | ω, град | Угол | ω, град |
| O(3)Zn(1)O(7) | 106.27(9) | O(3)Zn(1)O(5) | 116.24(9) |
| O(7)Zn(1)O(5) | 98.80(9) | O(3)Zn(1)O(1) | 103.34(9) |
| O(7)Zn(1)O(1) | 109.70(9) | O(5)Zn(1)O(1) | 121.56(9) |
| O(2)Zn(2)O(4) | 113.95(9) | O(2)Zn(2)O(8) | 108.89(9) |
| O(4)Zn(2)O(8) | 111.60(9) | O(2)Zn(2)O(6) | 109.80(10) |
| O(4)Zn(2)O(6) | 112.98(10) | O(8)Zn(2)O(6) | 98.52(8) |
| C(1)O(1)Zn(1) | 137.8(2) | C(1)O(2)Zn(2) | 126.60(19) |
| C(8)O(3)Zn(1) | 122.85(17) | C(8)O(4)Zn(2) | 141.4(2) |
| C(15)O(5)Zn(1) | 132.0(2) | C(15)O(6)Zn(2) | 131.41(18) |
| C(22)O(7)Zn(1) | 139.57(19) | C(22)#1O(8)Zn(2) | 117.32(18) |
Таблица 3.
Основные длины связей и величины валентных углов в комплексе 3
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Zn(1)–O(4A) | 1.938(16) | Zn(1)–O(1) | 1.952(6) |
| Zn(1)–N(1) | 2.046(6) | Zn(1)–N(2) | 2.081(6) |
| Zn(1)–O(4) | 2.420(17) | Zn(1)–O(3) | 2.482(10) |
| Угол | ω, град | Угол | ω, град |
| O(4A)Zn(1)O(1) | 131.0(5) | O(4A)Zn(1)N(1) | 120.3(5) |
| O(1)Zn(1)N(1) | 97.4(2) | O(4A)Zn(1)N(2) | 94.9(5) |
| O(1)Zn(1)N(2) | 107.2(3) | N(1)Zn(1)N(2) | 102.2(2) |
| O(4A)Zn(1)O(4) | 38.0(6) | O(1)Zn(1)O(4) | 154.1(5) |
| N(1)Zn(1)O(4) | 82.8(5) | N(2)Zn(1)O(4) | 98.0(5) |
| O(4A)Zn(1)O(3) | 56.6(5) | O(1)Zn(1)O(3) | 98.7(3) |
| N(1)Zn(1)O(3) | 88.1(3) | N(2)Zn(1)O(3) | 150.4(3) |
| O(4)Zn(1)O(3) | 55.3(5) | C(19)N(1)C(15) | 115.5(6) |
| C(19)N(1)Zn(1) | 120.2(5) | C(15)N(1)Zn(1) | 124.4(5) |
| C(24)N(2)Zn(1) | 121.0(5) | C(20)N(2)Zn(1) | 120.1(6) |
| C(1)O(1)Zn(1) | 117.2(5) | C(8)O(3)Zn(1) | 86.3(13) |
| C(8A)O(3)Zn(1) | 80.4(8) |
Таблица 4.
Основные длины связей и величины валентных углов в комплексе 4
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Zn(1)–O(5)#1 | 2.055(2) | Zn(1)–O(5) | 2.055(2) |
| Zn(1)–N(1) | 2.146(3) | Zn(1)–N(1)#1 | 2.146(3) |
| Zn(1)–O(1)#1 | 2.193(2) | Zn(1)–O(1) | 2.193(2) |
| Zn(2)–O(5) | 1.914(2) | Zn(2)–O(3) | 1.969(2) |
| Угол | ω, град | Угол | ω, град |
| O(5)#1Zn(1)O(5) | 180.00(10) | O(5)#1Zn(1)N(1) | 91.64(10) |
| O(5)Zn(1)N(1) | 88.36(10) | O(5)#1Zn(1)N(1)#1 | 88.36(10) |
| O(5)Zn(1)N(1)#1 | 91.64(10) | N(1)Zn(1)N(1)#1 | 180.0 |
| O(5)#1Zn(1)O(1)#1 | 89.71(9) | O(5)Zn(1)O(1)#1 | 90.29(9) |
| N(1)Zn(1)O(1)#1 | 90.86(9) | N(1)#1Zn(1)O(1)#1 | 89.14(9) |
| O(5)#1Zn(1)O(1) | 90.29(9) | O(5)Zn(1)O(1) | 89.71(9) |
| N(1)Zn(1)O(1) | 89.14(9) | N(1)#1Zn(1)O(1) | 90.86(9) |
| O(1)#1Zn(1)O(1) | 180.0 | O(5)Zn(2)O(3) | 123.38(10) |
| O(5)Zn(2)O(2) | 103.94(10) | O(3)Zn(2)O(2) | 107.31(10) |
| O(5)Zn(2)N(2) | 114.87(10) | O(3)Zn(2)N(2) | 107.80(10) |
| O(2)Zn(2)N(2) | 95.38(10) | C(1)O(1)Zn(1) | 134.2(2) |
| C(1)#1O(2)Zn(2) | 117.5(2) | C(8)O(3)Zn(2) | 107.6(2) |
| C(25)O(5)Zn(2) | 116.2(2) | C(25)O(5)Zn(1) | 128.9(2) |
| Zn(2)O(5)Zn(1) | 114.56(11) | C(15)N(1)C(19) | 116.4(3) |
| C(15)N(1)Zn(1) | 120.8(2) | C(19)N(1)Zn(1) | 122.7(2) |
| C(20)N(2)Zn(2) | 119.5(2) | C(24)N(2)Zn(2) | 123.4(2) |
Рентгеноструктурные исследования выполнены с использованием оборудования ЦКП ФМИ ИОНХ РАН, функционирующего при поддержке государственного задания ИОНХ РАН в области фундаментальных научных исследований.
Синтез комплексов {Zn(µ-OOCPh)3Zn(µ-OOCPh)}n (2)
а) Раствором 0.1 г (0.24 ммоль) комплекса Zn(OOCPh)2[O(H)Me]4 в 10 мл метанола аккуратно покрывали хлороформ (5 мл) и оставляли при комнатной температуре на 10 сут. Образовавшиеся в ходе диффузии бесцветные монокристаллы отделяли от маточного раствора декантацией, промывали гексаном и сушили в токе аргона. Выход 92% (0.06 г).
б) Монокристаллы аддукта Zn(OOCPh)2[O(H)Me]4 (0.1 г, 0.24 ммоль) растирали в ступке и выдерживали на воздухе при комнатной температуре в течение 1 ч. Порошок кипятили 3 ч в 7 мл ацетонитрила при перемешивании. Раствор отделяли от нерастворившегося осадка (0.03 г) и выдерживали в холодильнике при 5°С в течение 12 ч. Полученные бесцветные крупные монокристаллы отделяли декантацией, промывали последовательно холодным ацетонитрилом (10 мл), бензолом (10 мл), гексаном (10 мл) и сушили в токе аргона. Выход 58% (0.041 г).
в) Монокристаллы аддукта Zn(OOCPh)2[O(H)Me]4 растворяли в 10 мл кипящего метанола и оставляли в колбе при комнатной температуре на 3 мес. Полученные при этом крупные призматические кристаллы отделяли от раствора декантацией, промывали бензолом (10 мл), гексаном (10 мл) и сушили в токе аргона.
ИК-спектр 2 (ν, см–1): 1632 ср, 1592 ср, 1575 ср, 1554 сл, 1538 ср, 1552 с, 1494 ср, 1411 с, 1311 сл, 1175 сл, 1070 сл, 1026 сл, 938 сл, 865 сл, 841 сл, 821 сл, 818 сл, 713 с, 675 с, 611 сл.
{Zn(µ-dipy)(η2-OOCPh)(OOCPh)}n (3)
Раствор 0.1 г (0.24 ммоль) комплекса Zn(OOCPh)2[O(H)Me]4 в 5 мл метанола аккуратно покрывали раствором 0.036 г (0.24 ммоль) γ,γ'-дипиридила в 3 мл метанола и оставляли при комнатной температуре на 2 сут. Образовавшиеся белые монокристаллы отделяли от маточного раствора декантацией, промывали гексаном и сушили в токе аргона. Выход 88% (0.1 г).
ИК-спектр (ν, см–1): 3062 сл, 2864 сл, 2797 сл, 1598 с, 1555 с, 1489 ср, 1447 сл, 1397 с, 1361 с, 1217 ср, 1172 сл, 1158 сл, 1130 сл, 1068 с, 1046 ср, 1022 ср, 840 ср, 810 ср, 802 с, 714 с, 680 с, 639 ср, 630 ср.
{Zn[(µ-OMe)(µ-OOCPh)Zn(OOCPh)]2(µ-dipy)2}n (4)
Раствор 0.1 г (0.24 ммоль) комплекса Zn(OOCPh)2[O(H)Me]4 в 10 мл метанола аккуратно покрывали раствором 0.018 г (0.12 ммоль) γ,γ'-дипиридила в 15 мл метанола и оставляли при комнатной температуре. Образовавшиеся через 10 сут бесцветные монокристаллы отделяли от маточного раствора декантацией, промывали последовательно бензолом (10 мл), гексаном (10 мл) и сушили в токе аргона. Выход 37% (0.023 г).
ИК-спектр (ν, см–1): 2860 сл, 2800 сл, 1601 с, 1558 с, 1479 ср, 1390 с, 1358 с, 1210 ср, 1160 сл, 1128 сл, 1061 с, 1044 ср, 1018 ср, 838 ср, 808 ср, 800 с, 711 с, 678 с, 635 ср, 627 ср.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
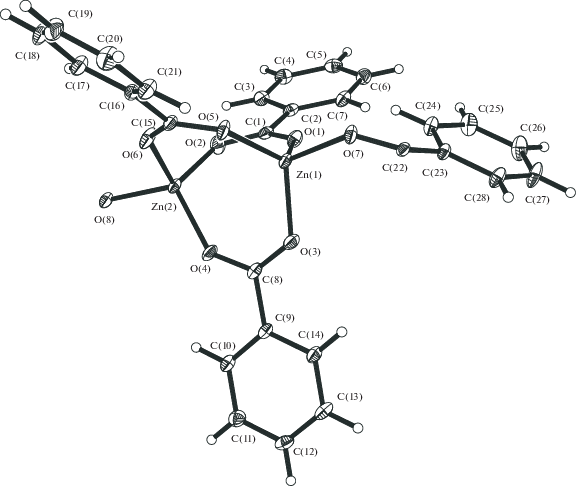
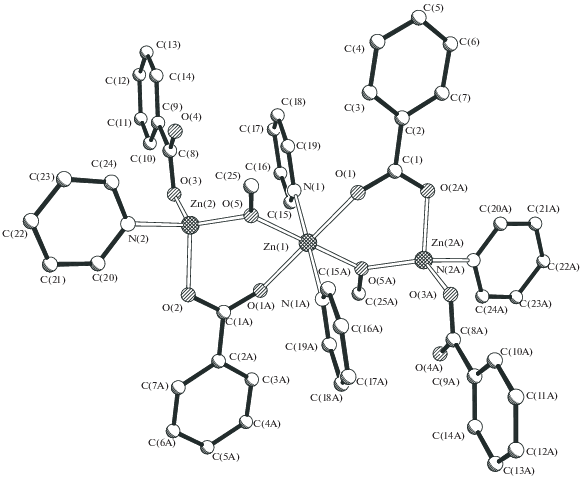
Обнаружено, что медленная диффузия раствора аддукта Zn[(OOCPh]2[O(H)Me]4 (1) в метаноле в хлороформ приводит с практически количественным выходом к образованию необычного бесцветного полимера [Zn(µ-OOCPh)3Zn(µ-OOCPh)]n (2). По данным РСА комплекса 2 (табл. 1, 2, рис. 1, 2), в биядерном фрагменте Zn2(µ-OOCPh)3 атомы металла расположены на несвязывающем расстоянии Zn…Zn 3.2492(6) Å и соединены тремя мостиковыми бензоат-анионами (Zn–O 1.931(2)–1.956(3) Å). Каждый атом цинка димера Zn2 связан с атомом кислорода, принадлежащим еще одному аниону, “сшивающему” димеры в 1D-полимер (Zn–O 1.932(2)–1.939(2) Å), а близлежащий атом металла соседнего димера находится на расстоянии 4.2708(7) Å.
Угол между линиями металл–металл димеров в полимере 2, имеющем геометрию “зигзаг”, составляет 92.3°. Таким образом, каждый атом металла имеет искаженное тетраэдрическое окружение из четырех атомов кислорода. КП 2 не растворяется в хлорсодержащих ор-ганических растворителях и в ТГФ, но ограниченно растворяется, как и исходный комплекс 1, при кипячении в ацетонитриле и может быть перекристаллизован из этого раствора. Полученный продукт заметно отличается от исследованного ранее изоструктурного аддукта кобальта(II), который растворяется в хлороформе, давая с небольшим выходом полимер {[Co2(µ,η2-OOCPh)(µ-OOCPh)2(O(H)Me)2](µ-OOCPh)(HCCl3)}n, в котором остаются координированные молекулы метанола и розовое соединение, представляющее собой, по-видимому, полимер [Co(OOCPh)2]n, растворяющийся лишь в кипящем метаноле [18]. Возможно, при переходе соединения 1 в 2 в результате удаления двух координированных молекул метанола образуется аналогичный полимер, однако зафиксировать его пока не удалось. Отметим, что полимер 2 также растворяется в кипящем метаноле с образованием 1. Кроме того, длительное выдерживание разбавленного раствора 1 в MeOH при комнатной температуре также приводит к формированию монокристаллов 2.
В отличие от 1, аддукт цимантрената цинка Zn[(OOCC5H4)Mn(CO)3]2[O(H)Me]4, имеющий близкое строение, растворяется в ацетонитриле и ТГФ, образуя трехъядерные комплексы Zn3[µ-(OOCC5H4)Mn(CO)3]4[µ-η2-(OOCC5H4)Mn(CO)3]2L4 (L = NCMe, THF), содержащие координированные молекулы донорных растворителей [10].
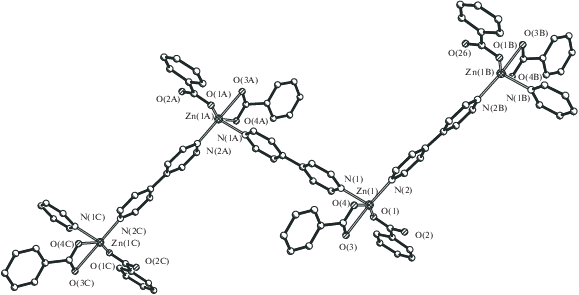
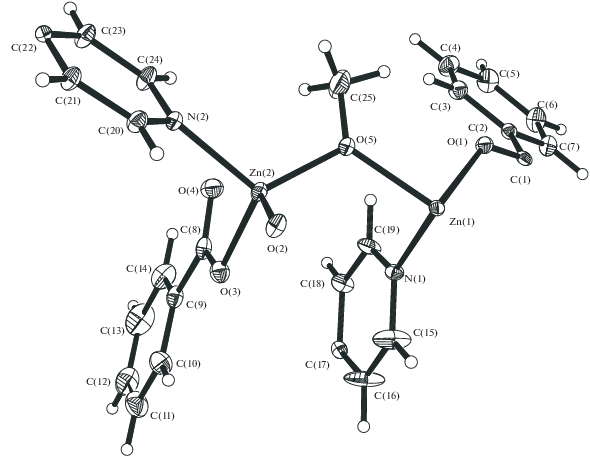
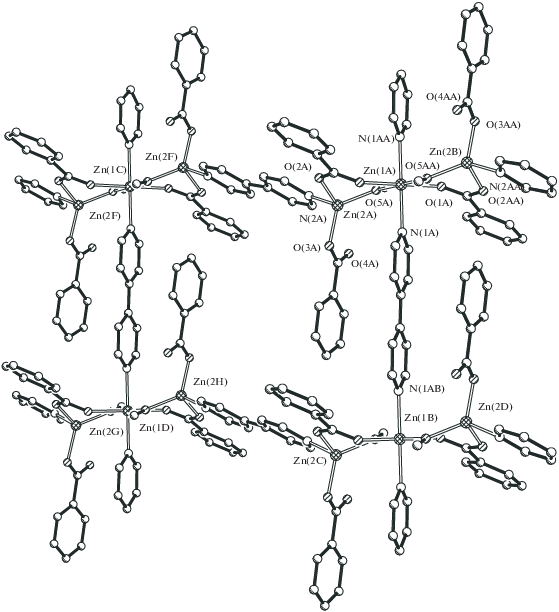
При диффузии раствора γ-γ'-дипиридила в метаноле в раствор 1 в MeOH и соотношении реагентов 1 : 1 также образуется полимер {Zn(µ-dipy)(η2-OOCPh)(OOCPh)}n (3, 88%), в котором, по данным РСА (табл. 1, 3, рис. 3, 4), моноядерные фрагменты Zn(η2-OOCPh)(OOCPh) (Zn–O(1) 1.952(6) Å, Zn–O(3) 2.482(10) Å, Zn–O(4) 2.420(17) Å, Zn–O(4А) 1.938(16) Å) сшиваются двумя атомами азота мостикового дипиридила (Zn–N(1) 2.046(4) Å, Zn–N(1) 2.081(6) Å). В результате атом металла имеет искаженное тетрагонально-пирамидальное окружение, а сам полимер представляет собой “зигзаг” с углом между фрагментами Zn(dipy) соседних звеньев 73.5° и расстояниями между атомами металла Zn(1)…Zn(1B) 17.962 Å, Zn(1)…Zn(1A) 11.200 Å (рис. 4).
Рис. 3.
Независимая часть полимера 3. η2-Связанные бензоат-анионы, разупорядоченные с кратностью 0.5, показаны пунктиром и сплошными линиями.
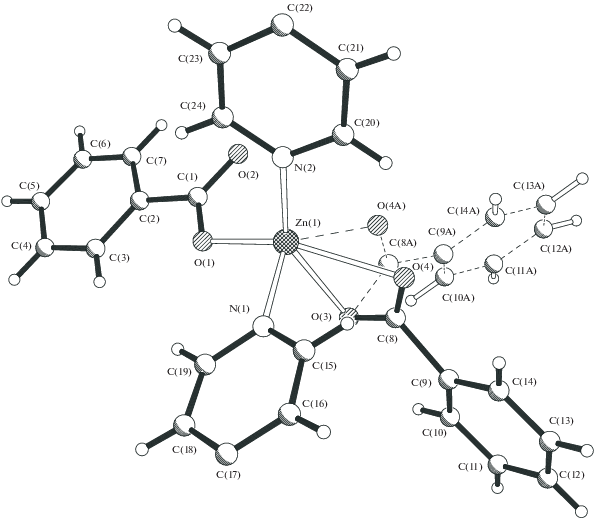
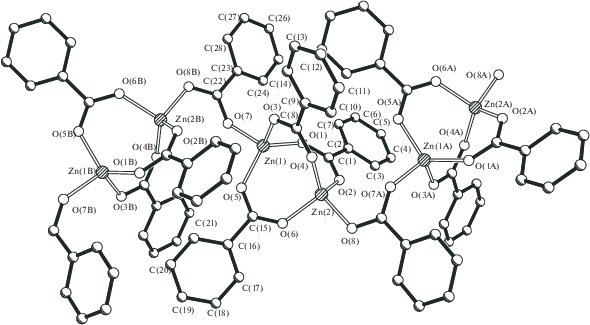
Аналогичная межфазная реакция, но уже при соотношении реагентов 2 : 1, высоком разбавлении и, соответственно, более медленном образовании монокристаллов дает необычный полимер – {Zn[(µ-OMe)(µ-OOCPh)Zn(OOCPh)]2(µ-dipy)2}n (4, 37%). В 2 D-полимере 4, по данным РСА (табл. 1, 4, рис. 5), центральный фрагмент представляет собой трехъядерный комплекс, в котором три атома цинка (Zn…Zn 3.3405(5) Å, угол Zn2/Zn2 180°) соединены попарно двумя атомами кислорода, принадлежащими неожиданно образовавшимся алкоголятным мостикам (Zn–O 1.914(2), 2.055(2) Å), и двумя мостиковыми бензоат-анионами (Zn–O 1.969(2)–2.193(2) Å) (рис. 6). Центральный атом цинка имеет искаженное октаэдрическое окружение, дополненное, помимо атомов кислорода, двумя атомами азота двух разных дипиридилов, сшивающих такие фрагменты в полимер в одном направлении (Zn(1)–N(1) 2.146(2) Å). Периферийные атомы цинка имеют искаженное тетрагональное окружение, дополненное атомом кислорода концевого аниона OOCPh и атомом азота дипиридила, сшивающего полимер в другом направлении (Zn–N 2.066(2) Å) (рис. 7). В итоге образуется практически плоский 2D-КП с отклонением атомов металла Zn(2) от плоскости атомов Zn(1) в четырехугольнике ±0.57 Å и расстояниями между ними 11.219–11.381 Å.
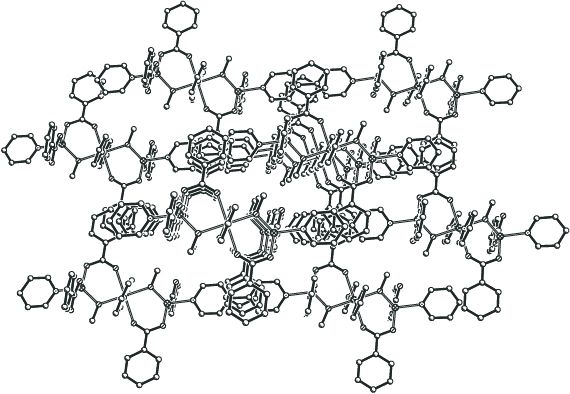
2D-полимеры связаны в кристаллической ячейке за счет π–π-стекинг взаимодействия фенильных заместителей карбоксилат-анионов одного полимера и делокализованной электронной плотности мостиковых дипиридилов другого полимера (3.65–3.8 Å), причем расстояние между одноименными атомами металла соседних слоев составляет 8.127–9.633 Å (рис. 8).
Образование алкоголятных мостиков при формировании КП 4 связано с депротонированием метанола. Можно предположить, что акцепторами протонов являются дипиридил и/или бензоат-анион, причем последний после координации сильного донора депротонирует координированную молекулу спирта с образованием кислоты, что, возможно, подтверждается заметным увеличением расстояний Zn–O η2-связанного аниона OOCPh, наблюдаемым в полимере 3. В то же время длительная перекристаллизация аддукта 1 и полимера 2 из метанола не приводит к образованию алкоголятных мостиков.
При этом ранее не обнаружено образование MeO-аниона в присутствии сильного акцептора фенантролина в реакциях аддуктов цимантренатов цинка, никеля и кобальта, а также при формировании полимеров с γ,γ'-дипиридилом [10, 13, 19]. Однако высказанное предположение, вне всякого сомнения, требует дополнительных исследований.
ЗАКЛЮЧЕНИЕ
Отметим, что известно лишь несколько структурно охарактеризованных комплексов цинка, содержащих одновременно карбоксилат- и алкоголят-анионы [15, 20–27], однако лишь в трех из них алкоголятные мостики образуются в результате депротонирования спирта в присутствии акцепторов протонов [20, 21, 23].
Список литературы
Cook T.R., Zheng Y.-R., Stang P.J. // Chem. Rev. 2013. V. 113. P. 734. https://doi.org/10.1021/cr3002824
Stock N., Biswas S. // Chem. Rev. 2012. V. 112. P. 933. https://doi.org/10.1021/cr200304e
Furukawa H., Cordova K.E., O’Keeffe M. et al. // Science. 2013. V. 341. P. 97. https://doi.org/10.1126/science.1230444
Stavila V., Talin A.A., Allendorf M.D. // Chem. Soc. Rev. 2014. V. 43. P. 5994. https://doi.org/10.1039/C4CS00096J
Li B., Chrzanowski M., Zhang Y., Ma Sh. // Coord. Chem. Rev. 2016. V. 307. Part 2. P.106. https://doi.org/10.1016/j.ccr.2015.05.005
Schoedel A., Li M., Li D. et al. // Chem. Rev. 2016. V. 116. P. 12466. https://doi.org/10.1021/acs.chemrev.6b00346
Medishetty R., Zareba J.K., Mayer D. et al. // Chem. Soc. Rev. 2017. V. 46. P. 4976. https://doi.org/10.1039/C7CS00162B
Uvarova M., Sinelshchikova A., Golubnichaya M. et al. // Cryst. Growth Des. 2014. V. 14. № 11. P. 5976. https://doi.org/10.1021/cg501157e
Mitrofanov A.Yu., Rousseli Y., Guilard R. et al. // New J. Chem. 2016. V. 40. P. 5896. https://doi.org/10.1039/C5NJ03572D
Uvarova M.A., Ageshina A.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1210. https://doi.org/10.1134/S0036023615100198
Ageshina A.A., Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1218. https://doi.org/10.1134/S0036023615100022
Ageshina A.A., Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1085. https://doi.org/10.1134/S0036023615090028
Uvarova M.A., Grineva A.A., Datchuk R.R. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 618. https://doi.org/10.1134/S0036023618050108
Datchuk R.R., Grineva A.A., Uvarova M.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1315. https://doi.org/10.1134/S0036023617100059
CSD version 5.38 updates feb.2017.
SMART (control) and SAINT (integration) Software. Version 5.0. Bruker AXS Inc., Madison, WI, 1997.
Sheldrick G.M. SADABS. Program for scaling and Correction of Area Detector Data, University of Göttingen, 1997.
Grineva A.A., Datchuk R.R., Uvarova M.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 468. https://doi.org/10.1134/S0036023618040095
Grineva A.A., Uvarova M.A., Datchuk R.R. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 610. https://doi.org/10.1134/S0036023618050091
Chandler C.D., Fallon G.D., West B.O. // Polyhedron. 1993. V. 12. № 16. P. 2001. https://doi.org/10.1016/S0277-5387(00)81472-2
Yokota S., Tachi Y., Itoh S. // Inorg. Chem. 2002. V. 41. № 6. P. 1342. https://doi.org/10.1021/ic0155535
Moore D.R., Cheng M., Lobkovsky E.B., Coates G.W. // J. Am. Chem. Soc. 2003. V. 125. № 39. P. 11911. https://doi.org/10.1021/ja020978r
Wang Z., Kravtsov V.C., Zaworotko M.J. // Angew. Chem. Int. Ed. 2005. V. 44. № 19. P. 2877. https://doi.org/10.1002/anie.200500156
Liu Y., Hou H., Chen Q., Fan Y. // Crystal Growth Design. 2008. V. 8. № 4. P. 1435. https://doi.org/10.1021/cg0505158
He K.-H., Li Y.-W., Chen Y.-Q. et al. // Cryst. Growth. Des. 2012. V. 12. № 6. P. 2730. https://doi.org/10.1021/cg300218z
Johnson A.L., Kingsley A.J., Kociok-Köhn G. et al. // Inorg. Chem. 2013. V. 52. № 9. P. 5515. https://doi.org/10.1021/ja036020t
Hurley N.J., Hayward J.J., Rawson J.M. et al. // Inorg. Chem. 2014. V. 53. № 16. P. 8610. https://doi.org/10.1021/ic501224q
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии