Журнал неорганической химии, 2019, T. 64, № 7, стр. 762-768
Окружение иона Al3+ и процесс пересольватации в водно-карбамидных растворах хлорида алюминия
А. К. Лященко 1, *, Е. Г. Тараканова 1, Е. А. Фролова 1, Л. И. Демина 2, В. П. Данилов 1, Г. В. Юхневич 1, Б. Г. Балмаев 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, корп. 4, Россия
3 Институт металлургии и материаловедения им. А.А. Байкова РАН
119334 Москва, Ленинский пр-т, 49, Россия
* E-mail: aklyas@mail.ru
Поступила в редакцию 07.12.2018
После доработки 26.12.2018
Принята к публикации 15.03.2019
Аннотация
Исследовано взаимодействие кристаллогидрата хлорида алюминия AlCl3(H2O)6 и карбамида в твердой фазе и водных растворах AlCl3(H2O)6–CO(NH2)2–H2O, AlCl3(CO(NH2)2)6–H2O. Анализ ИК-спектров изученных образцов показал, что при мольном соотношении Al : CO(NH2)2 = 1 : 6 и в твердой, и в жидкой фазе происходит полное замещение молекул воды в первой координационной сфере иона Al3+ молекулами карбамида. Методом теории функционала плотности (B3LYP-6-31++G(d,p)) выполнен расчет структур, ИК-спектров и энергетических параметров комплексов (CO(NH2)2)2, CO(NH2)2(H2O)2, CO(NH2)2(H2O)4, ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }},$ ${\text{Al(CO(N}}{{{\text{H}}}_{2}}{{)}_{2}})_{{6 + 6}}^{{3 + }}$ и ${\text{Al(CO(N}}{{{\text{H}}}_{2}}{{)}_{2}}{{)}_{6}}({{{\text{H}}}_{2}}{\text{O}})_{3}^{{3 + }}.$ На основании полученных данных изучена конкуренция между молекулами воды и карбамида в водных растворах AlCl3(CO(NH2)2)6 и объяснены результаты эксперимента.
ВВЕДЕНИЕ
Одной из важных задач создания эффективной технологии переработки алюминиевого сырья является получение безводного хлорида алюминия. Разработка теоретических основ такой технологии позволит предложить перспективные методы очистки алюминия от примесей и его последующего выделения в пригодных для электролиза формах. В связи этим несомненный интерес представляют исследования конкуренции между молекулами в водно-органических растворах хлорида алюминия и выявление факторов, определяющих способность органических молекул вытеснять молекулы воды из первой координационной сферы иона Al3+.
На первом этапе исследований было экспериментально установлено, что в тройной системе AlCl3–(CH3)2CO–H2O не происходит замещения молекул воды в сольватной оболочке иона Al3+ молекулами ацетона [1]. Анализ результатов расчета комплексов ${\text{Al}}\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)_{6}^{{3 + }},$ ${\text{Al(}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}_{{6 + 12}}^{{3 + }}$ и ${\text{Al((C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}}{\text{CO)}}_{6}^{{3 + }}$ методом теории функционала плотности позволил объяснить этот факт. Энергетическая предпочтительность вхождения в первую и вторую координационные сферы алюминия молекул H2O обусловлена возможностью их взаимодействия с соседними молекулами раствора (кооперативными эффектами) и отсутствием такой возможности у молекул (CH3)2CO, алкильные группы которых практически изолируют комплекс ${\text{Al((C}}{{{\text{H}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}}{\text{CO)}}_{6}^{{3 + }}$ от окружения [1]. Следовательно, для вытеснения молекул воды из гексагидрата алюминия органические молекулы должны обладать не только большой протоноакцепторной, но и значительной протонодонорной способностью.
Этим условиям отвечают молекулы карбамида, группы C=O и NH2 которых могут интенсивно взаимодействовать с сеткой водородных связей жидкой воды [2–12]. Известно, что в системе AlCl3(H2O)6–CO(NH2)2–С2H5OH происходит реакция замещения карбамидом воды в первой координационной сфере иона Al3+ с выпадением в осадок комплекса AlCl3(CO(NH2)2)6 [13]. Это позволило предположить, что подобное замещение возможно и в водном растворе.
Цель настоящей работы заключалась в экспериментальной проверке такого предположения и объяснении полученных результатов на основании данных квантово-химического расчета. В случае успеха итоги исследования могли быть использованы для разработки методики получения безводного хлорида алюминия AlCl3(CO(NH2)2)6.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
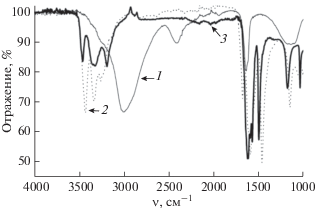
Взаимодействие твердых кристаллогидрата хлорида алюминия AlCl3(H2O)6 и карбамида CO(NH2)2 исследовали при комнатной температуре. Исходные вещества – AlCl3(H2O)6 и CO(NH2)2 квалификации “х. ч.” – смешивали в соотношении 1 : 6 и растирали в ступке, смесь при этом увлажнялась. Смешанный увлажненный образец высушивали при 60°C и исследовали методом колебательной спектроскопии. ИК-спектры исходных компонентов (AlCl3(H2O)6, CO(NH2)2) и полученного сухого порошка (образца 1) приведены на рис. 1 (кривые 1, 2 и 3 соответственно).
Рис. 1.
ИК-спектры исходных компонентов: 1 – AlCl3(H2O)6, 2 – CO(NH2)2, 3 – образца 1 (AlCl3(CO(NH2)2)6 (тв)).
Чтобы выяснить, происходит ли в растворе замещение молекул воды в первой координационной сфере иона Al3+ молекулами CO(NH2)2, гексагидрат хлорида алюминия и карбамид в мольном соотношении 1 : 6 растворяли в воде. Параллельно такой же раствор был приготовлен из образца 1. Оба раствора выпаривали при температуре 60°C. Полученные твердые фазы (образцы 2 и 3 соответственно) и исходные растворы исследовали методом ИК-спектроскопии. Спектры растворов AlCl3(H2O)6–CO(NH2)2–H2O и AlCl3(CO(NH2)2)6‒H2O очень похожи (на рис. 2 представлен второй из них), а ИК-спектры образцов 2 и 3 практически тождественны спектру образца 1.
Рис. 2.
ИК-спектры растворов AlCl3(H2O)6–CO(NH2)2–H2O с мольными соотношениями Al3+ : : CO(NH2)2 = 1 : 6 (1), 1 : 4 (2) и 1 : 2 (3).
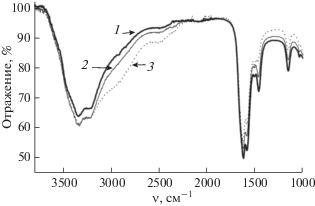
Для сравнения колебательных спектров растворов AlCl3(H2O)6–CO(NH2)2–H2O и AlCl3(CO(NH2)2)6‒H2O, в которых на каждый ион алюминия приходится шесть молекул карбамида, со спектрами растворов с мольными соотношениями Al3+ : CO(NH2)2 < 1 : 6 по той же методике были приготовлены еще два раствора. Мольные соотношения Al3+ : CO(NH2)2 в них составляли 1 : 4 и 1 : 2 соответственно. ИК-спектры этих растворов также приведены на рис. 2 (кривые 2 и 3).
ИК-спектры кристаллических образцов и растворов регистрировали в интервале 4000–550 см–1 методом нарушенного полного внутреннего отражения на ИК-Фурье-спектрометре NEXUS фирмы Nicolet (однолучевой, сканирующий, светоделитель – CsI, детектор – TGS-CsI, фотометрическая точность 0.1%, разрешение 2 см–1) с использованием приставки MIRacle фирмы PIKE Technologies с алмазным кристаллом. Кристаллические образцы наносили непосредственно на алмазный кристалл без дополнительной пробоподготовки. ИК-спектры растворов записывали в динамике с интервалом 15 мин до полного высыхания. Измерения проводили при стандартных условиях.
РАСЧЕТНАЯ ЧАСТЬ
Оптимальные конфигурации, энергетические характеристики и колебательные спектры молекулы карбамида и комплексов (CO(NH2)2)2, CO(NH2)2(H2O)2, CO(NH2)2(H2O)4, ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }},$ ${\text{Al(CO(N}}{{{\text{H}}}_{2}}{{)}_{2}})_{{6 + 6}}^{{3 + }}$ и ${\text{Al(CO(N}}{{{\text{H}}}_{2}}{{)}_{2}}{{)}_{6}}({{{\text{H}}}_{2}}{\text{O}})_{3}^{{3 + }}$ были рассчитаны методом теории функционала плотности (B3LYP-6-31++G(d,p)) по программе GAUSSIAN-09 [14]. Анализ найденных стационарных точек на поверхности потенциальной энергии всех комплексов, за исключением одного, показал, что они являются минимумами. В случае сольватации алюминия двенадцатью молекулами CO(NH2)2 не удалось рассчитать частоты, однако можно предположить, что полученная в результате оптимизации структура также соответствует минимуму.
Основные результаты расчета – энергии образования изученных комплексов и длины межмолекулярных связей – приведены в табл. 1, где также представлены аналогичные параметры комплексов ${\text{Al}}\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)_{6}^{{3 + }},$ ${\text{Al(}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}_{{6 + 12}}^{{3 + }}$ (из работы [1]) и оцененная на основании расчетных данных прочность связей Al–O (EAl–O), H(I)⋅⋅⋅O(II) (EH(I)⋅⋅⋅O(II)) и H⋅⋅⋅O (EH⋅⋅⋅O). Римскими цифрами I и II обозначены атомы молекул, входящих соответственно в первую и вторую координационные сферы иона Al3+. Прочность связей Al–O в сольватах ${\text{Al}}\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)_{6}^{{3 + }}$ и ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }}$ находили, полагая, что их энергия образования равна сумме энергий межмолекулярных связей. Прочность связей в любом комплексе, содержащем во второй сфере m молекул, оценивали, считая величину EH(I)⋅⋅⋅O(II) равной 1/m от энергии образования этого комплекса из гексасольвата иона Al3+ и m молекул карбамида или воды. При этом, пренебрегая влиянием второй координационной сферы, энергию связей Al–O в комплексе принимали равной EAl–O в гексасольвате.
Таблица 1.
Энергии образования комплексов (ΔE, ккал/моль), прочность межмолекулярных связей (EAl–O, EH(I)⋅⋅⋅O(II)a, EH⋅⋅⋅O, ккал/моль) и длины связей Al–O (rAl–O, Å)
| Комплекс | ΔE | EAl–O | EH(I)⋅⋅⋅O(II) (EH⋅⋅⋅O) | rAl–O |
|---|---|---|---|---|
| (CO(NH2)2)2 | 7.55 | – | (3.78) | – |
| CO(NH2)2(H2O)2 | 19.81 | – | (9.91)б | – |
| CO(NH2)2(H2O)4 | 34.08 | – | (4.11)в | – |
| ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }}$ | 920.38 | 153.40 | – | 1.931 |
| ${\text{Al(CO(N}}{{{\text{H}}}_{2}}{{)}_{2}})_{{6 + 6}}^{{3 + }}$ | 1095.86 | ~153.40д | 14.62 | 1.922 |
| 175.48г | 1.924 | |||
| ${\text{Al(CO(N}}{{{\text{H}}}_{{\text{2}}}}{{{\text{)}}}_{2}}{{)}_{6}}({{{\text{H}}}_{{\text{2}}}}{\text{O}})_{3}^{{3 + }}$ | 969.80 | ~153.40д | 16.47 | 1.894–1.946 |
| 49.41г | ||||
| ${\text{Al(}}{{{\text{H}}}_{{\text{2}}}}{\text{O}})_{6}^{{3 + }}$ | 706.30 | 117.72 | – | 1.942 |
| ${\text{Al(}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}_{{6 + 12}}^{{3 + }}$ | 1029.09 322.46г |
~117.72д | 26.87 | 1.913–1.931 |
a Римскими цифрами I и II обозначены атомы, принадлежащие молекулам, входящим в первую и вторую координационные сферы иона Al3+ соответственно. б, вПрочность H-связей, в которых молекула карбамида выступает как акцептор и донор протона соответственно. гЭнергия образования комплекса с полностью или частично заполненной второй сольватной оболочкой из гексасольвата иона Al3+ и молекул, вошедших во вторую сферу. дЗначения EAl–O, принятые равными EAl–O в гексасольвате иона Al3+ (ввиду невозможности их корректного получения).
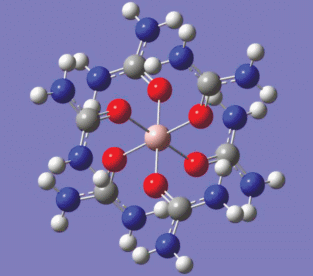
Отметим, что полученные в расчете структурные параметры молекулы карбамида и комплексов алюминия адекватно воспроизводят данные измерений. Так, средние отклонения длин связей, углов и двугранных углов молекулы CO(NH2)2 от результатов микроволновых исследований [15] составляют 0.009 Å, 1.0° и 2.1° соответственно. Из расчета, как и из экспериментов [15, 16], следует, что молекула карбамида имеет симметрию C2. Октаэдрическая структура комплекса ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }}$ (рис. 3) согласуется с данными, полученными методами ЯМР для AlCl3(CO(NH2)2)6 [13] и РСА для Al(ClO4)3(CO(NH2)2)6 [17]. Аналогичное строение этот комплекс имеет и в солях других трехвалентных металлов (см., например, [18, 19]). Рассчитанные длины связей Al⋅⋅⋅O в гексасольвате иона Al3+ составляют ~1.93 Å (табл. 1), а оцененные на основании данных для Cr(CO(NH2)2)6 в кристаллической фазе и разницы ионных радиусов Al3+ и Cr3+ (~0.07 Å [20]) – порядка 1.88–1.91 Å [19]. Соответствие эксперименту характеристик гидратных комплексов ${\text{Al}}\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)_{6}^{{3 + }}$ и ${\text{Al(}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}_{{6 + 12}}^{{3 + }}$ было показано в работе [1].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из сравнения ИК-спектров исходных компонентов (рис. 1, кривые 1 и 2) и образца 1 (рис. 1, кривая 3) следует, что в результате взаимодействия твердых кристаллогидрата хлорида алюминия AlCl3(H2O)6 и карбамида образуется комплекс хлорида алюминия с карбамидом состава AlCl3(CO(NH2)2)6. Действительно, в ИК-спектре образца 1 отсутствуют полосы поглощения гексагидрата треххлористого алюминия (рис. 1, кривая 1). При этом полосы колебаний молекул CO(NH2)2 в нем смещены (по сравнению со спектром на рис. 1, кривая 2) так же, как во всех случаях вхождения карбамида в первую координационную сферу ионов Al3+ [13] и других металлов, образующих связи с атомами кислорода, а не азота (например, [21–25]). Характерными признаками такого взаимодействия молекулы CO(NH2)2 с ионом металла являются значительные изменения частот двух ее валентных колебаний – ν(C=O) и νas(CN) [13, 21–25]. Частота первого из них в ИК-спектре образца 1 (1612 см–1) понизилась по сравнению со спектром карбамида на 64 см–1, а частота второго (1494 см–1) повысилась на 34 см–1 (табл. 2).
Таблица 2.
Значения частот колебаний молекул CO(NH2)2 в ИК-спектрах карбамида и образца 1 (эксперимент) в изолированном состоянии и в составе комплекса ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }}$ (расчет)
| Отнесение колебаний | Эксперимент | Расчет | |||
|---|---|---|---|---|---|
| CO(NH2)2 [16] | CO(NH2)2 | Al(CO(NH2)2)6Cl3 (образец 1) | CO(NH2)2 | ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }}$ | |
| ν(C=O) | 1734 | 1676 | 1612 | 1791 | 1694 1692 |
| δas( NH2) | 1605 | ~1620 | 1591 | 1636 | 1606 |
| δs(NH2) | 1594 | 1589 | 1567 | 1634 | 1587 |
| νas(CN) | 1394 | 1460 | 1494 | 1413 | 1540–1544 |
| ρs(NH2) | 1153 | 1150 | 1175 | 1173 | 1150 1137 |
| ρas(NH2) | 1014 | 1052 | 1036 | 1040 | 1068 |
| νs(CN) | 960 | 1004 | ~950 | 956 | 1041 |
| τ(OCNN) | 790 | 787 | 768 | 769 | 765–770 |
| δas(NCO) | 578 | 718 | 631 | 575 | 674–682 |
| γas(NH2) | 552 | ~550 | 558 | 541 | 610–616 |
ИК-спектры образцов 1–3 практически тождественны. Следовательно, в твердых фракциях, полученных после испарения воды из растворов AlCl3(H2O)6–CO(NH2)2–H2O и AlCl3(CO(NH2)2)6–H2O, ионы алюминия сольватированы шестью молекулами карбамида.
В спектрах обоих этих растворов (например, рис. 2, кривая 1) нет характерной широкой интенсивной полосы в области ~3000 см–1, отвечающей валентным колебаниям групп OH молекул H2O, взаимодействующих с ионом Al3+ [1]. В то же время в ИК-спектре раствора с мольным соотношением Al3+ : CO(NH2)2 = 1 : 4 (рис. 2, кривая 2) эта полоса проявляется в виде заметного поглощения, а в спектре раствора, в котором на каждый ион Al3+ приходится две молекулы CO(NH2)2, уже четко виден ее максимум (рис. 2, кривая 3). О появлении в первой сфере алюминия молекул воды, прочнее связанных со второй сферой, чем молекулы CO(NH2), свидетельствует еще один факт. При переходе от раствора с соотношением Al3+ : : CO(NH2)2 = 1 : 6 к раствору с соотношением 1 : 2 полоса валентных колебаний H-связей между молекулами первой и второй сфер (последняя в изученных растворах состоит только из воды) усиливается, становится шире, а ее максимум смещается в область высоких частот от ~2480 до ~2520 см–1. Из приведенных данных следует, что молекулы воды входят в состав первой сольватной сферы иона алюминия только в случае, если молекул карбамида в растворе не хватает для полного заполнения ими этой сферы.
После испарения воды из растворов с соотношениями Al3+ : CO(NH2)2 = 1 : 4 и 1 : 2 по методике, использованной для получения образцов 2 и 3, были получены сухие порошки. Их ИК-спектры отличаются от спектров образцов 1–3 наличием поглощения в той же области, что и в спектре гексагидрата AlCl3(H2O)6, приведенном на рис. 1 (кривая 1), причем для первого порошка оно заметно интенсивнее, чем для второго. Отсюда можно заключить, что данное поглощение, достигающее максимума при ~3000 см–1, обусловлено валентными колебаниями OH-групп молекул воды, взаимодействующих с ионом Al3+.
Таким образом, можно констатировать, что в системе AlCl3(H2O)6–CO(NH2)2–H2O произошло полное замещение гидратирующих алюминий молекул воды молекулами карбамида, а в системе AlCl3(CO(NH2)2)6–H2O состав растворенной в воде соли остался неизменным. Иными словами, экспериментально установлено, что растворение кристаллогидрата AlCl3(H2O)6 в водном растворе CO(NH2)2 с мольным соотношением Al : : CO(NH2)2 = 1 : 6 позволяет получить безводный хлорид алюминия AlCl3(CO(NH2)2)6.
Анализ факторов, приводящих к такому итогу конкуренции между молекулами воды и карбамида в первой координационной сфере иона Al3+, будет корректным, если расчет наряду со структурными параметрами адекватно воспроизводит частоты колебаний, а значит и прочность внутри- и межмолекулярных связей твердофазных объектов. Отличие рассчитанных ИК-спектров от экспериментальных оценили, сопоставив спектр молекулы CO(NH2)2 со спектрами карбамида в аргоновой матрице [16] и в твердой фазе, а спектры молекул CO(NH2)2, входящих в комплекс ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }}$ (рис. 3), со спектром образца 1 (табл. 2). При этом валентные колебания групп NH не рассматривали, так как в расчете не учитывается взаимодействие этих групп с соседними молекулами, что приводит к сильному завышению частот ν(NH).
Для повышения надежности оценки использовали два независимых параметра – среднее относительное отклонение рассчитанных частот от измеренных (α, %) и взаимное расположение полос в спектре (σ, %). Численные значения σ находили, приняв величину частотного интервала Δ, в котором лежат все анализируемые полосы колебаний, за 100%, выразив в процентах расстояния (νj–νi) между всеми соседними парами полос и вычислив среднее отклонение рассчитанных значений (νj–νi)/Δ от экспериментальных.
В итоге получилось, что вычисленный ИК-спектр молекулы CO(NH2)2 хорошо согласуется с ИК-спектром карбамида в Ar-матрице (α = = 1.81%, σ = 1.02%) и несколько хуже (так и должно быть) – со спектром твердой фазы (α = 4.57%, σ = 6.10%). Точность, с которой частоты колебаний молекул CO(NH2)2, входящих в состав комплекса ${\text{Al}}\left( {{\text{CO}}{{{\left( {{\text{N}}{{{\text{H}}}_{2}}} \right)}}_{2}}} \right)_{6}^{{3 + }},$ воспроизводят спектр образца 1 (с учетом того, что рассчитанный комплекс, в отличие от экспериментального, не содержит ионов Cl–), также вполне удовлетворительна: α = 4.32%, σ = 4.55%.
Из результатов расчета (табл. 1) следует, что энергия присоединения к иону алюминия шести молекул карбамида в 1.30 раза больше энергии присоединения шести молекул воды. Отметим, что это значение близко к отношению величин сродства к протону молекул CO(NH2)2 (PA = = 215.12 ккал/моль) и H2O (PA = 172.40 ккал/моль), равному 1.25.
Сравним энергетический выигрыш от присутствия в первой координационной сфере иона Al3+ молекул CO(NH2)2 и H2O. При растворении кристаллогидрата AlCl3(H2O)6 в воде каждая из входящих в эту сферу молекул H2O образует три связи: Al–O (~117.72 ккал/моль) и две сильные связи H(I)⋅⋅⋅O(II) (по 26.87 ккал/моль) с молекулами воды второй гидратной оболочки11 иона (табл. 1). Каждая из молекул второй сферы участвует в качестве донора протона еще в двух водородных связях, прочность каждой из которых ∼9–12 ккал/моль (подробнее см. [1]). При растворении карбамида в воде молекула CO(NH2)2 как акцептор протона образует две относительно сильные (по 9.91 ккал/моль), а как донор протона – две слабые (по 4.11 ккал/моль) H-связи. Энергии межмолекулярных связей в следующем гидратном слое обоих комплексов, по-видимому, примерно такие же, как в объемной воде. Из приведенных данных следует, что замещение молекулы H2O в первой координационной сфере иона Al3+ молекулой CO(NH2)2 будет сопровождаться разрывом связи Al–O и десяти водородных связей, суммарная прочность которых (117.78–129.78 ккал/моль) практически равна энергии EAl–O или даже превышает ее.
Вхождение молекулы CO(NH2)2 в первую сольватную оболочку иона Al3+ приведет к значительному по сравнению с гидратацией этого иона усилению связи Al–O (до ~153.4 ккал/моль). Кроме того, эта молекула может образовать четыре H-связи (по ~16.47 ккал/моль) с молекулами H2O второй сферы, каждая из которых участвует как донор протона еще в двух, заведомо более сильных, чем в объемной воде, межмолекулярных связях (по ≥7 ккал/моль). Таким образом, внедрение карбамида в первую координационную сферу алюминия ведет к появлению двенадцати прочных водородных связей. Для простоты рассуждений будем считать, что десять из них (с суммарной энергией 107.88 ккал/моль) образовались вместо H-связей, разорванных при удалении молекулы воды из первой сферы и молекулы карбамида из раствора. Остальные две связи стали прочней (на ≥1 ккал/моль каждая) за счет перехода образующих их молекул из объемной воды в третью сольватную оболочку иона Al3+. Учтем также, что молекула воды, перешедшая из гидратной оболочки алюминия в раствор, образует в нем две–четыре H-связи по 5 ккал/моль.
Суммарная энергия такой системы водородных связей (включая усиление двух из них) и связи Al–O равна 273.28–283.28 ккал/моль. Сопоставив ее с суммарной прочностью перечисленных выше разорванных связей, получим, что энергетический выигрыш от замещения в первой сфере иона Al3+ молекулы H2O молекулой CO(NH2)2 составляет порядка 25.78–35.78 ккал/моль.
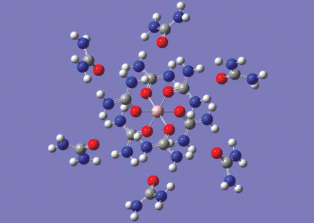
Исходя из этого вывода, рассмотрим факторы, влияющие на итог конкуренции между молекулами CO(NH2)2 и H2O во второй координационной сфере алюминия. Согласно результатам расчета, каждая молекула CO(NH2)2 первой сферы может образовать две H-связи с одной из шести молекул карбамида, находящихся в следующей сольватной оболочке иона Al3+ (рис. 4). Суммарная энергия этих связей (29.24 ккал/моль) почти в четыре раза превышает энергию аналогичных связей в димере (CO(NH2)2)2 (7.55 ккал/моль). Если же атомы водорода обеих групп NH молекулы CO(NH2)2 первой сферы, которые образуют H-связи с молекулой карбамида второй сферы, будут взаимодействовать не с ней, а с двумя молекулами воды, то это приведет к энергетическому выигрышу в 3.70 ккал/моль. Остальные атомы водорода могут образовывать H-связи с молекулами воды при любом из рассмотренных вариантов сольватации молекулы CO(NH2)2, входящей в первую сферу алюминия. Из приведенных данных следует, что в конкуренции за место во второй сольватной оболочке иона Al3+ выигрывают молекулы воды.
ЗАКЛЮЧЕНИЕ
Результаты проведенного экспериментально-расчетного исследования могут быть использованы при разработке методов получения безводного хлорида алюминия. Они представляют не только практический, но и теоретический интерес в связи с изучением процессов пересольватации в водно-неэлектролитных растворах. Метод, использованный при анализе факторов, определяющих итог конкуренции между молекулами воды и карбамида в растворах за место в первой координационной сфере иона Al3+, представляется весьма эффективным.
Список литературы
Panasyuk G.P., Lyashchenko A.K., Azarova L.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 6. P. 843. [Панасюк Г.П., Лященко А.К., Азарова Л.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 6. С. 796. https://doi.org/10.7868/S0044457X18060211]https://doi.org/10.1134/S0036023618060190
Зотов А.Т. Мочевина. М.: Госхимиздат, 1963. 175 с.
Структурная самоорганизация в растворах и на границе раздела фаз / Отв. ред. Цивадзе А.Ю. М.: Изд-во ЛКИ, 2008. 544 с.
Chitra R., Smith P.E. // J. Phys. Chem. B. 2000. V. 104. № 6. P. 5854.
Chitra R., Smith P.E. // J. Phys. Chem. B. 2002. V. 106. № 24. P. 1491.
Лященко А.К., Дуняшев В.С., Засецкий А.Ю. // Журн. физ. химии. 2017. Т. 91. № 5. С. 837. https://doi.org/10.7868/S004445371705017X
Kaatze U. // J. Chem. Phys. 2018. V. 148. № 1. P. 014504/1. https://doi.org/10.1063/1.5003569
Bandyopadhyay D., Mohan S., Ghosh S.K., Choudhury N. // J. Phys. Chem. B. 2014. V. 118. № 40. P. 11757. https://doi.org/10.1021/jp505147u
Funkner S., Havenith M., Schwaab G. // J. Phys. Chem. B. 2012. V. 116. № 45. P. 13374. https://doi.org/10.1021/jp308699w
Chettiyankandy P., Chowdhuri S. // J. Mol. Liq. 2016. V. 216. P. 788. https://doi.org/10.1016/j.molliq.2016.02.019
Kameda Y., Maki A., Amo Y., Usuki T. // Bull. Chem. Soc. Jpn. 2010. V. 83. № 2. P. 131.
Devi K.R., Rathika S. // J. Chem. Pharm. Research. 2015. V. 7. № 8. P. 967.
Qiu Y., Gao L. // JACS. 2004. V. 83. № 3. P. 352.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09, Rev. A.02. Gaussian, Inc., Wallingford CT, 2009.
Godfrey P.D., Brown R.D., Hunter A.N. // J. Mol. Struct. 1997. V. 413–414. P. 405.
King S.T. // Spectrochim. Acta. 1972. V. 28A. P. 165.
Mooy J.H.M., Krieger W., Heijdenrijk D., Stam C.H. // Chem. Phys. Lett. 1974. V. 29. P. 179.
Figgis B.N., Wadley L.G.B. // Acta Crystallogr. 1972. V. 28B. P. 187.
Moon D., Tanaka S., Akitsu T., Choi J.-H. // Acta Crystallogr. 2015. V. 71E. P. 1335. https://doi.org/10.1107/S2056989015019258
Бокий Г.Б. Кристаллохимия. М.: Наука, 1971. 400 с.
Penland R.B., Mizushima S.,Curran C., Quagliano J.V. // J. Am. Chem. Soc. 1957. V. 79. P. 1575.
Антоненко Н.С., Нугер Я.А. // Журн. неорган. химии. 1966. Т. 11. № 5. С. 1072.
Keuleers R., Janssens J., Desseyn H.O. // Thermochim. Acta. 2000. V. 354. P. 125.
Raptis S.G., Anastassopoulou J., Theophanidies T. // Theor. Chem. Accounts. 2000. V. 105. P. 156.https://doi.org/10.1007/s002140000200
Carp O., Patron L., Diamandescu L., Reller A. // Thermochim. Acta. 2002. V. 390. P. 169.
Смирнов П.Р., Тростин В.Н. // Журн. общ. химии. 2013. Т. 83. № 1. С. 18.
Rudolph W.W., Mason R., Pye C.C. // Phys. Chem. Chem. Phys. 2000. V. 2. P. 5030. https://doi.org/10.1039/b003764h
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии