Журнал неорганической химии, 2019, T. 64, № 7, стр. 782-786
Cтекло состава Аl2(SO4)3 · 8(CH3)2SO · 3Н2О – прекурсор для синтеза кристаллического Аl2(SO4)3 · 8(CH3)2SO
И. А. Кириленко 1, *, Г. П. Панасюк 1, Л. А. Азарова 1, Л. И. Демина 2, И. В. Козерожец 1, М. Г. Васильев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский пр-т, 31, корп. 4, Россия
* E-mail: iakirilenko@mail.ru
Поступила в редакцию 12.12.2018
После доработки 25.12.2018
Принята к публикации 09.01.2019
Аннотация
Синтезировано новое соединение состава Аl2(SO4)3 · 8(CH3)2SO из стекла состава Аl2(SO4)3 · 8(CH3)2SO · 3Н2О, которое прямым синтезом получить невозможно. Соединение идентифицировано методом рентгенофазового анализа. На основании ИК-спектров сделан вывод о смешанной координации иона Al3+ c молекулами диметилсульфоксида, связь между лигандами осуществляется через атомы S и О.
ВВЕДЕНИЕ
В настоящее время актуальной задачей является поиск новых экономически целесообразных методов получения чистых и/или особо чистых веществ [1–8]. Так, активно развивающимся современным направлением является использование стекол в качестве прекурсоров для получения новых чистых и/или особо чистых веществ или веществ с улучшенными характеристиками. Использование в качестве прекурсоров соединений металлов, содержащих легко уходящие молекулы диметилсульфоксида (ДМСО, (СН3)2SO) во внутренней координационной сфере и кластерные анионы бора в качестве противоионов, позволяет их применять в твердофазном синтезе новых веществ и материалов [4, 5] или, например, при низкотемпературном синтезе боридов металлов [6]. Получение материалов на основе стекол открывает широкие возможности варьирования их свойств. В настоящее время развивается перспективное направление по созданию материалов на основе жидкого натриевого стекла и солей кластерных анионов бора, которые могут использоваться в качестве защитных покрытий от нейтронного излучения [7, 8].
В настоящее время актуальной задачей остается получение электролизом особо чистого алюминия из его солей. Основную трудность представляет наличие молекул воды в первой координационной сфере иона Al3+, которая препятствует процессу его получения. Замена их на органическое соединение может способствовать решению этой проблемы [9]. С этой целью в работе [10] была предпринята попытка замены молекул воды в первой координационной сфере иона Al3+ на молекулы ацетона в системе AlCl3–(СН3)2CO–H2O. Исследование растворов этой системы методом ИК-спектроскопии показало, что ацетон в первую координационную сферу иона алюминия не входит. Кроме того, из данных квантово-химического расчета [11, 12] следует, что энергия образования комплекса Al3+ с шестью молекулами ацетона в 1.2 раза больше соответствующей энергии образования гидратного комплекса. Однако, несмотря на указанное преимущество в энергии, а также на то, что в изученных растворах молекул ацетона было достаточно для полного замещения первой координационной сферы иона Al3+, вытеснения молекул воды не происходило.
ДМСО и вода – универсальные растворители, которые образуют между собой очень сильные водородные связи. Силы взаимодействия между молекулами (CH3)2SO и Н2О в 1.5 раза больше, чем между молекулами воды [13].
Согласно приведенным в литературе [14–16] данным, конкурирующими лигандами за вхождение в первую координационную сферу иона Al3+ являются (CH3)2SO и H2O. В работе [14] методом ЯМР исследована система AlCl3–(CH3)2SO–H2O и установлено, что ионы Al3+ в первой координационной сфере предпочтительнее сольватируются молекулами воды. Сделано заключение, что полная замена молекул воды в первой координационной сфере Al3+ на (СН3)2SO невозможна из-за стерического фактора, определяемого ионом Cl–.
В работе [17] исследована система Al2(SO4)3–(СН3)2SO–H2O и обнаружено явление стеклообразования. Стеклообразующие составы этой системы по фактуре весьма разнообразны: это и водные растворы разной степени вязкости, и твердые вещества с той или иной степенью прозрачности. Наибольший интерес представляет стекло состава Al2(SO4)3 · 8 (СН3)2SO · 3H2O – прозрачное, твердое, с характерным раковистым изломом. Из результатов исследования его ИК-спектров следует, что молекулы (СH3)2SO полностью замещают молекулы воды в первой координационной сфере иона Al3+. Высказано предположение о возможности смешанной координации молекулами (СH3)2SO (через атомы S и O) иона Al3+ при вхождении в его первую координационную сферу.
Представляется интересным, сохранится ли комплекс [Al{(CH3)2SO}6]3+, присутствующий в стекле состава Al2(SO4)3 · 8(СН3)2SO · 3H2O, или произойдет его распад на составляющие после обезвоживания стекла. При сохранении комплекса можно предположить возможность получения нового безводного соединения состава А12(SO4)3 · 8(CH3)2SO из стекла. Получить прямым синтезом соединение этого состава из-за нерастворимости сульфата алюминия в (СН3)2SO, по данным Gaylord Cemical Company LLC USA, невозможно [18].
Цель исследования – выявление возможности получения безводного соединения А12(SO4)3 · 8(CH3)2SO из водного стекла состава Al2(SO4)3 · 8(СН3)2SO · 3H2O через дегидратацию с сохранением (СН3)2SO в первой координационной сфере иона Al3+.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали Al2(SO4)3 · 16.5H2O марки “ч. д. а.” и (CH3)2SO фирмы Aldrich (99.9 мас. %). Синтез стекла проводили методом испарения воды в открытых контейнерах при температуре не выше 105°С (для (CH3)2SO tкип = = 189°С) по методике, описанной в работе [19]. Полученное стекло состава Al2(SO4)3 · 8(СН3)2SO ⋅ ⋅ 3H2O исследовали методом ИК-спектроскопии.
Обезвоживание стекла проводили нагреванием его в открытом контейнере, контролируя потерю массы и состав полученного продукта вплоть до полной кристаллизации образца. Расчет химической формулы сделан исходя из потери массы во время нагрева. Полученное соединение устойчиво на воздухе и отвечает составу А12(SO4)3 · ⋅ 8(CH3)2SO, его идентифицировали методами РФА и ИК-спектроскопии.
Дифрактограммы соединения регистрировали на дифрактометре Bruker D8 Advance (CuK). ИК-спектры образцов записывали в интервале 4000–550 см–1 методом нарушенного полного внутреннего отражения на ИК-Фурье-спектрометре NEXUS фирмы NICOLET с использованием приставки MIRacle фирмы PIKETechnologies с алмазным кристаллом.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
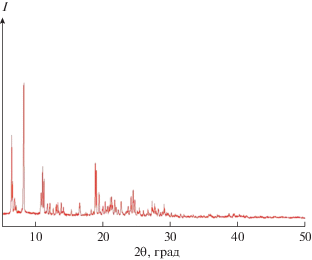
На рис. 1 представлена дифрактограмма полученного кристаллического соединения состава А12(SO4)3 · 8(CH3)2SO. Данные РФА свидетельствуют об индивидуальности полученного из стекла Al2(SO4)3 · 8(СН3)2SO · 3H2O соединения состава А12(SO4)3 · 8(CH3)2SO.
Для изучения строения А12(SO4)3 · 8(CH3)2SO исследованы его ИК-спектры (рис. 2). Многообразие полос поглощения в спектре нового соединения свидетельствует об участии в образовании комплекса не только донорных атомов (СН3)2SO, но и ионов ${\text{SO}}_{4}^{{2 - }},$ с помощью которых образуются кислородные связи сульфоксидных цепочек. Реализация активности атомов O и S в (СН3)2SO, а также участие групп ${\text{SO}}_{4}^{{2 - }}$ в образовании комплекса приводят к появлению многочисленных полос поглощения в ИК-спектрах. Поскольку полоса ν(S=O) при 1042 см–1 [20] в спектре свободного (CH3)2SO отсутствует, как и в спектре стекла состава Al2(SO4)3 · 8(СН3)2SO · 3H2O [17], можно сделать вывод, что все донорные атомы молекулы (CH3)2SO, а также S и O участвуют в образовании связей. Если координация молекул (CH3)2SO осуществляется через атом O, то это приводит к уменьшению частоты ν(S=O) [21], а если через атом S – к увеличению этой частоты [22]. Появление новых полос поглощения как в низкочастотной (1029, 991, 946, 881 см–1), так и в высокочастотной (1098, 1158, 1222, 1234, 1268 см–1) области относительно ν(S=O) свободного (CH3)2SO свидетельствует о том, что комплексообразование происходит с участием как атомов S, так и атомов O. Расщепление полосы симметричных валентных колебаний иона ${\text{SO}}_{4}^{{2 - }}$ в спектрах стекла состава Al2(SO4)3 · 8(СН3)2SO · 3H2O и нового соединения состава А12(SO4)3 · 8(CH3)2SO позволяет сделать вывод о вхождении иона ${\text{SO}}_{4}^{{2 - }}$ в первую координационную сферу алюминия.
Рис. 2.
ИК-спектры поглощения образцов: 1 – стекло состава Al2(SO4)3 · 8(СН3)2SO · 3H2O, 2 – (СН3)2SO, 3 – безводное соединение состава Al2(SO4)3 · 8(СН3)2SO.
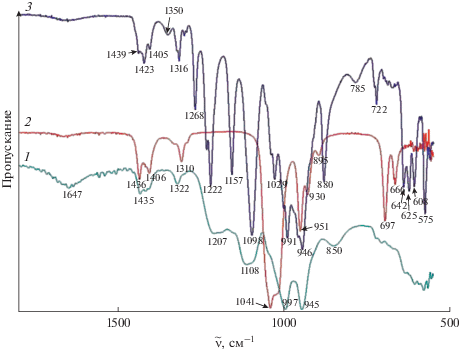
Большое число полос в спектре соединения (как и в спектре стекла [17]) в интервале 1300–850 см–1 (рис. 2), не относящихся ни к ν(S=O) свободного (CH3)2SO, ни к ${\text{SO}}_{4}^{{2 - }}$ в составе Al2SO4 · 18Н2О, свидетельствует о разнообразии связей S–O.
Образование прочных связей с участием атомов О и S молекул (CH3)2SO приводит к смещению электронной плотности в молекуле (CH3)2SO и усилению связей С–Н в метильных группах. В ИК-спектрах это выражается в высокочастотных сдвигах полос СН3-групп (3015, 2921 см–1) в Al2(SO4)3 · 8(СН3)2SO по сравнению с (CH3)2SO (2997, 2912 см–1). Изменения наблюдаются и в области деформационных колебаний СН3-групп, что выражается появлением новой полосы при 1423 см–1.
В спектре соединения А12(SO4)3 · 8(CH3)2SO отсутствуют полосы поглощения при 2700, 2400 см–1, отвечающие колебаниям ОН-групп, и при 1649 см–1, связанные с деформационными колебаниями ν(НОН), которые фиксировались в спектрах кристаллогидрата Al2SO4 · 16.5Н2О и стекла Al2(SO4)3 · 8(СН3)2SO · 3H2O (3300–2910 см–1 и ν(НОН) при 1655 см–1). Появляются лишь слабые полосы при 3482 см–1 и ν(НОН) при 1649 см–1, как и в спектре (СН3)2SO, что соответствует образованию водородных связей с координированным (СН3)2SO или ${\text{SO}}_{4}^{{2 - }}.$ На основании вышесказанного можно сделать вывод о том, что молекулы воды полностью вытесняются из первой координационной сферы иона алюминия в соединении состава А12(SO4)3 · 8(CH3)2SO.
При анализе ИК-спектров обращает на себя внимание идентичность основных полос поглощения ν(S=O) молекул (CH3)2SO, расщепление полосы симметричных валентных колебаний иона ${\text{SO}}_{4}^{{2 - }}$ в стекле Al2(SO4)3 · 8(СН3)2SO · 3H2O и в соединении А12(SO4)3 · 8(CH3)2SO и, как следствие, вхождение молекул (CH3)2SO в первую координационную сферу иона Al3+ через атомы S и O.
Следует отметить, что, согласно [13], ионы металлов с завершенной 18-электронной оболочкой координируются сульфоксидами через атом S, а с незавершенной электронной оболочкой, как, например, у атома Al {2)8)3)}, должны координироваться через атом O. Таким образом, полученные нами данные вносят существенный вклад в представление о возможной смешанной координации атома Al сульфоксидами, и конкретно (CH3)2SO, через атомы S и O.
Подобная смешанная координация молекулами (CH3)2SO отмечается в работе [23], где говорится о том, что в комплексах платиновых металлов возможна координация (CH3)2SO как через атом S, так и через атом O. Интересна работа [24], в которой на основании фундаментальных исследований методами ИК-спектрометрии, ЯМР и РСА доказано, что в бромодиметилсульфоксидных комплексах осмия существует смешанная координация иона Os молекулами (CH3)2SO через атомы S и O.
Стекло состава Al2(SO4)3 · 8(СН3)2SO · 3H2O синтезировано по методике синтеза стекла состава Al2(SO4)3 · 12H2O [19]. В работе [17] отмечается подобие по способу получения и внешним признакам стекол Al2(SO4)3 · 12H2O и Al2(SO4)3 · · 8(СН3)2SO · 3H2O. Целью работы [17] было “выяснение возможности замены молекул воды в первой координационной сфере иона алюминия в соединении Al2(SO4)3 · 12H2O” на молекулы (CH3)2SO с сохранением стеклообразного состояния. В результате исследования стекол Al2(SO4)3 · · 10H2O–Al2(SO4)3 · 12H2O методом дифракции рентгеновских лучей и спектроскопии КР впервые для водно-электролитных стекол выделена структурная единица стекол Al2(SO4)3 · 10H2O–Al2(SO4)3 · 12H2O, выявлена полимерная природа явления стеклообразования, оценена длина полимерной цепи, количество элементарных звеньев и их размер [25]. Согласно полученным результатам, ближнее окружение иона А13+ состоит из четырех молекул H2O и двух ионов ${\text{SO}}_{4}^{{2 - }}.$ Один ион ${\text{SO}}_{4}^{{2 - }}$ является мостиковым, соединяющим два иона А13+, два других иона ${\text{SO}}_{4}^{{2 - }}$ – концевые. Выводы, сделанные ранее относительно строения стекол Al2(SO4)3 · 10H2O–Al2(SO4)3 · 12H2O, по результатам рентгенодифракционного эксперимента, отработанного на растворах, спустя восемь лет были подтверждены немецкими исследователями при изучении структуры монокристалла состава Al2(SO4)2 · 10.5H2O методом РФА [26].
ЗАКЛЮЧЕНИЕ
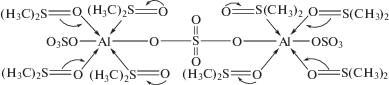
На основании вышеизложенного строение комплексов, определяющих структуру безводного соединения состава Al2(SO4)3 · 8(СН3)2SO, можно представить в виде схемы, приведенной на рис. 3.
Рис. 3.
Схема строения комплекса, определяющего структуру безводного соединения состава Al2(SO4)3 · 8(СН3)2SO.
Можно предположить, что при определенных технических усовершенствованиях процесса получения алюминия из его солей это соединение можно использовать вместо солей галогенидов для получения алюминия.
Список литературы
Panasyuk G.P., Semenov E.A., Kozerozhets I.V. et al. // Dokl. Chemistry. 2018. V. 483. № 1. P. 272. https://doi.org/10.1134/S0012500818110022
Panasyuk G.P., Azarova L.A., Belan V.N. et al. // Theor. Found. Chem. Eng. 2018. V. 52. № 5. P. 879. https://doi.org/10.1134/S0040579518050202
Panasyuk G.P., Kozerozhets I.V., Semenov E.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1303. [Панасюк Г.П., Козерожец И.В., Семенов Е.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 10. С. 1286.]https://doi.org/10.1134/S0036023618100157
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Goeva L.V., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1050. [Гоева Л.В., Авдеева В.В., Малинина Е.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 1015.]https://doi.org/10.1134/S0036023618080089
Avdeeva V.V., Polyakova I.N., Vologzhanina A.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 9. P. 112. [Авдеева В. В., Полякова И.Н., Вологжанина А.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 9. С. 1182. doi 10.7868/S0044457X16090026]https://doi.org/10.1134/S0036023616090023
Малинина Е.А., Скачкова В.К., Козерожец И.В. и др. // Доклады Академии наук. 2019. Т. 404. № 1. С. 41.
Skachkova V.K., Goeva L.V., Grachev A.V. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 1. P. 84. [Скачкова В.К., Гоева Л.В., Грачев А.В. и др. // Журн. неорган. химии. 2017. Т. 62. № 1. С. 81. doi 10.7868/S0044457X17010214]https://doi.org/10.1134/S0036023617010211
Каблов В.Ф., Быкадоров Н.У., Жохова О.К. и др. // Журн. Вестник Казанского технол. ун-та. 2013. Т. 16. № 1. С. 61.
Panasyuk G.P., Lyashchenko A.K., Azarova L.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 6. P. 843. [Панасюк Г.П., Лященко А.К., Азарова Л.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 6. С. 796. doi 10.7868/S0044457X18060211]https://doi.org/10.1134/S0036023618060190
Frisch M.I., Truck G.W., Schlegel H.B. et al. Gaussian 09, Revision A.02/Gaueeian, Jnc., Wallingford CT, 2009.
Тараканова Е.Г., Юхневич И.Б., Либрович Н.Б. // Журн. хим. физика. 2005. Т. 24. № 6. С. 44.
Кукушкин Ю.Н. // Соросовский образовательный журнал. 1997. № 9. С. 54.
Рындаревич С.Б. Комплексообразование А1(III) в неводных растворах. Дис. … канд. хим. наук. М., 1984.
Fratello A. et al. // J. Chem. Phys. 1968. V. 48. № 8. P. 3705.
Thovas S., Reynolds W.N. // Inorga. Chem. 1970. V. 9. № 1. P. 78.
Kirilenko I.A., Demina L.I. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1368. [Кириленко И.А., Демина Л.А. // Журн. неорган. химии. 2018. Т. 63. № 10. С. 1349.]https://doi.org/10.1134/S0036023618100108
Goylord Chemical Company L.L.C Your Global Leader for DMSO solutions kk 102.
Kirilenko I.A. // Russ. J. Inorg. Chem. 2017. V. 62. № 14. P. 1819. https://doi.org/10.1134/S0036023617140042
Nakamoto K. Infrared Spectra of Inorganic and Coordination Compounds. N.Y.: Wiley, 1963.
Cotton F.A., Francis R., Horrocks W.D. // J. Phys. Chem. 1960. V. 64. P. 1534.
Wayland B.B., Shramm R.F. // Inorg. Chem.1969.V. 8. P. 971.
Alessio E. // Chem. Rev. 2004. V. 104. № 9. P. 4203.
Rudnitskaya O.V., Kultyshkina E.K., Dobrokhotova E.V. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 9. P. 935. [Рудницкая О.В., Култышкина Е.К., Доброхотова Е.В. и др. // Журн. неорган. химии. 2014. Т. 59 № 9. С. 1166. doi 10.7868/S0044457X14090153]https://doi.org/10.1134/S003602361409014
Кириленко И.А. Водно-электролитные стеклообразующие системы. Красанд, 2016.
Fischer T., Eisenmann B. // Z. Kristallogr. 1996. V. 211. № 7. P. 475.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии